Legemidler ved kvinnesykdommer: Clomid 100mg, 25mg, 50mg Clomiphene Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Clomid 50mg og hvordan brukes det?
Clomid 100mg er en reseptbelagt medisin som brukes til å behandle symptomene på infertilitet hos kvinner som har eggløsningssvikt. Clomid kan brukes alene eller sammen med andre medisiner.
Clomid tilhører en klasse legemidler som kalles selektive østrogenreseptormodulatorer.
Det er ikke kjent om Clomid er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Clomid?
Clomid kan forårsake alvorlige bivirkninger, inkludert:
- . magesmerter, . oppblåsthet, . kvalme, . oppkast, . diaré, . rask vektøkning (spesielt i ansiktet og midtpartiet), . lite eller ingen vannlating, . smerte når du puster, . rask puls, og . kortpustethet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Clomid inkluderer:
- . rødming (varme, rødhet eller prikkende følelse), . kvalme, . oppkast, . oppblåsthet, . brystsmerter eller ømhet, . hodepine, og . gjennombruddsblødning eller flekker
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Clomid. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
CLOMID (clomiphene citrate tablets USP) er et oralt administrert, ikke-steroidt, eggløsningsstimulerende middel kjemisk betegnet som 2-[p-(2-klor-1,2-difenylvinyl)fenoksy]trietylaminsitrat (1:1). Den har molekylformelen C26H28ClNO • C6H8O7 og en molekylvekt på 598,09. Det er representert strukturelt som:
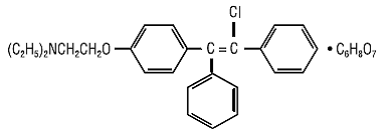
Klomifensitrat er et hvitt til blekgult, i hovedsak luktfritt, krystallinsk pulver. Det er fritt løselig i metanol; løselig i etanol; lett løselig i aceton, vann og kloroform; og uløselig i eter.
CLOMID 50mg er en blanding av to geometriske isomerer [cis (zuclomiphene) og trans (enclomiphene)] som inneholder mellom 30 % og 50 % av cis-isomeren.
Hver tablett med hvite delestreker inneholder 50 mg klomifensitrat USP. Tabletten inneholder også følgende inaktive ingredienser: maisstivelse, laktose, magnesiumstearat, pregelatinisert maisstivelse og sukrose.
INDIKASJONER
CLOMID 100mg er indisert for behandling av ovulatorisk dysfunksjon hos kvinner som ønsker å bli gravide. Hindringer for å oppnå graviditet må utelukkes eller behandles adekvat før behandling med CLOMID 50 mg startes. De pasientene som mest sannsynlig vil oppnå suksess med klomifenterapi inkluderer pasienter med polycystisk ovariesyndrom (se ADVARSLER : Ovarialt hyperstimuleringssyndrom ), amenoré-galaktoré-syndrom, psykogen amenoré, post-oral-prevensjons-amenoré og visse tilfeller av sekundær amenoré av ubestemt etiologi.
Riktig timet coitus i forhold til eggløsning er viktig. En graf for basal kroppstemperatur eller andre passende tester kan hjelpe pasienten og legen hennes å avgjøre om eggløsning har skjedd. Når eggløsningen er etablert, bør hver kur med CLOMID 100 mg startes på eller rundt den 5. dagen i syklusen. Langvarig syklisk behandling anbefales ikke utover totalt ca. seks sykluser (inkludert tre eggløsningssykluser). (Se DOSERING OG ADMINISTRASJON og FORHOLDSREGLER .)
CLOMID er kun indisert hos pasienter med påvist ovulatorisk dysfunksjon som oppfyller forholdene beskrevet nedenfor:
. Pasienter som ikke er gravide. . Pasienter uten ovariecyster. CLOMID 100mg skal ikke brukes til pasienter med ovarieforstørrelse bortsett fra de med polycystisk ovariesyndrom. Bekkenundersøkelse er nødvendig før den første og hver påfølgende behandlingskur med CLOMID. . Pasienter uten unormal vaginal blødning. Hvis det er unormal vaginal blødning, bør pasienten evalueres nøye for å sikre at neoplastiske lesjoner ikke er tilstede. . Pasienter med normal leverfunksjon.I tillegg bør pasienter valgt for CLOMID-behandling vurderes med hensyn til følgende:
. Østrogennivåer. Pasienter bør ha tilstrekkelige nivåer av endogent østrogen (som estimert fra vaginale utstryk, endometriebiopsi, analyse av urinøstrogen eller fra blødning som respons på progesteron). Reduserte østrogennivåer, selv om de er mindre gunstige, utelukker ikke vellykket behandling. . Priær hypofyse eller ovariesvikt. CLOMID 25 mg-behandling kan ikke forventes å erstatte spesifikk behandling av andre årsaker til ovulasjonssvikt. . Endometriose og endometriekarsinom. Forekomsten av endometriose og endometriekarsinom øker med alderen, og det samme gjør forekomsten av eggløsningsforstyrrelser. Endometriebiopsi bør alltid utføres før behandling med CLOMID 50 mg i denne populasjonen. . Andre hindringer for graviditet. Svangerskapshindringer kan omfatte skjoldbruskkjertelforstyrrelser, binyresykdommer, hyperprolaktinemi og mannlig faktor infertilitet. . Myomer i livmoren. Forsiktighet bør utvises ved bruk av CLOMID hos pasienter med uterine fibromer på grunn av muligheten for ytterligere forstørrelse av myomene.Det er ingen tilstrekkelige eller godt kontrollerte studier som viser effektiviteten til CLOMID 100 mg i behandlingen av mannlig infertilitet. I tillegg har testikkeltumorer og gynekomasti blitt rapportert hos menn som bruker klomifen. Årsak- og virkningsforholdet mellom rapporter om testikkeltumorer og administrering av CLOMID 25 mg er ikke kjent.
Selv om den medisinske litteraturen foreslår ulike metoder, finnes det ikke noe universelt akseptert standardregime for kombinert terapi (dvs. CLOMID i forbindelse med andre eggløsningsfremkallende legemidler). Tilsvarende er det ingen standard CLOMID-kur for eggløsningsinduksjon i in vitro fertiliseringsprogrammer for å produsere egg for befruktning og reintroduksjon. Derfor anbefales ikke CLOMID 50mg for disse bruksområdene.
DOSERING OG ADMINISTRASJON
Generelle betraktninger
Utarbeiding og behandling av kandidater for CLOMID 100 mg-behandling bør overvåkes av leger med erfaring i behandling av gynekologiske eller endokrine lidelser. Pasienter bør kun velges for behandling med CLOMID 50 mg etter nøye diagnostisk evaluering (se INDIKASJONER ). Behandlingsplanen bør skisseres på forhånd. Hindringer for å nå målet med behandlingen må utelukkes eller behandles adekvat før CLOMID starter. Det terapeutiske målet bør balanseres med potensielle risikoer og diskuteres med pasienten og andre som er involvert i oppnåelsen av en graviditet.
Eggløsning skjer oftest fra 5 til 10 dager etter en CLOMID-kur. Samelag bør tidsbestemmes til å falle sammen med forventet tidspunkt for eggløsning. Passende tester for å bestemme eggløsning kan være nyttige i løpet av denne tiden.
Anbefalt dosering
Behandling av den valgte pasienten bør begynne med en lav dose, 50 mg daglig (1 tablett) i 5 dager. Dosen bør kun økes hos de pasientene som ikke har eggløsning som respons på syklisk 50 mg CLOMID. En lav dosering eller varighet av behandlingsforløpet anbefales spesielt hvis det er mistanke om uvanlig følsomhet for hypofysegonadotropin, for eksempel hos pasienter med polycystisk ovariesyndrom (se ADVARSLER ; Ovarialt hyperstimuleringssyndrom ).
Pasienten bør evalueres nøye for å utelukke graviditet, ovarieforstørrelse eller dannelse av ovariecyster mellom hver behandlingssyklus.
Hvis progestinindusert blødning er planlagt, eller hvis spontan uterin blødning oppstår før behandling, bør kuren på 50 mg daglig i 5 dager startes på eller rundt den 5. dagen av syklusen. Terapi kan startes når som helst hos pasienten som ikke har hatt noen nylig uterin blødning. Når eggløsning skjer ved denne dosen, er det ingen fordel å øke dosen i påfølgende behandlingssykluser.
Hvis eggløsning ikke ser ut til å skje etter den første behandlingskuren, bør en ny kur på 100 mg daglig (to 50 mg tabletter gitt som en enkelt daglig dose) gis i 5 dager. Dette kurset kan startes så tidlig som 30 dager etter det forrige etter at forholdsregler er tatt for å utelukke tilstedeværelse av graviditet. Det anbefales ikke å øke dosen eller varigheten av behandlingen utover 100 mg/dag i 5 dager.
Flertallet av pasientene som skal ha eggløsning vil gjøre det etter den første behandlingskuren. Hvis eggløsning ikke oppstår etter tre behandlingskurer, anbefales ikke videre behandling med CLOMID 50 mg, og pasienten bør revurderes. Hvis tre eggløsningsreaksjoner oppstår, men graviditet ikke er oppnådd, anbefales ikke videre behandling. Hvis menstruasjonen ikke oppstår etter en eggløsningsrespons, bør pasienten revurderes. Langvarig syklisk terapi anbefales ikke utover totalt ca. seks sykluser (se FORHOLDSREGLER ).
HVORDAN LEVERES
NDC 0068-0226-30: 50 mg tabletter i kartonger med 30 tabletter er runde, hvite, med delestrek og preget CLOMID 50. Oppbevar tabletter ved kontrollert romtemperatur 59-86°F (15-30°C). Beskytt mot varme, lys og overdreven fuktighet, og oppbevar i lukkede beholdere.
Produsert av: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. Revidert: juli 2017
BIVIRKNINGER
Bivirkninger fra kliniske forsøk.
CLOMID, ved anbefalte doser, tolereres generelt godt. Bivirkningene har vanligvis vært milde og forbigående, og de fleste har forsvunnet umiddelbart etter at behandlingen er avsluttet. Bivirkninger rapportert hos pasienter behandlet med klomifensitrat under kliniske studier er vist i tabell 2.
Følgende bivirkninger er rapportert hos færre enn 1 % av pasientene i kliniske studier: Akutt abdomen, økt appetitt, forstoppelse, dermatitt eller utslett, depresjon, diaré, svimmelhet, tretthet, hårtap/tørt hår, økt urinfrekvens/volum, søvnløshet, ørhet, nervøs spenning, vaginal tørrhet, svimmelhet, vektøkning/tap.
Pasienter på langvarig behandling med CLOMID 25 mg kan vise forhøyede serumnivåer av desmosterol. Dette er mest sannsynlig på grunn av en direkte interferens med kolesterolsyntese. Serumsterolene hos pasienter som får anbefalt dose CLOMID 50 mg er imidlertid ikke signifikant endret. Eggstokkreft er sjelden rapportert hos pasienter som har fått fertilitetsmedisiner. Infertilitet er en primær risikofaktor for eggstokkreft; epidemiologiske data tyder imidlertid på at langvarig bruk av klomifen kan øke risikoen for en borderline eller invasiv eggstokksvulst.
Uønskede hendelser etter markedsføring
Følgende bivirkninger har blitt identifisert under bruk av Clomid etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Kroppen som helhet: Feber, tinnitus, svakhet
Kardiovaskulær: Arytmi, brystsmerter, ødem, hypertensjon, hjertebank, flebitt, lungeemboli, kortpustethet, takykardi, tromboflebitt
Sentralnervesystemet: Migrene hodepine, parestesi, anfall, hjerneslag, synkope
Dermatologisk: Akne, allergisk reaksjon, erytem, erythema multiforme, erythema nodosum, hypertrikose, kløe, urticaria
Fetale/neonatale anomalier:
- . Unormal beinutvikling: skjelettmisdannelser i hodeskallen, ansiktet, nesegangene, kjeve, hånd, lem (ekromelia inkludert amelia, hemimelia og phocomelia), fot (klumpfot), ryggrad og ledd . Hjerteabnormaliteter: septalhjertedefekter, muskelventrikulær septaldefekt, patent ductus arteriosus, tetralogi av Fallot og koarktasjon av aorta . Kromosomforstyrrelser: Downs syndrom . Øreavvik og døvhet . Mage-tarmkanalen: leppe- og ganespalte, imperforert anus, trakeøsofageal fistel, diafragmatisk brokk, omphalocele . Kjønnsorganabnormiteter: hypospadi, kloakeksstrofi . Misdannelser i lungevevet . Misdannelser i øyet og linsen (katarakt) . Neoplasmer: nevroektodermal svulst, skjoldbrusksvulst, hepatoblastom, lymfatisk leukemi . Avvik i nervesystemet: nevralrørsdefekter (anencefali, meningomyelocele), mikrocefali og hydrocephalus . Nyreabnormiteter: nyreagenese og nyredysgenese . Andre: dvergvekst, mental retardasjon
Gastrointestinale: Pankreatitt
Genitourinært: Endometriose, ovariecyster (ovarieforstørrelse eller cyster kan som sådan bli komplisert av adnexal torsjon), ovarieblødning, eggledergraviditet, livmorblødning, redusert endometrietykkelse
Hepatisk: Transaminaser økte, hepatitt
Metabolismeforstyrrelser: Hypertriglyseridemi, i noen tilfeller med pankreatitt
Muskuloskeletal: Artralgi, ryggsmerter, myalgi
Neoplasmer: Lever (hepatisk hemangiosarkom, levercelleadenom, hepatocellulært karsinom); bryst (fibrocystisk sykdom, brystkarsinom); endometrium (endometriekarsinom); nervesystemet (astrocytom, hypofysetumor, prolaktinom, nevrofibromatose, glioblastoma multiforme, hjerneabcess); eggstokk (luteom av svangerskapet, dermoid cyste i eggstokken, ovariekarsinom); trofoblastisk (hydatiform føflekk, koriokarsinom); diverse (melanom, myelom, perianale cyster, nyrecellekarsinom, Hodgkins lymfom, tungekarsinom, blærekarsinom)
Psykiatrisk: Angst, irritabilitet, humørsvingninger, psykose
Synsforstyrrelser: Unormal akkommodasjon, katarakt, øyesmerter, makulært ødem, optikusnevritt, fotopsi, bakre glasslegemeløsning, retinal blødning, retinal trombose, retinal vaskulær spasme, midlertidig eller langvarig synstap, muligens irreversibelt.
Annen: Leukocytose, skjoldbrusk lidelse
NARKOTIKAHANDEL
Legemiddelinteraksjoner med CLOMID er ikke dokumentert.
Narkotikamisbruk og avhengighet
Toleranse, misbruk eller avhengighet med CLOMID er ikke rapportert.
ADVARSLER
Visuelle symptomer
Pasienter bør informeres om at uskarphet eller andre visuelle symptomer som flekker eller blink (glitrende scotomater) av og til kan oppstå under behandling med CLOMID. Disse visuelle symptomene øker i forekomst med økende totaldose eller behandlingsvarighet. Disse synsforstyrrelsene er vanligvis reversible; Det er imidlertid rapportert tilfeller av langvarige synsforstyrrelser, og noen har oppstått etter seponering av CLOMID 50 mg. Synsforstyrrelsene kan være irreversible, spesielt ved økt dosering eller varighet av behandlingen. Pasienter bør advares om at disse visuelle symptomene kan gjøre slike aktiviteter som bilkjøring eller betjening av maskiner mer farlige enn vanlig, spesielt under forhold med variabel belysning.
Disse visuelle symptomene ser ut til å skyldes intensivering og forlengelse av etterbilder. Symptomer vises ofte først eller forsterkes ved eksponering for et sterkt opplyst miljø. Mens målt synsskarphet vanligvis ikke har blitt påvirket, utviklet en studiepasient som tok 200 mg CLOMID daglig synsuskarphet på den 7. behandlingsdag, som utviklet seg til en alvorlig reduksjon av synsskarphet innen den 10. dagen. Ingen annen abnormitet ble funnet, og synsstyrken ble normal igjen den 3. dagen etter at behandlingen ble avsluttet.
Oftalmologisk definerbare scotomater og endringer i retinalcellefunksjon (elektroretinografiske) er også rapportert. En pasient behandlet under kliniske studier utviklet fosfener og scotomater under forlenget CLOMID 50 mg-administrasjon, som forsvant innen den 32. dagen etter avsluttet behandling.
Overvåking etter markedsføring av bivirkninger har også avdekket andre visuelle tegn og symptomer under CLOMID-behandling (se BIVIRKNINGER ).
Selv om etiologien til disse visuelle symptomene ennå ikke er forstått, bør pasienter med visuelle symptomer avbryte behandlingen og få utført en fullstendig oftalmologisk evaluering umiddelbart.
Ovarialt hyperstimuleringssyndrom
Ovarielt hyperstimuleringssyndrom (OHSS) er rapportert å forekomme hos pasienter som får klomifensitratbehandling for eggløsningsinduksjon. OHSS kan utvikle seg raskt (innen 24 timer til flere dager) og bli en alvorlig medisinsk lidelse. I noen tilfeller oppsto OHSS etter syklisk bruk av klomifensitratbehandling eller når klomifensitrat ble brukt i kombinasjon med gonadotropiner. Forbigående abnormiteter i leverfunksjonsprøver som tyder på leverdysfunksjon, som kan være ledsaget av morfologiske endringer på leverbiopsi, er rapportert i forbindelse med OHSS.
OHSS er en medisinsk hendelse forskjellig fra ukomplisert eggstokkforstørrelse. De kliniske tegnene på dette syndromet i alvorlige tilfeller kan inkludere grov ovarieforstørrelse, gastrointestinale symptomer, ascites, dyspné, oliguri og pleural effusjon. I tillegg er følgende symptomer rapportert i forbindelse med dette syndromet: perikardial effusjon, anasarca, hydrothorax, akutt abdomen, hypotensjon, nyresvikt, lungeødem, intraperitoneal og ovarieblødning, dyp venøs trombose, torsjon av eggstokken og akutt respiratorisk. nød. De tidlige varseltegnene på OHSS er magesmerter og oppblåsthet, kvalme, oppkast, diaré og vektøkning. Forhøyede urinsteroidnivåer, varierende grader av elektrolyttubalanse, hypovolemi, hemokonsentrasjon og hypoproteinemi kan forekomme. Død på grunn av hypovolemisk sjokk, hemokonsentrasjon eller tromboemboli har forekommet. På grunn av skjørhet av forstørrede eggstokker i alvorlige tilfeller, bør abdominal- og bekkenundersøkelse utføres svært forsiktig. Hvis unnfangelse resulterer, kan rask progresjon til den alvorlige formen av syndromet forekomme.
For å minimere faren forbundet med sporadiske unormale eggstokkforstørrelser assosiert med CLOMID 100 mg-behandling, bør den laveste dosen som samsvarer med forventede kliniske resultater, brukes. Maksimal forstørrelse av eggstokken, enten fysiologisk eller unormal, kan ikke forekomme før flere dager etter seponering av den anbefalte dosen av CLOMID. Noen pasienter med polycystisk ovariesyndrom som er uvanlig sensitive for gonadotropin kan ha en overdreven respons på vanlige doser av CLOMID. Derfor bør pasienter med polycystisk ovariesyndrom startes med laveste anbefalte dose og korteste behandlingsvarighet for den første behandlingskuren (se DOSERING OG ADMINISTRASJON ).
Hvis forstørrelse av eggstokken oppstår, bør ikke tilleggsbehandling med CLOMID gis før eggstokkene har gått tilbake til størrelsen før behandling, og dosen eller varigheten av neste kur bør reduseres. Ovarieforstørrelse og cystedannelse assosiert med CLOMID 50 mg-behandling regresserer vanligvis spontant innen noen få dager eller uker etter avsluttet behandling. Den potensielle fordelen med påfølgende CLOMID 25 mg-behandling i disse tilfellene bør overstige risikoen. Med mindre kirurgisk indikasjon for laparotomi eksisterer, bør slik cystisk forstørrelse alltid behandles konservativt.
En årsakssammenheng mellom eggstokhyperstimulering og eggstokkreft er ikke fastslått. Men fordi en korrelasjon mellom eggstokkreft og nulliparitet, infertilitet og alder har blitt foreslått, hvis ovariecyster ikke regresserer spontant, bør en grundig evaluering utføres for å utelukke tilstedeværelsen av ovarial neoplasi.
FORHOLDSREGLER
Generell
Nøye oppmerksomhet bør gis til valg av kandidater for CLOMID-behandling. Bekkenundersøkelse er nødvendig før behandling med CLOMID og før hver påfølgende kur (se KONTRAINDIKASJONER og ADVARSLER ).
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Langtids toksisitetsstudier på dyr er ikke utført for å evaluere det karsinogene eller mutagene potensialet til klomifensitrat.
Oral administrering av CLOMID 25 mg til hannrotter i doser på 0,3 eller 1 mg/kg/dag forårsaket redusert fertilitet, mens høyere doser forårsaket midlertidig infertilitet. Orale doser på 0,1 mg/kg/dag hos hunnrotter avbrøt midlertidig det normale sykliske vaginale mønsteret og forhindret unnfangelse. Doser på 0,3 mg/kg/dag reduserte antall eggløsninger og corpora lutea noe, mens 3 mg/kg/dag hemmet eggløsning.
Svangerskap
Sammendrag av fosterrisiko
Bruk av CLOMID 100 mg hos gravide kvinner er kontraindisert, da behandling med CLOMID 25 mg ikke gir noen fordel i denne populasjonen.
Tilgjengelige humane data antyder ikke økt risiko for medfødte anomalier over bakgrunnspopulasjonsrisikoen. Imidlertid viste reproduksjonstoksikologiske studier hos dyr økt embryo-føtalt tap og strukturelle misdannelser hos avkom. Hvis dette legemidlet brukes under graviditet, eller hvis pasienten blir gravid mens du tar dette legemidlet, bør pasienten informeres om den potensielle risikoen for fosteret.
Kliniske betraktninger
For å unngå utilsiktet administrering av CLOMID 25 mg under tidlig graviditet, bør passende tester brukes under hver behandlingssyklus for å avgjøre om eggløsning og/eller graviditet forekommer. Pasienter bør evalueres nøye for å utelukke ovarieforstørrelse eller dannelse av ovariecyster mellom hver behandlingssyklus. Neste kur med CLOMID-behandling bør utsettes til disse tilstandene er utelukket.
Menneskelige data
De tilgjengelige humane dataene fra epidemiologiske studier viser ingen tilsynelatende årsak og virkningsforhold mellom klomifensitrat perikonseptuell eksponering og en økt risiko for generelle fødselsdefekter, eller noen spesifikk anomali. På grunn av det lille antallet tilfeller av medfødte anomalier som forekommer hos klomifensitratbehandlede kvinner, var disse epidemiologiske studiene bare i stand til å utelukke store forskjeller i risiko. Studiene tok ikke hensyn til faktorer assosiert med kvinnelig subfertilitet og var ikke i stand til å justere for andre viktige konfoundere. I tillegg støtter ikke tilgjengelige data en økt forekomst av spontanabort blant subfertile kvinner behandlet med klomifensitrat for induksjon av eggløsning.
Dyredata
Oral administrering av klomifensitrat til drektige rotter under organogenese i doser på 1 til 2 mg/kg/dag resulterte i hydramnion og svake, ødematøse fostre med bølgete ribben og andre midlertidige benforandringer. Doser på 8 mg/kg/dag eller mer forårsaket også økte resorpsjoner og døde fostre, dystoki og forsinket fødsel, og 40 mg/kg/dag resulterte i økt mødredødelighet. Enkeltdoser på 50 mg/kg forårsaket grå stær hos fosteret, mens 200 mg/kg forårsaket ganespalte. Etter injeksjon av klomifensitrat 2 mg/kg til mus og rotter under graviditet, viste avkommet metaplastiske endringer i forplantningskanalen. Nyfødte mus og rotter injisert i løpet av de første dagene av livet utviklet også metaplastiske forandringer i livmor- og skjedeslimhinnen, samt for tidlig skjedeåpning og anovulatoriske eggstokker. Disse funnene ligner den unormale reproduktive oppførselen og steriliteten beskrevet med andre østrogener og antiøstrogener.
Hos kaniner ble det sett noen midlertidige beinforandringer hos fostre fra mødre som fikk orale doser på 20 eller 40 mg/kg/dag under svangerskapet, men ikke etter 8 mg/kg/dag. Ingen permanente misdannelser ble observert i disse studiene. Også rhesus-aper som ble gitt orale doser på 1,5 til 4,5 mg/kg/dag i ulike perioder under svangerskapet, hadde ikke noe unormalt avkom.
Ammende mødre
Det er ikke kjent om CLOMID utskilles i morsmelk. Fordi mange legemidler skilles ut i morsmelk, bør det utvises forsiktighet hvis CLOMID administreres til en ammende kvinne. Hos noen pasienter kan CLOMID redusere amming.
Eggstokkreft
Langvarig bruk av klomifensitrat-tabletter USP kan øke risikoen for en borderline eller invasiv eggstoksvulst (se BIVIRKNINGER ).
OVERDOSE
Tegn og symptomer
Toksiske effekter ved akutt overdosering av CLOMID 50 mg er ikke rapportert. Tegn og symptomer på overdosering som følge av bruk av mer enn den anbefalte dosen under behandling med CLOMID 100 mg inkluderer kvalme, oppkast, vasomotoriske flushes, visuell uskarphet, flekker eller blinker, scotomater, ovarieforstørrelse med bekken- eller magesmerter. (Se KONTRAINDIKASJONER : Ovariecyste .)
Oral LD50
Den akutte orale LD50 av CLOMID 25 mg er 1700 mg/kg hos mus og 5750 mg/kg hos rotter. Den toksiske dosen hos mennesker er ikke kjent.
Dialyse
Det er ikke kjent om CLOMID er dialyserbart.
Behandling
Ved overdosering bør egnede støttetiltak brukes i tillegg til gastrointestinal dekontaminering.
KONTRAINDIKASJONER
Overfølsomhet
CLOMID 100mg er kontraindisert hos pasienter med kjent overfølsomhet eller allergi mot klomifensitrat eller noen av ingrediensene i det.
Svangerskap
Bruk av CLOMID hos gravide kvinner er kontraindisert, da CLOMID ikke gir noen fordel i denne populasjonen.
Tilgjengelige humane data tyder ikke på en økt risiko for medfødte anomalier over bakgrunnspopulasjonsrisikoen ved bruk som indikert. Imidlertid viste reproduksjonstoksikologiske studier hos dyr økt embryo-føtalt tap og strukturelle misdannelser hos avkom. Hvis dette legemidlet brukes under graviditet, eller hvis pasienten blir gravid mens du tar dette legemidlet, bør pasienten informeres om den potensielle risikoen for fosteret. (Se FORHOLDSREGLER : Svangerskap .)
Leversykdom
Behandling med CLOMID 25 mg er kontraindisert hos pasienter med leversykdom eller en historie med leverdysfunksjon (se også INDIKASJONER og BIVIRKNINGER ).
Unormal livmorblødning
CLOMID 25mg er kontraindisert hos pasienter med unormal livmorblødning av ubestemt opprinnelse (se INDIKASJONER ).
Cyster på eggstokkene
CLOMID er kontraindisert hos pasienter med ovariecyster eller forstørrelse som ikke skyldes polycystisk ovariesyndrom (se INDIKASJONER og ADVARSLER ).
Annen
CLOMID er kontraindisert hos pasienter med ukontrollert skjoldbrusk- eller binyredysfunksjon eller i nærvær av en organisk intrakraniell lesjon som hypofysetumor (se INDIKASJONER ).
KLINISK FARMAKOLOGI
Handling
CLOMID 25mg er et legemiddel med betydelig farmakologisk styrke. Med nøye utvalg og riktig behandling av pasienten, har CLOMID 100 mg vist seg å være en nyttig terapi for den anovulatoriske pasienten som ønsker å bli gravid.
Klomifensitrat er i stand til å samhandle med østrogenreseptorholdig vev, inkludert hypothalamus, hypofysen, eggstokken, endometriet, skjeden og livmorhalsen. Det kan konkurrere med østrogen om østrogen-reseptorbindingssteder og kan forsinke påfyll av intracellulære østrogenreseptorer. Klomifensitrat initierer en rekke endokrine hendelser som kulminerer i en preovulatorisk gonadotropinstigning og påfølgende follikulær ruptur. Den første endokrine hendelsen som respons på et kurs med klomifenterapi er en økning i frigjøringen av hypofysegonadotropiner. Dette initierer steroidogenese og follikulogenese, noe som resulterer i vekst av eggstokkfollikkelen og en økning i det sirkulerende nivået av østradiol. Etter eggløsning stiger og faller plasmaprogesteron og østradiol som i en normal eggløsningssyklus.
Tilgjengelige data tyder på at både de østrogene og antiøstrogene egenskapene til klomifen kan delta i initieringen av eggløsning. De to klomifenisomerene har vist seg å ha blandede østrogene og antiøstrogene effekter, som kan variere fra en art til en annen. Noen data tyder på at zuklomifen har større østrogen aktivitet enn enklomifen.
Klomifensitrat har ingen tilsynelatende progestasjonelle, androgene eller antiandrogene effekter og ser ikke ut til å forstyrre hypofyse-binyre- eller hypofyse-skjoldbruskkjertelen. Selv om det ikke er bevis på en "bærende effekt" av CLOMID, har spontane ovulatoriske menstruasjoner blitt observert hos noen pasienter etter CLOMID 100 mg-behandling.
Farmakokinetikk
Basert på tidlige studier med 14C-merket klomifensitrat, ble stoffet vist å absorberes lett oralt hos mennesker og skilles ut hovedsakelig i avføringen. Kumulativ urin- og fekal utskillelse av 14C var i gjennomsnitt ca. 50 % av den orale dosen og 37 % av en intravenøs dose etter 5 dager. Gjennomsnittlig urinutskillelse var ca. 8 % med fekal utskillelse på ca. 42 %.
Noe 14C-merke var fortsatt til stede i avføringen 6 uker etter administrering. Påfølgende enkeltdosestudier på normale frivillige viste at zuklomifen (cis) har lengre halveringstid enn enklomifen (trans). Detekterbare nivåer av zuklomifen vedvarte i mer enn en måned hos disse personene. Dette kan tyde på stereospesifikk enterohepatisk resirkulering eller sekvestrering av zuklomifen. Det er således mulig at noe aktivt medikament kan forbli i kroppen under tidlig graviditet hos kvinner som blir gravide i menstruasjonssyklusen under behandling med CLOMID.
Kliniske studier
Under kliniske undersøkelser fikk 7578 pasienter CLOMID, hvorav noen hadde andre hindringer for eggløsning enn ovulatorisk dysfunksjon (se INDIKASJONER ). I disse kliniske studiene forekom vellykket behandling preget av graviditet hos omtrent 30 % av disse pasientene.
Det ble rapportert totalt 2635 graviditeter i løpet av den kliniske prøveperioden. Av disse graviditetene var informasjon om utfallet kun tilgjengelig for 2369 av tilfellene. Tabell 1 oppsummerer utfallet av disse sakene.
Av de rapporterte svangerskapene var forekomsten av flerlingsgraviditet 7,98 %: 6,9 % tvilling, 0,5 % trilling, 0,3 % firling og 0,1 % femling. Av de 165 tvillingsvangerskapene som det forelå tilstrekkelig informasjon om, var forholdet mellom eneggede og tosidige tvillinger omtrent 1:5. Tabell 1 rapporterer overlevelsesraten for de levende flerfødte.
En sekstuplettfødsel ble rapportert etter fullføring av originale kliniske studier; ingen av sekstuplettene overlevde (hver veide mindre enn 400 g), selv om hver av dem virket helt normal.
Den totale overlevelsen for spedbarn fra flere graviditeter, inkludert spontane aborter, dødfødsler og neonatale dødsfall er 73 %.
Fetale/neonatale anomalier og dødelighet
Følgende føtale abnormiteter er rapportert etter graviditet etter ovulasjonsinduksjonsbehandling med CLOMID under kliniske studier. Hver av følgende føtale abnormiteter ble rapportert med en frekvens på
tillegg er det mottatt rapporter om medfødte anomalier under overvåking etter markedsføring av CLOMID (se BIVIRKNINGER ).
PASIENTINFORMASJON
Hensikten med og risikoen ved CLOMID-behandling bør presenteres for pasienten før behandlingsstart. Det bør understrekes at målet med CLOMID-behandling er eggløsning for påfølgende graviditet. Legen bør gi pasienten råd med spesiell hensyn til følgende potensielle risikoer:
Visuelle symptomer
Gi beskjed om at uskarphet eller andre visuelle symptomer av og til kan oppstå under eller kort tid etter CLOMID-behandling. Det bør gjøres klart for pasienten at synsforstyrrelser i noen tilfeller kan være langvarige og muligens irreversible, spesielt ved økt dosering eller varighet av behandlingen. Advar om at visuelle symptomer kan gjøre slike aktiviteter som å kjøre bil eller betjene maskiner mer farlig enn vanlig, spesielt under forhold med variabel belysning (se ADVARSLER ).
Pasienten bør instrueres om å informere legen hver gang det oppstår uvanlige visuelle symptomer. Hvis pasienten har noen visuelle symptomer, bør behandlingen avbrytes og fullstendig oftalmologisk utredning utføres.
Mage/bekkensmerter eller oppblåsthet
Ovarieforstørrelse kan forekomme under eller kort tid etter behandling med CLOMID. For å minimere risikoen forbundet med ovarieforstørrelse, bør pasienten instrueres om å informere legen om eventuelle mage- eller bekkensmerter, vektøkning, ubehag eller oppblåsthet etter å ha tatt CLOMID (se ADVARSLER ).
Flergangsgraviditet
Informer pasienten om at det er en økt sjanse for flerfoldsgraviditet, inkludert bilateral tubal graviditet og sameksisterende tubal og intrauterin graviditet, når unnfangelse oppstår i forhold til CLOMID-behandling. Potensielle komplikasjoner og farer ved flerlingsgraviditet bør forklares.
Spontan abort og medfødte anomalier
Informer pasienten om at tilgjengelige data ikke tyder på noen økning i hyppigheten av spontanabort (abort) eller medfødte anomalier ved bruk av CLOMID 50 mg hos mor sammenlignet med forekomstene i den generelle befolkningen.
Under klinisk undersøkelse viser erfaringen fra pasienter med kjent graviditetsutfall (tabell 1) en spontanabortrate på 20,4 % og dødfødselsrate på 1,0 %. (Se Kliniske studier ). Blant fødselsavvikene som spontant er rapportert som individuelle tilfeller siden kommersiell tilgjengelighet av Clomid, har andelen nevralrørsdefekter vært høy blant svangerskap assosiert med eggløsning indusert av Clomid, men dette har ikke blitt støttet av data fra populasjonsbaserte studier.
