Celebrex 100mg, 200mg Celecoxib Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Celebrex 100mg og hvordan brukes det?
Celebrex 200mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på akutt smerte eller betennelse. Celebrex kan brukes alene eller sammen med andre medisiner.
Celebrex 100mg tilhører en klasse legemidler som kalles ikke-steroide antiinflammatoriske legemidler (NSAIDs).
Det er ikke kjent om Celebrex er trygt og effektivt hos barn under 2 år.
Hva er de mulige bivirkningene av Celebrex 100mg?
Celebrex 200mg kan forårsake alvorlige bivirkninger inkludert:
- . opphovning, . rask vektøkning, . kortpustethet, . blodig eller tjæreaktig avføring, . hoste opp blod eller oppkast som ser ut som kaffegrut, . kvalme, . magesmerter øverst til høyre, . kløe, . tretthet, . mørk urin, . gulfarging av hud eller øyne (gulsott), . lite eller ingen vannlating, . hevelse i føttene eller anklene, . føler meg sliten, . blek hud, . svimmelhet, og . kalde hender og føtter
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Celebrex inkluderer:
- . magesmerter, . halsbrann, . gass, . diaré, . forstoppelse, . kvalme, . oppkast, . hevelse i hender eller føtter, . svimmelhet, en . d . forkjølelsessymptomer (tett nese, nysing, sår hals)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Celebrex. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
RISIKO FOR ALVORLIG HJERTE- OG GASTROINTESTINALE HENDELSER
Kardiovaskulære trombotiske hendelser
- . Ikke-steroide antiinflammatoriske legemidler (NSAIDs) forårsaker økt risiko for alvorlige kardiovaskulære trombotiske hendelser, inkludert hjerteinfarkt og hjerneslag, som kan være dødelige. Denne risikoen kan oppstå tidlig i behandlingen og kan øke med varigheten av bruken. [se ADVARSLER OG FORHOLDSREGLER] . CELEBREX er kontraindisert i forbindelse med koronar bypass-operasjon (CABG). [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER]
Gastrointestinal blødning, sårdannelse og perforering
- . NSAIDs forårsaker økt risiko for alvorlige gastrointestinale (GI) bivirkninger, inkludert blødning, sårdannelse og perforering av mage eller tarm, som kan være dødelig. Disse hendelsene kan oppstå når som helst under bruk og uten varselsymptomer. Eldre pasienter og pasienter med tidligere magesårsykdom og/eller GI-blødninger har større risiko for alvorlige (GI) hendelser. [se ADVARSLER OG FORHOLDSREGLER]
BESKRIVELSE
CELEBREX (celecoxib) kapsel er et ikke-steroid antiinflammatorisk legemiddel, tilgjengelig som kapsler som inneholder 50 mg, 100 mg, 200 mg og 400 mg celecoxib for oral administrering. Det kjemiske navnet er 4-[5-(4-metylfenyl)-3-(trifluormetyl)-1H-pyrazol-1-yl]benzensulfonamid og er en diaryl-substituert pyrazol. Molekylvekten er 381,38. Dens molekylære formel er C17H14F3N3O2S, og den har følgende kjemiske struktur:
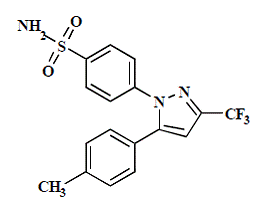
Celecoxib er et hvitt til off-white pulver med en pKa på 11,1 (sulfonamiddel). Celecoxib er hydrofob (log P er 3,5) og er praktisk talt uløselig i vandige medier ved fysiologisk pH-område.
De inaktive ingrediensene i CELEBREX 200mg inkluderer: kroskarmellosenatrium, spiselig blekk, gelatin, laktosemonohydrat, magnesiumstearat, povidon og natriumlaurylsulfat.
INDIKASJONER
CELEBREX er indikert
Artrose (OA)
For behandling av tegn og symptomer på OA [se Kliniske studier ].
Revmatoid artritt (RA)
For behandling av tegn og symptomer på RA [se Kliniske studier ].
Juvenil revmatoid artritt (JRA)
For behandling av tegn og symptomer på JRA hos pasienter 2 år og eldre [se Kliniske studier ].
Ankyloserende spondylitt (AS)
For håndtering av tegn og symptomer på AS [se Kliniske studier ].
Akutt smerte
For behandling av akutt smerte hos voksne [se Kliniske studier ].
Primær dysmenoré
For behandling av primær dysmenoré [se Kliniske studier ].
DOSERING OG ADMINISTRASJON
Generelle doseringsinstruksjoner
Vurder nøye de potensielle fordelene og risikoene ved CELEBREX og andre behandlingsalternativer før du bestemmer deg for å bruke CELEBREX. Bruk den laveste effektive dosen for den korteste varigheten i samsvar med individuelle pasientbehandlingsmål [se ADVARSLER OG FORHOLDSREGLER ].
Disse dosene kan gis uten hensyn til tidspunkt for måltider.
Artrose
For OA er dosen 200 mg per dag administrert som en enkeltdose eller som 100 mg to ganger daglig.
Leddgikt
For RA er dosen 100 mg til 200 mg to ganger daglig.
Juvenil revmatoid artritt
For JRA er doseringen for pediatriske pasienter (alder 2 år og eldre) basert på vekt. For pasienter ≥10 kg til ≤25 kg er anbefalt dose 50 mg to ganger daglig. For pasienter >25 kg er anbefalt dose 100 mg to ganger daglig.
For pasienter som har problemer med å svelge kapsler, kan innholdet i en CELEBREX-kapsel tilsettes eplemos. Hele kapselinnholdet tømmes forsiktig på en jevn teskje kjølig eller romtemperatur eplemos og inntas umiddelbart med vann. Innholdet av drysset kapsel på eplemos er stabilt i opptil 6 timer under kjøleforhold (2°C til 8°C/35°F til 45°F).
Ankyloserende spondylitt
For AS er dosen av CELEBREX 200 mg daglig i enkeltdoser (en gang daglig) eller delte (to ganger daglig). Hvis ingen effekt observeres etter 6 uker, kan en prøve på 400 mg daglig være verdt. Hvis det ikke observeres noen effekt etter 6 uker på 400 mg daglig, er det ikke sannsynlig med respons, og alternative behandlingsalternativer bør vurderes.
Behandling av akutte smerter og behandling av primær dysmenoré
For behandling av akutte smerter og behandling av primær dysmenoré er dosen 400 mg initialt, etterfulgt av en ekstra dose på 200 mg om nødvendig den første dagen. På etterfølgende dager er anbefalt dose 200 mg to ganger daglig etter behov.
Spesielle populasjoner
Nedsatt leverfunksjon
Hos pasienter med moderat nedsatt leverfunksjon (Child-Pugh klasse B), reduser dosen med 50 %. Bruk av CELEBREX 100 mg hos pasienter med alvorlig nedsatt leverfunksjon anbefales ikke [se ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner , og KLINISK FARMAKOLOGI ].
Dårlige metabolisatorer av CYP2C9-substrater
Hos voksne pasienter som er kjent eller mistenkt for å være dårlige CYP2C9-metabolisatorer basert på genotype eller tidligere historie/erfaring med andre CYP2C9-substrater (som warfarin, fenytoin), initier behandlingen med halvparten av den laveste anbefalte dosen.
Hos pasienter med JRA som er kjent eller mistenkt for å være dårlige CYP2C9-metabolisatorer, bør du vurdere å bruke alternative behandlinger [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
CELEBREX (celecoxib) kapsler:
50 mg hvit, med omvendt trykt hvitt på rødt bånd på kroppen og hette med markeringer på 7767 på hetten og 50 på kroppen.
100 mg hvit, med omvendt trykt hvitt på blått bånd på kroppen og hette med markeringer på 7767 på hetten og 100 på kroppen.
200 mg hvit, med omvendt trykt hvitt på gullbånd med markeringer på 7767 på hetten og 200 på kroppen.
400 mg hvit, med omvendt trykt hvitt på grønt bånd med markeringer på 7767 på hetten og 400 på kroppen.
Oppbevaring og håndtering
CELEBREX (celecoxib) 50 mg kapslene er hvite, med omvendt trykt hvitt på rødt bånd på kroppen og hette med markeringer på 7767 på hetten og 50 på kroppen, levert som:
CELEBREX (celecoxib) 100 mg kapslene er hvite, med omvendt trykt hvitt på blått bånd på kroppen og hette med markeringer på 7767 på hetten og 100 på kroppen, levert som:
CELEBREX (celecoxib) 200 mg kapslene er hvite, med omvendt trykt hvitt på gullbånd med markeringer på 7767 på hetten og 200 på kroppen, levert som:
CELEBREX (celecoxib) 400 mg kapslene er hvite, med omvendt trykt hvitt på grønt bånd med markeringer på 7767 på theca og 400 på kroppen, levert som:
Oppbevaring
Oppbevares ved romtemperatur 20°C til 25°C (68°F til 77°F); utflukter tillatt mellom 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ].
Distribuert av: GD Searle LLC, Division of Pfizer Inc, NY, NY 10017. Revidert: april 2021
BIVIRKNINGER
Følgende bivirkninger er omtalt mer detaljert i andre deler av merkingen:
- . Kardiovaskulære trombotiske hendelser [se ADVARSLER OG FORHOLDSREGLER ] . GI-blødning, sårdannelse og perforering [se ADVARSLER OG FORHOLDSREGLER ] . Levertoksisitet [se ADVARSLER OG FORHOLDSREGLER ] . Hypertensjon [se ADVARSLER OG FORHOLDSREGLER ] . Hjertesvikt og ødem [se ADVARSLER OG FORHOLDSREGLER ] . Nyretoksisitet og hyperkalemi [se ADVARSLER OG FORHOLDSREGLER ] . Anafylaktiske reaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Alvorlige hudreaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Hematologisk toksisitet [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis. Bivirkningsinformasjonen fra kliniske studier gir imidlertid et grunnlag for å identifisere de uønskede hendelsene som ser ut til å være relatert til legemiddelbruk og for å tilnærme rater.
Av de CELEBREX-behandlede pasientene i de kontrollerte kliniske studiene før markedsføring, var ca. 4 250 pasienter med OA, ca. 2 100 pasienter med RA, og ca. 1 050 pasienter med postkirurgiske smerter. Mer enn 8 500 pasienter fikk en total daglig dose av CELEBREX 200 mg på 200 mg (100 mg to ganger daglig eller 200 mg én gang daglig) eller mer, inkludert mer enn 400 behandlet med 800 mg (400 mg to ganger daglig). Omtrent 3 900 pasienter fikk CELEBREX i disse dosene i 6 måneder eller mer; ca. 2300 av disse har mottatt den i 1 år eller mer og 124 av disse har mottatt den i 2 år eller mer.
Forsøk med kontrollert leddgikt før markedsføring
Tabell 1 viser alle bivirkninger, uavhengig av årsakssammenheng, som forekommer hos ≥2 % av pasientene som fikk CELEBREX 100 mg fra 12 kontrollerte studier utført på pasienter med OA eller RA som inkluderte en placebo og/eller en positiv kontrollgruppe. Siden disse 12 studiene var av ulik varighet, og pasientene i studiene kanskje ikke har vært eksponert i samme tidsperiode, fanger ikke disse prosentene opp kumulative forekomster.
I placebo- eller aktivkontrollerte kliniske studier var seponeringsfrekvensen på grunn av bivirkninger 7,1 % for pasienter som fikk CELEBREX og 6,1 % for pasienter som fikk placebo. Blant de vanligste årsakene til seponering på grunn av uønskede hendelser i CELEBREX-behandlingsgruppene var dyspepsi og magesmerter (angitt som årsaker til seponering hos henholdsvis 0,8 % og 0,7 % av CELEBREX-pasientene). Blant pasienter som fikk placebo, avbrøt 0,6 % behandlingen på grunn av dyspepsi og 0,6 % trakk seg på grunn av magesmerter.
Følgende bivirkninger forekom hos 0,1 % til 1,9 % av pasientene behandlet med CELEBREX (100 mg til 200 mg to ganger daglig eller 200 mg én gang daglig):
Gastrointestinale: Forstoppelse, divertikulitt, dysfagi, eruktasjon, øsofagitt, gastritt, gastroenteritt, gastroøsofageal refluks, hemorroider, hiatal brokk, melena, munntørrhet, stomatitt, tenesmus, oppkast
Kardiovaskulær: Forverret hypertensjon, angina pectoris, koronarsykdom, hjerteinfarkt
Generell: Overfølsomhet, allergisk reaksjon, brystsmerter, cyste NOS, generalisert ødem, ansiktsødem, tretthet, feber, hetetokter, influensalignende symptomer, smerte, perifere smerte
Sentralt, perifert nervesystem: Benkramper, hypertoni, hypoestesi, migrene, parestesi, vertigo
Hørsel og vestibulær: Døvhet, tinnitus
Hjertefrekvens og rytme: Hjertebank, takykardi
Lever og galleveier: Leverenzym økt (inkludert SGOT økt, SGPT økt)
Metabolsk og ernæringsmessig: blod urea nitrogen (BUN) økt, kreatinfosfokinase (CPK) økt, hyperkolesterolemi, hyperglykemi, hypokalemi, NPN økt, kreatinin økt, alkalisk fosfatase økt, vektøkt
Muskuloskeletal: Artralgi, artrose, myalgi, synovitt, senebetennelse
Blodplater (blødning eller koagulering): Ekkymose, neseblødning, trombocytemi,
Psykiatrisk: Anoreksi, angst, økt appetitt, depresjon, nervøsitet, somnolens
Hemisk: Anemi
Luftveiene: Bronkitt, bronkospasme, bronkospasme forverret, hoste, dyspné, laryngitt, lungebetennelse
Hud og vedheng: Alopecia, dermatitt, lysfølsomhetsreaksjon, kløe, erytematøst utslett, makulopapulært utslett, hudlidelse, tørr hud, økt svette, urticaria
Forstyrrelser på applikasjonsstedet: Cellulitt, dermatittkontakt
Urin: Albuminuri, blærebetennelse, dysuri, hematuri, vannlatingsfrekvens, renal calculus
Følgende alvorlige bivirkninger (årsakssammenheng ikke evaluert) forekom hos
Kardiovaskulær: Synkope, kongestiv hjertesvikt, ventrikkelflimmer, lungeemboli, cerebrovaskulær ulykke, perifer koldbrann, tromboflebitt
Gastrointestinale: Intestinal obstruksjon, tarmperforasjon, gastrointestinal blødning, kolitt med blødning, esophageal perforasjon, pankreatitt, ileus
Generell: Sepsis, plutselig død
Lever og galleveier: Kolelithiasis
Hemisk og lymfatisk: Trombocytopeni
Nervøs: Ataksi, selvmord [se NARKOTIKAHANDEL ]
Nyre: Akutt nyresvikt
Celecoxib langsiktig leddgiktsikkerhetsstudie
[se Kliniske studier ]
Hematologiske hendelser: Forekomsten av klinisk signifikant reduksjon i hemoglobin (>2 g/dL) var lavere hos pasienter på CELEBREX 400 mg to ganger daglig (0,5 %) sammenlignet med pasienter på enten diklofenak 75 mg to ganger daglig (1,3 %) eller ibuprofen 800 mg tre ganger daglig 1,9 %. Den lavere forekomsten av hendelser med CELEBREX ble opprettholdt med eller uten bruk av aspirin [se KLINISK FARMAKOLOGI ].
Uttak/alvorlige uønskede hendelser: Kaplan-Meier kumulative rater ved 9 måneder for seponeringer på grunn av bivirkninger for CELEBREX 100 mg, diklofenak og ibuprofen var henholdsvis 24 %, 29 % og 26 %. Hyppighetene for alvorlige uønskede hendelser (dvs. forårsaket sykehusinnleggelse eller føltes som livstruende eller på annen måte medisinsk signifikant), uavhengig av årsakssammenheng, var ikke forskjellige på tvers av behandlingsgruppene (henholdsvis 8 %, 7 % og 8 %).
Juvenil Revmatoid Artritt Studie
en 12-ukers, dobbeltblind, aktiv-kontrollert studie ble 242 JRA-pasienter i alderen 2 år til 17 år behandlet med celecoxib eller naproxen; 77 JRA-pasienter ble behandlet med celecoxib 3 mg/kg to ganger daglig, 82 pasienter ble behandlet med celecoxib 6 mg/kg to ganger daglig, og 83 pasienter ble behandlet med naproksen 7,5 mg/kg to ganger daglig. De vanligst forekommende (≥5 %) bivirkningene hos celecoxib-behandlede pasienter var hodepine, feber (pyreksi), øvre magesmerter, hoste, nasofaryngitt, magesmerter, kvalme, artralgi, diaré og oppkast. De vanligste bivirkningene (≥5 %) for pasienter behandlet med naproksen var hodepine, kvalme, oppkast, feber, øvre magesmerter, diaré, hoste, magesmerter og svimmelhet (tabell 2). Sammenlignet med naproksen hadde celecoxib i doser på 3 og 6 mg/kg to ganger daglig ingen observerbar skadelig effekt på vekst og utvikling i løpet av den 12-ukers dobbeltblinde studien. Det var ingen vesentlig forskjell i antall kliniske eksaserbasjoner av uveitt eller systemiske trekk ved JRA blant behandlingsgruppene.
en 12-ukers åpen utvidelse av den dobbeltblinde studien beskrevet ovenfor, ble 202 JRA-pasienter behandlet med celecoxib 6 mg/kg to ganger daglig. Forekomsten av uønskede hendelser var lik den som ble observert under den dobbeltblinde studien; ingen uventede bivirkninger av klinisk betydning dukket opp.
Andre forhåndsgodkjenningsstudier
Uønskede hendelser fra studier av ankyloserende spondylitt
Totalt 378 pasienter ble behandlet med CELEBREX 200 mg i placebo- og aktivkontrollerte AS-studier. Doser opp til 400 mg én gang daglig ble studert. Bivirkningstypene rapportert i AS-studiene var lik de som ble rapportert i OA/RA-studiene.
Uønskede hendelser fra studier av analgesi og dysmenoré
Omtrent 1700 pasienter ble behandlet med CELEBREX 200 mg i analgesi- og dysmenoréstudier. Alle pasienter i smertestudier etter oral kirurgi fikk en enkelt dose studiemedisin. Doser opp til 600 mg/dag av CELEBREX 200 mg ble studert i primær dysmenoré-studier og smertestudier etter ortopedisk kirurgi. Typen av uønskede hendelser i analgesi- og dysmenoréstudiene var lik de som ble rapportert i artrittstudier. Den eneste ekstra bivirkningen som ble rapportert var post-dental ekstraksjon alveolær osteitt (tørr socket) i smertestudiene etter oral kirurgi.
APC- og PreSAP-prøvene
Bivirkninger fra langsiktige, placebokontrollerte polyppforebyggende studier
Eksponering for CELEBREX i APC- og PreSAP-studiene var 400 mg til 800 mg daglig i opptil 3 år [se Kliniske studier ].
Noen bivirkninger forekom hos høyere prosentandeler av pasienter enn i førmarkedsføringsstudiene med leddgikt (behandlingsvarighet opptil 12 uker; se Bivirkninger fra CELEBREX 200 mg kontrollerte leddgiktstudier før markedsføring, ovenfor). Bivirkningene for hvilke disse forskjellene hos pasienter behandlet med CELEBREX var større sammenlignet med førmarkedsføringsstudiene med leddgikt, var som følger:
Følgende tilleggsbivirkninger forekom hos ≥0,1 % og
Forstyrrelser i nervesystemet: Cerebralt infarkt
Øyelidelser: Glasslegemet flyter, konjunktival blødning
Øre og labyrint: Labyrintitt
Hjertesykdommer: Angina ustabil, aortaklaffen inkompetanse, koronar arterie aterosklerose, sinus bradykardi, ventrikulær hypertrofi
Vaskulære lidelser: Dyp venetrombose
Reproduksjonssystem og brystsykdommer: Ovariecyste
Undersøkelser: Kalium i blodet økte, blodnatrium økt, blodtestosteron redusert
Skader, forgiftning og prosedyrekomplikasjoner: Epikondylitt, seneruptur
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av CELEBREX etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering.
Kardiovaskulær: Vaskulitt, dyp venøs trombose
Generell: Anafylaktoid reaksjon, angioødem
Lever og galleveier: Levernekrose, hepatitt, gulsott, leversvikt
Hemisk og lymfatisk: Agranulocytose, aplastisk anemi, pancytopeni, leukopeni
Metabolsk: Hypoglykemi, hyponatremi
Nervøs: Aseptisk meningitt, ageusia, anosmia, dødelig intrakraniell blødning
Nyre: Interstitiell nefritt
NARKOTIKAHANDEL
Se tabell 3 for klinisk signifikante legemiddelinteraksjoner med celecoxib.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Kardiovaskulære trombotiske hendelser
Kliniske studier av flere cyklooksygenase-2 (COX-2) selektive og ikke-selektive NSAIDs av opptil tre års varighet har vist økt risiko for alvorlige kardiovaskulære (CV) trombotiske hendelser, inkludert hjerteinfarkt (MI) og hjerneslag, som kan være dødelige. Basert på tilgjengelige data er det uklart at risikoen for CV-trombotiske hendelser er lik for alle NSAIDs. Den relative økningen i alvorlige CV-trombotiske hendelser over baseline forårsaket av NSAID-bruk ser ut til å være lik hos de med og uten kjent CV-sykdom eller risikofaktorer for CV-sykdom. Pasienter med kjent CV-sykdom eller risikofaktorer hadde imidlertid en høyere absolutt forekomst av overskytende alvorlige CV-trombotiske hendelser, på grunn av økt baselinerate. Noen observasjonsstudier fant at denne økte risikoen for alvorlige CV-trombotiske hendelser begynte så tidlig som de første ukene av behandlingen. Økningen i CV-trombotisk risiko har blitt observert mest konsekvent ved høyere doser.
APC-studien (Adenoma Prevention with Celecoxib) var det omtrent tre ganger økt risiko for det sammensatte endepunktet kardiovaskulær død, MI eller hjerneslag for behandlingsarmene CELEBREX 400 mg to ganger daglig og CELEBREX 200 mg to ganger daglig sammenlignet med placebo. Økningen i begge dosegruppene med celecoxib sammenlignet med placebo-behandlede pasienter skyldtes hovedsakelig økt forekomst av hjerteinfarkt [se Kliniske studier ].
En randomisert kontrollert studie med tittelen Prospective Randomized Evaluation of Celecoxib Integrated Safety vs. Ibuprofen or Naproxen (PRECISION) ble utført for å vurdere den relative kardiovaskulære trombotiske risikoen for en COX-2-hemmer, celecoxib, sammenlignet med de ikke-selektive NSAIDene naprofenen og ibuprofenen. Celecoxib 100 mg to ganger daglig var ikke dårligere enn naproxen 375 til 500 mg to ganger daglig og ibuprofen 600 til 800 mg tre ganger daglig for det sammensatte endepunktet til antiplatelet trialists' Samarbeid (APTC), som består av kardiovaskulær død (inkludert hemorragisk død), ikke-dødelig hjerteinfarkt og ikke-dødelig hjerneslag [se Kliniske studier ].
For å minimere den potensielle risikoen for en uønsket CV-hendelse hos NSAID-behandlede pasienter, bruk den laveste effektive dosen for kortest mulig varighet. Leger og pasienter bør være på vakt for utviklingen av slike hendelser, gjennom hele behandlingsforløpet, selv i fravær av tidligere CV-symptomer. Pasienter bør informeres om symptomene på alvorlige CV-hendelser og trinnene de skal ta hvis de oppstår.
Det er ingen konsistente bevis for at samtidig bruk av aspirin reduserer den økte risikoen for alvorlige CV-trombotiske hendelser forbundet med NSAID-bruk. Samtidig bruk av aspirin og et NSAID, som celecoxib, øker risikoen for alvorlige gastrointestinale (GI) hendelser [se ADVARSLER OG FORHOLDSREGLER ].
Status etter koronar bypass graft (CABG) kirurgi
To store, kontrollerte kliniske studier av et COX-2 selektivt NSAID for behandling av smerte i de første 10 til 14 dagene etter CABG-operasjon fant en økt forekomst av hjerteinfarkt og hjerneslag. NSAIDs er kontraindisert ved CABG [se KONTRAINDIKASJONER ].
Pasienter etter MI
Observasjonsstudier utført i det danske folkeregisteret har vist at pasienter behandlet med NSAIDs i post-MI-perioden hadde økt risiko for reinfarkt, CV-relatert død og dødelighet av alle årsaker fra den første uken av behandlingen. I denne samme kohorten var forekomsten av død det første året etter MI 20 per 100 personår hos NSAID-behandlede pasienter sammenlignet med 12 per 100 personår hos ikke-NSAID-eksponerte pasienter. Selv om den absolutte dødsraten falt noe etter det første året etter MI, vedvarte den økte relative risikoen for død hos NSAID-brukere over minst de neste fire årene med oppfølging.
Unngå bruk av CELEBREX 100mg hos pasienter med nylig hjerteinfarkt med mindre fordelene forventes å oppveie risikoen for tilbakevendende CV-trombotiske hendelser. Hvis CELEBREX brukes hos pasienter med nylig hjerteinfarkt, overvåk pasientene for tegn på hjerteiskemi.
Gastrointestinal blødning, sårdannelse og perforering
NSAIDs, inkludert celecoxib forårsaker alvorlige gastrointestinale (GI) bivirkninger, inkludert betennelse, blødning, sårdannelse og perforering av spiserøret, magen, tynntarmen eller tykktarmen, som kan være dødelig. Disse alvorlige bivirkningene kan oppstå når som helst, med eller uten varselsymptomer, hos pasienter behandlet med CELEBREX. Bare én av fem pasienter som utvikler en alvorlig øvre GI-bivirkning under NSAID-behandling er symptomatisk. Øvre GI-sår, grov blødning eller perforasjon forårsaket av NSAIDs forekom hos omtrent 1 % av pasientene behandlet i 3 til 6 måneder, og hos omtrent 2 % til 4 % av pasientene behandlet i ett år. Men selv kortvarig NSAID-behandling er ikke uten risiko.
Risikofaktorer for GI-blødning, sårdannelse og perforering
Pasienter med tidligere magesårsykdom og/eller GI-blødninger som brukte NSAIDs hadde en mer enn 10 ganger økt risiko for å utvikle GI-blødning sammenlignet med pasienter uten disse risikofaktorene. Andre faktorer som øker risikoen for GI-blødning hos pasienter behandlet med NSAIDs inkluderer lengre varighet av NSAID-behandling; samtidig bruk av orale kortikosteroider, blodplatehemmere (som aspirin), antikoagulantia; eller selektive serotoninreopptakshemmere (SSRI); røyking; bruk av alkohol; eldre alder; og dårlig generell helsetilstand. De fleste rapporter etter markedsføring om fatale GI-hendelser skjedde hos eldre eller svekkede pasienter. I tillegg har pasienter med avansert leversykdom og/eller koagulopati økt risiko for GI-blødning.
Hyppigheten av kompliserte og symptomatiske sår var 0,78 % etter ni måneder for alle pasienter i CLASS-studien, og 2,19 % for undergruppen på lavdose ASA. Pasienter 65 år og eldre hadde en insidens på 1,40 % ved ni måneder, 3,06 % når de også tok ASA [se Kliniske studier ].
Strategier for å minimere GI-risikoen hos NSAID-behandlede pasienter
- . Bruk den laveste effektive dosen for kortest mulig varighet. . Unngå administrering av mer enn ett NSAID om gangen. . Unngå bruk hos pasienter med høyere risiko med mindre fordelene forventes å oppveie den økte risikoen for blødning. For slike pasienter, så vel som de med aktiv GI-blødning, bør du vurdere alternative behandlinger andre enn NSAIDs. . Vær på vakt for tegn og symptomer på magesår og blødninger under NSAID-behandling. . Hvis det er mistanke om en alvorlig GI-bivirkning, initier umiddelbart evaluering og behandling, og seponer CELEBREX 200 mg inntil en alvorlig GI-bivirkning er utelukket. . Ved samtidig bruk av lavdose acetylsalisylsyre for hjerteprofylakse, overvåk pasienter tettere for tegn på GI-blødning [se NARKOTIKAHANDEL ].
Hepatotoksisitet
Forhøyelser av ALAT eller ASAT (tre eller flere ganger øvre normalgrense [ULN]) er rapportert hos omtrent 1 % av NSAID-behandlede pasienter i kliniske studier. I tillegg er det rapportert sjeldne, noen ganger dødelige, tilfeller av alvorlig leverskade, inkludert fulminant hepatitt, levernekrose og leversvikt.
Forhøyelser av ALAT eller ASAT (mindre enn tre ganger ULN) kan forekomme hos opptil 15 % av pasientene som behandles med NSAIDs inkludert celecoxib.
I kontrollerte kliniske studier av CELEBREX 200 mg var forekomsten av grensestigninger (større enn eller lik 1,2 ganger og mindre enn 3 ganger øvre normalgrense) av leverassosierte enzymer 6 % for CELEBREX og 5 % for placebo, og ca. 0,2 % av pasientene som tok CELEBREX og 0,3 % av pasientene som tok placebo hadde merkbare forhøyelser av ALAT og ASAT.
Informer pasientene om varseltegn og symptomer på levertoksisitet (f.eks. kvalme, tretthet, sløvhet, diaré, kløe, gulsott, ømhet i øvre øvre kvadrant og "influensalignende" symptomer). Hvis kliniske tegn og symptomer forenlig med leversykdom utvikles, eller hvis systemiske manifestasjoner oppstår (f.eks. eosinofili, utslett), seponer CELEBREX umiddelbart og utfør en klinisk evaluering av pasienten.
Hypertensjon
NSAIDs, inkludert CELEBREX 200 mg, kan føre til ny oppstart av hypertensjon eller forverring av eksisterende hypertensjon, som begge kan bidra til økt forekomst av CV-hendelser. Pasienter som tar angiotensin-konverterende enzym (ACE)-hemmere, tiaziddiuretika eller loop-diuretika kan ha nedsatt respons på disse behandlingene når de tar NSAIDs [se NARKOTIKAHANDEL ].
Se Kliniske studier for ytterligere blodtrykksdata for CELEBREX.
Overvåk blodtrykket (BP) under oppstart av NSAID-behandling og gjennom hele behandlingen.
Hjertesvikt og ødem
Coxib og tradisjonelle NSAID-forsøkere' Samarbeidsmetaanalyse av randomiserte kontrollerte studier viste en omtrent to ganger økning i sykehusinnleggelser for hjertesvikt hos COX-2 selektivt behandlede pasienter og ikke-selektive NSAID-behandlede pasienter sammenlignet med placebobehandlede pasienter. I en dansk nasjonal registerstudie av pasienter med hjertesvikt økte NSAID-bruk risikoen for MI, sykehusinnleggelse for hjertesvikt og død.
I tillegg har væskeretensjon og ødem blitt observert hos noen pasienter behandlet med NSAIDs. Bruk av celecoxib kan gjøre CV-effektene av flere terapeutiske midler som brukes til å behandle disse medisinske tilstandene (f.eks. diuretika, ACE-hemmere eller angiotensinreseptorblokkere [ARB]) [se NARKOTIKAHANDEL ].
I CLASS-studien [se Kliniske studier ], Kaplan-Meier kumulative rater ved 9 måneder med perifert ødem inneliggende pasienter på CELEBREX 400 mg to ganger daglig (henholdsvis 4 ganger og 2 ganger anbefalte OA og RA doser), ibuprofen 800 mg tre ganger daglig og diklofenak 75 mg to ganger daglig var henholdsvis 4,5 %, 6,9 % og 4,7 %.
Unngå bruk av CELEBREX 200 mg hos pasienter med alvorlig hjertesvikt med mindre fordelene forventes å oppveie risikoen for forverring av hjertesvikt. Hvis CELEBREX 100mg brukes til pasienter med alvorlig hjertesvikt, overvåk pasientene for tegn på forverret hjertesvikt.
Nyretoksisitet og hyperkalemi
Nyretoksisitet
Langvarig administrering av NSAIDs har resultert i nyrepapillær nekrose og annen nyreskade.
Nyretoksisitet er også sett hos pasienter hvor nyreprostaglandiner har en kompenserende rolle i vedlikehold av nyreperfusjon. Hos disse pasientene kan administrering av et NSAID forårsake en doseavhengig reduksjon i prostaglandinformasjon og sekundært i renal blodstrøm, noe som kan utløse åpenbar nyredekompensasjon. Pasienter med størst risiko for denne reaksjonen er de med nedsatt nyrefunksjon, dehydrering, hypovolemi, hjertesvikt, leverdysfunksjon, de som tar diuretika, ACE-hemmere eller ARB, og eldre. Seponering av NSAID-behandling etterfølges vanligvis av gjenoppretting til forbehandlingstilstand.
Ingen informasjon er tilgjengelig fra kontrollerte kliniske studier angående bruk av CELEBREX 100 mg hos pasienter med avansert nyresykdom. Nyreeffektene av CELEBREX kan fremskynde progresjonen av nyredysfunksjon hos pasienter med eksisterende nyresykdom.
Korrekt volumstatus hos dehydrerte eller hypovolemiske pasienter før oppstart av CELEBREX. Overvåk nyrefunksjonen hos pasienter med nedsatt nyre- eller leverfunksjon, hjertesvikt, dehydrering eller hypovolemi under bruk av CELEBREX [se NARKOTIKAHANDEL ]. Unngå bruk av CELEBREX 200 mg hos pasienter med avansert nyresykdom med mindre fordelene forventes å oppveie risikoen for forverret nyrefunksjon. Hvis CELEBREX 200 mg brukes til pasienter med avansert nyresykdom, overvåk pasienter for tegn på forverret nyrefunksjon.
Hyperkalemi
Økning i serumkaliumkonsentrasjon, inkludert hyperkalemi, er rapportert ved bruk av NSAIDs, selv hos noen pasienter uten nedsatt nyrefunksjon. Hos pasienter med normal nyrefunksjon har disse effektene blitt tilskrevet ahyporeninemisk-hypoaldosteronisme.
Anafylaktiske reaksjoner
Celecoxib har vært assosiert med anafylaktiske reaksjoner hos pasienter med og uten kjent overfølsomhet overfor celecoxib og hos pasienter med aspirinsensitiv astma. Celebrex 200mg er et sulfonamid og både NSAIDs og sulfonamider kan forårsake allergiske reaksjoner inkludert anafylaktiske symptomer og livstruende eller mindre alvorlige astmatiske episoder hos visse mottakelige personer [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Søk nødhjelp hvis noen anafylaktisk reaksjon oppstår.
Forverring av astma relatert til aspirinfølsomhet
En underpopulasjon av pasienter med astma kan ha aspirinsensitiv astma som kan omfatte kronisk rhinosinusitt komplisert av nesepolypper; alvorlig, potensielt dødelig bronkospasme; og/eller intoleranse mot aspirin og andre NSAIDs. Fordi kryssreaktivitet mellom aspirin og andre NSAIDs er rapportert hos slike aspirinsensitive pasienter, er CELEBREX kontraindisert hos pasienter med denne formen for aspirinsensitivitet [se KONTRAINDIKASJONER ]. Når CELEBREX brukes til pasienter med eksisterende astma (uten kjent aspirinfølsomhet), overvåk pasientene for endringer i tegn og symptomer på astma.
Alvorlige hudreaksjoner
Alvorlige hudreaksjoner har oppstått etter behandling med Celebrex 200 mg, inkludert erythema multiforme, eksfoliativ dermatitt, Stevens-Johnson syndrom (SJS), toksisk epidermal nekrolyse (TEN), medikamentreaksjon med eosinofili og systemiske symptomer (DRESS) og akutt generalisert eksantematøs pustulose AGEP). Disse alvorlige hendelsene kan oppstå uten forvarsel og kan være dødelige.
Informer pasientene om tegn og symptomer på alvorlige hudreaksjoner, og å avbryte bruken av CELEBREX 100 mg ved første opptreden av hudutslett eller andre tegn på overfølsomhet. CELEBREX 200mg er kontraindisert hos pasienter med tidligere alvorlige hudreaksjoner på NSAIDs [se KONTRAINDIKASJONER ].
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS)
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) er rapportert hos pasienter som tar NSAIDs som CELEBREX. Noen av disse hendelsene har vært dødelige eller livstruende. DRESS gir vanligvis, men ikke utelukkende, feber, utslett, lymfadenopati og/eller hevelse i ansiktet. Andre kliniske manifestasjoner kan inkludere hepatitt, nefritt, hematologiske abnormiteter, myokarditt eller myositt. Noen ganger kan symptomer på DRESS ligne på en akutt virusinfeksjon. Eosinofili er ofte tilstede. Fordi denne lidelsen er variabel i presentasjonen, kan andre organsystemer som ikke er nevnt her være involvert. Det er viktig å merke seg at tidlige manifestasjoner av overfølsomhet, som feber eller lymfadenopati, kan være tilstede selv om utslett ikke er tydelig. Hvis slike tegn eller symptomer er tilstede, seponer CELEBREX 200mg og evaluer pasienten umiddelbart.
Fostertoksisitet
For tidlig stenging av føtal ductus arteriosus
Unngå bruk av NSAIDs, inkludert CELEBREX 100mg, hos gravide kvinner ved ca. 30 ukers svangerskap og senere. NSAIDs, inkludert CELEBREX, øker risikoen for for tidlig lukking av fosterets ductus arteriosus ved omtrent denne svangerskapsalderen.
Oligohydramnios/neonatal nyresvikt
Bruk av NSAIDs, inkludert CELEBREX, ved ca. 20 svangerskapsuker eller senere i svangerskapet kan forårsake føtal nyresvikt som fører til oligohydramnios og, i noen tilfeller, nyresvikt hos nyfødte. Disse uønskede utfallene sees i gjennomsnitt etter dager til uker med behandling, selv om oligohydramnios sjelden har blitt rapportert så snart som 48 timer etter NSAID-start. Oligohydramnios er ofte, men ikke alltid, reversibelt ved seponering av behandlingen. Komplikasjoner av langvarig oligohydramnios kan for eksempel inkludere lemmerkontrakturer og forsinket lungemodning. I noen tilfeller etter markedsføring av nedsatt nyrefunksjon hos nyfødte, var invasive prosedyrer som utvekslingstransfusjon eller dialyse nødvendig.
Hvis NSAID-behandling er nødvendig mellom ca. 20 uker og 30 ukers svangerskap, begrense bruken av CELEBREX til den laveste effektive dosen og kortest mulig varighet. Vurder ultralydovervåking av fostervann hvis behandlingen med CELEBREX varer utover 48 timer. Seponer CELEBREX hvis oligohydramnios oppstår og følg opp i henhold til klinisk praksis[se Bruk i spesifikke populasjoner ].
Hematologisk toksisitet
Anemi har forekommet hos NSAID-behandlede pasienter. Dette kan skyldes okkult eller grovt blodtap, væskeretensjon eller en ufullstendig beskrevet effekt på erytropoesen. Hvis en pasient behandlet med CELEBREX har noen tegn eller symptomer på anemi, overvåk hemoglobin eller hematokrit.
I kontrollerte kliniske studier var forekomsten av anemi 0,6 % med CELEBREX og 0,4 % med placebo. Pasienter på langtidsbehandling med CELEBREX 200 mg bør få hemoglobin eller hematokrit kontrollert dersom de viser tegn eller symptomer på anemi eller blodtap.
NSAIDs, inkludert CELEBREX 100 mg, kan øke risikoen for blødningshendelser. Komorbide tilstander som koagulasjonsforstyrrelser eller samtidig bruk av warfarin, andre antikoagulantia, blodplatehemmere (f.eks. aspirin), SSRI og serotonin noradrenalin gjenopptakshemmere (SNRI) kan øke denne risikoen. Overvåk disse pasientene for tegn på blødning [se NARKOTIKAHANDEL ].
Maskering av betennelse og feber
Den farmakologiske aktiviteten til CELEBREX 100 mg for å redusere betennelse, og muligens feber, kan redusere nytten av diagnostiske tegn for å oppdage infeksjoner.
Laboratorieovervåking
Fordi alvorlig GI-blødning, hepatotoksisitet og nyreskade kan oppstå uten advarselssymptomer eller tegn, bør du vurdere å overvåke pasienter på langvarig NSAID-behandling med en CBC og en kjemiprofil med jevne mellomrom [se ADVARSLER OG FORHOLDSREGLER ].
kontrollerte kliniske studier forekom forhøyet BUN hyppigere hos pasienter som fikk CELEBREX sammenlignet med pasientens sønn placebo. Denne laboratorieavviket ble også sett hos pasienter som fikk komparatoriske NSAIDs i disse studiene. Den kliniske betydningen av denne abnormiteten er ikke fastslått.
Disseminert intravaskulær koagulasjon (DIC)
På grunn av risikoen for disseminert intravaskulær koagulasjon ved bruk av CELEBREX 200 mg hos pediatriske pasienter med systemisk debut JRA, overvåk pasienter for tegn og symptomer på unormal koagulasjon eller blødning, og informer pasienter og deres omsorgspersoner om å rapportere symptomer så snart som mulig.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning ) som følger med hver resept som utleveres. Informer pasienter, familier eller deres omsorgspersoner om følgende informasjon før du starter behandling med CELEBREX og med jevne mellomrom i løpet av pågående behandling.
Kardiovaskulære trombotiske hendelser
Råd pasientene til å være på vakt for symptomene på kardiovaskulære trombotiske hendelser, inkludert brystsmerter, kortpustethet, svakhet eller sløret tale, og rapportere alle disse symptomene til helsepersonell umiddelbart [se ADVARSLER OG FORHOLDSREGLER ].
Gastrointestinal blødning, sårdannelse og perforering
Råd pasientene til å rapportere symptomer på sårdannelse og blødning, inkludert epigastriasmerte, dyspepsi, melena og hematemese til helsepersonell. Ved samtidig bruk av lavdose aspirin for hjerteprofylakse, informer pasientene om økt risiko for og tegn og symptomer på GI-blødning [se ADVARSLER OG FORHOLDSREGLER ].
Hepatotoksisitet
Informer pasientene om advarselstegn og symptomer på levertoksisitet (f.eks. kvalme, tretthet, sløvhet, kløe, diaré gulsott, ømhet i øvre høyre kvadrant og "influensalignende" symptomer). Hvis disse oppstår, instruer pasientene om å slutte med CELEBREX 200 mg og oppsøke øyeblikkelig medisinsk behandling [se ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner ].
Hjertesvikt og ødem
Råd pasientene til å være på vakt for symptomene på kongestiv hjertesvikt inkludert kortpustethet, uforklarlig vektøkning eller ødem og kontakte helsepersonell dersom slike symptomer oppstår [se ADVARSLER OG FORHOLDSREGLER ].
Anafylaktiske reaksjoner
Informer pasientene om tegn på en anafylaktisk reaksjon (f.eks. pustevansker, hevelse i ansikt eller hals). Instruer pasienter om å søke øyeblikkelig nødhjelp hvis disse oppstår [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Alvorlige hudreaksjoner, inkludert DRESS
Råd pasientene til å slutte å ta CELEBREX 100 mg umiddelbart hvis de utvikler noen form for utslett eller feber og kontakte helsepersonell så snart som mulig [se ADVARSLER OG FORHOLDSREGLER ].
Kvinnelig fruktbarhet
Informer kvinner med reproduktivt potensial som ønsker graviditet som NSAIDs, inkludert CELEBREX 200 mg, kan være assosiert med er versible forsinkelser i eggløsning [se Bruk i spesifikke populasjoner ].
Fostertoksisitet
Informer gravide kvinner om å unngå bruk av CELEBREX og andre NSAIDs fra og med 30 ukers svangerskap på grunn av risikoen for for tidlig lukking av fosterets ductus arteriosus. Hvis behandling med CELEBREX 200 mg er nødvendig for en gravid kvinne mellom ca. 20 til 30 ukers svangerskap, informer henne om at hun kanskje må overvåkes for oligohydramnios, hvis behandlingen fortsetter i mer enn 48 timer [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Unngå samtidig bruk av NSAIDs
Informer pasienter om at samtidig bruk av CELEBREX med andre NSAIDs eller salisylater (f.eks. diflunisal, salsalat) ikke anbefales på grunn av økt risiko for gastrointestinal toksisitet og liten eller ingen økning i effekt [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ]. Varsle pasienter om at NSAIDs kan være til stede i "reseptfri" medisiner for behandling av forkjølelse, feber eller søvnløshet.
Bruk av NSAID og lavdose aspirin
Informer pasienter om ikke å bruke lavdose aspirin samtidig med CELEBREX 200 mg før de har snakket med helsepersonell [se NARKOTIKAHANDEL ].
Merkingen av dette produktet kan ha blitt oppdatert. For den nyeste forskrivningsinformasjonen, vennligst besøk www.pfizer.com.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Celecoxib var ikke kreftfremkallende hos Sprague-Dawley-rotter som fikk orale doser på opptil 200 mg/kg for hanner og 10 mg/kg for hunner (omtrent 2 til 4 ganger den menneskelige eksponeringen målt ved AUC0-24 ved 200 mg to ganger daglig ) eller hos mus gitt orale doser opptil 25 mg/kg for hanner og 50 mg/kg for hunner (omtrent lik human eksponering målt ved AUC0-24 ved 200 mg to ganger daglig) i to år.
Mutagenese
Celecoxib var ikke mutagent i en Ames-test og en mutasjonsanalyse i ovarieceller fra kinesisk hamster (CHO), og heller ikke klastogen i en kromosomavviksanalyse i CHO-celler og en in vivo mikronukleustest i rottebenmarg.
Nedsatt fruktbarhet
Celecoxib hadde ingen effekt på mannlig eller kvinnelig fertilitet eller mannlig reproduksjonsfunksjon hos rotter ved orale doser opptil 600 mg/kg/dag (ca. 11 ganger human eksponering ved 200 mg to ganger daglig basert på AUC0-24). Ved ≥50 mg/kg/dag (ca. 6 ganger human eksponering basert på AUC0-24 ved 200 mg to ganger daglig) var det økt preimplantasjonstap.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Bruk av NSAIDs, inkludert CELEBREX 200 mg, kan føre til for tidlig lukking av føtal ductus arteriosus og føtal nyresvikt som fører til oligohydramnios og, i noen tilfeller, nyresvikt hos nyfødte. På grunn av disse risikoene, begrense dosen og varigheten av CELEBREX 200 mg bruk mellom ca. 20 og 30 uker av svangerskapet og unngå bruk av CELEBREX ved ca. 30 uker av svangerskapet og senere i svangerskapet (se Kliniske vurderinger, data ).
For tidlig stenging av føtal ductus arteriosus
Bruk av NSAIDs, inkludert CELEBREX, ved ca. 30 svangerskapsuker eller senere i svangerskapet øker risikoen for for tidlig lukking av fosterets ductus arteriosus.
Oligohydramnios/neonatal nyresvikt
Bruk av NSAIDs ved ca. 20 ukers svangerskap eller senere i svangerskapet har vært assosiert med tilfeller av føtal nyresvikt som fører til oligohydramnios, og i noen tilfeller nyresvikt hos nyfødte.
Data fra observasjonsstudier angående andre potensielle embryoføtale risikoer ved bruk av NSAID hos kvinner i første eller andre trimester av svangerskapet er ikke konklusive. I reproduksjonsstudier på dyr ble embryo-føtale dødsfall og en økning i diafragmatisk brokk observert hos rotter som ble administrert celecoxib daglig i løpet av organogeneseperioden ved orale doser omtrent 6 ganger den maksimale anbefalte humane dosen (MRHD) på 200 mg to ganger daglig. I tillegg ble strukturelle abnormiteter (f.eks. septaldefekter, sammensmeltede ribber, sammensmeltede brystben og feilformede brystben) observert hos kaniner som ble gitt daglige orale doser av celecoxib i løpet av organogeneseperioden med omtrent 2 ganger MRHD (se Data ). Basert på dyredata har prostaglandiner vist seg å ha en viktig rolle i endometrial vaskulær permeabilitet, blastocystimplantasjon og decidualisering. I dyrestudier resulterte administrering av prostaglandinsyntesehemmere som celecoxib i økt pre- og post-implantasjonstap. Prostaglandiner har også vist seg å ha en viktig rolle i fosterets nyreutvikling. I publiserte dyrestudier har prostaglandinsyntesehemmere blitt rapportert å svekke nyreutviklingen når de administreres i klinisk relevante doser.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Fetale/neonatale bivirkninger
For tidlig stenging av føtal ductus arteriosus
Unngå bruk av NSAIDs hos kvinner ved ca. 30 ukers svangerskap og senere i svangerskapet, fordi NSAIDs, inkludert CELEBREX 200 mg, kan forårsake for tidlig stenging av fosterets ductus arteriosus (se Data ).
Oligohydramnios/neonatal nyresvikt:
Hvis et NSAID er nødvendig ved ca. 20 ukers svangerskap eller senere i svangerskapet, begrense bruken til den laveste effektive dosen og kortest mulig varighet. Hvis CELEBREX-behandlingen varer utover 48 timer, bør du vurdere å overvåke med ultralyd for oligohydramnios. Hvis oligohydramnios oppstår, seponer CELEBREX og følg opp i henhold til klinisk praksis (se Data ).
Arbeid eller levering
Det er ingen studier på effekten av CELEBREX under fødsel eller fødsel. I dyrestudier hemmer NSAIDs, inkludert celecoxib, prostaglandinsyntesen, forårsaker forsinket fødsel og øker forekomsten av dødfødsler.
Data
Menneskelige data
Tilgjengelige data fastslår ikke tilstedeværelse eller fravær av utviklingstoksisitet relatert til bruk av CELEBREX.
For tidlig stenging av føtal ductus arteriosus
Publisert litteratur rapporterer at bruk av NSAIDs ved ca. 30 uker av svangerskapet og senere i svangerskapet kan forårsake for tidlig lukking av fosterets ductus arteriosus.
Oligohydramnios/neonatal nyresvikt
Publiserte studier og rapporter etter markedsføring beskriver mors NSAID-bruk ved ca. 20 ukers svangerskap eller senere i svangerskapet assosiert med føtal nyresvikt som fører til oligohydramnios, og i noen tilfeller, nyresvikt hos nyfødte. Disse uønskede utfallene sees i gjennomsnitt etter dager til uker med behandling, selv om oligohydramnios sjelden har blitt rapportert så snart som 48 timer etter NSAID-start. I mange tilfeller, men ikke alle, var nedgangen i fostervann forbigående og reversibel ved seponering av medikamentet. Det har vært et begrenset antall kasusrapporter om bruk av NSAID hos mor og nyresvikt hos nyfødte uten oligohydramnios, hvorav noen var irreversible. Noen tilfeller av nyresvikt hos nyfødte krevde behandling med invasive prosedyrer, som utvekslingstransfusjon eller dialyse.
Metodiske begrensninger ved disse postmarkedsføringsstudiene og rapportene inkluderer mangel på en kontrollgruppe; begrenset informasjon om dose, varighet og tidspunkt for medikamenteksponering; og samtidig bruk av andre medisiner. Disse begrensningene utelukker etablering av et pålitelig estimat av risikoen for uønskede føtale og neonatale utfall ved bruk av NSAID hos mor. Fordi de publiserte sikkerhetsdataene om nyfødte utfall hovedsakelig involverte premature spedbarn, er det usikkert om visse rapporterte risikoer for fullbårne spedbarn eksponert for NSAIDs ved bruk av mor kan generaliseres.
Dyredata
Celecoxib ved orale doser ≥150 mg/kg/dag (ca. 2 ganger eksponeringen hos mennesker ved 200 mg to ganger daglig målt ved AUC0–24), forårsaket økt forekomst av ventrikkelseptumdefekter, en sjelden hendelse og fosterforandringer, som f.eks. ribben smeltet sammen, brystbenene smeltet sammen og brystene misformes når kaniner ble behandlet gjennom hele organogenesen. En doseavhengig økning av indiafragmatisk brokk ble observert når rotter ble gitt celecoxib i orale doser ≥30 mg/kg/dag (ca. 6 ganger human eksponering basert på AUC 0–24 ved 200 mg to ganger daglig for RA) gjennom hele organogenesen. Hos rotter resulterte eksponering for celecoxib under tidlig embryonal utvikling i pre-implantasjon og post-implantasjonstap ved orale doser ≥50 mg/kg/dag (omtrent 6 ganger human eksponering basert på AUC 0–24 ved 200 mg to ganger daglig for RA).
Celecoxib ga ingen tegn på forsinket fødsel eller forsinket fødsel ved orale doser opptil 100 mg/kg hos rotter (ca. 7 ganger menneskelig eksponering målt ved AUC 0–24 ved 200 mg to ganger daglig). Effekten av CELEBREX på fødsel og fødsel hos gravide kvinner er ukjent.
Amming
Risikosammendrag
Begrensede data fra 3 publiserte rapporter som inkluderte totalt 12 ammende kvinner, viste lave nivåer av CELEBREX i morsmelk. Den beregnede gjennomsnittlige daglige spedbarnsdosen var 10 til 40 mikrogram/kg/dag, mindre enn 1 % av den vektbaserte terapeutiske dosen for et to år gammelt barn. En rapport om to spedbarn som ammes på 17 og 22 måneder viste ingen bivirkninger. Forsiktighet bør utvises når CELEBREX 100 mg gis til en ammende kvinne. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med mors kliniske behov for CELEBREX og eventuelle skadelige effekter på det ammede spedbarnet fra CELEBREX 200 mg eller fra den underliggende mors tilstand.
Kvinner og menn med reproduktivt potensial
Infertilitet
Kvinner
Basert på virkningsmekanismen, kan bruk av prostaglandin-mediert NSAID, inkludert CELEBREX, forsinke eller forhindre ruptur av eggstokkfollikler, som har vært assosiert med reversibel infertilitet hos noen kvinner. Publiserte dyrestudier har vist at administrering av prostaglandinsyntesehemmere har potensial til å forstyrre prostaglandinmediert follikulær ruptur som kreves for eggløsning. Små studier på kvinner behandlet med NSAIDs har også vist en reversibel forsinkelse i eggløsning. Vurder seponering av NSAIDs, inkludert CELEBREX 200mg, hos kvinner som har problemer med å bli gravide eller som er under utredning av infertilitet.
Pediatrisk bruk
CELEBREX 200mg er godkjent for lindring av tegn og symptomer på juvenil revmatoid artritt hos pasienter 2 år og eldre. Sikkerhet og effekt har ikke blitt undersøkt etter seks måneder hos barn. Den langsiktige kardiovaskulære toksisiteten hos barn eksponert for CELEBREX 100 mg har ikke blitt evaluert, og det er ukjent om langsiktige risikoer kan være lik den som er sett hos voksne eksponert for CELEBREX eller andre COX-2 selektive og ikke-selektive NSAIDs [se ADVARSEL i boks , ADVARSLER OG FORHOLDSREGLER , og Kliniske studier ].
Bruken av celecoxib hos pasienter i alderen 2 år til 17 år med pauciartikulær, polyartikulær JRA eller hos pasienter med systemisk debut JRA ble studert i en 12-ukers, dobbeltblind, aktiv kontrollert, farmakokinetisk, sikkerhets- og effektstudie, med en 12 ukers åpen forlengelse. Celecoxib er ikke studert hos pasienter under 2 år, hos pasienter med kroppsvekt mindre enn 10 kg (22 lbs), og hos pasienter med aktive systemiske funksjoner. Pasienter med systemisk debut JRA (uten aktive systemiske trekk) ser ut til å ha risiko for utvikling av unormale koagulasjonslaboratorietester. Hos noen pasienter med systemisk debut JRA var både celekoksib og naproksen assosiert med mild forlengelse av aktivert partiell tromboplastintid (APTT), men ikke protrombintid (PT). Når NSAIDs inkludert celecoxib brukes hos pasienter med systemisk debut JRA, overvåk pasienter for tegn og symptomer på unormal koagulering eller blødning, på grunn av risikoen for disseminert intravaskulær koagulasjon. Pasienter med systemisk debut JRA bør overvåkes for utvikling av unormale koagulasjonstester [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , BIVIRKNINGER , dyretoksikologi , Kliniske studier ].
Alternative terapier for behandling av JRA bør vurderes hos pediatriske pasienter identifisert for å være CYP2C9-fattige metabolisatorer [se Dårlige metabolisatorer av CYP2C9-substrater ].
Geriatrisk bruk
Eldre pasienter, sammenlignet med yngre pasienter, har større risiko for NSAID-assosierte alvorlige kardiovaskulære, gastrointestinale og/eller renale bivirkninger. Hvis den forventede fordelen for den eldre pasienten oppveier disse potensielle risikoene, start doseringen i den lave enden av doseringsområdet og overvåk pasientene for bivirkninger [se ADVARSLER OG FORHOLDSREGLER ].
Av det totale antallet pasienter som fikk CELEBREX 100 mg i kliniske studier før godkjenning, var mer enn 3 300 65–74 år gamle, mens omtrent 1 300 ekstra pasienter var 75 år og eldre. Ingen vesentlige forskjeller i effektivitet ble observert mellom disse forsøkspersonene og yngre forsøkspersoner. I kliniske studier som sammenlignet nyrefunksjon målt ved GFR, BUN og kreatinin, og blodplatefunksjon målt ved blødningstid og blodplateaggregering, var resultatene ikke forskjellige mellom eldre og unge frivillige. Men som med andre NSAIDs, inkludert de som selektivt hemmer COX-2, har det vært flere spontane rapporter etter markedsføring om fatale GI-hendelser og akutt nyresvikt hos eldre enn hos yngre pasienter [se ADVARSLER OG FORHOLDSREGLER ].
Nedsatt leverfunksjon
Den daglige anbefalte dosen av CELEBREX kapsler til pasienter med moderat nedsatt leverfunksjon (Child-Pugh klasse B) bør reduseres med 50 %. Bruk av CELEBREX hos pasienter med alvorlig nedsatt leverfunksjon anbefales ikke [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
CELEBREX anbefales ikke til pasienter med alvorlig nyresvikt [se ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Dårlige metabolisatorer av CYP2C9-substrater
Hos pasienter som er kjent eller mistenkt for å være dårlige CYP2C9-metabolisatorer (dvs. CYP2C9*3/*3), basert på genotype eller tidligere historie/erfaring med andre CYP2C9-substrater (som warfarin, fenytoin), gis CELEBREX 200mg med start med halvparten av laveste anbefalt dose. Alternativ behandling bør vurderes hos JRA-pasienter som er identifisert som CYP2C9-fattige metabolisatorer [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
OVERDOSE
Symptomer etter akutte NSAID-overdoser har vanligvis vært begrenset til sløvhet, døsighet, kvalme, oppkast og epigastriasmerte, som generelt har vært reversible med støttebehandling. Gastrointestinal blødning har oppstått. Hypertensjon, akutt nyresvikt, respirasjonsdepresjon og koma har forekommet, men var sjeldne [se ADVARSLER OG FORHOLDSREGLER ].
Ingen overdoser av CELEBREX 200 mg ble rapportert under kliniske studier. Doser opptil 2400 mg/dag i opptil 10 dager hos 12 pasienter resulterte ikke i alvorlig toksisitet. Ingen informasjon er tilgjengelig om fjerning av celekoksib ved hemodialyse, men basert på dens høye grad av plasmaproteinbinding (>97 %) er det usannsynlig at dialyse vil være nyttig ved overdose.
Behandle pasienter med symptomatisk og støttende behandling etter en NSAID-overdosering. Det er ingen spesifikke motgift. Vurder brekninger og/eller aktivt kull (60 til 100 gram hos voksne, 1 til 2 gram per kg kroppsvekt hos pediatriske pasienter) og/eller osmotisk katartisk hos symptomatiske pasienter sett innen fire timer etter inntak eller hos pasienter med stor overdosering ( 5 til 10 ganger anbefalt dose). Tvunget diurese, alkalinisering av urin, hemodialyse eller hemoperfusjon er kanskje ikke nyttig på grunn av høy proteinbinding.
For ytterligere informasjon om overdoseringsbehandling, kontakt et giftkontrollsenter (1-800-222-1222).
KONTRAINDIKASJONER
CELEBREX er kontraindisert hos følgende pasienter:
- . Kjent overfølsomhet (f.eks. anafylaktiske reaksjoner og alvorlige hudreaksjoner) overfor celecoxib, alle komponenter i legemiddelet [se ADVARSLER OG FORHOLDSREGLER ]. . Anamnese med astma, urticaria eller andre allergiske reaksjoner etter inntak av aspirin eller andre NSAIDs. Alvorlige, noen ganger fatale, anafylaktiske reaksjoner på NSAIDs er rapportert hos slike pasienter [se ADVARSLER OG FORHOLDSREGLER ]. . I innstillingen av CABG-kirurgi [se ADVARSLER OG FORHOLDSREGLER ]. . Hos pasienter som har vist allergiske reaksjoner på sulfonamider [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Celecoxib har smertestillende, anti-inflammatoriske og febernedsettende egenskaper.
Virkningsmekanismen til CELEBREX 100 mg antas å skyldes hemming av prostaglandinsyntese, primært via hemming av COX-2.
Celecoxib er en potent hemmer av prostaglandinsyntese in vitro. Celekoksibkonsentrasjoner oppnådd under behandling har gitt in vivo-effekter. Prostaglandiner sensibiliserer afferente nerver og potenserer virkningen av bradykinin for å indusere smerte i dyremodeller. Prostaglandiner er mediatorer av betennelse. Siden celecoxib er en hemmer av prostaglandinsyntese, kan dets virkemåte skyldes en reduksjon av prostaglandiner i perifert vev.
Farmakodynamikk
Blodplater
kliniske studier med normale frivillige, hadde CELEBREX ved enkeltdoser på opptil 800 mg og flere doser på 600 mg to ganger daglig i opptil 7 dagers varighet (høyere enn anbefalte terapeutiske doser) ingen effekt på reduksjon av blodplateaggregering eller økning i blødningstid. På grunn av mangelen på blodplateeffekter er CELEBREX 100mg ikke en erstatning for aspirin for kardiovaskulær profylakse. Det er ikke kjent om det er noen effekter av CELEBREX på blodplater som kan bidra til økt risiko for alvorlige kardiovaskulære trombotiske bivirkninger forbundet med bruk av CELEBREX.
Væskeretensjon
Inhibering av PGE2-syntese kan føre til natrium- og vannretensjon gjennom økt reabsorpsjon i nyremarvens tykke stigende løkke av Henle og kanskje andre segmenter av det distale nefronet. I samlekanalene ser PGE2 ut til å hemme vannreabsorpsjon ved å motvirke virkningen av antidiuretisk hormon.
Farmakokinetikk
Celecoxib viser doseproporsjonal økning i eksponering etter oral administrering opp til 200 mg to ganger daglig og mindre enn proporsjonal økning ved høyere doser. Den har omfattende distribusjon og høy proteinbinding. Det metaboliseres primært av CYP2C9 med en halveringstid på ca. 11 timer.
Absorpsjon
Maksimal plasmanivå av celekoksib inntreffer ca. 3 timer etter en oral dose. Under fastende forhold er både maksimale plasmanivåer (Cmax) og arealet under kurven (AUC) omtrent doseproporsjonale opp til 200 mg to ganger daglig; ved høyere doser er det mindre enn proporsjonale økninger i Cmax og AUC (se Mateffekter ). Absolutte biotilgjengelighetsstudier er ikke utført. Ved gjentatt dosering oppnås steady-state-tilstander på eller før dag 5. De farmakokinetiske parameterne til celecoxib i en gruppe friske forsøkspersoner er vist i tabell 4.
Mateffekter
Når CELEBREX 200 mg kapsler ble tatt sammen med et fettrikt måltid, ble maksimale plasmanivåer forsinket i ca. 1 til 2 timer med en økning i total absorpsjon (AUC) på 10 % til 20 %. Under fastende forhold, ved doser over 200 mg, er det mindre enn en proporsjonal økning i Cmax og AUC, som antas å skyldes den lave løseligheten til legemidlet i vandige medier.
Samtidig administrering av CELEBREX med et antacida som inneholder aluminium og magnesium resulterte i en reduksjon i plasmakonsentrasjonen av celekoksib med en reduksjon på 37 % i Cmax og 10 % i AUC. CELEBREX, i doser på opptil 200 mg to ganger daglig, kan administreres uten hensyn til tidspunkt for måltider. Høyere doser (400 mg to ganger daglig) bør gis sammen med mat for å forbedre absorpsjonen.
Hos friske voksne frivillige var den totale systemiske eksponeringen (AUC) av celecoxib ekvivalent når celecoxib ble administrert som intakt kapsel eller kapselinnhold drysset på eplemos. Det var ingen signifikante endringer i Cmax, Tmax eller t½ etter administrering av kapselinnhold på eplemos [se DOSERING OG ADMINISTRASJON ].
Fordeling
Hos friske personer er celecoxib sterkt proteinbundet (~97 %) innenfor det kliniske doseområdet. In vitro-studier indikerer at celekoksib primært binder seg til albumin og, i mindre grad, α-syreglykoprotein. Det tilsynelatende distribusjonsvolumet ved steady state (V/F) er omtrent 400 L, noe som tyder på omfattende distribusjon i vevet. Celecoxib er ikke fortrinnsvis bundet til røde blodlegemer.
Eliminering
Metabolisme
Celecoxib metabolisme medieres primært via CYP2C9. Tre metabolitter, en primær alkohol, den tilsvarende karboksylsyren og dens glukuronidkonjugat, er identifisert i humant plasma. Disse metabolittene er inaktive som COX-1- eller COX-2-hemmere.
Utskillelse
Celekoksib elimineres hovedsakelig ved levermetabolisme, og lite (
Spesifikke populasjoner
Geriatrisk
Ved steady state hadde eldre personer (over 65 år) 40 % høyere Cmax og 50 % høyere AUC sammenlignet med de unge. Hos eldre kvinner er Cmax og AUC for celecoxib høyere enn for eldre menn, men disse økningene skyldes hovedsakelig lavere kroppsvekt hos eldre kvinner. Dosejustering hos eldre er generelt ikke nødvendig. Men for pasienter med en kroppsvekt under 50 kg, start behandlingen med den laveste anbefalte dosen [se Bruk i spesifikke populasjoner ].
Pediatrisk
Steady state farmakokinetikken til celekoksib administrert som en undersøkelses oral suspensjon ble evaluert hos 152 JRA-pasienter i alderen 2 år til 17 år som veide ≥10 kg med pauciartikulær eller polyartikulær JRA og hos pasienter med systemisk debut JRA. Populasjonsfarmakokinetisk analyse indikerte at den orale clearance (ujustert for kroppsvekt) av celecoxib øker mindre enn proporsjonalt med økende vekt, med 10 kg og 25 kg pasienter spådd å ha henholdsvis 40 % og 24 % lavere clearance, sammenlignet med en 70 kg voksen RA tålmodig.
Administrering av 50 mg kapsler to ganger daglig til JRA-pasienter som veier ≥12 til ≤25 kg og 100 mg kapsler til JRA-pasienter som veier >25 kg bør oppnå plasmakonsentrasjoner som ligner på de som ble observert i en klinisk studie som viste at celekoksib ikke er mindreverdig overfor naproxen 7,5 mg/kg to ganger daglig [se DOSERING OG ADMINISTRASJON ]. Celecoxib har ikke blitt studert hos JRA-pasienter under 2 år, hos pasienter med kroppsvekt mindre enn 10 kg (22 lbs), eller utover 24 uker.
Løp
Meta-analyse av farmakokinetiske studier har antydet en ca. 40 % høyere AUC for celecoxib hos svarte sammenlignet med kaukasiere. Årsaken og den kliniske betydningen av dette funnet er ukjent.
Nedsatt leverfunksjon
En farmakokinetisk studie hos personer med mild (Child-Pugh klasse A) og moderat (Child-Pugh klasse B) nedsatt leverfunksjon har vist at steady-state AUC for celecoxib er økt med henholdsvis ca. 40 % og 180 %, over det som sees hos frisk kontroll. fag. Derfor bør den daglige anbefalte dosen av CELEBREX kapsler reduseres med ca. 50 % hos pasienter med moderat (Child-Pugh klasse B) nedsatt leverfunksjon. Pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh klasse C) er ikke studert. Bruk av CELEBREX hos pasienter med alvorlig nedsatt leverfunksjon anbefales ikke [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Nedsatt nyrefunksjon
en kryssstudie-sammenligning var AUC for celekoksib omtrent 40 % lavere hos pasienter med kronisk nyresvikt (GFR35–60 ml/min) enn hos personer med normal nyrefunksjon. Det ble ikke funnet noen signifikant sammenheng mellom GFR og celekoksib-clearance. Pasienter med alvorlig nyresvikt er ikke studert. I likhet med andre NSAIDs anbefales ikke CELEBREX 200 mg til pasienter med alvorlig nyresvikt [se ADVARSLER OG FORHOLDSREGLER ].
Legemiddelinteraksjonsstudier
In vitro-studier indikerer at celekoksib ikke er en hemmer av cytokrom P450 2C9, 2C19 eller 3A4.
In vivo-studier har vist følgende:
Aspirin
Når NSAIDs ble administrert sammen med aspirin, ble proteinbindingen til NSAIDs redusert, selv om clearance av fri NSAID ikke ble endret. Den kliniske betydningen av denne interaksjonen er ikke kjent. Se tabell 3 for klinisk signifikante legemiddelinteraksjoner av NSAIDs med aspirin [se NARKOTIKAHANDEL ].
Litium
en studie utført på friske forsøkspersoner økte gjennomsnittlige steady-state litiumplasmanivåer med ca. 17 % hos forsøkspersoner som fikk litium 450 mg to ganger daglig med CELEBREX 200 mg to ganger daglig sammenlignet med forsøkspersoner som fikk litium alene. NARKOTIKAHANDEL ].
Flukonazol
Samtidig administrering av flukonazol i 200 mg én gang daglig resulterte i en to ganger økning i plasmakonsentrasjonen av celecoxib. Denne økningen skyldes hemming av celecoxib metabolisme via P450 2C9 av flukonazol [se NARKOTIKAHANDEL ].
Andre stoffer
Effekten av celekoksib på farmakokinetikken og/eller farmakodynamikken til glyburid, ketokonazol, [se NARKOTIKAHANDEL ], fenytoin og tolbutamid har blitt studert in vivo og klinisk viktige interaksjoner er ikke funnet.
Farmakogenomikk
CYP2C9-aktivitet er redusert hos individer med genetiske polymorfismer som fører til redusert enzymaktivitet, slik som de som er homozygote for CYP2C9*2 og CYP2C9*3 polymorfismer. Begrensede data fra 4 publiserte rapporter som inkluderte totalt 8 personer med den homozygote CYP2C9*3/*3 genotypen, viste systemiske nivåer av celekoksib som var 3- til 7 ganger høyere hos disse individene sammenlignet med personer med CYP2C9*1/*1 eller * I/*3 genotyper. Farmakokinetikken til celekoksib har ikke blitt evaluert hos personer med andre CYP2C9-polymorfismer, slik som *2, *5, *6, *9 og *11. Det er anslått at frekvensen av den homozygote *3/*3 genotypen er 0,3 % til 1,0 % i ulike etniske grupper [se DOSERING OG ADMINISTRASJON , Bruk i spesifikke populasjoner ].
dyretoksikologi
En økning i forekomsten av bakgrunnsfunn av spermatocele med eller uten sekundære forandringer som epididymalhy pospermia samt minimal til svak utvidelse av sædrørene ble sett hos juvenile rotter. Selv om disse reproduksjonsfunnene tilsynelatende var behandlingsrelaterte, økte ikke i insidens eller alvorlighetsgrad med dose og kan indikere en forverring av en spontan tilstand. Lignende reproduksjonsfunn ble ikke observert i studier av unge eller voksne hunder eller hos voksne rotter behandlet med celecoxib. Den kliniske betydningen av denne observasjonen er ukjent.
Kliniske studier
Artrose
CELEBREX 200mg har vist betydelig reduksjon i leddsmerter sammenlignet med placebo. CELEBREX ble evaluert for behandling av tegn og symptomer på OA i kne og hofte i placebo- og aktivt kontrollerte kliniske studier av opptil 12 ukers varighet. Hos pasienter med artrose resulterte behandling med CELEBREX 100 mg to ganger daglig eller 200 mg én gang daglig i bedring i WOMAC (Western Ontario og McMaster Universities) artroseindeks, en sammensetning av smerte, stivhet og funksjonelle mål ved OA. I tre 12-ukers studier av smerter som ledsager OA-utbrudd, ga CELEBREX 100 mg doser på 100 mg to ganger daglig og 200 mg to ganger daglig signifikant reduksjon av smerte innen 24 til 48 timer etter start av dosering. Ved doser på 100 mg to ganger daglig eller 200 mg to ganger daglig ble effekten av CELEBREX 200 mg vist å være lik den til naproxen 500 mg to ganger daglig. Doser på 200 mg to ganger daglig ga ingen ekstra fordel utover det som sees med 100 mg to ganger daglig. En total daglig dose på 200 mg har vist seg å være like effektiv enten den administreres som 100 mg to ganger daglig eller 200 mg én gang daglig.
Leddgikt
CELEBREX har vist signifikant reduksjon i leddømhet/smerte og leddhevelse sammenlignet med placebo. CELEBREX 100 mg ble evaluert for behandling av tegn og symptomer på RA i placebo- og aktivt kontrollerte kliniske studier med en varighet på opptil 24 uker. CELEBREX ble vist å være overlegen placebo i disse studiene, ved å bruke ACR20 Responder Index, en sammensetning av kliniske, laboratoriemessige og funksjonelle mål ved RA. CELEBREX-doser på 100 mg to ganger daglig og 200 mg to ganger daglig var like i effektivitet og begge var sammenlignbare med naproxen 500 mg to ganger daglig.
Selv om CELEBREX 100 mg to ganger daglig og 200 mg to ganger daglig ga tilsvarende total effekt, hadde noen pasienter ytterligere fordel av dosen på 200 mg to ganger daglig. Doser på 400 mg to ganger daglig ga ingen ekstra fordel utover det som sees med 100 mg til 200 mg to ganger daglig.
Juvenil revmatoid artritt (NCT00652925)
en 12-ukers, randomisert, dobbeltblind aktiv-kontrollert, parallellgruppe, multisenter, non-inferiority studie, pasienter fra 2 år til 17 år med pauciartikulær, polyartikulær JRA eller systemisk debut JRA (med for tiden inaktive systemiske trekk ), mottok en av følgende behandlinger: celecoxib 3 mg/kg (til maksimalt 150 mg) to ganger daglig; celecoxib 6 mg/kg (til maksimalt 300 mg) to ganger daglig; eller naproxen 7,5 mg/kg (til maksimalt 500 mg) to ganger daglig. Responsratene var basert på JRA-definisjonen av forbedring større enn eller lik 30 % (JRA DOI 30), som er en sammensetning av kliniske, laboratoriemessige og funksjonelle mål for JRA. JRA DOI 30-responsratene ved uke 12 var henholdsvis 69 %, 80 % og 67 % i celecoxib 3 mg/kg to ganger daglig, celecoxib 6 mg/kg to ganger daglig og naproxen 7,5 mg/kg to ganger daglig behandlingsgruppene.
Effekten og sikkerheten til CELEBREX 100 mg for JRA er ikke undersøkt etter seks måneder. Den langsiktige kardiovaskulære toksisiteten hos barn eksponert for CELEBREX 200 mg har ikke blitt evaluert, og det er ukjent om langtidsrisikoen kan være lik den som er sett hos voksne eksponert for CELEBREX 100 mg eller andre COX-2 selektive og ikke-selektive NSAIDs [ se ADVARSEL i boks , ADVARSLER OG FORHOLDSREGLER ].
Ankyloserende spondylitt
CELEBREX ble evaluert hos AS-pasienter i to placebo- og aktivkontrollerte kliniske studier av 6 og 12 ukers varighet. CELEBREX ved doser på 100 mg to ganger daglig, 200 mg én gang daglig og 400 mg én gang daglig ble vist å være statistisk overlegen placebo i disse studiene for alle tre co-primære effektmål som vurderer global smerteintensitet (Visual Analogue Scale), global sykdomsaktivitet (Visual Analogue Scale) og funksjonsnedsettelse (Bath Ankyloserende Spondylitt Functional Index). I den 12-ukers studien var det ingen forskjell i graden av forbedring mellom 200 mg og 400 mg CELEBREX 200 mg doser i en sammenligning av gjennomsnittlig endring fra baseline, men det var en større prosentandel av pasientene som responderte på CELEBREX 400 mg, 53 %, enn til CELEBREX 200 mg, 44 %, ved bruk av vurderingskriteriene for Bekhterevs sykdom (ASAS20). ASAS 20 definerer en responder som en forbedring fra baseline på minst 20 % og en absolutt forbedring på minst 10 mm, på en 0 mm til 100 mm skala, i minst tre av de fire følgende domenene: pasientens globale smerte, Bath Ankyloserende Spondylitt Funksjonell indeks og betennelse. Responseranalysen viste heller ingen endring i responderraten utover 6 uker.
Analgesi, inkludert primær dysmenoré
I akutte analgetiske modeller av postoral kirurgi smerte, postortopedisk kirurgisk smerte og primær dysmenoré, lindret CELEBREX 100 mg smerte som ble vurdert av pasienter som moderat til alvorlig. Enkeltdoser [se DOSERING OG ADMINISTRASJON ] av CELEBREX 200 mg ga smertelindring innen 60 minutter.
Kardiovaskulære utfallsforsøk: Prospektiv randomisert evaluering av Celecoxib Integrert sikkerhet vs. Ibuprofen eller Naproxen (PRESISJON; NCT00346216)
Design
PRECISION-studien var en dobbeltblind randomisert kontrollert studie av kardiovaskulær sikkerhet hos OA- og RA-pasienter med eller med høy risiko for kardiovaskulær sykdom, sammenlignet med celecoxib med naproxen og ibuprofen. Pasientene ble randomisert til en startdose på 100 mg to ganger daglig av celecoxib, 600 mg tre ganger daglig av ibuprofen, eller 375 mg to ganger daglig av naproxen, med mulighet for å øke dosen etter behov for smertebehandling. Basert på merkede doser kunne ikke OA-pasienter randomisert til celecoxib doseeskalere.
Det primære endepunktet, Antiplatelet Trialists' Collaboration (APTC) kompositt, var en uavhengig dømt kompositt av kardiovaskulær død (inkludert hemorragisk død), ikke-dødelig hjerteinfarkt og ikke-dødelig hjerneslag med 80 % kraft til å evaluere ikke-inferioritet. Alle pasienter ble foreskrevet åpen esomeprazol (20–40 mg) for gastrobeskyttelse. Behandlingsrandomisering ble stratifisert ved baseline lavdose aspirinbruk.
I tillegg var det en 4-måneders delstudie som vurderte effekten av de tre legemidlene på blodtrykket målt ved ambulant overvåking.
Resultater
Blant forsøkspersoner med OA var det bare 0,2 % (17/7259) som eskalerte celecoxib til 200 mg to ganger daglig dose, mens 54,7 % (3946/7208) eskalerte ibuprofen til 800 mg tre ganger daglig, og 54,8 % (3937/717 napro)en eskalerte til 500 mg to ganger daglig dose. Blant forsøkspersoner med RA eskalerte 55,7 % (453/813) celecoxib til 200 mg to ganger daglig dose, 56,5 % (470/832) eskalerte ibuprofen til 800 mg tre ganger daglig, og 54,6 % (432/791) eskalerte til naprox. 500 mg dose to ganger daglig; Imidlertid utgjorde RA-populasjonen bare 10 % av prøvepopulasjonen.
Fordi relativt få celekoksibpasienter totalt sett (5,8 % [470/8072]) doseeskalerte til 200 mg to ganger daglig, er ikke resultatene av PRECISION-studien egnet for å bestemme den relative CV-sikkerheten til celekoksib ved 200 mg to ganger daglig sammenlignet med ibuprofen og naproxen ved de dosene som tas.
Primært endepunkt
Forsøket hadde to forhåndsspesifiserte analysepopulasjoner:
- . Intent-to-treat-populasjon (ITT): Består av alle randomiserte personer fulgt i maksimalt 30 måneder . Modifisert intent-to-treat-populasjon (mITT): Består av alle randomiserte forsøkspersoner som fikk minst én dose studiemedisin og hadde minst ett besøk etter baseline fulgt til det første av behandlingens seponering pluss 30 dager eller 43 måneder
Celecoxib, ved en dose på 100 mg to ganger daglig, sammenlignet med enten naproksen eller ibuprofen ved dosene som ble tatt, oppfylte alle fire forhåndsspesifiserte ikke-underordnethetskriterier (p
De primære analyseresultatene for ITT og mITT er beskrevet i tabell 5.
ITT-analysepopulasjonen gjennom 30 måneder var dødeligheten av alle årsaker 1,6 % i celecoxib-gruppen, 1,8 % i ibuprofen-gruppen og 2,0 % i naproxen-gruppen.
Ambulatorisk blodtrykksovervåking (ABPM) Delstudie
I PRECISION-ABPM-understudien, blant totalt 444 analyserbare pasienter ved måned 4, reduserte celecoxib dosert med 100 mg to ganger daglig gjennomsnittlig 24-timers systolisk blodtrykk (SBP) med 0,3 mmHg, mens ibuprofen og naproxen økte ved dosene som ble tatt. gjennomsnittlig 24-timers SBP med henholdsvis 3,7 og 1,6 mmHg. Disse endringene resulterte i en statistisk signifikant og klinisk meningsfull forskjell på 3,9 mmHg (p=0,0009) mellom celekoksib og ibuprofen og en ikke-statistisk signifikant forskjell på 1,8 (p=0,119) mmHg mellom celekoksib og naproksen.
Spesialstudier
Studier for forebygging av adenomatøse polypper (NCT00005094 og NCT00141193)
Kardiovaskulær sikkerhet ble evaluert i to randomiserte, dobbeltblindede, placebokontrollerte, treårige studier som involverte pasienter med sporadiske adenomatøse polypper behandlet med CELEBREX: APC-studien (Adenoma Prevention with Celecoxib) og PreSAP-studien (Prevention of Spontaneous Adenomatous Polyps) . I APC-studien var det en doserelatert økning i det sammensatte endepunktet (bedømt) kardiovaskulær død, hjerteinfarkt eller hjerneslag med celecoxib sammenlignet med placebo over 3 års behandling. PreSAP-studien viste ikke en statistisk signifikant økt risiko for det samme sammensatte endepunktet (bedømt):
- . APC-studien var fareforholdene sammenlignet med placebo for et sammensatt endepunkt (bedømt) av kardiovaskulær død, hjerteinfarkt eller hjerneslag 3,4 (95 % KI 1,4 – 8,5) med celecoxib 400 mg to ganger daglig og 2,8 (95 %). CI 1,1 – 7,2) med celecoxib 200 mg to ganger daglig. Kumulative rater for dette sammensatte endepunktet over 3 år var henholdsvis 3,0 % (20/671 personer) og 2,5 % (17/685 personer), sammenlignet med 0,9 % (6/679 personer) med placebobehandling. Økningen i begge dosegruppene med celecoxib sammenlignet med placebobehandlede pasienter skyldtes hovedsakelig økt forekomst av hjerteinfarkt. . I PreSAP-studien var hazard ratio for dette samme sammensatte endepunktet (bedømt) 1,2 (95 % KI 0,6 – 2,4) med celecoxib 400 mg én gang daglig sammenlignet med placebo. Kumulative rater for dette sammensatte endepunktet over 3 år var henholdsvis 2,3 % (21/933 forsøkspersoner) og 1,9 % (12/628 forsøkspersoner).
Kliniske studier av andre COX-2-selektive og ikke-selektive NSAIDs av opptil tre års varighet har vist økt risiko for alvorlige kardiovaskulære trombotiske hendelser, hjerteinfarkt og hjerneslag, som kan være dødelige. Som et resultat anses alle NSAIDs som potensielt assosiert med denne risikoen.
Celecoxib langsiktig leddgikt sikkerhetsstudie (KLASSE)
Dette var en prospektiv, langsiktig studie med sikkerhetsresultater utført etter markedsføring hos omtrent 5 800 OA-pasienter og 2 200 RA-pasienter. Pasientene fikk CELEBREX 400 mg to ganger daglig (henholdsvis fire ganger og to ganger anbefalte OA- og RA-doser), ibuprofen 800 mg tre ganger daglig eller diklofenak 75 mg to ganger daglig (vanlige terapeutiske doser). Median eksponering for CELEBREX (n = 3 987) og diklofenak (n = 1 996) var 9 måneder mens ibuprofen (n = 1 985) var 6 måneder. Det primære endepunktet for denne utfallsstudien var forekomsten av kompliserte sår (gastrointestinal blødning, perforasjon eller obstruksjon). Pasientene fikk ta samtidig lavdose (≤ 325 mg/dag) aspirin (ASA) for kardiovaskulær profylakse (ASA-undergrupper: CELEBREX, n = 882; diklofenak, n = 445; ibuprofen, n = 412). Forskjeller i forekomst av kompliserte sår mellom CELEBREX 200 mg og den kombinerte gruppen av ibuprofen og diklofenak var ikke statistisk signifikante.
Pasienter på CELEBREX og samtidig lavdose ASA (N=882) opplevde 4 ganger høyere forekomst av kompliserte sår sammenlignet med de som ikke fikk ASA (N=3105). Kaplan-Meier-frekvensen for kompliserte sår etter 9 måneder var 1,12 % mot 0,32 % for henholdsvis de som fikk lavdose ASA og de som ikke fikk ASA [se ADVARSLER OG FORHOLDSREGLER ].
De estimerte kumulative frekvensene ved 9 måneder av kompliserte og symptomatiske sår for pasienter behandlet med CELEBREX 400 mg to ganger daglig er beskrevet i tabell 7. Tabell 7 viser også resultater for pasienter under eller eldre enn 65 år. Forskjellen i rater mellom CELEBREX 200mg alene og CELEBREX 100mg med ASA-grupper kan skyldes høyere risiko for GI-hendelser hos ASA-brukere.
Hos et lite antall pasienter med en historie med magesår, var de kompliserte og symptomatiske sårfrekvensene hos pasienter som tok CELEBREX 100 mg alene eller CELEBREX 100 mg med ASA henholdsvis 2,56 % (n=243) og 6,85 % (n=91) kl. 48 uker. Disse resultatene er å forvente hos pasienter med en tidligere historie med sårsykdom [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Kardiovaskulære sikkerhetsresultater ble også evaluert i CLASS-studien. Kaplan-Meier kumulative rater for etterforsker-rapporterte alvorlige kardiovaskulære tromboemboliske bivirkninger (inkludert MI, lungeemboli, dyp venøs trombose, ustabil angina, forbigående iskemiske anfall og iskemiske cerebrovaskulære ulykker) viste ingen forskjeller mellom CELEFEN-, eller iprolofenmac-behandlingen. grupper. Den kumulative raten hos alle pasienter etter ni måneder for CELEBREX, diklofenak og ibuprofen var henholdsvis 1,2 %, 1,4 % og 1,1 %. De kumulative ratene for ikke-ASA-brukere etter ni måneder i hver av de tre behandlingsgruppene var mindre enn 1 %. Den kumulative raten for hjerteinfarkt hos ikke-ASA-brukere etter ni måneder i hver av de tre behandlingsgruppene var mindre enn 0,2 %. Det var ingen placebogruppe i CLASS-studien, noe som begrenser muligheten til å fastslå om de tre testede legemidlene ikke hadde økt risiko for CV-hendelser eller om de alle økte risikoen i tilsvarende grad. I CLASS-studien, Kaplan-Meier kumulative rater ved 9 måneder med perifert ødem hos pasienter på CELEBREX 400 mg to ganger daglig (henholdsvis 4 ganger og 2 ganger anbefalte OA og RA doser), ibuprofen 800 mg tre ganger daglig og diklofenak 75 mg to ganger daglig var henholdsvis 4,5 %, 6,9 % og 4,7 %. Hypertensjonsraten fra CLASS-studien hos pasienter behandlet med CELEBREX, ibuprofen og diklofenak var henholdsvis 2,4 %, 4,2 % og 2,5 %.
Endoskopiske studier
Korrelasjonen mellom funn fra korttidsendoskopiske studier med CELEBREX og den relative forekomsten av klinisk signifikante alvorlige øvre GI-hendelser ved langvarig bruk er ikke fastslått. Alvorlig klinisk signifikant blødning i øvre GI har blitt observert hos pasienter som får CELEBREX 100 mg i kontrollerte og åpne studier [se ADVARSLER OG FORHOLDSREGLER og Kliniske studier ].
En randomisert, dobbeltblind studie på 430 RA-pasienter ble utført hvor en endoskopisk undersøkelse ble utført etter 6 måneder. Forekomsten av endoskopiske sår hos pasienter som tok CELEBREX 200 mg to ganger daglig var 4 % vs. 15 % for pasienter som tok diklofenak SR 75 mg to ganger daglig. Imidlertid var CELEBREX ikke statistisk forskjellig fra diklofenak for klinisk relevante GI-utfall i CLASS-studien [se Kliniske studier ].
Forekomsten av endoskopiske sår ble studert i to 12-ukers, placebokontrollerte studier hos 2157 OA- og RA-pasienter hvor baseline-endoskopier ikke avdekket sår. Det var ingen doserelasjon for forekomsten av gastro duodenalsår og dosen av CELEBREX (50 mg til 400 mg to ganger daglig). Forekomsten for naproxen 500 mg to ganger daglig var 16,2 % og 17,6 % i de to studiene, for placebo var 2,0 % og 2,3 %, og for alle doser av CELEBREX varierte forekomsten mellom 2,7 %–5,9 %. Det har ikke vært noen store, kliniske utfallsstudier for å sammenligne klinisk relevante GI-utfall med CELEBREX og naproxen.
I de endoskopiske studiene tok omtrent 11 % av pasientene aspirin (≤ 325 mg/dag). I CELEBREX-gruppene så den endoskopiske sårfrekvensen ut til å være høyere hos aspirinbrukere enn hos ikke-brukere. Imidlertid var den økte frekvensen av sår hos disse aspirinbrukerne mindre enn frekvensen av endoskopiske sår observert i de aktive komparatorgruppene, med eller uten aspirin.
PASIENTINFORMASJON
Medisineringsveiledning for ikke-steroide antiinflammatoriske legemidler (NSAIDs)
Hva er den viktigste informasjonen jeg bør vite om medisiner kalt ikke-steroide antiinflammatoriske legemidler (NSAIDs)?
NSAIDs kan forårsake alvorlige bivirkninger, inkludert:
- . Økt risiko for hjerteinfarkt eller hjerneslag som kan føre til døden. Denne risikoen kan oppstå tidlig i behandlingen og kan øke:
- . med økende doser av NSAIDs . ved lengre bruk av NSAIDs
Ikke ta NSAIDs rett før eller etter en hjerteoperasjon kalt "koronararterie bypass graft (CABG)." Unngå å ta NSAIDs etter et nylig hjerteinfarkt, med mindre helsepersonell ber deg om det. Du kan ha økt risiko for et nytt hjerteinfarkt hvis du tar NSAIDs etter et nylig hjerteinfarkt.
- . Økt risiko for blødninger, sår og rifter (perforering) av spiserøret (rør som fører fra munnen til magesekken), mage og tarm:
- . når som helst under bruk . uten varselsymptomer . som kan forårsake død
- . tidligere historie med magesår, eller mage- eller tarmblødninger ved bruk av NSAIDs . tar medisiner kalt "kortikosteroider", "platehemmende legemidler", "antikoagulantia", "SSRI" eller "SNRI" . økende doser av NSAIDs . lengre bruk av NSAIDs . røyking . drikker alkohol . eldre alder . dårlig helse . avansert leversykdom . blødningsproblemer
- . akkurat som foreskrevet . ved lavest mulig dose for din behandling . for kortest mulig tid
Hva er NSAIDs?
NSAIDs brukes til å behandle smerte og rødhet, hevelse og varme (betennelse) fra medisinske tilstander som forskjellige typer leddgikt, menstruasjonssmerter og andre typer kortvarige smerter.
Hvem bør ikke ta NSAIDs?
Ikke ta NSAIDs:
- . hvis du har hatt et astmaanfall, elveblest eller annen allergisk reaksjon med aspirin eller andre NSAIDs. . rett før eller etter bypassoperasjon.
Før du tar NSAID, fortell helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
- . har lever- eller nyreproblemer . har høyt blodtrykk . har astma . er gravid eller planlegger å bli gravid. Å ta NSAIDs ved ca. 20 uker av svangerskapet eller senere kan skade det ufødte barnet. Hvis du trenger å ta NSAIDs i mer enn 2 dager når du er mellom 20 og 30 uker av svangerskapet, kan det hende at helsepersonell må overvåke mengden væske i livmoren rundt babyen din. Du bør ikke ta NSAIDs etter ca. 30 uker med graviditet . ammer eller planlegger å amme.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte eller reseptfrie medisiner, vitaminer eller urtetilskudd. NSAIDs og noen andre medisiner kan samhandle med hverandre og forårsake alvorlige bivirkninger. Ikke begynn å ta noen ny medisin uten å snakke med helsepersonell først.
Hva er de mulige bivirkningene av NSAIDs?
NSAIDs kan forårsake alvorlige bivirkninger, inkludert:
Se " Hva er den viktigste informasjonen jeg bør vite om medisiner kalt ikke-steroide antiinflammatoriske legemidler (NSAIDs)?
- . nytt eller verre høyt blodtrykk . hjertefeil . leverproblemer inkludert leversvikt . nyreproblemer inkludert nyresvikt . lavt antall røde blodlegemer (anemi) . livstruende hudreaksjoner . livstruende allergiske reaksjoner
Andre bivirkninger av NSAIDs inkluderer: magesmerter, forstoppelse, diaré, gass, halsbrann, kvalme, oppkast og svimmelhet.
Få nødhjelp umiddelbart hvis du får noen av følgende symptomer:
- . kortpustethet eller problemer med å puste . brystsmerter . svakhet i en del eller side av kroppen din . utydelig tale . hevelse i ansiktet eller halsen
Slutt å ta NSAID og ring legen din med en gang hvis du får noen av følgende symptomer:
- . kvalme . mer sliten eller svakere enn vanlig . diaré . kløe . huden eller øynene dine ser gule ut . fordøyelsesbesvær eller magesmerter . influensalignende symptomer . spy blod . det er blod i avføringen eller den er svart og klissete som tjære . uvanlig vektøkning . hudutslett eller blemmer med feber . hevelse i armer, ben, hender og føtter
Hvis du tar for mye av NSAID-en, ring legen din eller få medisinsk hjelp med en gang.
Dette er ikke alle mulige bivirkninger av NSAIDs. For mer informasjon, spør helsepersonell eller apotek om NSAIDs.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Annen informasjon om NSAIDs
- . Aspirin er et NSAID, men det øker ikke sjansen for hjerteinfarkt. Aspirin kan forårsake blødninger i hjernen, magen og tarmen. Aspirin kan også forårsake sår i mage og tarm. . Noen NSAIDs selges i lavere doser uten resept (reseptfri). Snakk med helsepersonell før du bruker reseptfrie NSAIDs i mer enn 10 dager.
Generell informasjon om sikker og effektiv bruk av NSAIDs
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk NSAIDs for en tilstand det ikke er foreskrevet for. Ikke gi NSAIDs til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Hvis du vil ha mer informasjon om NSAIDs, snakk med helsepersonell. Du kan spørre apoteket eller helsepersonell om informasjon om NSAIDs som er skrevet for helsepersonell.
Denne medisinveiledningen er godkjent av US Food and Drug Administration.
