Maxalt 5mg, 10mg Rizatriptan Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Maxalt og hvordan brukes det?
Maxalt er et reseptbelagt legemiddel som brukes til å behandle symptomene på migrenehodepine. Maxalt 10mg kan brukes alene eller sammen med andre medisiner.
Maxalt tilhører en klasse legemidler som kalles Serotonin 5-HT-reseptoragonister; Antimigrenemidler.
Det er ikke kjent om Maxalt 5mg er trygt og effektivt hos barn under 6 år.
Hva er de mulige bivirkningene av Maxalt?
Maxalt kan forårsake alvorlige bivirkninger, inkludert:
- . plutselige og sterke magesmerter, . blodig diaré, . kald følelse, . nummenhet i føtter og hender, . alvorlig hodepine, . tåkesyn, . dunker i nakken eller ørene, . brystsmerter eller trykk, . smerte som sprer seg til kjeven eller skulderen, . kvalme, . svette, . opphisselse, . hallusinasjoner, . feber, . skjelver, . rask puls, . muskelstivhet, . rykninger, . tap av koordinasjon, . kvalme, . tap av koordinasjon, . oppkast, . diaré, . plutselig nummenhet eller svakhet (spesielt på den ene siden av kroppen), . plutselig kraftig hodepine, . slørete tale, og . problemer med syn eller balanse
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Maxalt inkluderer:
- . svimmelhet, . døsighet, . føler meg sliten, og . smerte eller følelse av trykk i halsen eller brystet
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Maxalt. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
MAXALT 10mg inneholder rizatriptanbenzoat, en selektiv 5-hydroksytryptamin1B/1D (5-HT1B/1D) reseptoragonist.
Rizatriptanbenzoat beskrives kjemisk som: N,N-dimetyl-5-(1H-1,2,4-triazol-1-ylmetyl)-1Hindol-3-etanaminmonobenzoat og dets strukturformel er:
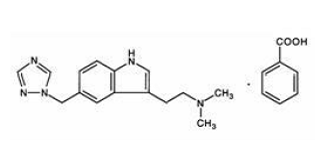
Dens empiriske formel er C15H19N5•C7H6O2, som representerer en molekylvekt av den frie basen på 269,4. Rizatriptanbenzoat er et hvitt til off-white, krystallinsk fast stoff som er løselig i vann ved ca. 42 mg per ml (uttrykt som fri base) ved 25°C.
MAXALT 5 mg tabletter og MAXALT-MLT oralt desintegrerende tabletter er tilgjengelige for oral administrering i styrker på 5 og 10 mg (tilsvarende henholdsvis 7,265 mg eller 14,53 mg av benzoatsaltet). Hver komprimert tablett inneholder følgende inaktive ingredienser: laktosemonohydrat, mikrokrystallinsk cellulose, pregelatinisert stivelse, jernoksid (rødt) og magnesiumstearat. Hver lyofilisert oralt desintegrerende tablett inneholder følgende inaktive ingredienser: gelatin, mannitol, glycin, aspartam og peppermyntesmak.
INDIKASJONER
MAXALT® og MAXALT-MLT® er indisert for akutt behandling av migrene med eller uten aura hos voksne og pediatriske pasienter i alderen 6 til 17 år.
Bruksbegrensninger
- . MAXALT skal kun brukes der en klar diagnose av migrene er etablert. Hvis en pasient ikke har respons på det første migreneanfallet behandlet med MAXALT 10mg, bør diagnosen migrene revurderes før MAXALT 5mg administreres for å behandle eventuelle påfølgende anfall. . MAXALT 10mg er ikke indisert for bruk ved behandling av hemiplegisk eller basilar migrene [se KONTRAINDIKASJONER ]. . MAXALT 10mg er ikke indisert for forebygging av migreneanfall. . Sikkerhet og effektivitet av MAXALT 5mg er ikke fastslått for klasehodepine.
DOSERING OG ADMINISTRASJON
Doseringsinformasjon hos voksne
Den anbefalte startdosen av MAXALT er enten 5 mg eller 10 mg for akutt behandling av migrene hos voksne. 10 mg-dosen kan gi en større effekt enn 5-mg-dosen, men kan ha større risiko for bivirkninger [se Kliniske studier ].
Redosering hos voksne
Selv om effektiviteten av en andre dose eller påfølgende doser ikke er fastslått i placebokontrollerte studier, kan en ny dose gis 2 timer etter den første dosen hvis migrenehodepinen kommer tilbake. Maksimal daglig dose bør ikke overstige 30 mg i en 24-timers periode. Sikkerheten ved å behandle i gjennomsnitt mer enn fire hodepine i løpet av en 30-dagers periode er ikke fastslått.
Doseringsinformasjon hos pediatriske pasienter (alder 6 til 17 år)
Dosering til pediatriske pasienter er basert på pasientens kroppsvekt. Den anbefalte dosen av MAXALT 10 mg er 5 mg hos pasienter som veier mindre enn 40 kg (88 lb), og 10 mg hos pasienter som veier 40 kg (88 lb) eller mer.
Effekten og sikkerheten ved behandling med mer enn én dose MAXALT innen 24 timer hos pediatriske pasienter i alderen 6 til 17 år er ikke fastslått.
Administrering av MAXALT-MLT oralt desintegrerende tabletter
For MAXALT-MLT oralt desintegrerende tabletter er administrering med væske ikke nødvendig. Oralt desintegrerende tabletter er pakket i en blisterpakning i en ytre aluminiumspose, og pasienter bør ikke fjerne blisterpakningen fra den ytre posen før like før dosering. Blisterpakningen skal deretter åpnes med tørre hender og den oralt desintegrerende tabletten legges på tungen, hvor den vil løses opp og svelges sammen med spyttet.
Dosejustering for pasienter på propranolol
Voksne pasienter
Hos voksne pasienter som tar propranolol, anbefales kun 5 mg dose av MAXALT 5 mg, opptil maksimalt 3 doser i en 24-timers periode (15 mg) [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
Pediatriske pasienter
For pediatriske pasienter som veier 40 kg (88 lb) eller mer som tar propranolol, anbefales kun en enkelt 5 mg dose av MAXALT (maksimal dose på 5 mg i en 24-timers periode). MAXALT skal ikke forskrives til propranolol-behandlede pediatriske pasienter som veier mindre enn 40 kg (88 lb) [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ].
HVORDAN LEVERES
Doseringsformer og styrker
MAXALT tabletter
- . mg tabletter er blekrosa, kapselformede, komprimerte tabletter kodet MRK på den ene siden og 266 på den andre. . 10 mg tabletter er blekrosa, kapselformede, komprimerte tabletter kodet MAXALT 5 mg på den ene siden og MRK 267 på den andre.
MAXALT-MLT oralt desintegrerende tabletter
- . 5 mg oralt desintegrerende tabletter er hvite til off-white, runde lyofiliserte tabletter preget med en modifisert trekant på den ene siden. . 10 mg oralt desintegrerende tabletter er hvite til off-white, runde lyofiliserte tabletter preget med en modifisert firkant på den ene siden.
Oppbevaring og håndtering
nr. 3732 - MAXALT Tabletter, 5 mg , er blekrosa, kapselformede, komprimerte tabletter kodet
MRK på den ene siden og 266 på den andre:
NDC 0006-0266-18, kartong med 18 tabletter.
nr. 3733 - MAXALT 5mg Tabletter, 10 mg , er lyserosa, kapselformede, komprimerte tabletter kodet MAXALT 10mg på den ene siden og MRK 267 på den andre:
NDC 0006-0267-18, kartong med 18 tabletter.
nr. 3800 - MAXALT-MLT oralt desintegrerende tabletter, 5 mg er hvite til off-white, runde lyofiliserte oralt desintegrerende tabletter preget med en modifisert trekant på den ene siden, og måler 10,0-11,5 mm (side-til-side) med peppermyntesmak. Hver oralt desintegrerende tablett er individuelt pakket i en blisterpakning inne i en aluminiumspose (pose). De leveres som følger:
NDC 0006-3800-18, 6 x bruksenhet bæreveske med 3 oralt desintegrerende tabletter (totalt 18 tabletter).
nr. 3801 - MAXALT-MLT oralt desintegrerende tabletter, 10 mg , er hvite til off-white, runde lyofiliserte oralt desintegrerende tabletter preget med en modifisert firkant på den ene siden, og måler 12,0-13,8 mm (side-til-side) med peppermyntesmak. Hver oralt desintegrerende tablett er individuelt pakket i en blisterpakning inne i en aluminiumspose (pose). De leveres som følger:
NDC 0006-3801-18, 6 x bruksenhet bæreveske med 3 oralt desintegrerende tabletter (totalt 18 tabletter).
Oppbevaring
Oppbevar MAXALT 5mg tabletter ved romtemperatur, 15°C-30°C (59°F-86°F).
Oppbevar MAXALT-MLT oralt desintegrerende tabletter ved romtemperatur, 15°C-30°C (59°F-86°F).
Distribuert av: Merck Sharp & Dohme Corp., et datterselskap av MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revidert: oktober 2019
BIVIRKNINGER
Følgende bivirkninger er omtalt mer detaljert i andre deler av merkingen:
- . Myokardiskemi, hjerteinfarkt og Prinzmetals angina [se ADVARSLER OG FORHOLDSREGLER ]. . Arytmier [se ADVARSLER OG FORHOLDSREGLER ]. . Bryst-, hals-, nakke- og/eller kjevesmerter/tetthet/trykk [se ADVARSLER OG FORHOLDSREGLER ]. . Cerebrovaskulære hendelser [se ADVARSLER OG FORHOLDSREGLER ]. . Andre vasospasmereaksjoner [se ADVARSLER OG FORHOLDSREGLER ]. . Overforbruk av medisiner Hodepine [se ADVARSLER OG FORHOLDSREGLER ]. . Serotoninsyndrom [se ADVARSLER OG FORHOLDSREGLER ]. . Økning i blodtrykk [se ADVARSLER OG FORHOLDSREGLER ].
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
Voksne
Forekomst i kontrollerte kliniske studier
Bivirkninger av MAXALT ble vurdert i kontrollerte kliniske studier som inkluderte over 3700 voksne pasienter som fikk enkeltdoser eller flere doser MAXALT tabletter. De vanligste bivirkningene under behandling med MAXALT (≥5 % i begge behandlingsgruppene og høyere enn placebo) var asteni/tretthet, somnolens, smerte/trykkfølelse og svimmelhet. Disse bivirkningene så ut til å være doserelaterte.
Tabell 1 viser bivirkningene (insidens ≥2 % og høyere enn placebo) etter en enkeltdose MAXALT 5 mg hos voksne.
Frekvensen av bivirkninger i kliniske studier økte ikke når opptil tre doser ble tatt innen 24 timer. Bivirkningsfrekvensen var også uendret ved samtidig bruk av legemidler som vanligvis brukes for migreneprofylakse (inkludert propranolol), p-piller eller analgetika. Forekomsten av bivirkninger ble ikke påvirket av alder eller kjønn. Det var utilstrekkelig data til å vurdere effekten av rase på forekomsten av bivirkninger.
Andre hendelser observert i forbindelse med administrasjonen av MAXALT hos voksne
det følgende avsnittet presenteres frekvensene av mindre vanlige rapporterte bivirkninger som ikke ble rapportert i andre deler av merkingen. Fordi rapportene inkluderer hendelser observert i åpne studier, kan ikke rollen til MAXALT 5 mg i årsakssammenhengen bestemmes pålitelig. Videre begrenser variabilitet knyttet til rapportering av uønskede hendelser, terminologien som brukes for å beskrive uønskede hendelser, verdien av de kvantitative frekvensestimatene som er gitt. Hendelsesfrekvenser beregnes som antall pasienter som brukte MAXALT og rapporterte en hendelse delt på det totale antallet pasienter eksponert for MAXALT (N=3716). Alle rapporterte hendelser skjedde med en insidens ≥1 %, eller antas å være rimelig assosiert med bruken av legemidlet. Hendelser er videre klassifisert innenfor kroppssystemkategorier og oppregnet i rekkefølge etter avtagende frekvens ved å bruke følgende definisjoner: hyppige bivirkninger er de som er definert som de som forekommer hos minst (>)1/100 pasienter; sjeldne bivirkninger er de som forekommer hos 1/100 til 1/1000 pasienter; og sjeldne bivirkninger er de som forekommer hos færre enn 1/1000 pasienter.
Generell: Sjelden var ansiktsødem. Sjeldne var synkope og ødem/hevelse.
Atypiske sensasjoner: Hyppige var varme opplevelser.
Kardiovaskulær: Hyppig var hjertebank. Sjeldne var takykardi, kalde ekstremiteter og bradykardi.
Fordøyelsessystemet: Ofte var diaré og oppkast. Sjeldne var dyspepsi, tungeødem og abdominal oppblåsthet.
Muskuloskeletal: Sjeldne var muskelsvakhet, stivhet, myalgi og muskelkramper/spasmer.
Nevrologisk/psykiatrisk: Hyppige var hypoestesi, eufori og skjelving. Sjeldne var svimmelhet, søvnløshet, forvirring/desorientering, unormal gange, hukommelsessvikt og agitasjon.
Luftveiene: Hyppig var dyspné. Sjelden var faryngealt ødem.
Spesielle sanser: Sjeldne var tåkesyn og tinnitus. Sjelden var øyehevelse.
Hud og hudvedheng: Hyppig var rødming. Sjeldne var svette, kløe, utslett og urticaria. Sjelden var erytem, hetetokter.
Bivirkningsprofilen sett med MAXALT-MLT oralt desintegrerende tabletter var lik den som ble sett med MAXALT 10 mg tabletter.
Pediatriske pasienter i alderen 6 til 17 år
Forekomst i kontrollerte kliniske studier hos pediatriske pasienter
Bivirkninger av MAXALT-MLT ble vurdert i en kontrollert klinisk studie i akuttbehandling av migrene (studie 7) som inkluderte totalt 1382 pediatriske pasienter i alderen 6-17 år, hvorav 977 (72 %) administrerte minst én dose av studiebehandling (MAXALT-MLT og/eller placebo) [se Kliniske studier ]. Forekomsten av bivirkninger rapportert for pediatriske pasienter i den akutte kliniske studien var lik hos pasienter som fikk MAXALT som de som fikk placebo. Bivirkningsmønsteret hos pediatriske pasienter forventes å være likt det hos voksne.
Andre hendelser observert i forbindelse med administrering av MAXALT-MLT hos pediatriske pasienter
det følgende avsnittet presenteres frekvensene av mindre vanlige rapporterte bivirkninger. Fordi rapportene inkluderer hendelser observert i åpne studier, kan ikke rollen til MAXALT-MLT i årsakssammenhengen bestemmes pålitelig. Videre begrenser variabilitet knyttet til rapportering av uønskede hendelser, terminologien som brukes for å beskrive uønskede hendelser, verdien av de kvantitative frekvensestimatene som er gitt.
Hendelsesfrekvenser er beregnet som antall pediatriske pasienter i alderen 6 til 17 år som brukte MAXALT-MLT og rapporterte en hendelse delt på det totale antallet pasienter eksponert for MAXALT-MLT (N=1068). Alle rapporterte hendelser skjedde med en insidens ≥1 %, eller antas å være rimelig assosiert med bruken av legemidlet. Hendelser er videre klassifisert innenfor systemorganklasse og oppregnet i rekkefølge etter avtagende frekvens ved bruk av følgende definisjoner: hyppige bivirkninger er de som forekommer hos (>)1/100 pediatriske pasienter; sjeldne bivirkninger er de som forekommer hos 1/100 til 1/1000 pediatriske pasienter; og sjeldne bivirkninger er de som forekommer hos færre enn 1/1000 pasienter.
Generell: Ofte var tretthet.
Øre- og labyrintlidelser: Sjelden var hypoakusis.
Gastrointestinale lidelser: Hyppig var ubehag i magen.
Forstyrrelser i nervesystemet: Sjeldne var unormal koordinasjon, forstyrrelse i oppmerksomhet og presynkope.
Psykiatriske lidelser: Sjelden var hallusinasjoner.
Postmarketing-erfaring
Følgende avsnitt oppregner potensielt viktige bivirkninger som har oppstått i klinisk praksis og som er rapportert spontant til ulike overvåkingssystemer. Hendelsene som er oppregnet inkluderer alle unntatt de som allerede er oppført i andre deler av merkingen eller de som er for generelle til å være informative. Fordi rapportene siterer hendelser som er rapportert spontant fra verdensomspennende erfaring etter markedsføring, kan frekvensen av hendelser og rollen til MAXALT 5 mg i årsakssammenhengen ikke fastslås pålitelig.
Nevrologisk/psykiatrisk: Anfall.
Generell: Allergiske tilstander inkludert anafylaksi/anafylaktoid reaksjon, angioødem, hvesing og toksisk epidermal nekrolyse [se KONTRAINDIKASJONER ].
Spesielle sanser: Dysgeusi.
NARKOTIKAHANDEL
Propranolol
Dosen av MAXALT 5 mg bør justeres hos pasienter behandlet med propranolol, da propranolol har vist seg å øke plasma-AUC for rizatriptan med 70 % [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
Ergotholdige legemidler
Medikamenter som inneholder ergot er rapportert å forårsake langvarige vasospastiske reaksjoner. Fordi disse effektene kan være additive, er bruk av medisiner som inneholder ergotamin eller ergot-type (som dihydroergotamin eller metysergid) og MAXALT 5 mg innen 24 timer kontraindisert [se KONTRAINDIKASJONER ].
Andre 5-HT1-agonister
Fordi deres vasospastiske effekter kan være additive, er samtidig administrering av MAXALT 10mg og andre 5-HT1-agonister innen 24 timer etter hverandre kontraindisert [se KONTRAINDIKASJONER ].
SSRI/SNRI og serotoninsyndrom
Tilfeller av serotonergt syndrom er rapportert under samtidig administrering av triptaner og selektive serotoninreopptakshemmere (SSRI) eller serotonin noradrenalin reopptakshemmere (SNRI) [se ADVARSLER OG FORHOLDSREGLER ].
Monoaminoksidasehemmere
MAXALT er kontraindisert hos pasienter som tar MAO-A-hemmere og ikke-selektive MAO-hemmere. En spesifikk MAO-A-hemmer økte den systemiske eksponeringen av rizatriptan og dets metabolitt [se KONTRAINDIKASJONER og KLINISK FARMAKOLOGI ].
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Myokardiskemi, hjerteinfarkt og Prinzmetals angina
MAXALT skal ikke gis til pasienter med iskemisk eller vasospastisk koronararteriesykdom. Det har vært sjeldne rapporter om alvorlige hjertebivirkninger, inkludert akutt hjerteinfarkt, som oppstår innen noen få timer etter administrering av MAXALT. Noen av disse reaksjonene oppsto hos pasienter uten kjent koronararteriesykdom (CAD). 5-HT1-agonister, inkludert MAXALT 5mg, kan forårsake koronararterievasospasme (Prinzmetals angina), selv hos pasienter uten en historie med CAD.
Triptan-naive pasienter som har flere kardiovaskulære risikofaktorer (f.eks. økt alder, diabetes, hypertensjon, røyking, fedme, sterk familiehistorie med CAD) bør ha en kardiovaskulær evaluering før de får MAXALT. Hvis det er tegn på CAD eller koronararterievasospasme, skal MAXALT ikke administreres [se KONTRAINDIKASJONER ]. For pasienter som har en negativ kardiovaskulær evaluering, bør det vurderes administrering av den første MAXALT-dosen i en medisinsk overvåket setting og å utføre et elektrokardiogram (EKG) umiddelbart etter administrering av MAXALT 10 mg. Periodisk kardiovaskulær evaluering bør vurderes hos intermitterende langtidsbrukere av MAXALT som har kardiovaskulære risikofaktorer.
Arytmier
Livstruende forstyrrelser i hjerterytmen, inkludert ventrikkeltakykardi og ventrikkelflimmer som fører til død, er rapportert innen få timer etter administrering av 5-HT1-agonister. Seponer MAXALT 10 mg hvis disse forstyrrelsene oppstår.
Bryst-, hals-, nakke- og/eller kjevesmerter/tetthet/trykk
Som med andre 5-HT1-agonister, oppstår følelsen av tetthet, smerte, trykk og tyngde i prekordium, svelg, nakke og kjeve ofte etter behandling med MAXALT 5mg og er vanligvis ikke-kardielt. Men hvis det er mistanke om hjerteopprinnelse, bør pasientene evalueres. Pasienter som har vist seg å ha CAD og de med Prinzmetals variant angina bør ikke få 5-HT1-agonister.
Cerebrovaskulære hendelser
Hjerneblødning, subaraknoidalblødning og hjerneslag har forekommet hos pasienter behandlet med 5-HT1-agonister, og noen har resultert i dødsfall. I en rekke tilfeller ser det ut til at de cerebrovaskulære hendelsene var primære, da 5-HT1-agonisten ble administrert i feil tro at symptomene som ble opplevd var en konsekvens av migrene, mens de ikke var det. Pasienter med migrene kan også ha økt risiko for visse cerebrovaskulære hendelser (f.eks. slag, blødning, forbigående iskemisk angrep). Seponer MAXALT hvis en cerebrovaskulær hendelse oppstår.
Som med andre akutte migrenebehandlinger, før behandling av hodepine hos pasienter som ikke tidligere er diagnostisert som migrenepasienter, og hos migrenepasienter som har atypiske symptomer, bør man være forsiktig med å utelukke andre potensielt alvorlige nevrologiske tilstander. MAXALT skal ikke gis til pasienter med hjerneslag eller forbigående iskemisk anfall [se KONTRAINDIKASJONER ].
Andre vasospasmereaksjoner
5-HT1-agonister, inkludert MAXALT, kan forårsake ikke-koronare vasospastiske reaksjoner, som perifer vaskulær iskemi, gastrointestinal vaskulær iskemi og infarkt (med magesmerter og blodig diaré), miltinfarkt og Raynauds syndrom. Hos pasienter som opplever symptomer eller tegn som tyder på ikke-koronar vasospasmereaksjon etter bruk av en hvilken som helst 5-HT1-agonist, bør den mistenkte vasospasmereaksjonen utelukkes før de får ytterligere MAXALT 10 mg doser.
Rapporter om forbigående og permanent blindhet og betydelig delvis synstap er rapportert ved bruk av 5-HT1-agonister. Siden synsforstyrrelser kan være en del av et migreneanfall, er det ikke klart fastslått en årsakssammenheng mellom disse hendelsene og bruken av 5-HT1-agonister.
Overforbruk av medisiner Hodepine
Overforbruk av akutte migrenemedisiner (f.eks. ergotamin, triptaner, opioider eller en kombinasjon av legemidler i 10 eller flere dager per måned) kan føre til forverring av hodepine (hodepine for overforbruk av medisiner). Overforbrukshodepine kan vise seg som migrenelignende daglig hodepine, eller som en markant økning i frekvensen av migreneanfall. Avrusning av pasienter, inkludert seponering av de overbrukte medikamentene, og behandling av abstinenssymptomer (som ofte inkluderer en forbigående forverring av hodepine) kan være nødvendig.
Serotonin syndrom
Serotonergt syndrom kan forekomme med triptaner, inkludert MAXALT 10 mg, spesielt ved samtidig administrering med selektive serotoninreopptakshemmere (SSRI), serotonin noradrenalin reopptakshemmere (SNRI), trisykliske antidepressiva (TCA) og MAO-hemmere [se NARKOTIKAHANDEL ]. Symptomer på serotonergt syndrom kan omfatte endringer i mental status (f.eks. agitasjon, hallusinasjoner, koma), autonom ustabilitet (f.eks. takykardi, labilt blodtrykk, hypertermi), nevromuskulære aberrasjoner (f.eks. hyperrefleksi, inkoordinasjon) og/eller gastrointestinale symptomer (f.eks. kvalme). , oppkast, diaré). Utbruddet av symptomer kan oppstå i løpet av minutter til timer etter å ha mottatt en ny eller en større dose av en serotonerg medisin. MAXALT-behandling bør seponeres ved mistanke om serotonergt syndrom [se NARKOTIKAHANDEL og PASIENTINFORMASJON ].
Økning i blodtrykk
Signifikant forhøyet blodtrykk, inkludert hypertensiv krise med akutt svekkelse av organsystemer, er rapportert i sjeldne tilfeller hos pasienter med og uten hypertensjon i anamnesen som har fått 5-HT1-agonister, inkludert MAXALT. Hos friske unge voksne mannlige og kvinnelige pasienter som fikk maksimale doser av MAXALT (10 mg hver 2. time for 3 doser), ble det observert en liten økning i blodtrykket (omtrent 2-3 mmHg). MAXALT er kontraindisert hos pasienter med ukontrollert hypertensjon [se KONTRAINDIKASJONER ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Risiko for myokardiskemi og/eller infarkt, Prinzmetals angina, andre vasospasmerelaterte hendelser og cerebrovaskulære hendelser
Informer pasienter om at MAXALT kan forårsake alvorlige kardiovaskulære bivirkninger som hjerteinfarkt eller hjerneslag. Selv om alvorlige kardiovaskulære hendelser kan oppstå uten advarselssymptomer, bør pasienter være oppmerksomme på tegn og symptomer på brystsmerter, kortpustethet, svakhet, slørete tale, og bør be om medisinsk råd når de observerer veiledende tegn eller symptomer. Pasienter bør informeres om viktigheten av denne oppfølgingen [se ADVARSLER OG FORHOLDSREGLER ].
Serotonin syndrom
Pasienter bør advares om risikoen for serotonergt syndrom ved bruk av MAXALT 10 mg eller andre triptaner, spesielt ved kombinert bruk med selektive serotoninreopptakshemmere (SSRI) eller serotonin noradrenalin reopptakshemmere (SNRI) [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL , og KLINISK FARMAKOLOGI ].
Svangerskap
Informer pasientene om at MAXALT ikke skal brukes under graviditet med mindre den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret [se Bruk i spesifikke populasjoner ].
Amming
Råd pasientene til å varsle helsepersonell dersom de ammer eller planlegger å amme [se Bruk i spesifikke populasjoner ].
Evne til å utføre komplekse oppgaver
Siden migrene eller behandling med MAXALT 10 mg kan forårsake døsighet og svimmelhet, instruer pasientene om å vurdere deres evne til å utføre komplekse oppgaver under migreneanfall og etter administrering av MAXALT.
Overforbruk av medisiner Hodepine
Informer pasienter om at bruk av akutte migrenemedisiner i 10 eller flere dager per måned kan føre til forverring av hodepine, og oppmuntre pasientene til å registrere hodepinefrekvens og medikamentbruk (f.eks. ved å føre en hodepinedagbok) [se ADVARSLER OG FORHOLDSREGLER ].
Håndtering av oralt desintegrerende tablettpakker
Instruer pasienter om ikke å fjerne blisterpakningen fra den ytre aluminiumsposen før de er klare til å bruke den oralt desintegrerende tabletten på innsiden [se DOSERING OG ADMINISTRASJON ].
Pasienter med fenylketonuri
Informer fenylketonuriske pasienter om at MAXALT-MLT oralt desintegrerende tabletter inneholder fenylalanin (en komponent av aspartam). Hver 5 mg oralt desintegrerende tablett inneholder 1,1 mg fenylalanin, og hver 10 mg oralt desintegrerende tablett inneholder 2,1 mg fenylalanin [se Bruk i spesifikke populasjoner ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Orale karsinogenitetsstudier av rizatriptan ble utført på mus (100 uker) og rotter (106 uker) i doser på opptil 125 mg/kg/dag. Det var ingen bevis for en økning i tumorforekomst relatert til rizatriptan hos noen av artene. Plasmaeksponering (AUC) ved den høyeste dosen som ble testet var omtrent 150 (mus) og 240 ganger (rotter) den hos mennesker ved maksimal anbefalt human dose (MRHD) på 30 mg/dag.
Mutagenese
Rizatriptan var verken mutagent eller klastogent i en rekke in vitro og in vivo genetiske toksisitetsstudier, inkludert: mikrobiell mutagenese (Ames) analyse, in vitro pattedyrcelle mutagenese og kromosomavviksanalyser, og in vivo kromosomavviksanalyse hos mus.
Nedsatt fruktbarhet
Oral administrering av rizatriptan (0, 2, 10 eller 100 mg/kg/dag) til hunnrotter før og under paring og fortsatte gjennom svangerskapet og diegivningen ga ingen effekt på fertiliteten; endret brunstsyklisitet og forsinkelser i tid til parring ble imidlertid observert ved den høyeste testede dosen. Plasmaeksponering ved dose uten effekt (10 mg/kg/dag) for reproduksjonstoksisitet var omtrent 15 ganger høyere enn hos mennesker ved MRHD.
Oral administrering av rizatriptan (0, 5, 35 eller 250 mg/kg/dag) til hannrotter før og under paring resulterte ikke i svekkelse av fertilitet eller reproduksjonsevne. Plasmaeksponering (AUC) ved den høyeste dosen som ble testet var omtrent 550 ganger høyere enn hos mennesker ved MRHD.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Tilgjengelige humane data om bruk av MAXALT hos gravide kvinner er ikke tilstrekkelige til å trekke konklusjoner om legemiddelassosiert risiko for alvorlige fødselsskader og spontanabort.
dyrestudier ble utviklingstoksisitet observert etter oral administrering av rizatriptan under graviditet (redusert føtal kroppsvekt hos rotter) eller gjennom hele svangerskapet og amming (økt dødelighet, redusert kroppsvekt og nedsatt nevroatferd hos rotteavkom) ved større plasmaeksponeringer enn det forventet ved terapeutiske doser hos mennesker [se Dyredata ].
I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %. Den rapporterte frekvensen av alvorlige fødselsdefekter blant fødsler til kvinner med migrene varierer fra 2,2 % til 2,9 %, og den rapporterte frekvensen av spontanabort var 17 %, som er lik frekvensen rapportert hos kvinner uten migrene.
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-/fosterrisiko
Hos kvinner med migrene er det en økt risiko for uønskede perinatale utfall hos moren, inkludert preeklampsi og svangerskapshypertensjon.
Data
Menneskelige data
Graviditetsregisteret for MAXALT identifiserte ikke noe mønster av medfødte anomalier eller andre uønskede fødselsutfall i perioden 1998 til 2018. Manglende identifisering av ethvert mønster bør imidlertid sees på med forsiktighet, da antallet potensielle rapporter med utfallsinformasjon var lav og ga ikke tilstrekkelig kraft til å oppdage økt risiko for individuelle fødselsskader forbundet med bruk av MAXALT. I tillegg var det betydelig tap av oppfølging i de prospektive graviditetsrapportene, noe som ytterligere kompliserte denne vurderingen av en sammenheng mellom MAXALT og ethvert mønster av medfødte anomalier eller andre uønskede fødselsutfall.
en studie med data fra det svenske medisinske fødselsregisteret, ble levendefødte kvinner som rapporterte å bruke triptaner eller ergoter under svangerskapet sammenlignet med kvinner som ikke gjorde det. Av de 157 fødslene med eksponering for rizatriptan i første trimester, ble 7 spedbarn født med misdannelser (relativ risiko 1,01 [95 % KI: 0,40 til 2,08]). En studie med lenkede data fra Medisinsk fødselsregister til Norsk Reseptdatabase sammenlignet svangerskapsutfall hos kvinner som løste ut resepter på triptaner under svangerskapet, samt en sammenligningsgruppe for migrenesykdom som løste inn resepter på triptaner kun før graviditet, sammenlignet med en befolkningskontrollgruppe. Av de 310 kvinnene som løste inn resepter på rizatriptan i løpet av første trimester, hadde 10 spedbarn med store medfødte misdannelser (OR 1,03 [95 % KI: 0,55 til 1,93]), mens for de 271 kvinnene som løste inn resepter på rizatriptan før, men ikke under , graviditet, hadde 12 spedbarn med store medfødte misdannelser (OR 1,48 [95 % KI: 0,83 til 2,64]), hver sammenlignet med populasjonssammenligningsgruppen.
Dyredata
Når rizatriptan (0, 2, 10 eller 100 mg/kg/dag) ble administrert oralt til drektige rotter gjennom hele organogenesen, ble det observert en reduksjon i føtal kroppsvekt ved de høyeste testede dosene. Ved midtdosen (10 mg/kg/dag), som var en dose uten effekt for uønskede effekter på embryoføtal utvikling, var plasmaeksponering (AUC) omtrent 15 ganger høyere enn hos mennesker ved maksimal anbefalt human dose (MRHD) på 30 mg/dag. Når rizatriptan (0, 5, 10 eller 50 mg/kg/dag) ble administrert oralt til drektige kaniner gjennom hele organogenesen, ble det ikke observert uønskede fostereffekter. Plasmaeksponering (AUC) ved den høyeste dosen som ble testet var 115 ganger høyere enn hos mennesker ved MRHD. Placental overføring av medikament til fosteret ble påvist hos begge arter.
Oral administrering av rizatriptan (0, 2, 10 eller 100 mg/kg/dag) til hunnrotter før og under paring og fortsettelse gjennom svangerskapet og diegivningen resulterte i redusert kroppsvekt hos avkom fra fødselen og gjennom hele diegivningen i det hele tatt, men den laveste dosetestet (2 mg/kg/dag). Plasmaeksponering (AUC) ved ingen-effektdose (2 mg/kg/dag) for bivirkninger på postnatal utvikling var lik den hos mennesker ved MRHD.
Oral administrering av rizatriptan (0, 5, 100 eller 250 mg/kg/dag) gjennom organogenese og laktasjon resulterte i neonatal dødelighet, redusert kroppsvekt (som vedvarte i voksen alder) og svekket nevroatferdsfunksjon hos avkom i det hele tatt, men den laveste dosen testet. Plasmaeksponering (AUC) ved ingen-effektdose for bivirkninger på postnatal utvikling (5 mg/kg/dag) var omtrent 8 ganger høyere enn hos mennesker ved MRHD.
Amming
Risikosammendrag
Det er ingen data på tilstedeværelsen av rizatriptan eller noen aktive metabolitter i morsmelk, eller på effekten av rizatriptan på spedbarn som ammes, eller på melkeproduksjonen.
Rizatriptan ble utskilt i rottemelk, med nivåer i melk ca. 6 ganger høyere enn i mors plasma.
De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for MAXALT eller MAXALT-MLT og eventuelle potensielle bivirkninger på det ammede spedbarnet fra MAXALT eller MAXALT-MLT eller fra den underliggende mors tilstand.
Data
Etter oral administrering av rizatriptan til diegivende rotter i en dose på 100 mg/kg/dag, oversteg legemiddelkonsentrasjonen av rizatriptan i melkeprøver maternal plasmakonsentrasjon med ca. 6 ganger.
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter under 6 år er ikke fastslått. Effekten og sikkerheten til MAXALT 5 mg ved akutt behandling av migrene hos pasienter i alderen 6 til 17 år ble fastslått i en adekvat og godt kontrollert studie [se Kliniske studier ].
Forekomsten av bivirkninger rapportert for pediatriske pasienter i den akutte kliniske studien var lik hos pasienter som fikk MAXALT 5 mg som de som fikk placebo. Bivirkningsmønsteret hos pediatriske pasienter forventes å være likt det hos voksne.
Geriatrisk bruk
Kliniske studier av MAXALT 5 mg inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter.
Selv om farmakokinetikken til rizatriptan var lik hos eldre (i alderen ≥65 år) og hos yngre voksne (n=17), bør dosevalg generelt for en eldre pasient være forsiktig, med start i den lave enden av doseringsområdet. Dette gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og av samtidig sykdom eller annen medikamentell behandling.
Geriatriske pasienter som har andre kardiovaskulære risikofaktorer (f.eks. diabetes, hypertensjon, røyking, fedme, sterk familiehistorie med koronararteriesykdom) bør ha en kardiovaskulær evaluering før de får MAXALT [se ADVARSLER OG FORHOLDSREGLER ].
Pasienter med fenylketonuri
Oralt desintegrerende tabletter inneholder fenylalanin (en komponent av aspartam). De oralt desintegrerende tablettene på 5 og 10 mg inneholder henholdsvis 1,1 og 2,1 mg fenylalanin.
OVERDOSE
Ingen overdoser av MAXALT ble rapportert under kliniske studier hos voksne.
Noen voksne pasienter som fikk 40 mg MAXALT 5 mg enten en enkeltdose eller som to doser med et 2-timers interdoseintervall hadde svimmelhet og somnolens.
I en klinisk farmakologisk studie der 12 voksne forsøkspersoner fikk MAXALT 5 mg, ved totale kumulative doser på 80 mg (gitt innen fire timer), opplevde to av forsøkspersonene synkope, svimmelhet, bradykardi inkludert tredjegrads AV-blokk, oppkast og/eller inkontinens .
I den langsiktige, åpne studien, som involverte 606 behandlede pediatriske migrenepasienter i alderen 12 til 17 år (hvorav 432 ble behandlet i minst 12 måneder), tok 151 pasienter (25 %) to 10 mg doser MAXALT-MLT innen en 24-timers periode. Bivirkninger for 3 av disse pasientene inkluderte ubehag i magen, tretthet og dyspné.
tillegg, basert på farmakologien til MAXALT 10 mg, kan hypertensjon eller myokardiskemi oppstå etter overdosering. Gastrointestinal dekontaminering (dvs. mageskylling etterfulgt av aktivt kull) bør vurderes hos pasienter som mistenkes for en overdose med MAXALT. Klinisk og elektrokardiografisk overvåking bør fortsette i minst 12 timer, selv om kliniske symptomer ikke observeres.
Effekten av hemo- eller peritonealdialyse på serumkonsentrasjoner av rizatriptan er ukjent.
KONTRAINDIKASJONER
MAXALT 5mg er kontraindisert hos pasienter med:
- . Iskemisk koronarsykdom (angina pectoris, historie med hjerteinfarkt eller dokumentert stille iskemi), eller annen betydelig underliggende kardiovaskulær sykdom [se ADVARSLER OG FORHOLDSREGLER ]. . Koronararterievasospasme inkludert Prinzmetals angina [se ADVARSLER OG FORHOLDSREGLER ]. . Anamnese med slag eller forbigående iskemisk angrep (TIA) [se ADVARSLER OG FORHOLDSREGLER ]. . Perifer vaskulær sykdom (PVD) [se ADVARSLER OG FORHOLDSREGLER ]. . Iskemisk tarmsykdom [se ADVARSLER OG FORHOLDSREGLER ]. . Ukontrollert hypertensjon [se ADVARSLER OG FORHOLDSREGLER ]. . Nylig bruk (dvs. innen 24 timer) av en annen 5-HT1-agonist, ergotaminholdig medisin eller medisin av ergottype (som dihydroergotamin eller metysergid) [se NARKOTIKAHANDEL ]. . Hemiplegisk eller basilær migrene [se INDIKASJONER ]. . Samtidig administrering eller nylig seponering (dvs. innen 2 uker) av en MAO-A-hemmer [se NARKOTIKAHANDEL og KLINISK FARMAKOLOGI ]. . Overfølsomhet overfor rizatriptan eller noen av hjelpestoffene (angioødem og anafylaksi sett) [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Rizatriptan binder seg med høy affinitet til humane klonede 5-HT1B/1D-reseptorer. MAXALT 10mg utøver antagelig sin terapeutiske effekt ved behandling av migrenehodepine ved å binde seg til 5-HT1B/1D-reseptorer lokalisert på intrakranielle blodårer og sensoriske nerver i trigeminussystemet.
Farmakokinetikk
Absorpsjon
Rizatriptan absorberes fullstendig etter oral administrering. Gjennomsnittlig oral absolutt biotilgjengelighet av MAXALT 10 mg tablett er ca. 45 %, og gjennomsnittlig maksimal plasmakonsentrasjon (Cmax) nås i løpet av ca. 1-1,5 timer (Tmax). Tilstedeværelsen av migrenehodepine så ikke ut til å påvirke absorpsjonen eller farmakokinetikken til rizatriptan. Mat har ingen signifikant effekt på biotilgjengeligheten av rizatriptan, men forsinker tiden for å nå toppkonsentrasjonen med en time. I kliniske studier ble MAXALT 10 mg administrert uten hensyn til mat.
Biotilgjengeligheten og Cmax for rizatriptan var like etter administrering av MAXALT-tabletter og MAXALT-MLT oralt desintegrerende tabletter, men absorpsjonshastigheten er noe langsommere med MAXALT-MLT, med Tmax forsinket med opptil 0,7 time. AUC for rizatriptan er omtrent 30 % høyere hos kvinner enn hos menn. Ingen akkumulering skjedde ved gjentatt dosering.
Fordeling
Gjennomsnittlig distribusjonsvolum er ca. 140 liter hos mannlige forsøkspersoner og 110 liter hos kvinnelige forsøkspersoner. Rizatriptan er minimalt bundet (14 %) til plasmaproteiner.
Metabolisme
Den primære ruten for rizatriptanmetabolisme er via oksidativ deaminering av monoaminoksidase-A (MAO-A) til indoleddiksyremetabolitten, som ikke er aktiv på 5-HT1B/1D-reseptoren. N-monodesmetyl-rizatriptan, en metabolitt med aktivitet lik den til moderforbindelsen ved 5-HT1B/1D-reseptoren, dannes i mindre grad. Plasmakonsentrasjoner av N-monodesmetyl-rizatriptan er ca. 14 % av konsentrasjonene til moderforbindelsen, og det elimineres med tilsvarende hastighet. Andre mindre metabolitter, N-oksidet, 6-hydroksyforbindelsen og sulfatkonjugatet til 6-hydroksymetabolitten er ikke aktive på 5-HT1B/1D-reseptoren.
Eliminering
Den totale radioaktiviteten til den administrerte dosen gjenvunnet i løpet av 120 timer i urin og feces var henholdsvis 82 % og 12 %, etter en enkelt 10 mg oral administrering av 14C-rizatriptan. Etter oral administrering av 14C-rizatriptan utgjorde rizatriptan ca. 17 % av sirkulerende plasmaradioaktivitet. Omtrent 14 % av en oral dose skilles ut i urinen som uendret rizatriptan, mens 51 % skilles ut som indoleddiksyremetabolitt, noe som indikerer betydelig førstegangsmetabolisme.
Plasmahalveringstiden til rizatriptan hos menn og kvinner er gjennomsnittlig 2-3 timer.
Cytokrom P450 isoformer
Rizatriptan er ikke en hemmer av aktivitetene til human levercytokrom P450 isoform 3A4/5, 1A2, 2C9, 2C19 eller 2E1; rizatriptan er en konkurrerende hemmer (Ki=1400 nM) av cytokrom P450 2D6, men kun ved høye, klinisk irrelevante konsentrasjoner.
Spesielle populasjoner
Geriatrisk
Rizatriptans farmakokinetikk hos friske eldre frivillige uten migrene (alder 65-77 år) var lik den hos yngre frivillige uten migrene (alder 18-45 år).
Pediatrisk
Farmakokinetikken til rizatriptan ble bestemt hos pediatriske migrenepasienter i alderen 6 til 17 år. Eksponering etter enkeltdoseadministrasjon av 5 mg MAXALT-MLT til pediatriske pasienter som veier 20-39 kg (44-87 lb) eller 10 mg MAXALT-MLT til pediatriske pasienter som veier ≥40 kg (88 lb) var lik de som ble observert etter enkeltdose administrering av 10 mg MAXALT-MLT til voksne.
Kjønn
Gjennomsnittlig AUC0-∞ og Cmax for rizatriptan (10 mg oralt) var henholdsvis ca. 30 % og 11 % høyere hos kvinner sammenlignet med menn, mens Tmax forekom omtrent samtidig.
Nedsatt leverfunksjon
Etter oral administrering til pasienter med nedsatt leverfunksjon forårsaket av mild til moderat alkoholisk levercirrhose, var plasmakonsentrasjonen av rizatriptan lik hos pasienter med mild leversvikt sammenlignet med en kontrollgruppe av personer med normal leverfunksjon; Plasmakonsentrasjoner av rizatriptan var omtrent 30 % høyere hos pasienter med moderat leversvikt.
Nedsatt nyrefunksjon
Hos pasienter med nedsatt nyrefunksjon (kreatininclearance 10-60 ml/min/1,73 m2), var AUC0-∞ for rizatriptan ikke signifikant forskjellig fra det hos personer med normal nyrefunksjon. Hos hemodialysepasienter (kreatininclearance
Løp
Farmakokinetiske data viste ingen signifikante forskjeller mellom afroamerikanske og kaukasiske personer.
Narkotikahandel
[Se også NARKOTIKAHANDEL ]
Monoaminoksidasehemmere
Rizatriptan metaboliseres hovedsakelig via monoaminoksidase, 'A' subtype (MAO-A). Plasmakonsentrasjoner av rizatriptan kan økes av legemidler som er selektive MAO-A-hemmere (f.eks. moklobemid) eller ikke-selektive MAO-hemmere [type A og B] (f.eks. isokarboksazid, fenelzin, tranylcypromin og pargylin). I en legemiddelinteraksjonsstudie, da MAXALT 10 mg ble administrert til personer (n=12) som fikk samtidig behandling med den selektive, reversible MAO-A-hemmeren, moklobemid 150 mg tid, var det gjennomsnittlig økning i rizatriptan AUC og Cmax på 119 % og 41 % henholdsvis; og AUC for den aktive N-monodesmetylmetabolitten til rizatriptan økte med mer enn 400 %. Interaksjonen forventes å være større med irreversible MAO-hemmere. Ingen farmakokinetisk interaksjon er forventet hos pasienter som får selektive MAO-B-hemmere [se KONTRAINDIKASJONER og NARKOTIKAHANDEL ].
Propranolol
en studie med samtidig administrering av propranolol 240 mg/dag og en enkeltdose rizatriptan 10 mg hos friske voksne personer (n=11), ble gjennomsnittlig plasma-AUC for rizatriptan økt med 70 % under propranololadministrasjon, og en fire ganger økning ble observert i ett emne. AUC for den aktive N-monodesmetylmetabolitten til rizatriptan ble ikke påvirket av propranolol [se DOSERING OG ADMINISTRASJON og NARKOTIKAHANDEL ].
Nadolol/Metoprolol
I en legemiddelinteraksjonsstudie ble effekten av flere doser av nadolol 80 mg eller metoprolol 100 mg hver 12. time på farmakokinetikken til en enkeltdose på 10 mg rizatriptan evaluert hos friske personer (n=12). Ingen farmakokinetiske interaksjoner ble observert.
Paroksetin
I en studie av interaksjonen mellom den selektive serotoninreopptakshemmeren (SSRI) paroksetin 20 mg/dag i to uker og en enkeltdose MAXALT 10 mg hos friske personer (n=12), verken plasmakonsentrasjonene av rizatriptan eller sikkerhetsprofilen. ble påvirket av paroksetin [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL , og PASIENTINFORMASJON ].
Orale prevensjonsmidler
en studie av samtidig administrering av et oralt prevensjonsmiddel i løpet av 6 dager med administrering av MAXALT (10-30 mg/dag) hos friske kvinnelige frivillige (n=18), påvirket ikke rizatriptan plasmakonsentrasjonene av etinyløstradiol eller noretindron.
Kliniske studier
Voksne
Effekten av MAXALT 5 mg tabletter ble fastslått i fire multisenter, randomiserte, placebokontrollerte studier. Pasienter som ble inkludert i disse studiene var hovedsakelig kvinner (84 %) og kaukasiske (88 %), med en gjennomsnittsalder på 40 år (område 18 til 71). Pasientene ble bedt om å behandle moderat til alvorlig hodepine. Hodepinerespons, definert som en reduksjon av moderat eller alvorlig hodepinesmerte til ingen eller mild hodepinesmerte, ble vurdert i opptil 2 timer (studie 1) eller opptil 4 timer etter dosering (studier 2, 3 og 4). Assosierte symptomer på kvalme, fotofobi og fonofobi og opprettholdelse av respons opp til 24 timer etter dose ble evaluert. En andre dose av MAXALT 10 mg tabletter ble tillatt 2 til 24 timer etter dosering for behandling av tilbakevendende hodepine i studie 1 og 2. Ytterligere analgetika og/eller antiemetika ble tillatt 2 timer etter initial behandling for redning i alle fire studiene.
alle studiene var prosentandelen av pasienter som oppnådde hodepinerespons 2 timer etter behandling signifikant høyere hos pasienter som fikk enten MAXALT 5 eller 10 mg sammenlignet med de som fikk placebo. I en separat studie var doser på 2,5 mg ikke forskjellige fra placebo. Doser større enn 10 mg var assosiert med økt forekomst av bivirkninger. Resultatene fra de fire kontrollerte studiene er oppsummert i tabell 2.
Sammenligninger av legemiddelytelse basert på resultater oppnådd i forskjellige kliniske studier er kanskje ikke pålitelige. Fordi studier utføres til forskjellige tider, med forskjellige utvalg av pasienter, av forskjellige etterforskere, som bruker forskjellige kriterier og/eller forskjellige tolkninger av de samme kriteriene, under forskjellige forhold (dose, doseringsregime, etc.), kvantitative estimater av behandlingsrespons og tidspunktet for respons kan forventes å variere betydelig fra studie til studie.
Den estimerte sannsynligheten for å oppnå en innledende hodepinerespons innen 2 timer etter behandling i de samlede studiene 1, 2, 3 og 4 er vist i figur 1.
Figur 1: Estimert sannsynlighet for å oppnå en innledende hodepinerespons med 2 timer i sammenslåtte studier 1, 2, 3 og 4* 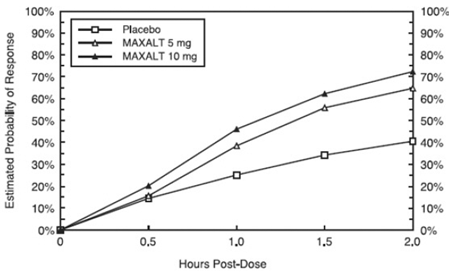
For pasienter med migrene-assosiert fotofobi, fonofobi og kvalme ved baseline, var det en redusert forekomst av disse symptomene etter administrering av MAXALT sammenlignet med placebo.
To til 24 timer etter den første dosen av studiebehandlingen fikk pasientene bruke tilleggsbehandling for smerterespons i form av en andre dose studiebehandling eller annen medisin. Den estimerte sannsynligheten for at pasienter tar en ny dose eller annen medisin mot migrene i løpet av 24 timer etter den første dosen av studiebehandlingen er oppsummert i figur 2.
Figur 2: Estimert sannsynlighet for at pasienter tar en andre dose av MAXALT 10 mg tabletter eller annen medisin for migrene i løpet av 24 timer etter den første dosen av studiebehandlingen i sammenslåtte studier 1, 2, 3 og 4* 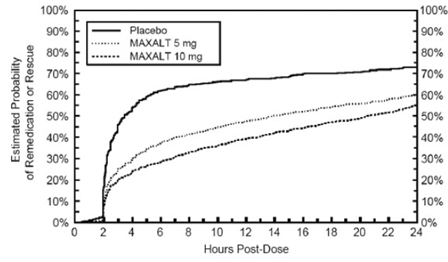
Effekten var upåvirket av tilstedeværelsen av aura; etter kjønn eller alder på pasienten; eller ved samtidig bruk av vanlige migreneprofylaktiske legemidler (f.eks. betablokkere, kalsiumkanalblokkere, trisykliske antidepressiva) eller orale prevensjonsmidler. I ytterligere to lignende studier var effekten upåvirket av forholdet til menstruasjon. Det var utilstrekkelig data til å vurdere effekten av rase på effekten.
MAXALT-MLT oralt desintegrerende tabletter
Effekten av MAXALT-MLT ble etablert i to multisenter, randomiserte, placebokontrollerte studier som var lik utformingen av studiene med MAXALT tabletter (studier 5 og 6). Pasientene ble bedt om å behandle moderat til alvorlig hodepine. Pasienter som ble behandlet i disse studiene var hovedsakelig kvinner (88 %) og kaukasiske (95 %), med en gjennomsnittsalder på 42 år (spredning 18-72).
begge studiene var prosentandelen av pasienter som oppnådde hodepinerespons 2 timer etter behandling signifikant høyere hos pasienter som fikk enten MAXALT-MLT 5 eller 10 mg sammenlignet med de som fikk placebo. Resultatene fra studie 5 og 6 er oppsummert i tabell 3.
Den estimerte sannsynligheten for å oppnå en innledende hodepinerespons innen 2 timer etter behandling med MAXALT-MLT i sammenslåtte studier 5 og 6 er vist i figur 3.
Figur 3: Estimert sannsynlighet for å oppnå en innledende hodepinerespons med MAXALT-MLT med 2 timer i sammenslåtte studier 5 og 6* 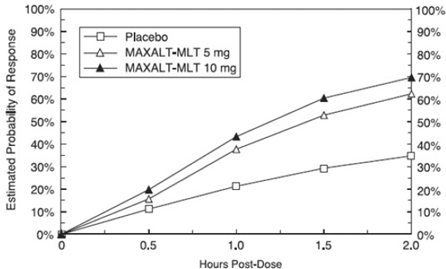
For pasienter med migreneassosiert fotofobi og fonofobi ved baseline var det en redusert forekomst av disse symptomene etter administrering av MAXALT-MLT sammenlignet med placebo.
To til 24 timer etter den første dosen av studiebehandlingen fikk pasientene bruke tilleggsbehandling for smerterespons i form av en andre dose studiebehandling eller annen medisin. Den estimerte sannsynligheten for at pasienter tar en ny dose eller annen medisin mot migrene i løpet av 24 timer etter den første dosen av studiebehandlingen er oppsummert i figur 4.
Figur 4: Estimert sannsynlighet for at pasienter tar en andre dose MAXALT-MLT eller annen medisin mot migrene i løpet av 24 timer etter den første dosen av studiebehandlingen i sammenslåtte studier 5 og 6* 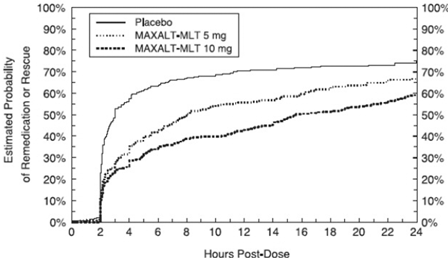
Pediatriske pasienter i alderen 6 til 17 år
Effekten av MAXALT-MLT hos pediatriske pasienter 6 til 17 år ble evaluert i en multisenter, randomisert, dobbeltblind, placebokontrollert, parallell gruppe klinisk studie (Studie 7). Pasienter måtte ha minst en 6-måneders historie med migreneanfall (med eller uten aura) som vanligvis varte i 3 timer eller mer (når ubehandlet). Pasientpopulasjonen har historisk sett ikke respondert på NSAIDs og paracetamolbehandling.
Pasientene ble bedt om å behandle et enkelt migreneanfall med hodepinesmerter av moderat til alvorlig intensitet. Behandlingsfasen av studien hadde to stadier. Fase 1 ble brukt til å identifisere placebo-ikke-responderere, som deretter gikk inn i stadium 2, der pasienter ble randomisert til MAXALT-MLT eller placebo. Ved å bruke en vektbasert doseringsstrategi fikk pasienter 20 kg til
Gjennomsnittsalderen for den studerte pasientpopulasjonen var 13 år. Sekstien prosent av pasientene var kaukasiske, og femtiseks prosent av pasientene var kvinner. Prosentandelen av pasienter som oppnådde det primære endepunktet for ingen hodepinesmerter 2 timer etter behandling var signifikant høyere hos pasienter som fikk MAXALT-MLT, sammenlignet med de som fikk placebo (33 % vs. 24 %). Resultatene fra studie 7 er oppsummert i tabell 4.
Den observerte prosentandelen av pediatriske pasienter som ikke oppnår hodepinesmerter innen 2 timer etter innledende behandling med MAXALT-MLT er vist i figur 5.
Figur 5: Observert prosentandel av pasienter som ikke rapporterte hodepinesmerter 2 timer etter dose i studie 7 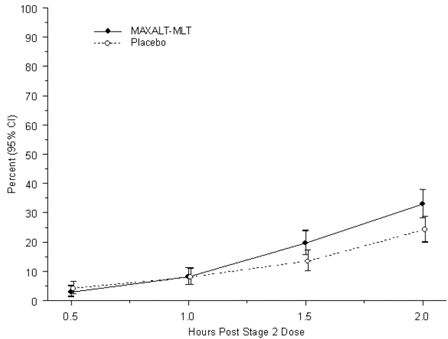
Prevalensen av de utforskende endepunktene for fravær av migreneassosierte symptomer (kvalme, fotofobi og fonofobi) 2 timer etter inntak av dosen var ikke statistisk signifikant forskjellig mellom pasienter som fikk MAXALT-MLT og de som fikk placebo.
PASIENTINFORMASJON
MAXALT® (max-awlt)
MAXALT-MLT® (rizatriptanbenzoat) Tabletter og oralt desintegrerende tabletter
Les denne pasientinformasjonen før du begynner å ta MAXALT® og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med legen din om din medisinske tilstand eller din behandling.
Med mindre annet er oppgitt, gjelder informasjonen i dette pasientinformasjonsheftet både MAXALT 10 mg tabletter og MAXALT-MLT® oralt desintegrerende tabletter.
Hva er MAXALT?
MAXALT er et reseptbelagt legemiddel som tilhører en klasse legemidler som kalles triptaner. MAXALT er tilgjengelig som en tradisjonell tablett (MAXALT) og som en oralt desintegrerende tablett (MAXALT-MLT).
MAXALT 5mg og MAXALT-MLT brukes til å behandle migreneanfall med eller uten aura hos voksne og barn i alderen 6 til 17 år.
MAXALT 5mg skal ikke brukes for å forhindre migreneanfall.
MAXALT er ikke for behandling av hemiplegisk eller basilær migrene.
Det er ikke kjent om MAXALT er trygt og effektivt for behandling av gruppehodepine.
Det er ikke kjent om det er trygt og effektivt å ta mer enn 1 dose MAXALT i løpet av 24 timer hos barn i alderen 6 til 17 år.
Det er ikke kjent om MAXALT er trygt og effektivt hos barn under 6 år.
Hvem bør ikke ta MAXALT?
Ikke ta MAXALT hvis du:
- . har eller har hatt hjerteproblemer . har eller har hatt hjerneslag eller forbigående iskemisk anfall (TIA) . har eller har hatt blodåreproblemer inkludert iskemisk tarmsykdom . har ukontrollert høyt blodtrykk . har tatt andre Triptan-medisiner de siste 24 timene . har tatt medisiner som inneholder ergot de siste 24 timene . har hemiplegisk eller basilær migrene . ta monoaminoksidase (MAO)-hemmer eller har tatt en MAO-hemmer i løpet av de siste 2 ukene . er allergisk mot rizatriptanbenzoat eller noen av innholdsstoffene i MAXALT. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i MAXALT.
Snakk med legen din før du tar dette legemidlet hvis du har noen av tilstandene som er oppført ovenfor eller hvis du ikke er sikker på om du tar noen av disse legemidlene.
Hva bør jeg fortelle legen min før jeg tar MAXALT?
Før du tar MAXALT, fortell legen din dersom du:
- . har eller har hatt hjerteproblemer, høyt blodtrykk, brystsmerter eller kortpustethet . har noen risikofaktorer for hjerteproblemer eller blodåreproblemer som:
- . høyt blodtrykk . høyt kolesterol . røyking . fedme . diabetes . familiehistorie med hjerteproblemer . du er postmenopausal . du er en mann over 40
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
MAXALT 10mg og andre legemidler kan påvirke hverandre og forårsake bivirkninger. MAXALT kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan MAXALT 5mg virker.
Fortell legen din spesielt hvis du tar:
- . medisiner som inneholder propranolol som Inderal®, Inderal® LA eller Innopran® XL . legemidler som brukes til å behandle stemningslidelser, inkludert selektive serotoninreopptakshemmere (SSRI) eller serotonin noradrenalin reopptakshemmere (SNRI).
Spør legen din eller apoteket om en liste over disse legemidlene hvis du er usikker.
Kjenn til medisinene du tar. Hold en liste over dem for å vise legen din og apoteket når du får en ny medisin.
Hvordan skal jeg ta MAXALT?
- . Ta MAXALT nøyaktig slik legen din sier at du skal ta det. . Legen din vil fortelle deg hvor mye MAXALT 5 mg du skal ta og når du skal ta det. . Slik tar du MAXALT-MLT:
- . La MAXALT-MLT oralt desintegrerende tabletter ligge i pakken den kommer i til du er klar til å ta den. Når du er klar til å ta den:
- . Fjern blemmen fra folieposen. Ikke skyv den oralt desintegrerende MAXALT-MLT-tabletten gjennom blisterpakningen. . Skrell opp blisterpakningen med tørre hender og plasser den oralt oppløselige MAXALT-MLT-tabletten på tungen. Tabletten vil løse seg opp og bli svelget sammen med spyttet. Ingen væske er nødvendig for å ta den oralt desintegrerende tabletten.
- . For voksne: en ny dose kan tas 2 timer etter den første dosen. Ikke ta mer enn 30 mg MAXALT i løpet av en 24-timers periode (ta for eksempel ikke mer enn 3 10 mg tabletter i løpet av en 24-timers periode). . For barn i alderen 6 til 17 år: Det er ikke kjent om det er trygt og effektivt å ta mer enn 1 dose MAXALT 5 mg i løpet av 24 timer. Snakk med legen din om hva du skal gjøre hvis hodepinen ikke forsvinner eller kommer tilbake.
Hva bør jeg unngå mens jeg tar MAXALT?
MAXALT 5mg kan forårsake svimmelhet, svakhet eller besvimelse. Hvis du har disse symptomene, ikke kjør bil, bruk maskiner eller gjør noe som krever at du er på vakt.
Hva er de mulige bivirkningene av MAXALT 5mg?
MAXALT 5mg kan forårsake alvorlige bivirkninger. Ring legen din eller gå til nærmeste legevakt umiddelbart hvis du tror du har noen av de alvorlige bivirkningene av MAXALT, inkludert:
- . hjerteinfarkt. Symptomer på hjerteinfarkt kan omfatte:
- . ubehag i brystet i midten av brystet som varer i mer enn noen få minutter eller som går bort og kommer tilbake . ubehag i brystet som føles som ubehagelig trykk, klemming, fylde eller smerte . smerte eller ubehag i armer, rygg, nakke, kjeve eller mage . kortpustethet med eller uten ubehag i brystet . bryter ut i kaldsvette . kvalme eller oppkast . føler seg svimmel
- . nummenhet eller svakhet i ansiktet, armen eller benet, spesielt på den ene siden av kroppen . forvirring, problemer med å snakke eller forstå . problemer med å se i ett eller begge øynene dine . problemer med å gå, svimmelhet, tap av balanse eller koordinasjon . alvorlig hodepine uten kjent årsak
- . magesmerter . blodig diaré . synsproblemer . kulde og nummenhet i hender og føtter
- . opphisselse . hallusinasjoner . koma . rask hjerterytme . raske endringer i blodtrykket ditt . økt kroppstemperatur . muskelspasme . tap av koordinasjon . kvalme, oppkast eller diaré
De vanligste bivirkningene av MAXALT hos voksne inkluderer:
- . føler seg trøtt eller trøtt . smerte eller trykk i brystet eller halsen . svimmelhet
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Hvis du tar MAXALT 10 mg for ofte, kan dette føre til at du får kronisk hodepine. I slike tilfeller bør du kontakte legen din, da du kanskje må slutte å ta MAXALT.
Dette er ikke alle mulige bivirkninger av MAXALT. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA1088.
Hvordan bør jeg oppbevare MAXALT?
- . Oppbevar MAXALT ved romtemperatur mellom 59 °F til 86 °F (15 °C til 30 °C). . Kast medisin som er utdatert eller ikke lenger er nødvendig.
Oppbevar MAXALT 10mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av MAXALT.
Medisiner blir noen ganger foreskrevet for andre formål enn de som er oppført i et pasientinformasjonshefte. Ikke bruk MAXALT for en tilstand det ikke er foreskrevet for. Ikke gi MAXALT til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Dette Pasientinformasjonsheftet oppsummerer den viktigste informasjonen om MAXALT. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre apoteket eller legen om informasjon om MAXALT som er skrevet for helsepersonell.
For mer informasjon, gå til www.maxalt.com.
Hva er ingrediensene i MAXALT?
Aktiv ingrediens i MAXALT 10mg og MAXALT-MLT oralt desintegrerende tabletter:
rizatriptanbenzoat.
Inaktive ingredienser i MAXALT: laktosemonohydrat, mikrokrystallinsk cellulose, pregelatinisert stivelse, jernoksid (rødt) og magnesiumstearat.
Inaktive ingredienser i MAXALT-MLT oralt desintegrerende tabletter: smak av gelatin, mannitol, glycin, aspartam og peppermynte.
MAXALT-MLT oralt desintegrerende tabletter inneholder aspartam, en kilde til fenylalanin.
Fenylketonurika:
MAXALT-MLT oralt desintegrerende tabletter 5 mg inneholder 1,1 mg fenylalanin. MAXALT-MLT oralt desintegrerende tabletter 10 mg inneholder 2,1 mg fenylalanin.
Denne pasientinformasjonen er godkjent av US Food and Drug Administration.
