Imitrex 100mg, 25mg, 50mg Sumatriptan Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Imitrex 25mg og hvordan brukes det?
Imitrex 100mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på migrenehodepine og klyngehodepine. Imitrex kan brukes alene eller sammen med andre medisiner.
Imitrex 50mg er et antimigrenemiddel, seratonin 5-HT-reseptoragonist.
Det er ikke kjent om Imitrex 50mg er trygt og effektivt hos barn under 18 år, og bruk anbefales ikke for geriatriske pasienter.
Hva er de mulige bivirkningene av Imitrex 50mg?
Imitrex 25mg kan forårsake alvorlige bivirkninger inkludert:
- . plutselige, sterke magesmerter, . diaré med eller uten tilstedeværelse av blod, . sterke brystsmerter, . smerter i kjeven eller skulderen, . kortpustethet, . uregelmessige hjerteslag, . anfall (kramper), . kramper i benet, . nummenhet eller prikking i bena eller føttene, . brennende smerte i bena eller føttene, . kald følelse i bena eller føttene, . fargeendringer i bena eller føttene, . hoftesmerter, . kvalme, . oppkast, . svette eller skjelving, . opphisselse, . hallusinasjoner, . feber, . muskelstivhet, . tap av koordinasjon, . plutselig nummenhet eller svakhet på den ene siden av kroppen, . utydelig tale, . vanskeligheter med å se, . dårlig balanse, og . plutselig kraftig hodepine
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Imitrex inkluderer:
- . smerte eller tetthet i brystet, halsen eller kjeven, . trykk i hvilken som helst del av kroppen din, . nummenhet eller prikking, . føler seg varm eller kald, . svimmelhet, . døsighet, . svakhet, . ubehagelig smak etter bruk av nesemedisin, . smerte, svie, nummenhet eller prikking i nesen eller halsen etter bruk av nesemedisinen, og . rennende eller tett nese etter bruk av nesemedisinen
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Imitrex. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
IMITREX 50 mg injeksjon inneholder sumatriptansuccinat, en selektiv 5-HT1B/1D reseptoragonist. Sumatriptansuccinat er kjemisk betegnet som 3-[2-(dimetylamino)etyl]-N-metyl-indol5-metansulfonamidsuksinat (1:1), og det har følgende struktur:
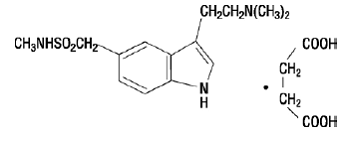
Den empiriske formelen er C14H21N3O2S•C4H6O4, som representerer en molekylvekt på 413,5. Sumatriptan succinat er et hvitt til off-white pulver som er lett løselig i vann og i saltvann.
IMITREX injeksjon er en klar, fargeløs til blekgul, steril, ikke-pyrogen oppløsning for subkutan injeksjon. Hver 0,5 ml IMITREX injeksjonsløsning 8 mg/ml inneholder 4 mg sumatriptan (base) som succinatsaltet og 3,8 mg natriumklorid, USP i vann til injeksjon, USP. Hver 0,5 ml IMITREX injeksjon 12 mg/ml oppløsning inneholder 6 mg sumatriptan (base) som succinatsaltet og 3,5 mg natriumklorid, USP i vann til injeksjon, USP. pH-området for begge løsningene er omtrent 4,2 til 5,3. Osmolaliteten til begge injeksjonene er 291 mOsmol.
INDIKASJONER
IMITREX® Injection er indisert hos voksne for (1) akutt behandling av migrene, med eller uten aura, og (2) akutt behandling av klasehodepine.
Bruksbegrensninger
- . Bruk kun hvis en klar diagnose av migrene eller klasehodepine er etablert. Hvis en pasient ikke har noen respons på det første migrene- eller klasehodepineanfallet behandlet med IMITREX 50 mg injeksjon, revurder diagnosen før IMITREX injeksjon administreres for å behandle eventuelle påfølgende angrep. . IMITREX injeksjon er ikke indisert for å forebygge migrene eller klasehodepineanfall.
DOSERING OG ADMINISTRASJON
Doseringsinformasjon
Maksimal enkelt anbefalt voksendose av IMITREX 25 mg injeksjon for akutt behandling av migrene eller klasehodepine er 6 mg injisert subkutant. For behandling av migrene, hvis bivirkninger er dosebegrensende, kan lavere doser (1 mg til 5 mg) brukes [se Kliniske studier ]. For behandling av klyngehodepine er effekten av lavere doser ikke fastslått.
Den maksimale kumulative dosen som kan gis i løpet av 24 timer er 12 mg, to 6 mg injeksjoner atskilt med minst 1 time. En andre dose på 6 mg bør kun vurderes dersom en viss respons på en første injeksjon ble observert.
Administrering med IMITREX STATdose Pen®
En autoinjektorenhet (IMITREX 25 mg STATdose Pen) er tilgjengelig for bruk med 4 mg og 6 mg ferdigfylte sprøytepatroner. Med denne enheten penetrerer nålen ca. 1/4 tomme (5 til 6 mm). Injeksjonen er ment å gis subkutant, og intramuskulær eller intravaskulær levering må unngås. Instruer pasientene om riktig bruk av IMITREX 100 mg STATdose Pen og instruer dem til å bruke injeksjonssteder med tilstrekkelig hud og subkutan tykkelse for å passe til lengden på nålen.
Administrering av andre doser av IMITREX enn 4 eller 6 mg
Hos pasienter som får andre doser enn 4 mg eller 6 mg, bruk 6-mg enkeltdose hetteglasset; ikke bruk IMITREX 50mg STATdose Pen. Inspiser hetteglasset visuelt for partikler og misfarging før administrering. Må ikke brukes hvis partikler og misfarging er registrert.
HVORDAN LEVERES
Doseringsformer og styrker
- . Injeksjon: 4 mg og 6 mg endose ferdigfylte sprøytepatroner for bruk med IMITREX STATdose Pen. . Injeksjon: 6 mg enkeltdose hetteglass.
Oppbevaring og håndtering
IMITREX 100mg injeksjon inneholder sumatriptan (base) som succinatsaltet og leveres som en klar, fargeløs til blekgul, steril, ikke-pyrogen løsning som følger:
Ferdigfylt sprøyte og/eller autoinjektorpenn
Hver pakke inneholder en pasientinformasjon og brukerveiledning for pasienten.
IMITREX 100 mg STATdose System®, 4 mg , som inneholder 1 IMITREX 25 mg STAT-dosepenn, 2 ferdigfylte enkeltdose-sprøytepatroner og 1 bæreveske ( NDC 0173-0739-00).
IMITREX 100 mg STATdosesystem, 6 mg som inneholder 1 IMITREX STAT-dosepenn, 2 ferdigfylte endose-sprøytepatroner og 1 bæreveske ( NDC 0173-0479-00).
To 4 mg enkeltdose ferdigfylte sprøyter patroner for bruk med IMITREX STATdose System ( NDC 0173-0739-02).
To 6 mg enkeltdose ferdigfylte sprøyter patroner for bruk med IMITREX 25mg STATdose System ( NDC 0173-0478-00).
Enkeltdose hetteglass
IMITREX 25 mg enkeltdose hetteglass for injeksjon (6 mg/0,5 ml) i kartonger som inneholder 5 hetteglass ( NDC 01730449-02).
Oppbevares mellom 2° og 30°C (36° og 86°F). Beskytt mot lys.
GlaxoSmithKline, Research Triangle Park, NC 27709
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i merkingen:
- . Myokardiskemi, hjerteinfarkt og Prinzmetals angina [se ADVARSLER OG FORHOLDSREGLER ] . Arytmier [se ADVARSLER OG FORHOLDSREGLER ] . Bryst-, hals-, nakke- og/eller kjevesmerter/tetthet/trykk [se ADVARSLER OG FORHOLDSREGLER ] . Cerebrovaskulære hendelser [se ADVARSLER OG FORHOLDSREGLER ] . Andre vasospasmereaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Medikamentoverforbrukshodepine [se ADVARSLER OG FORHOLDSREGLER ] . Serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ] . Økning i blodtrykk [se ADVARSLER OG FORHOLDSREGLER ] . Overfølsomhetsreaksjoner [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER ] . Anfall [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
Migrene hodepine
Tabell 1 viser bivirkninger som oppsto i 2 amerikanske placebokontrollerte kliniske studier hos migrenepasienter (studier 2 og 3) etter enten en enkeltdose på 6 mg IMITREX 100 mg injeksjon eller placebo. Bare reaksjoner som oppstod med en frekvens på 2 % eller mer i grupper behandlet med IMITREX injeksjon 6 mg og som oppstod med en frekvens høyere enn placebogruppen, er inkludert i tabell 1.
Forekomsten av bivirkninger i kontrollerte kliniske studier ble ikke påvirket av kjønn eller alder på pasientene. Det var utilstrekkelig data til å vurdere effekten av rase på forekomsten av bivirkninger.
Klyngehodepine
I de kontrollerte kliniske studiene som vurderte effekten av IMITREX 50 mg injeksjon som behandling for klasehodepine (studier 4 og 5), ble det ikke oppdaget nye signifikante bivirkninger som ikke allerede var identifisert i studier med IMITREX 100 mg hos pasienter med migrene.
Samlet sett var frekvensen av bivirkninger rapportert i studiene med klasehodepine generelt lavere enn i migrenestudiene. Unntak inkluderer rapporter om parestesi (5 % IMITREX, 0 % placebo), kvalme og oppkast (4 % IMITREX, 0 % placebo) og bronkospasme (1 % IMITREX 50 mg, 0 % placebo).
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av IMITREX 50 mg tabletter, IMITREX nesespray og IMITREX 50 mg injeksjon etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Kardiovaskulær
Hypotensjon, hjertebank.
Nevrologisk
Dystoni, skjelving.
NARKOTIKAHANDEL
Ergotholdige legemidler
Medikamenter som inneholder ergot er rapportert å forårsake langvarige vasospastiske reaksjoner. Fordi disse effektene kan være additive, er bruk av medisiner som inneholder ergotamin eller ergot-type (som dihydroergotamin eller metysergid) og IMITREX 25 mg injeksjon innen 24 timer etter hverandre kontraindisert.
Monoaminoksidase-A-hemmere
MAO-A-hemmere øker den systemiske eksponeringen med 2 ganger. Derfor er bruk av IMITREX injeksjon hos pasienter som får MAO-A-hemmere kontraindisert [se KLINISK FARMAKOLOGI ].
Andre 5-HT1-agonister
Fordi deres vasospastiske effekter kan være additive, er samtidig administrering av IMITREX Injection og andre 5-HT1-agonister (f.eks. triptaner) kontraindisert innen 24 timer etter hverandre.
Selektive serotoninreopptakshemmere / serotonin noradrenalin reopptakshemmere og serotonin syndrom
Tilfeller av serotonergt syndrom er rapportert under samtidig administrering av triptaner og SSRI, SNRI, TCA og MAO-hemmere [se ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Myokardiskemi, hjerteinfarkt og Prinzmetals angina
Bruk av IMITREX injeksjon er kontraindisert hos pasienter med iskemisk eller vasospastisk CAD. Det har vært sjeldne rapporter om alvorlige hjertebivirkninger, inkludert akutt hjerteinfarkt, som oppstår innen noen få timer etter administrering av IMITREX-injeksjon. Noen av disse reaksjonene oppsto hos pasienter uten kjent CAD. IMITREX 100mg injeksjon kan forårsake koronararterievasospasme (Prinzmetals angina), selv hos pasienter uten en historie med CAD.
Utfør en kardiovaskulær evaluering hos triptan-naive pasienter som har flere kardiovaskulære risikofaktorer (f.eks. økt alder, diabetes, hypertensjon, røyking, fedme, sterk familiehistorie med CAD) før de får IMITREX-injeksjon. Hvis det er tegn på CAD eller koronararterievasospasme, er IMITREX 100mg injeksjon kontraindisert. For pasienter med flere kardiovaskulære risikofaktorer som har en negativ kardiovaskulær evaluering, bør du vurdere å administrere den første dosen av IMITREX-injeksjon i en medisinsk overvåket setting og utføre et elektrokardiogram (EKG) umiddelbart etter administrering av IMITREX-injeksjon. For slike pasienter bør du vurdere periodisk kardiovaskulær evaluering hos intermitterende langtidsbrukere av IMITREX 100 mg injeksjon.
Arytmier
Livstruende forstyrrelser i hjerterytmen, inkludert ventrikkeltakykardi og ventrikkelflimmer som fører til død, er rapportert innen få timer etter administrering av 5-HT1-agonister. Avbryt IMITREX-injeksjonen hvis disse forstyrrelsene oppstår. IMITREX-injeksjon er kontraindisert hos pasienter med Wolff-Parkinson-White syndrom eller arytmier assosiert med andre ledningsforstyrrelser i hjertet.
Bryst, hals, nakke og/eller kjevesmerter/tetthet/trykk
Følelser av tetthet, smerte, trykk og tyngde i prekordium, svelg, nakke og kjeve oppstår ofte etter behandling med IMITREX Injection og er vanligvis ikke-kardielt. Utfør imidlertid en hjerteevaluering hvis disse pasientene har høy hjerterisiko. Bruk av IMITREX injeksjon er kontraindisert hos pasienter med CAD og de med Prinzmetals variant angina.
Cerebrovaskulære hendelser
Hjerneblødning, subaraknoidalblødning og hjerneslag har forekommet hos pasienter behandlet med 5-HT1-agonister, og noen har resultert i dødsfall. I en rekke tilfeller ser det ut til at de cerebrovaskulære hendelsene var primære, da 5-HT1-agonisten ble administrert i feil tro at symptomene som ble opplevd var en konsekvens av migrene når de ikke var det. Pasienter med migrene kan også ha økt risiko for visse cerebrovaskulære hendelser (f.eks. slag, blødning, TIA). Avbryt IMITREX-injeksjonen hvis det oppstår en cerebrovaskulær hendelse.
Før behandling av hodepine hos pasienter som ikke tidligere er diagnostisert med migrene eller klasehodepine eller hos pasienter som har atypiske symptomer, utelukk andre potensielt alvorlige nevrologiske tilstander. IMITREX injeksjon er kontraindisert hos pasienter med en historie med slag eller TIA.
Andre vasospasmereaksjoner
IMITREX 25 mg injeksjon kan forårsake ikke-koronare vasospastiske reaksjoner, slik som perifer vaskulær iskemi, gastrointestinal vaskulær iskemi og infarkt (med magesmerter og blodig diaré), miltinfarkt og Raynauds syndrom. Hos pasienter som opplever symptomer eller tegn som tyder på ikke-koronar vasospasmereaksjon etter bruk av en hvilken som helst 5-HT1-agonist, utelukk en vasospastisk reaksjon før de får ytterligere IMITREX-injeksjoner.
Rapporter om forbigående og permanent blindhet og betydelig delvis synstap er rapportert ved bruk av 5-HT1-agonister. Siden synsforstyrrelser kan være en del av et migreneanfall, er det ikke klart fastslått en årsakssammenheng mellom disse hendelsene og bruken av 5-HT1-agonister.
Overforbruk av medisiner Hodepine
Overforbruk av akutte migrenemedisiner (f.eks. ergotamin, triptaner, opioider eller kombinasjoner av disse legemidlene i 10 eller flere dager per måned) kan føre til forverring av hodepine (hodepine for overforbruk av medisiner). Overforbrukshodepine kan vise seg som migrenelignende daglig hodepine, eller som en markant økning i frekvensen av migreneanfall. Avrusning av pasienter, inkludert seponering av de overbrukte medikamentene, og behandling av abstinenssymptomer (som ofte inkluderer en forbigående forverring av hodepine) kan være nødvendig.
Serotonin syndrom
Serotonergt syndrom kan oppstå med IMITREX-injeksjon, spesielt ved samtidig administrering med selektive serotoninreopptakshemmere (SSRI), serotonin noradrenalin reopptakshemmere (SNRI), trisykliske antidepressiva (TCA) og MAO-hemmere [se NARKOTIKAHANDEL ]. Symptomer på serotonergt syndrom kan omfatte endringer i mental status (f.eks. agitasjon, hallusinasjoner, koma), autonom ustabilitet (f.eks. takykardi, labilt blodtrykk, hypertermi), nevromuskulære aberrasjoner (f.eks. hyperrefleksi, inkoordinering) og/eller gastrointestinale symptomer (f.eks. kvalme, oppkast, diaré). Utbruddet av symptomer oppstår vanligvis innen minutter til timer etter å ha mottatt en ny eller en større dose av en serotonerg medisin. Avbryt IMITREX-injeksjonen hvis det er mistanke om serotonergt syndrom.
Økning i blodtrykk
Betydelig økning i blodtrykket, inkludert hypertensiv krise med akutt svekkelse av organsystemer, er rapportert i sjeldne tilfeller hos pasienter behandlet med 5-HT1-agonister, inkludert pasienter uten hypertensjon i anamnesen. Overvåk blodtrykket hos pasienter som behandles med IMITREX. IMITREX injeksjon er kontraindisert hos pasienter med ukontrollert hypertensjon.
Anafylaktiske/anafylaktiske reaksjoner
Anafylaktiske/anafylaktoide reaksjoner har forekommet hos pasienter som får IMITREX. Slike reaksjoner kan være livstruende eller dødelige. Generelt er det mer sannsynlig at anafylaktiske reaksjoner på legemidler oppstår hos personer med en historie med følsomhet for flere allergener. IMITREX 50 mg injeksjon er kontraindisert hos pasienter med en historie med overfølsomhetsreaksjoner overfor IMITREX.
Anfall
Kramper er rapportert etter administrering av IMITREX. Noen har forekommet hos pasienter med enten en historie med anfall eller samtidige tilstander som disponerer for anfall. Det er også rapporter hos pasienter der ingen slike predisponerende faktorer er tydelige. IMITREX Injection bør brukes med forsiktighet hos pasienter med epilepsi i anamnesen eller tilstander assosiert med senket krampeterskel.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON og bruksanvisning ).
Risiko for myokardiskemi og/eller infarkt, Prinzmetals angina, andre vasospasmerelaterte hendelser, arytmier og cerebrovaskulære hendelser
Informer pasienter om at IMITREX 50 mg injeksjon kan forårsake alvorlige kardiovaskulære bivirkninger som hjerteinfarkt eller hjerneslag. Selv om alvorlige kardiovaskulære hendelser kan oppstå uten varselsymptomer, bør pasienter være oppmerksomme på tegn og symptomer på brystsmerter, kortpustethet, uregelmessig hjerterytme, betydelig økning i blodtrykk, svakhet og sløret tale, og bør be om medisinsk råd dersom noen veiledende tegn eller symptomer observeres. Gjør pasientene kjent med viktigheten av denne oppfølgingen [se ADVARSLER OG FORHOLDSREGLER ].
Anafylaktiske/anafylaktiske reaksjoner
Informer pasienter om at anafylaktiske/anafylaktoide reaksjoner har oppstått hos pasienter som får IMITREX 100 mg injeksjon. Slike reaksjoner kan være livstruende eller dødelige. Generelt er det mer sannsynlig at anafylaktiske reaksjoner på legemidler oppstår hos personer med en historie med følsomhet overfor flere allergener [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER ].
Samtidig bruk med andre triptaner eller ergotmedisiner
Informer pasienter om at bruk av IMITREX 50 mg injeksjon innen 24 timer etter en annen triptan eller en ergot-type medisin (inkludert dihydroergotamin eller metysergid) er kontraindisert [se KONTRAINDIKASJONER , NARKOTIKAHANDEL ].
Serotonin syndrom
Forsiktig pasienter om risikoen for serotonergt syndrom ved bruk av IMITREX-injeksjon eller andre triptaner, spesielt ved kombinert bruk med SSRI-er, SNRI-er, TCA-er og MAO-hemmere [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL ].
Overforbruk av medisiner Hodepine
Informer pasienter om at bruk av akutte migrenemedisiner i 10 eller flere dager per måned kan føre til forverring av hodepine og oppmuntre pasientene til å registrere hodepinefrekvens og medikamentbruk (f.eks. ved å føre en hodepinedagbok) [se ADVARSLER OG FORHOLDSREGLER ].
Svangerskap
Informer pasientene om at IMITREX 25 mg injeksjon ikke skal brukes under graviditet med mindre den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret [se Bruk i spesifikke populasjoner ].
Ammende mødre
Råd pasientene til å varsle helsepersonell dersom de ammer eller planlegger å amme [se Bruk i spesifikke populasjoner ].
Evne til å utføre komplekse oppgaver
Behandling med IMITREX 25 mg injeksjon kan forårsake søvnighet og svimmelhet; instruere pasienter til å vurdere deres evne til å utføre komplekse oppgaver etter administrering av IMITREX 25 mg injeksjon.
Hvordan bruke IMITREX 100mg injeksjon
Gi pasientene instruksjoner om riktig bruk av IMITREX 100 mg injeksjon hvis de er i stand til selv å administrere IMITREX 50 mg injeksjon i medisinske situasjoner uten tilsyn.
Informer pasientene om at nålen i IMITREX STATdose Pen penetrerer omtrent 5 til 6 mm. Informer pasientene om at injeksjonen er ment å gis subkutant og intramuskulær eller intravaskulær levering bør unngås. Instruer pasientene til å bruke injeksjonssteder med tilstrekkelig hud og subkutan tykkelse for å tilpasse seg lengden på nålen.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
karsinogenitetsstudier hos mus og rotter der sumatriptan ble administrert oralt i henholdsvis 78 uker og 104 uker i doser opp til 160 mg/kg/dag (den høyeste dosen hos rotter ble redusert fra 360 mg/kg/dag i uke 21 ). Den høyeste dosen til mus og rotter var omtrent 130 og 260 ganger enkelt MRHD på 6 mg administrert subkutant på mg/m²-basis. Det var ingen bevis hos noen av artene for en økning i tumorer relatert til sumatriptanadministrasjon.
Mutagenese
Sumatriptan var negativ i in vitro (bakteriell revers mutasjon [Ames], gencellemutasjon i kinesisk hamster V79/HGPRT, kromosomavvik i humane lymfocytter) og in vivo (rotte mikronucleus) analyser.
Nedsatt fertilitet
Når sumatriptan ble administrert ved subkutan injeksjon til hann- og hunnrotter før og gjennom parringsperioden, var det ingen tegn på nedsatt fertilitet ved doser opp til 60 mg/kg/dag eller omtrent 100 ganger enkeltdosen til mennesker på 6 mg på en mg/m² basis. Når sumatriptan (5, 50, 500 mg/kg/dag) ble administrert oralt til hann- og hunnrotter før og gjennom paringsperioden, var det en behandlingsrelatert reduksjon i fertilitet sekundært til en reduksjon i paring hos dyr behandlet med doser mer enn 5 mg/kg/dag. Det er ikke klart om dette funnet skyldtes en effekt på menn eller kvinner eller begge deler.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori C
Det er ingen tilstrekkelige og velkontrollerte studier av IMITREX 50 mg injeksjon hos gravide kvinner. I utviklingstoksisitetsstudier på rotter og kaniner var oral administrering av sumatriptan til drektige dyr assosiert med embryodødelighet, fosterabnormiteter og valpedødelighet. Ved intravenøs administrering til drektige kaniner var sumatriptan embryoletalt. IMITREX 100mg injeksjon skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Oral administrering av sumatriptan til drektige rotter i løpet av organogenesen resulterte i økt forekomst av abnormiteter i føtale blodkar (cervikotorakal og navlestreng). Den høyeste ingen-effektdosen for embryoføtal utviklingstoksisitet i rater var 60 mg/kg/dag, eller omtrent 100 ganger den maksimale anbefalte enkeltdosen til mennesker (MRHD) på 6 mg administrert subkutant på mg/m²-basis. Oral administrering av sumatriptan til drektige kaniner i løpet av organogenese-perioden resulterte i økt forekomst av embryodødelighet og føtale cervicothoracal vaskulære og skjelettavvik. Intravenøs administrering av sumatriptan til drektige kaniner i perioden med organogenese resulterte i økt forekomst av embryodødelighet. De høyeste orale og intravenøse ingen-effektdosene for utviklingstoksisitet hos kaniner var 15 og 0,75 mg/kg/dag, eller henholdsvis ca. 50 og 2 ganger enkelt MRHD på 6 mg administrert subkutant på mg/m²-basis.
Oral administrering av sumatriptan til rotter før og gjennom svangerskapet resulterte i embryoføtal toksisitet (redusert kroppsvekt, redusert ossifikasjon, økt forekomst av skjelettavvik). Den høyeste dosen uten effekt var 50 mg/kg/dag, eller omtrent 80 ganger enkelt MRHD på 6 mg administrert subkutant på mg/m²-basis. Hos avkom av drektige rotter som ble behandlet oralt med sumatriptan under organogenese, var det en reduksjon i valpeoverlevelse. Den høyeste dosen uten effekt for denne effekten var 60 mg/kg/dag, eller omtrent 100 ganger enkelt MRHD på 6 mg administrert subkutant på mg/m²-basis. Peroral behandling av drektige rotter med sumatriptan i siste del av svangerskapet og gjennom amming resulterte i en reduksjon i valpeoverlevelse. Den høyeste dosen uten effekt for dette funnet var 100 mg/kg/dag, eller omtrent 160 ganger enkelt MRHD på 6 mg administrert subkutant på mg/m²-basis.
Ammende mødre
Sumatriptan skilles ut i morsmelk etter subkutan administrering. Spedbarns eksponering for sumatriptan kan minimeres ved å unngå amming i 12 timer etter behandling med IMITREX 50 mg injeksjon.
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter er ikke fastslått. IMITREX 100mg injeksjon anbefales ikke til pasienter yngre enn 18 år.
To kontrollerte kliniske studier evaluerte IMITREX nesespray (5 til 20 mg) hos 1248 pediatriske migrenepasienter i alderen 12 til 17 år som behandlet ett enkelt anfall. Forsøkene fastslo ikke effekten av IMITREX nesespray sammenlignet med placebo ved behandling av migrene hos pediatriske pasienter. Bivirkninger observert i disse kliniske studiene var lik de som ble rapportert i kliniske studier hos voksne.
Fem kontrollerte kliniske studier (2 studier med enkeltangrep, 3 studier med flere angrep) som evaluerte oral IMITREX (25 til 100 mg) hos pediatriske pasienter i alderen 12 til 17 år, inkluderte totalt 701 pediatriske migrenepasienter. Disse studiene viste ikke effekten av oral IMITREX 25 mg sammenlignet med placebo ved behandling av migrene hos pediatriske pasienter. Bivirkninger observert i disse kliniske studiene var lik de som ble rapportert i kliniske studier hos voksne. Frekvensen av alle bivirkninger hos disse pasientene så ut til å være både dose- og aldersavhengige, med yngre pasienter som rapporterte reaksjoner mer vanlig enn eldre pediatriske pasienter.
Erfaring etter markedsføring dokumenterer at alvorlige bivirkninger har oppstått i den pediatriske populasjonen etter bruk av subkutan, oral og/eller intranasal IMITREX. Disse rapportene inkluderer reaksjoner som ligner på de som rapporteres sjelden hos voksne, inkludert hjerneslag, synstap og død. Et hjerteinfarkt er rapportert hos en 14 år gammel mann etter bruk av oral IMITREX; kliniske tegn oppsto innen 1 dag etter legemiddeladministrering. Kliniske data for å bestemme frekvensen av alvorlige bivirkninger hos pediatriske pasienter som kan få subkutan, oral eller intranasal IMITREX er foreløpig ikke tilgjengelig.
Geriatrisk bruk
Kliniske studier med IMITREX 100 mg injeksjon inkluderte ikke tilstrekkelig antall pasienter 65 år og eldre til å avgjøre om de responderer annerledes enn yngre pasienter. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Generelt bør dosevalg for en eldre pasient være forsiktig, vanligvis med start i den lave enden av doseringsområdet, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon og samtidig sykdom eller annen medikamentell behandling.
En kardiovaskulær evaluering anbefales for geriatriske pasienter som har andre kardiovaskulære risikofaktorer (f.eks. diabetes, hypertensjon, røyking, fedme, sterk familiehistorie med CAD) før de får IMITREX-injeksjon [se ADVARSLER OG FORHOLDSREGLER ].
OVERDOSE
Koronar vasospasme ble observert etter intravenøs administrering av IMITREX 50 mg injeksjon [se KONTRAINDIKASJONER ]. Overdoser forventes ut fra dyredata (hunder med 0,1 g/kg, rotter med 2 g/kg) muligens å forårsake kramper, skjelving, inaktivitet, erytem i ekstremitetene, redusert respirasjonsfrekvens, cyanose, ataksi, mydriasis, reaksjoner på injeksjonsstedet ( avskalling, hårtap og skorpedannelse), og lammelser.
Eliminasjonshalveringstiden for sumatriptan er ca. 2 timer [se KLINISK FARMAKOLOGI ]; derfor bør overvåking av pasienter etter overdosering med IMITREX-injeksjon fortsette i minst 10 timer eller mens symptomer eller tegn vedvarer.
Det er ukjent hvilken effekt hemodialyse eller peritonealdialyse har på serumkonsentrasjonen av sumatriptan.
KONTRAINDIKASJONER
IMITREX injeksjon er kontraindisert hos pasienter med:
- . Iskemisk koronararteriesykdom (CAD) (angina pectoris, historie med hjerteinfarkt eller dokumentert stille iskemi) eller koronararterievasospasme, inkludert Prinzmetals angina [se ADVARSLER OG FORHOLDSREGLER ]. . Wolff-Parkinson-White syndrom eller arytmier assosiert med andre hjertetilbehør ledningsforstyrrelser [se ADVARSLER OG FORHOLDSREGLER ]. . Anamnese med slag eller forbigående iskemisk anfall (TIA) eller historie med hemiplegisk eller basilær migrene fordi disse pasientene har høyere risiko for hjerneslag [se ADVARSLER OG FORHOLDSREGLER ]. . Perifer vaskulær sykdom [se ADVARSLER OG FORHOLDSREGLER ]. . Iskemisk tarmsykdom [se ADVARSLER OG FORHOLDSREGLER ]. . Ukontrollert hypertensjon [se ADVARSLER OG FORHOLDSREGLER ]. . Nylig bruk (dvs. innen 24 timer) av medisiner som inneholder ergotamin, medisiner av ergot-typen (som dihydroergotamin eller metysergid), eller en annen 5-hydroksytryptamin1 (5-HT1) agonist [se NARKOTIKAHANDEL ]. . Samtidig administrering av en monoaminoksidase (MAO)-A-hemmer eller nylig (innen 2 uker) bruk av en MAO-A-hemmer [se NARKOTIKAHANDEL , KLINISK FARMAKOLOGI ]. . Overfølsomhet overfor IMITREX (angioødem og anafylaksi sett) [se ADVARSLER OG FORHOLDSREGLER ]. . Alvorlig nedsatt leverfunksjon [se KLINISK FARMAKOLOGI ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Sumatriptan binder seg med høy affinitet til humane klonede 5-HT1B/1D-reseptorer. Sumatriptan utøver antagelig sin terapeutiske effekt ved behandling av migrene og klyngehodepine gjennom agonisteffekter ved 5-HT1B/1D-reseptorene på intrakraniale blodkar og sensoriske nerver i trigeminussystemet, noe som resulterer i kranialårekonstriksjon og hemming av pro-inflammatorisk nevropeptid. utgivelse.
Farmakodynamikk
Blodtrykk
Betydelig økning i blodtrykket, inkludert hypertensiv krise, er rapportert hos pasienter med og uten hypertensjon i anamnesen [se ADVARSLER OG FORHOLDSREGLER ].
Perifere (små) arterier
Hos friske frivillige (N = 18) klarte ikke en studie som evaluerte effekten av sumatriptan på perifer (små kar) arteriell reaktivitet å oppdage en klinisk signifikant økning i perifer motstand.
Puls
Forbigående økning i blodtrykket observert hos noen pasienter i kliniske studier utført under sumatriptans utvikling som behandling for migrene, ble ikke ledsaget av noen klinisk signifikante endringer i hjertefrekvens.
Farmakokinetikk
Absorpsjon og biotilgjengelighet
Biotilgjengeligheten av sumatriptan via subkutan injeksjon til 18 friske mannlige forsøkspersoner var 97 % ± 16 % av det som ble oppnådd etter intravenøs injeksjon.
Etter en enkelt 6-mg subkutan manuell injeksjon i deltoideusområdet av armen hos 18 friske menn (alder: 24 ± 6 år, vekt: 70 kg), var den maksimale serumkonsentrasjonen (Cmax) av sumatriptan (gjennomsnittlig ± standardavvik) 74 ± 15 ng/ml og tiden til toppkonsentrasjon (Tmax) var 12 minutter etter injeksjon (område: 5 til 20 minutter). I denne studien ga den samme dosen injisert subkutant i låret en Cmax på 61 ± 15 ng/ml ved manuell injeksjon versus 52 ± 15 ng/ml ved autoinjektorteknikker. Tmax eller absorbert mengde ble ikke signifikant endret av verken injeksjonsstedet eller -teknikken.
Fordeling
Proteinbinding, bestemt ved likevektsdialyse over konsentrasjonsområdet 10 til 1000 ng/ml er lav, omtrent 14 % til 21 %. Effekten av sumatriptan på proteinbindingen til andre legemidler er ikke evaluert.
Etter en 6-mg subkutan injeksjon i deltoidområdet av armen hos 9 menn (gjennomsnittsalder: 33 år, gjennomsnittlig vekt: 77 kg) var distribusjonsvolumet sentralt til sumatriptan 50 ± 8 liter og distribusjonshalveringstiden var 15 ± 2 minutter.
Metabolisme
In vitro-studier med humane mikrosomer tyder på at sumatriptan metaboliseres av MAO, hovedsakelig A-isoenzymet. Mesteparten av en radiomerket dose av sumatriptan som skilles ut i urinen er hovedmetabolitten indoleddiksyre (IAA) eller IAA-glukuronid, som begge er inaktive.
Eliminering
Etter en enkelt 6 mg subkutan dose ble 22 % ± 4 % utskilt i urinen som uendret sumatriptan og 38 % ± 7 % som IAA-metabolitten.
Etter en 6-mg subkutan injeksjon i deltoidområdet av armen var den systemiske clearance av sumatriptan 1 194 ± 149 ml/min og den terminale halveringstiden var 115 ± 19 minutter.
Spesifikke populasjoner
Alder
Farmakokinetikken til sumatriptan hos eldre (gjennomsnittsalder: 72 år, 2 menn og 4 kvinner) og hos personer med migrene (gjennomsnittsalder: 38 år, 25 menn og 155 kvinner) var lik den hos friske menn (gjennomsnittsalder: 30 år).
Nedsatt leverfunksjon
Effekten av mild til moderat leversykdom på farmakokinetikken til subkutant administrert sumatriptan er evaluert. Det var ingen signifikante forskjeller i farmakokinetikken til subkutant administrert sumatriptan hos moderat nedsatt leverfunksjon sammenlignet med friske kontroller. Farmakokinetikken til subkutant administrert sumatriptan hos pasienter med alvorlig nedsatt leverfunksjon er ikke studert. Bruk av IMITREX injeksjon i denne populasjonen er kontraindisert [se KONTRAINDIKASJONER ].
Løp
Systemisk clearance og Cmax for subkutan sumatriptan var lik hos svarte (n = 34) og kaukasiske (n = 38) friske menn.
Legemiddelinteraksjonsstudier
Monoaminoksidase-A-hemmere
en studie med 14 friske kvinner reduserte forbehandling med en MAO-A-hemmer clearance av subkutan sumatriptan, noe som resulterte i en 2 ganger økning i arealet under sumatriptan plasmakonsentrasjon-tid-kurven (AUC), tilsvarende en økning på 40 %. i eliminasjonshalveringstid.
Dyretoksikologi og/eller farmakologi
Opaciteter i hornhinnen
Hunder som fikk oral sumatriptan utviklet hornhinneopacitet og defekter i hornhinneepitel. Uklarhet i hornhinnen ble sett ved den laveste testede dosen, 2 mg/kg/dag, og var tilstede etter 1 måneds behandling. Defekter i hornhinneepitel ble notert i en 60-ukers studie. Tidligere undersøkelser for disse toksisitetene ble ikke utført og ingen effektdoser ble ikke etablert; den relative plasmaeksponeringen ved den laveste testede dosen var imidlertid omtrent 3 ganger den humane eksponeringen etter en 6 mg subkutan dose.
Kliniske studier
Migrene
kontrollerte kliniske studier med mer enn 1000 pasienter under migreneanfall som opplevde moderate eller sterke smerter og 1 eller flere av symptomene som er oppregnet i tabell 3, begynte lindring så tidlig som 10 minutter etter en 6 mg IMITREX 50 mg injeksjon. Lavere doser av IMITREX 100 mg injeksjon kan også vise seg å være effektive, selv om andelen pasienter som oppnådde tilstrekkelig lindring ble redusert og latensen til denne lindring er større med lavere doser.
I studie 1 ble 6 forskjellige doser av IMITREX 100 mg injeksjon (n = 30 hver gruppe) sammenlignet med placebo (n = 62), i et enkeltangrep, parallellgruppedesign, ble dose-respons-forholdet funnet å være som vist i tabell 2.
2 randomiserte, placebokontrollerte kliniske studier av IMITREX 25 mg injeksjon 6 mg hos 1 104 pasienter med moderate eller alvorlige migrenesmerter (studier 2 og 3), begynte lindring mindre enn 10 minutter. Lindring av hodepine, som definert ved en reduksjon i smerte fra alvorlig eller moderat alvorlig til mild eller ingen hodepine, ble oppnådd hos 70 % av pasientene innen 1 time etter en enkelt 6 mg subkutan dose av IMITREX-injeksjon. Omtrent 82 % og 65 % av pasientene behandlet med IMITREX 6 mg hadde henholdsvis hodepine og var smertefrie innen 2 timer.
Tabell 3 viser 1- og 2-timers effektresultater for IMITREX-injeksjon 6 mg i studie 2 og 3.
IMITREX 100mg injeksjon lindret også fotofobi, fonofobi (lydfølsomhet), kvalme og oppkast assosiert med migreneanfall. Tilsvarende effekt ble sett når pasienter selv administrerte IMITREX 50 mg injeksjon med IMITREX 100 mg STATdose Pen.
Effekten av IMITREX-injeksjon var upåvirket av hvorvidt migrene var assosiert med aura, varighet av angrepet, kjønn eller alder på pasienten, eller samtidig bruk av vanlige migreneprofylaktiske legemidler (f.eks. betablokkere).
Klyngehodepine
Effekten av IMITREX-injeksjon ved akutt behandling av klyngehodepine ble vist i 2 randomiserte, dobbeltblindede, placebokontrollerte, 2-perioders crossover-studier (studier 4 og 5). Pasienter i alderen 21 til 65 år ble registrert og ble instruert om å behandle moderat til svært alvorlig hodepine innen 10 minutter etter debut. Lindring av hodepine ble definert som en reduksjon av alvorlighetsgraden av hodepine til mild eller ingen smerte. I begge studiene var andelen individer som fikk lindring etter 10 eller 15 minutter signifikant større blant pasienter som fikk 6 mg IMITREX-injeksjon sammenlignet med de som fikk placebo (se tabell 4).
Et estimat av den kumulative sannsynligheten for at en pasient med klyngehodepine skal oppnå lindring etter å ha blitt behandlet med enten IMITREX 25 mg injeksjon eller placebo er presentert i figur 1.
Figur 1: Tid til lindring av klasehodepine fra tidspunkt for injeksjon 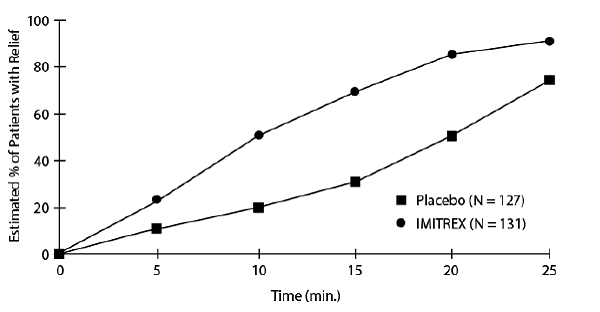
aFiguren bruker Kaplan-Meier (produktgrense) Survivorship Plot. Pasienter som tok redningsmedisin ble sensurert etter 15 minutter.
Plottet ble konstruert med data fra pasienter som enten opplevde lindring eller som ikke trengte (forespør) redningsmedisin innen en periode på 2 timer etter behandling. Som en konsekvens er dataene i plottet kun utledet fra en undergruppe av de 258 hodepinene som ble behandlet (redningsmedisin var nødvendig for 52 av de 127 placebobehandlede hodepinene og 18 av de 131 hodepinene som ble behandlet med IMITREX 50 mg injeksjon).
Andre data tyder på at behandling med IMITREX 25 mg injeksjon ikke er assosiert med en økning i tidlig tilbakefall av hodepine og har liten effekt på forekomsten av senere hodepine (dvs. de som oppstår etter 2, men før 18 eller 24 timer).
PASIENTINFORMASJON
IMITREX® (IM-i-trex) (sumatriptansuksinat) Injeksjon
Les denne pasientinformasjonen før du begynner å ta IMITREX og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller behandling.
Hva er den viktigste informasjonen jeg bør vite om IMITREX?
IMITREX kan forårsake alvorlige bivirkninger, inkludert:
Hjerteinfarkt og andre hjerteproblemer. Hjerteproblemer kan føre til døden.
Slutt å ta IMITREX 25mg og få akutt medisinsk hjelp umiddelbart hvis du har noen av følgende symptomer på hjerteinfarkt:
- . ubehag i midten av brystet som varer i mer enn noen få minutter, eller som går bort og kommer tilbake . alvorlig tetthet, smerte, trykk eller tyngde i brystet, halsen, nakken eller kjeven . smerte eller ubehag i armer, rygg, nakke, kjeve eller mage . kortpustethet med eller uten ubehag i brystet . bryter ut i kaldsvette . kvalme eller oppkast . føler seg svimmel
IMITREX er ikke for personer med risikofaktorer for hjertesykdom med mindre en hjerteundersøkelse er utført og ikke viser noe problem. Du har høyere risiko for hjertesykdom hvis du:
- . har høyt blodtrykk . har høye kolesterolnivåer . røyk . er overvektige . har diabetes . har en familiehistorie med hjertesykdom
Hva er IMITREX?
IMITREX Injection er et reseptbelagt legemiddel som brukes til å behandle akutt migrenehodepine med eller uten aura og akutt klasehodepine hos voksne som har blitt diagnostisert med migrene eller klasehodepine.
IMITREX 50mg brukes ikke til å behandle andre typer hodepine som hemiplegisk (som gjør at du ikke kan bevege deg på den ene siden av kroppen) eller basilar (sjelden form for migrene med aura) migrene.
IMITREX 100mg brukes ikke til å forhindre eller redusere antall migrene- eller klasehodepine du har.
Det er ikke kjent om IMITREX 100mg er trygt og effektivt hos barn under 18 år.
Hvem bør ikke ta IMITREX 100mg?
Ikke ta IMITREX 50mg hvis du har:
- . hjerteproblemer eller en historie med hjerteproblemer . innsnevring av blodårer til bena, armene, magen eller nyrene (perifer vaskulær sykdom) . ukontrollert høyt blodtrykk . alvorlige leverproblemer . hemiplegisk migrene eller basilar migrene. Hvis du ikke er sikker på om du har denne typen migrene, spør helsepersonell. . hatt hjerneslag, forbigående iskemiske anfall (TIA) eller problemer med blodsirkulasjonen . tatt noen av følgende medisiner i løpet av de siste 24 timene:
- . almotriptan (AXERT®) . eletriptan (RELPAX®) . frovatriptan (FROVA®) . naratriptan (AMERGE®) . rizatriptan (MAXALT®, MAXALT-MLT®) . sumatriptan og naproxen (TREXIMET®) . ergotaminer (CAFERGOT®, ERGOMAR®, MIGERGOT®) . dihydroergotamin (DHE 45®, MIGRANAL®) Spør helsepersonell hvis du ikke er sikker på om medisinen din er oppført ovenfor.
- . allergi mot sumatriptan eller noen av ingrediensene i IMITREX. Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i IMITREX.
Hva bør jeg fortelle helsepersonell før jeg tar IMITREX?
Før du tar IMITREX, fortell helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
- . har høyt blodtrykk . har høyt kolesterol . har diabetes . røyk . er overvektige . har hjerteproblemer eller familiehistorie med hjerteproblemer eller hjerneslag . har nyreproblemer . har leverproblemer . har hatt epilepsi eller anfall . ikke bruker effektiv prevensjon . bli gravid mens du tar IMITREX . ammer eller planlegger å amme. IMITREX 25mg går over i morsmelk og kan skade babyen din. Snakk med helsepersonell om den beste måten å mate babyen din på hvis du tar IMITREX.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
IMITREX og visse andre legemidler kan påvirke hverandre og forårsake alvorlige bivirkninger.
Fortell spesielt helsepersonell hvis du tar antidepressive medisiner kalt:
- . selektive serotoninreopptakshemmere (SSRI) . serotonin noradrenalin reopptakshemmere (SNRI) . trisykliske antidepressiva (TCA) . monoaminoksidasehemmere (MAO-hemmere)
Spør helsepersonell eller apotek om en liste over disse medisinene hvis du er usikker.
Kjenn til medisinene du tar. Hold en liste over dem for å vise helsepersonell eller apotek når du får en ny medisin.
Hvordan skal jeg ta IMITREX 100mg?
- . Enkelte personer bør ta sin første dose av IMITREX 25 mg på helsepersonells kontor eller i en annen medisinsk setting. Spør helsepersonell om du bør ta din første dose i medisinske omgivelser. . Bruk IMITREX 50mg nøyaktig slik helsepersonell ber deg bruke det. . Helsepersonell kan endre dosen din. Ikke endre dosen uten først å snakke med helsepersonell. . For voksne er den vanlige dosen en enkelt injeksjon gitt rett under huden. . Du bør gi en injeksjon så snart symptomene på hodepine begynner, men den kan gis når som helst under et migrene- eller klasehodepineanfall. . Hvis du ikke fikk noen lettelse etter den første injeksjonen, ikke gi en ny injeksjon uten først å snakke med helsepersonell. . Hvis hodepinen kommer tilbake eller du bare får litt lindring etter den første injeksjonen, kan du ta en ny injeksjon 1 time etter den første injeksjonen, men ikke før. . Ikke ta mer enn 12 mg i løpet av en 24-timers periode. . Hvis du bruker for mye IMITREX 25 mg, ring legen din eller gå til nærmeste legevakt umiddelbart. . Du bør skrive ned når du har hodepine og når du tar IMITREX, slik at du kan snakke med helsepersonell om hvordan IMITREX 25mg fungerer for deg.
Hva bør jeg unngå mens jeg tar IMITREX?
IMITREX kan forårsake svimmelhet, svakhet eller døsighet. Hvis du har disse symptomene, ikke kjør bil, bruk maskiner eller gjør noe der du trenger å være på vakt.
Hva er de mulige bivirkningene av IMITREX 25mg?
IMITREX kan forårsake alvorlige bivirkninger. Se "Hva er den viktigste informasjonen jeg bør vite om IMITREX?"
Disse alvorlige bivirkningene inkluderer:
- . endringer i farge eller følelse i fingrene og tærne (Raynauds syndrom) . mage- og tarmproblemer (gastrointestinale og iskemiske hendelser i tykktarmen). Symptomer på gastrointestinale og koloniske iskemiske hendelser inkluderer:
- . plutselige eller sterke magesmerter . magesmerter etter måltider . vekttap . kvalme eller oppkast . forstoppelse eller diaré . blodig diaré . feber
- . kramper og smerter i bena eller hoftene . følelse av tyngde eller tetthet i benmusklene . brennende eller verkende smerte i føttene eller tærne mens du hviler . nummenhet, prikking eller svakhet i bena . kald følelse eller fargeforandringer i 1 eller begge ben eller føtter
- . mentale endringer som å se ting som ikke er der (hallusinasjoner), agitasjon eller koma . rask hjerterytme . endringer i blodtrykket . høy kroppstemperatur . stramme muskler . problemer med å gå
De vanligste bivirkningene av IMITREX 50 mg injeksjon inkluderer:
- . smerte eller rødhet på injeksjonsstedet . prikking eller nummenhet i fingrene eller tærne . svimmelhet . varm, varm, brennende følelse i ansiktet ditt (rødme) . ubehag eller stivhet i nakken . føler seg svak, døsig eller trøtt
Fortell helsepersonell dersom du har noen bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av IMITREX. For mer informasjon, spør helsepersonell eller apotek.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg oppbevare IMITREX Injection?
- . Oppbevar IMITREX mellom 36°F til 86°F (2°C til 30°C). . Oppbevar medisinen vekk fra lys. . Oppbevar medisinen i emballasjen eller bærevesken som følger med.
Oppbevar IMITREX og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av IMITREX
Medisiner foreskrives noen ganger til andre formål enn de som er oppført i Pasientinformasjonsbrosjyrer. Ikke bruk IMITREX for en tilstand det ikke er foreskrevet for. Ikke gi IMITREX 25 mg til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Dette Pasientinformasjonsheftet oppsummerer den viktigste informasjonen om IMITREX. Hvis du vil ha mer informasjon, snakk med helsepersonell. Du kan spørre helsepersonell eller apotek om informasjon om IMITREX som er skrevet for helsepersonell.
For mer informasjon, gå til www.gsk.com eller ring 1-888-825-5249.
Hva er ingrediensene i IMITREX Injection?
Aktiv ingrediens: sumatriptansuccinat
Inaktive ingredienser: natriumklorid, vann til injeksjonsvæsker
Denne pasientinformasjonen og bruksanvisningen er godkjent av US Food and Drug Administration.
Pasientens bruksanvisning
IMITREX STAT dosesystem
Les denne pasientens bruksanvisning før du begynner å bruke IMITREX STATdose-systemet. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller behandling. Du og helsepersonell bør snakke om IMITREX 25 mg injeksjon når du begynner å ta den og ved regelmessige kontroller.
Oppbevar IMITREX STATdose-systemet utilgjengelig for barn.
Før du bruker IMITREX STATdose-systemet
Når du først åpner IMITREX 25 mg STATdose System-esken, er patronpakken og IMITREX STATdose Pen® allerede i bærevesken for enkelhets skyld.
Den grå og blå Bæreveske brukes til å oppbevare den tomme pennen og patronpakken når de ikke er i bruk.
De Patronpakke holder 2 individuelt forseglet Sprøytepatroner Hver sprøytekassett inneholder 1 dose IMITREX® (sumatriptan succinat) injeksjon. Patronpakken for 4 mg-styrken til dette legemidlet er gul, og patronpakken for 6-mg-styrken er blå (som vist). Påfyllingskassetter er tilgjengelige.
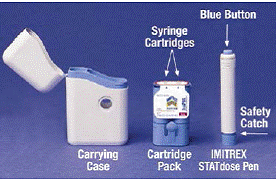
Den grå og blå Penn brukes til automatisk å injisere 1 dose medisin fra en sprøytekassett. Ikke berør Blå knapp til du har trykket pennen mot huden for å gi en dose. Hvis du trykker på den på et annet tidspunkt, kan du miste en dose. De Sikkerhetsfangst forhindrer at pennen avfyres ved et uhell før du er klar. Pennen vil bare fungere når du skyver den grå delen av fatet ned til den blå delen. Kontroller alltid at den hvite primingsstangen ikke stikker ut fra enden av pennen (som vist i figur B) før du setter i en ny sprøytekassett. Hvis det stikker ut, vil du miste den dosen.
Hvordan fylle IMITREX STATdose Pen
Ikke legg i pennen før du er klar til å gi deg selv en injeksjon. Ikke berør den blå knappen på toppen av pennen (se figur A) mens du legger i pennen.
Figur A 
Figur B 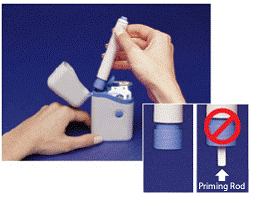
1. Åpne lokket på bærevesken. De manipulerende forseglingen over de 2 sprøytepatronene er merket "A" og "B" (se Figur A innfelt ).
Bruk alltid sprøytepatronen merket "A" før den merket "B" for å hjelpe deg med å holde oversikt over dosene dine. Ikke bruk hvis forseglingen er brutt eller mangler når du først åpner bærevesken.
2. Riv av en av de manipulasjonssikre forseglingen (se Figur A ). Kast forseglingen. Åpne lokket over sprøytepatronen.
3. Hold pennen i kantene på toppen. Ta pennen ut av bærevesken (se Figur B ).
Kontroller at den hvite primingsstangen ikke stikker ut fra den nedre enden av pennen (se Figur B innfelt ). Hvis den stikker ut, setter du pennen tilbake i bærevesken og trykker godt ned til du kjenner at den klikker. Ta pennen ut av bærevesken.
Figur C 
4. Sett pennen i patronpakken. Vri den til høyre (med klokken) til den ikke vil dreie mer (omtrent en halv omdreining) (se Figur C ).
5. Hold den ladede pennen i kantene og trekk den rett ut (se Figur D ). Du må kanskje trekke hardt i pennen, men dette er normalt. Ikke trykk på den blå knappen ennå.
Figur D 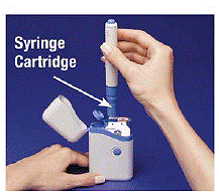
Pennen er nå klar til bruk. Ikke legg den ladede pennen tilbake i bærevesken fordi det vil skade nålen.
Hvordan du bruker IMITREX STAT dose Pen for å ta medisinen din
Før du injiserer medisinen, velg et område med et fettlag (se figur E eller figur F). Spør helsepersonell hvis du har spørsmål om hvor du skal injisere medisinen din.
For å klargjøre hudområdet der IMITREX skal injiseres, tørk av injeksjonsstedet med en alkoholserviett. Ikke berør dette området igjen før du gir injeksjonen.
Figur E eller Figur F Figur G 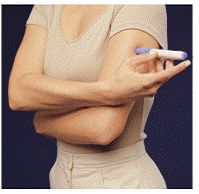
6. Uten å trykke på den blå knappen, trykk den ladede pennen fast mot huden slik at den grå sylinderen glir ned mot den blå delen som holder sprøytepatronen (se Figur D ). (Dette frigjør sikkerhetslåsen som hindrer pennen i å skyte ved en feiltakelse før du er klar.)
7. Trykk på den blå knappen. Hold pennen stille minst 5 sekunder . Hvis pennen tas bort fra huden for tidlig, vil ikke all medisinen komme ut.
8 Etter 5 sekunder , ta pennen forsiktig vekk fra huden din. Nålen vil vises (se Figur G ). Ikke berør nålen.
Hvordan ta ut IMITREX STAT dose Pen etter at du har tatt medisinen
Rett etter at du har tatt en dose med pennen, må du returnere den brukte sprøytepatronen til patronpakken.
Figur H Figur I og Figur J 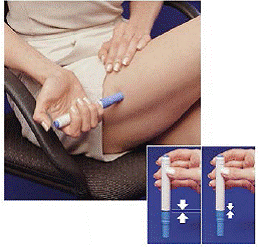
9. Skyv pennen ned i den tomme siden av patronpakken så langt det går (se Figur H ).
10. Vri pennen til venstre (mot klokken) omtrent en halv omdreining til den frigjøres fra sprøytepatronen (se Figur I ).
11. Trekk den tomme pennen ut av patronpakken (se Figur J ).
Fordi pennen nå er brukt, vil den hvite grunningsstangen stikke ut fra den nedre enden av pennen (se Figur J ).
12. Lukk lokket på patronpakken over den brukte sprøytepatronen. Når de brukte sprøytepatronene er satt inn riktig, er patronpakken en beskyttende engangsveske for å hjelpe deg med å unngå nålestikk og bruke sprøytene på riktig måte.
13. Sett pennen tilbake i bærevesken og trykk den godt ned til du kjenner at den klikker. Lukk lokket på bærevesken. Dette gjør pennen klar til neste bruk.
Hvis lokket ikke lukkes, skyv pennen ned til du kjenner at den klikker. Lukk deretter lokket.
Hvordan ta ut en brukt patronpakke
Etter at begge sprøytepatronene er brukt, ta patronpakken ut av bærevesken. Aldri gjenbruk eller resirkuler en sprøytekassett.
Figur K Figur L 
14. Åpne lokket til bærevesken.
15. Hold bærevesken med én hånd og trykk på de 2 knappene på hver side av bærevesken (se Figur K ).
16. Trekk forsiktig ut patronpakken med den andre hånden (se Figur L ).
17. Kast patronpakken eller kast den som instruert av helsepersonell. Det kan være spesielle statlige og lokale lover for kassering av brukte kanyler og sprøyter. Oppbevar alltid utilgjengelig for barn.
Slik setter du inn en ny patronpakke
Figur M Figur N og Figur O 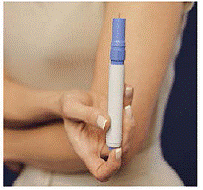
18. Ta den nye patronpakken ut av esken. Ikke ta av de manipulasjonssikre forseglingen (se figur M).
19. Legg kassettpakken i bærevesken. Skyv den jevnt ned (se Figur N ).
20. Patronpakken klikker på plass når de 2 knappene vises gjennom hullene i bærevesken (se Figur O ). Lukk lokket.
Denne pasientinformasjonen og bruksanvisningen er godkjent av US Food and Drug Administration.
