Imuran 50mg, 25mg Azathioprine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Imuran og hvordan brukes det?
Imuran 25mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på revmatoid artritt og som forebygging av transplantasjonsavstøting. Imuran kan brukes alene eller sammen med andre medisiner.
Imuran 25mg tilhører en klasse legemidler som kalles DMARDs, immunmodulatorer; Immundempende midler.
Hva er de mulige bivirkningene av Imuran?
Imuran 25mg kan forårsake alvorlige bivirkninger inkludert:
- . feber, . hovne kjertler, . Smerter i kroppen, . nattesvette, . føler meg ikke bra, . blek hud, . utslett, . lett blåmerker eller blødninger, . kalde hender og føtter, . svimmelhet, . kortpustethet, . smerter i øvre del av magen som kan spre seg til skulderen, . mett etter å ha spist bare en liten mengde, . vekttap, . tegn på infeksjon (feber, frysninger, svakhet, influensasymptomer, sår hals, hoste, smerte eller svie når du tisser), . alvorlig kvalme, . oppkast, . diaré, . raske hjerteslag, . mørk urin, og . gulfarging av hud eller øyne (gulsott)
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Imuran 50mg inkluderer:
- . kvalme, . diaré, . magesmerter, . hårtap, og . hudutslett
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Imuran. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
Malignitet
Kronisk immunsuppresjon med IMURAN, en purin-antimetabolitt, øker risikoen for malignitet hos mennesker. Rapporter om malignitet inkluderer post-transplantasjon lymfom og hepatosplenisk T-celle lymfom (HSTCL) hos pasienter med inflammatorisk tarmsykdom. Leger som bruker dette stoffet bør være godt kjent med denne risikoen så vel som med det mutagene potensialet for både menn og kvinner og med mulig hematologisk toksisitet. Leger bør informere pasienter om risikoen for malignitet med IMURAN. Se ADVARSLER .
BESKRIVELSE
IMURAN (azatioprin), en immunsuppressiv antimetabolitt, er tilgjengelig i tablettform for oral administrering. Hver tablett med skårede deler inneholder 50 mg azatioprin og de inaktive ingrediensene laktose, magnesiumstearat, potetstivelse, povidon og stearinsyre.
Azatioprin er kjemisk 6-[(1-metyl-4-nitro-1H-imidazol-5-yl)tio]-1H-purin. Strukturformelen til azatioprin er:
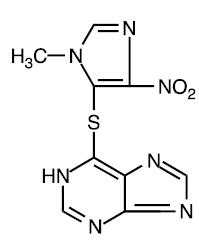
Det er et imidazolylderivat av 6-merkaptopurin, og mange av dets biologiske effekter ligner på moderforbindelsen.
Azatioprin er uløselig i vann, men kan løses opp med tilsetning av en molar ekvivalent alkali. Azatioprin er stabil i løsning ved nøytral eller sur pH, men hydrolyse til merkaptopurin skjer i overskudd av natriumhydroksid (0,1N), spesielt ved oppvarming. Konvertering til merkaptopurin skjer også i nærvær av sulfhydrylforbindelser som cystein, glutation og hydrogensulfid.
INDIKASJONER
IMURAN er indisert som et tillegg for forebygging av avstøtning ved nyrehomotransplantasjon. Det er også indisert for behandling av aktiv revmatoid artritt for å redusere tegn og symptomer.
Nyrehomotransplantasjon
IMURAN er indisert som et tillegg for forebygging av avstøtning ved nyrehomotransplantasjon. Erfaring med over 16 000 transplantasjoner viser en 5-års pasientoverlevelse på 35 % til 55 %, men dette er avhengig av donor, match for HLA antigener, antidonor eller anti-B-celle alloantigen antistoff og andre variabler. Effekten av IMURAN på disse variablene er ikke testet i kontrollerte studier.
Leddgikt
IMURAN er indisert for behandling av aktiv revmatoid artritt (RA) for å redusere tegn og symptomer. Aspirin, ikke-steroide antiinflammatoriske legemidler og/eller lavdose glukokortikoider kan fortsettes under behandling med IMURAN. Den kombinerte bruken av IMURAN 25mg med sykdomsmodifiserende antirevmatiske legemidler (DMARDs) har ikke blitt studert for verken ekstra fordel eller uventede bivirkninger. Bruk av IMURAN med disse midlene kan ikke anbefales.
DOSERING OG ADMINISTRASJON
TPMT-TESTING KAN IKKE ERSTATTE FOR FULLSTENDIG BLODTELL (CBC) OVERVÅKING HOS PASIENTER SOM MOTTER IMURAN. TPMT-genotyping eller fenotyping kan brukes til å identifisere pasienter med fraværende eller redusert TPMT-aktivitet. Pasienter med lav eller fraværende TPMT-aktivitet har økt risiko for å utvikle alvorlig, livstruende myelotoksisitet fra IMURAN hvis konvensjonelle doser gis. Leger kan vurdere alternative behandlingsformer for pasienter som har lav eller fraværende TPMT-aktivitet (homozygot for ikke-funksjonelle alleler). IMURAN 25 mg bør administreres med forsiktighet til pasienter som har en ikke-funksjonell allel (heterozygot) som har risiko for redusert TPMT-aktivitet som kan føre til toksisitet dersom konvensjonelle doser gis. Dosereduksjon anbefales hos pasienter med redusert TPMT-aktivitet. Tidlig seponering av medikamentet kan vurderes hos pasienter med unormale CBC-resultater som ikke reagerer på dosereduksjon.
Nyrehomotransplantasjon
Dosen av IMURAN 50 mg som kreves for å forhindre avstøtning og minimere toksisitet vil variere med individuelle pasienter; dette krever nøye håndtering. Startdosen er vanligvis 3 til 5 mg/kg daglig, med start på transplantasjonstidspunktet. IMURAN gis vanligvis som en enkelt daglig dose på dagen for, og i et mindretall av tilfellene 1 til 3 dager før, transplantasjonen. Dosereduksjon til vedlikeholdsnivåer på 1 til 3 mg/kg daglig er vanligvis mulig. Dosen av IMURAN 50mg bør ikke økes til toksiske nivåer på grunn av truet avstøtning. Seponering kan være nødvendig for alvorlig hematologisk eller annen toksisitet, selv om avvisning av homograft kan være en konsekvens av medikamentabstinens.
Leddgikt
IMURAN 50 mg gis vanligvis på daglig basis. Startdosen bør være ca. 1,0 mg/kg (50 til 100 mg) gitt som enkeltdose eller to ganger daglig. Dosen kan økes, fra 6 til 8 uker og deretter trinnvis med 4 ukers intervaller, hvis det ikke er alvorlige toksisiteter og hvis den første responsen er utilfredsstillende. Doseøkninger bør være 0,5 mg/kg daglig, opp til en maksimal dose på 2,5 mg/kg per dag. Terapeutisk respons oppstår etter flere ukers behandling, vanligvis 6 til 8; en tilstrekkelig utprøving bør vare minst 12 uker. Pasienter som ikke ble bedre etter 12 uker kan betraktes som refraktære. IMURAN 50 mg kan fortsettes over lang tid hos pasienter med klinisk respons, men pasienter bør overvåkes nøye, og gradvis dosereduksjon bør forsøkes for å redusere risikoen for toksisitet.
Vedlikeholdsbehandling bør være ved laveste effektive dose, og dosen som gis kan reduseres dekrementelt med endringer på 0,5 mg/kg eller ca. 25 mg daglig hver 4. uke mens annen behandling holdes konstant. Den optimale varigheten av vedlikeholdet IMURAN 50mg er ikke bestemt. IMURAN kan seponeres brått, men forsinkede effekter er mulige.
Bruk ved nedsatt nyrefunksjon
Relativt oliguriske pasienter, spesielt de med tubulær nekrose i den umiddelbare postkadaveriske transplantasjonsperioden, kan ha forsinket clearance av IMURAN eller dets metabolitter, kan være spesielt følsomme for dette legemidlet, og gis vanligvis lavere doser.
Prosedyrer for riktig håndtering og avhending av dette immunsuppressive antimetabolittmedisinen bør vurderes. Det er publisert flere retningslinjer om dette emnet.25-31 Det er ingen generell enighet om at alle prosedyrene som anbefales i retningslinjene er nødvendige eller hensiktsmessige.
HVORDAN LEVERES
50 mg overlappende sirkelformede, gule til off-white tabletter med delestrek merket med "IMURAN" og "50" på hver tablett; flaske med 100 ( NDC 65483-590-10).
Oppbevares ved 15° til 25°C (59° til 77°F) på et tørt sted og beskyttes mot lys.
REFERANSER
25. Anbefalinger for sikker håndtering av parenterale antineoplastiske legemidler. Washington, DC: Sikkerhetsavdelingen; Klinisk senter apotekavdeling og kreftsykepleietjenester, National Institute of Health; 1992. US Dept of Health and Human Services. Public Health Service Publication NIH 92-2621.
26. AMA Council on Scientific Affairs. Retningslinjer for håndtering av parenterale antineoplastiske midler. JAMA. 1985; 253:15901592.
27. Nasjonal studiekommisjon for cytotoksisk eksponering. Anbefalinger for håndtering av cellegift. 1987. Tilgjengelig fra Louis P. Jeffrey, styreleder, National Study Commission on Cytotoxic Exposure. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Clinical Oncological Society of Australia. Retningslinjer og anbefalinger for sikker håndtering av antineoplastiske midler. Med J Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Sikker håndtering av kjemoterapeutiske midler: en rapport fra The Mount Sinai Medical Center. CA Cancer J for klinikere. 1983; 33:258-263.
30. American Society of Hospital Pharmacists. ASHP teknisk assistansebulletin om håndtering av cellegift og farlige stoffer. Am J Hosp Pharm. 1990; 47:1033-1049.
31. Yodaiken RE, Bennett D. OSHA Work-Practice-retningslinjer for personell som arbeider med cellegift (antineoplastiske) medikamenter. Am J Hosp Pharm, 1996; 43:1193-1204.
Produsert av Pharmaceutics International, Inc. Hunt Valley, MD 21031 for Prometheus Laboratories Inc. San Diego, CA 92121. Revidert: feb 2014
BIVIRKNINGER
De viktigste og potensielt alvorlige toksiske effektene av IMURAN er hematologiske og gastrointestinale. Risikoen for sekundær infeksjon og malignitet er også betydelig (se ADVARSLER ). Hyppigheten og alvorlighetsgraden av bivirkningene avhenger av dosen og varigheten av IMURAN så vel som av pasientens underliggende sykdom eller samtidige behandlinger. Forekomsten av hematologisk toksisitet og neoplasi hos grupper av nyrehomograft-mottakere er betydelig høyere enn i studier som bruker IMURAN 25 mg for revmatoid artritt. Den relative forekomsten i kliniske studier er oppsummert nedenfor:
Hematologisk
Leukopeni og/eller trombocytopeni er doseavhengige og kan forekomme sent i behandlingsforløpet med IMURAN. Dosereduksjon eller midlertidig seponering kan føre til reversering av disse toksisitetene. Infeksjon kan forekomme som en sekundær manifestasjon av benmargssuppresjon eller leukopeni, men forekomsten av infeksjon ved nyrehomotransplantasjon er 30 til 60 ganger høyere enn ved revmatoid artritt. Anemier, inkludert makrocytisk anemi og/eller blødning, er rapportert.
TPMT-genotyping eller fenotyping kan bidra til å identifisere pasienter med lav eller fraværende TPMT-aktivitet (homozygot for ikke-funksjonelle alleler) som har økt risiko for alvorlig, livstruende myelosuppresjon fra IMURAN. Se KLINISK FARMAKOLOGI , ADVARSLER og FORHOLDSREGLER : Laboratorietester . Død assosiert med pancytopeni er rapportert hos pasienter med manglende TPMT-aktivitet som får azatioprin.6,20
Gastrointestinale
Kvalme og oppkast kan forekomme i løpet av de første månedene av behandlingen med IMURAN 50 mg, og forekom hos ca. 12 % av 676 pasienter med revmatoid artritt. Hyppigheten av mageforstyrrelser kan ofte reduseres ved administrering av legemidlet i delte doser og/eller etter måltider. Hos noen pasienter kan imidlertid kvalme og oppkast være alvorlig og kan være ledsaget av symptomer som diaré, feber, ubehag og myalgi (se FORHOLDSREGLER ). Oppkast med magesmerter kan forekomme i sjeldne tilfeller med overfølsomhetspankreatitt. Levertoksisitet manifestert ved økning av serum alkalisk fosfatase, bilirubin og/eller serumtransaminaser er kjent for å forekomme etter bruk av azatioprin, primært hos allograftmottakere. Levertoksisitet har vært uvanlig (mindre enn 1 %) hos pasienter med revmatoid artritt. Levertoksisitet etter transplantasjon oppstår oftest innen 6 måneder etter transplantasjon og er vanligvis reversibel etter avbrudd av IMURAN. En sjelden, men livstruende levervenookklusiv sykdom assosiert med kronisk administrering av azatioprin er beskrevet hos transplanterte pasienter og hos en pasient som får IMURAN for panuveitt.21,22,23 Periodisk måling av serumtransaminaser, alkalisk fosfatase og bilirubin er indisert for tidlig påvisning av levertoksisitet. Hvis det er klinisk mistanke om levervenookklusiv sykdom, bør IMURAN seponeres permanent.
Andre
Ytterligere bivirkninger av lav frekvens er rapportert. Disse inkluderer hudutslett, alopecia, feber, artralgier, diaré, steatoré, negativ nitrogenbalanse, reversibel interstitiell pneumonitt, hepatosplenisk T-celle lymfom (se ADVARSLER – Malignitet ), og Sweets syndrom (akutt febril nøytrofil dermatose).
NARKOTIKAHANDEL
Bruk sammen med Allopurinol
En av veiene for inaktivering av azatioprin hemmes av allopurinol. Pasienter som får IMURAN 50 mg og allopurinol samtidig, bør ha en dosereduksjon på IMURAN 50 mg, til omtrent 1/3 til 1/4 av den vanlige dosen. Det anbefales at ytterligere dosereduksjon eller alternative behandlinger vurderes for pasienter med lav eller manglende TPMT-aktivitet som får IMURAN 50 mg og allopurinol fordi både TPMT- og XO-inaktiveringsveier påvirkes. Se KLINISK FARMAKOLOGI , ADVARSLER , FORHOLDSREGLER : Laboratorietester og BIVIRKNINGER seksjoner.
Bruk sammen med aminosalicylater
Det er in vitro bevis på at aminosalisylatderivater (f.eks. sulfasalazin, mesalazin eller olsalazin) hemmer TPMT-enzymet. Samtidig bruk av disse midlene med IMURAN 50 mg bør gjøres med forsiktighet.
Bruk sammen med andre midler som påvirker myelopoese
Legemidler som kan påvirke leukocyttproduksjonen, inkludert cotrimoksazol, kan føre til overdreven leukopeni, spesielt hos nyretransplanterte.
Bruk med angiotensin-konverterende enzymhemmere
Bruk av angiotensin-konverterende enzymhemmere for å kontrollere hypertensjon hos pasienter på azatioprin har blitt rapportert å indusere anemi og alvorlig leukopeni.
Bruk sammen med Warfarin
IMURAN kan hemme den antikoagulerende effekten av warfarin.
Bruk sammen med ribavirin
Bruk av ribavirin for hepatitt C hos pasienter som får azatioprin har blitt rapportert å indusere alvorlig pancytopeni og kan øke risikoen for azatioprin-relatert myelotoksisitet. Inosinmonofosfatdehydrogenase (IMDH) er nødvendig for en av metabolske veier til azatioprin. Ribavirin er kjent for å hemme IMDH, og dermed føre til akkumulering av en azatioprinmetabolitt, 6-metyltioionosinmonofosfat (6MTITP), som er assosiert med myelotoksisitet (nøytropeni, trombocytopeni og anemi). Pasienter som får azatioprin sammen med ribavirin bør ha fullstendige blodtellinger, inkludert antall blodplater, overvåket ukentlig den første måneden, to ganger månedlig i den andre og tredje måneden av behandlingen, deretter månedlig eller oftere hvis dosendringer eller andre behandlingsendringer er nødvendig.
REFERANSER
6. Data på fil, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Azatioprin-indusert myelosuppresjon hos hjertetransplanterte pasienter med tiopurinmetyltransferase. Lancet. 1993; 341:436.
21. Les AE, Wiesner RH, LaBrecque DR, et al. Hepatisk veno-okklusiv sykdom assosiert med nyretransplantasjon og azatioprinbehandling. Ann Intern Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et al. Azatioprin og hepatisk veno-okklusiv sykdom hos nyretransplanterte pasienter. Gastroenterologi. 1986; 90:446-454.
23. Weitz H, Gokel JM, Loeshke K, et al. Veno-okklusiv sykdom i leveren hos pasienter som får immunsuppressiv terapi. Virchows Arch A Pathol Anat Histol. 1982; 395:245-256.
ADVARSLER
Malignitet
Pasienter som får immunsuppressiva, inkludert IMURAN 50 mg, har økt risiko for å utvikle lymfom og andre maligniteter, spesielt i huden. Leger bør informere pasienter om risikoen for malignitet med IMURAN. Som vanlig for pasienter med økt risiko for hudkreft, bør eksponering for sollys og ultrafiolett lys begrenses ved å bruke verneklær og bruke en solkrem med høy beskyttelsesfaktor.
Etter transplantasjon
Nyretransplanterte pasienter er kjent for å ha økt risiko for malignitet, hovedsakelig hudkreft og retikulumcelle- eller lymfomatøse svulster. Risikoen for post-transplantasjonslymfomer kan øke hos pasienter som får aggressiv behandling med immunsuppressive legemidler, inkludert IMURAN. Derfor bør immunsuppressiv medikamentell behandling opprettholdes på de laveste effektive nivåene.
Leddgikt
Informasjon er tilgjengelig om risikoen for malignitet ved bruk av IMURAN 50mg ved revmatoid artritt (se BIVIRKNINGER ). Det har ikke vært mulig å definere den nøyaktige risikoen for malignitet på grunn av IMURAN. Dataene antyder at risikoen kan være forhøyet hos pasienter med revmatoid artritt, men lavere enn for nyretransplanterte pasienter. Imidlertid er akutt myelogen leukemi så vel som solide svulster rapportert hos pasienter med revmatoid artritt som har fått IMURAN.
Inflammatorisk tarmsykdom
Etter markedsføring er tilfeller av hepatosplenisk T-celle lymfom (HSTCL), en sjelden type T-celle lymfom, rapportert hos pasienter behandlet med IMURAN. Disse tilfellene har hatt et svært aggressivt sykdomsforløp og har vært dødelige. De fleste rapporterte tilfellene har forekommet hos pasienter med Crohns sykdom eller ulcerøs kolitt, og flertallet var hos ungdom og unge voksne menn. Noen av pasientene ble behandlet med IMURAN som monoterapi og noen hadde fått samtidig behandling med en TNFα-blokker ved eller før diagnosen. Sikkerhet og effekt av IMURAN 25 mg for behandling av Crohns sykdom og ulcerøs kolitt er ikke fastslått.
Cytopenier
Alvorlig leukopeni, trombocytopeni, anemier inkludert makrocytisk anemi og/eller pancytopeni kan forekomme hos pasienter som behandles med IMURAN. Alvorlig benmargssuppresjon kan også forekomme. Pasienter med intermediær tiopurin S-metyltransferase (TPMT) aktivitet kan ha økt risiko for myelotoksisitet dersom de får konvensjonelle doser av IMURAN. Pasienter med lav eller manglende TPMT-aktivitet har økt risiko for å utvikle alvorlig, livstruende myelotoksisitet dersom de får konvensjonelle doser av IMURAN. TPMT-genotyping eller fenotyping kan bidra til å identifisere pasienter som har økt risiko for å utvikle IMURAN 50 mg toksisitet.2-9 (se FORHOLDSREGLER : Laboratorietester ). Hematologisk toksisitet er doserelatert og kan være mer alvorlig hos nyretransplanterte pasienter hvis homograft gjennomgår avstøting. Det foreslås at pasienter på IMURAN har fullstendige blodtellinger, inkludert antall blodplater, ukentlig i løpet av den første måneden, to ganger månedlig i den andre og tredje måneden av behandlingen, deretter månedlig eller oftere hvis doseendringer eller andre behandlingsendringer er nødvendig. Forsinket hematologisk undertrykkelse kan forekomme. Umiddelbar reduksjon i dosen eller midlertidig seponering av legemidlet kan være nødvendig hvis det er et raskt fall i eller vedvarende lavt antall leukocytter, eller andre tegn på benmargsdepresjon. Leukopeni korrelerer ikke med terapeutisk effekt; dosen bør derfor ikke økes med vilje for å senke antallet hvite blodlegemer.
Alvorlige infeksjoner
Pasienter som får immunsuppressiva, inkludert Imuran 25 mg, har økt risiko for bakterielle, virale, sopp-, protozoale og opportunistiske infeksjoner, inkludert reaktivering av latente infeksjoner. Disse infeksjonene kan føre til alvorlige, inkludert dødelige utfall.
Progressiv multifokal leukoencefalopati
Tilfeller av JC-virusassosiert infeksjon som resulterer i progressiv multifokal leukoencefalopati (PML), noen ganger dødelig, er rapportert hos pasienter behandlet med immunsuppressiva, inkludert Imuran. Risikofaktorer for PML inkluderer behandling med immunsuppressive terapier og svekkelse av immunfunksjonen. Vurder diagnosen PML hos enhver pasient som har nye nevrologiske manifestasjoner og vurder konsultasjon med en nevrolog som klinisk indisert. Vurder å redusere mengden immunsuppresjon hos pasienter som utvikler PML. Hos transplanterte pasienter, vurder risikoen som den reduserte immunsuppresjonen representerer for transplantatet.
Effekt på sæd hos dyr
IMURAN har blitt rapportert å forårsake midlertidig depresjon i spermatogenese og reduksjon i spermlevedyktighet og spermatall hos mus ved doser 10 ganger den humane terapeutiske dosen;10 en redusert prosentandel av fertile parringer skjedde når dyr fikk 5 mg/kg.11
Svangerskap
Graviditetskategori D
IMURAN kan forårsake fosterskader når det gis til en gravid kvinne. IMURAN 50mg bør ikke gis under graviditet uten nøye veiing av risiko kontra nytte. Når det er mulig, bør bruk av IMURAN hos gravide pasienter unngås. Dette stoffet bør ikke brukes til behandling av revmatoid artritt hos gravide kvinner.12
IMURAN er teratogent hos kaniner og mus når det gis i doser tilsvarende human dose (5 mg/kg daglig). Abnormiteter inkluderte skjelettmisdannelser og viscerale anomalier.11
Begrensede immunologiske og andre abnormiteter har forekommet hos noen få spedbarn født av nyre-allograftmottakere på IMURAN. I en detaljert kasusrapport 13 ble det observert lymfopeni, reduserte IgG- og IgM-nivåer, CMV-infeksjon og redusert thymusskygge hos et spedbarn født av en mor som fikk 150 mg azatioprin og 30 mg prednison daglig gjennom hele svangerskapet. Etter 10 uker var de fleste funksjonene normalisert. DeWitte et al rapporterte pancytopeni og alvorlig immunsvikt hos et premature spedbarn hvis mor fikk 125 mg azatioprin og 12,5 mg prednison daglig.14 Det har vært to publiserte rapporter om unormale fysiske funn. Williamson og Karp beskrev et spedbarn født med preaksial polydaktyli hvis mor fikk azatioprin 200 mg daglig og prednison 20 mg annenhver dag under svangerskapet.15 Tallent et al beskrev et spedbarn med en stor myelomeningocele i øvre lumbalregion, bilaterale dislokerte hofter og bilaterale hofter. talipes equinovarus. Faren var på langtidsbehandling med azatioprin.16
Nytte versus risiko må veies nøye før bruk av IMURAN hos pasienter med reproduksjonspotensial. Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Hvis dette legemidlet brukes under graviditet eller hvis pasienten blir gravid mens du tar dette legemidlet, bør pasienten informeres om den potensielle faren for fosteret. Kvinner i fertil alder bør rådes til å unngå å bli gravide.
FORHOLDSREGLER
Generell
En gastrointestinal overfølsomhetsreaksjon preget av alvorlig kvalme og oppkast er rapportert. Disse symptomene kan også være ledsaget av diaré, utslett, feber, ubehag, myalgi, forhøyede leverenzymer og noen ganger hypotensjon. Symptomer på gastrointestinal toksisitet utvikles oftest i løpet av de første ukene av behandlingen med IMURAN 25 mg og er reversible ved seponering av legemidlet. Reaksjonen kan gjenta seg innen timer etter re-utfordring med en enkelt dose IMURAN.
Laboratorietester
Overvåking av fullstendig blodtelling (CBC).
Pasienter på IMURAN 25 mg bør ha fullstendige blodtellinger, inkludert blodplatetall, ukentlig i løpet av den første måneden, to ganger i måneden i den andre og tredje måneden av behandlingen, deretter månedlig eller oftere hvis doseendringer eller andre behandlingsendringer er nødvendig.
TPMT-testing
Det anbefales at det tas hensyn til enten genotype- eller fenotypepasienter for TPMT. Fenotyping og genotypingsmetoder er kommersielt tilgjengelige. De vanligste ikke-funksjonelle allelene assosiert med reduserte nivåer av TPMT-aktivitet er TPMT*2, TPMT*3A og TPMT*3C. Pasienter med to ikke-funksjonelle alleler (homozygote) har lav eller fraværende TPMT-aktivitet og de med én ikke-funksjonell allel (heterozygot) har middels aktivitet. Nøyaktige fenotypingsresultater (TPMT-aktivitet av røde blodlegemer) er ikke mulig hos pasienter som nylig har fått blodtransfusjoner. TPMT-testing kan også vurderes hos pasienter med unormale CBC-resultater som ikke reagerer på dosereduksjon. Tidlig seponering av medikamentet hos disse pasientene er tilrådelig. TPMT-TESTING KAN IKKE ERSTATTE FOR FULLSTENDIG BLODTELL (CBC) OVERVÅKING HOS PASIENTER SOM MOTTER IMURAN. Se KLINISK FARMAKOLOGI , ADVARSLER , BIVIRKNINGER og DOSERING OG ADMINISTRASJON seksjoner.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Se ADVARSLER seksjon.
Svangerskap
Teratogene effekter
Graviditetskategori D. Se ADVARSLER seksjon.
Ammende mødre
Bruk av IMURAN 25mg hos ammende mødre anbefales ikke. Azatioprin eller dets metabolitter overføres i lave nivåer, både transplacentalt og i morsmelk.17,18,19 På grunn av potensialet for tumorigenisitet vist for azatioprin, bør det tas en beslutning om å avbryte amming eller seponere medikamentet, tatt i betraktning stoffets betydning for moren.
Pediatrisk bruk
Sikkerhet og effekt av azatioprin hos pediatriske pasienter er ikke fastslått.
REFERANSER
2. Weinshilboum R. Tiopurin farmakogenetikk: kliniske og molekylære studier av tiopurin metyltransferase. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Tiopurin S-metyltransferase-genet - implikasjoner for klinisk farmakogenomikk. Farmakogenomikk. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopeni relatert til azatioprin - en enzymmangel forårsaket av en vanlig genetisk polymorfisme: en gjennomgang. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Redusert tiopurinmetyltransferaseaktivitet og utvikling av bivirkninger av azatioprinbehandling hos pasienter med revmatoid artritt. Leddgikt Reum. 1998; 41:18581866.
6. Data på fil, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Molekylær diagnose av tiopurin S-metyltransferase-mangel: genetisk grunnlag for azatioprin- og merkaptopurinintoleranse. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Tiopurin-metyltransferase-genotype forutsier terapibegrensende alvorlig toksisitet fra azatioprin. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevansen av tiopurinmetyltransferasestatus hos revmatologiske pasienter som får azatioprin. Revmatologi. 2004; 43:13-18.
10. Clark JM. Mutagenisiteten til azatioprin hos mus, Drosophila melanogaster og Neurospora crassa. Mutat Res. 1975; 28:87-99.
11. Data på fil, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Graviditet etter nyretransplantasjon. Ann Intern Med. 1975; 82:113-114. Redaksjonelle merknader.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Effekter på nyfødte av prednison og azatioprin administrert til moren under graviditet. J Pediatr. 1974; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et al. Neonatal pancytopeni og alvorlig kombinert immunsvikt assosiert med prenatal administrering av azatioprin og prednison. J Pediatr. 1984; 105:625-628.
15. Williamson RA, Karp LE. Azatioprin teratogenisitet: gjennomgang av litteraturen og saksrapporten. Obstet Gynecol. 1981; 58:247-250.
16. Tallent MB, Simmons RL, Najarian JS. Fødselsskader hos barn til mannlig mottaker av nyretransplantasjon. JAMA. 1970; 211: 1854-1855.
17. Data på fil, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Immunsuppresjon under graviditet: overføring av azatioprin og dets metabolitter fra mor til foster. Am J Obstet Gynecol. 1973; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et al. Amming etter nyretransplantasjon. Transplantasjon Proc. 1982; 14: 605-609.
OVERDOSE
De orale LD50-verdiene for enkeltdoser av IMURAN 50 mg hos mus og rotter er henholdsvis 2500 mg/kg og 400 mg/kg. Svært store doser av denne antimetabolitten kan føre til marghypoplasi, blødning, infeksjon og død. Omtrent 30 % av IMURAN er bundet til serumproteiner, men omtrent 45 % fjernes under en 8-timers hemodialyse.24 Det er rapportert et enkelt tilfelle av en nyretransplantert pasient som inntok en enkeltdose på 7500 mg IMURAN. De umiddelbare toksiske reaksjonene var kvalme, oppkast og diaré, etterfulgt av mild leukopeni og milde avvik i leverfunksjonen. Antall hvite blodlegemer, SGOT og bilirubin gikk tilbake til det normale 6 dager etter overdosen.
KONTRAINDIKASJONER
IMURAN 25 mg skal ikke gis til pasienter som har vist overfølsomhet for legemidlet. IMURAN skal ikke brukes til behandling av revmatoid artritt hos gravide kvinner. Pasienter med revmatoid artritt tidligere behandlet med alkylerende midler (cyklofosfamid, klorambucil, melfalan eller andre) kan ha en uoverkommelig risiko for malignitet dersom de behandles med IMURAN.
REFERANSER
24. Schusziarra V, Ziekursch V, Schlamp R, et al. Farmakokinetikk av azatioprin under hemodialyse. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.
KLINISK FARMAKOLOGI
Azatioprin absorberes godt etter oral administrering. Maksimal serumradioaktivitet oppstår 1 til 2 timer etter oral 35S-azatioprin og avtar med en halveringstid på 5 timer. Dette er ikke et estimat på halveringstiden til selve azatioprin, men er nedbrytningshastigheten for alle 35S-holdige metabolitter av legemidlet. På grunn av omfattende metabolisme er bare en brøkdel av radioaktiviteten tilstede som azatioprin. Vanlige doser produserer blodnivåer av azatioprin og merkaptopurin avledet fra det, som er lave ( OVERDOSERING .
Azatioprin metaboliseres til 6-merkaptopurin (6-MP). Begge forbindelsene elimineres raskt fra blod og oksideres eller metyleres i erytrocytter og lever; ingen azatioprin eller merkaptopurin kan påvises i urin etter 8 timer. Aktivering av 6-merkaptopurin skjer via hypoxantin-guanin-fosforibosyltransferase (HGPRT) og en rekke multi-enzymatiske prosesser som involverer kinaser for å danne 6-tioguanin-nukleotider (6-TGN) som hovedmetabolitter (se Metabolismeskjema i figur 1 ). Cytotoksisiteten til azatioprin skyldes delvis inkorporeringen av 6-TGN i DNA.
6-MP gjennomgår to store inaktiveringsruter (Figur 1). Den ene er tiolmetylering, som katalyseres av enzymet tiopurin S-metyltransferase (TPMT), for å danne den inaktive metabolitten metyl-6-MP (6-MeMP). TPMT-aktivitet er kontrollert av en genetisk polymorfisme.1,2,3 For kaukasiere og afroamerikanere arver omtrent 10 % av befolkningen en ikke-funksjonell TPMT-allel (heterozygot) som gir mellomliggende TPMT-aktivitet, og 0,3 % arver to TPMT-ikke-funksjonelle. alleler (homozygote) for lav eller fraværende TPMT-aktivitet. Ikke-funksjonelle alleler er mindre vanlige hos asiater. TPMT-aktivitet korrelerer omvendt med 6-TGN-nivåer i erytrocytter og antagelig annet hematopoietisk vev, siden disse cellene har ubetydelig xantinoksidase (involvert i den andre inaktiveringsveien) aktiviteter, og etterlater TPMT-metylering som den eneste inaktiveringsveien. Pasienter med middels TPMT-aktivitet kan ha økt risiko for myelotoksisitet dersom de får konvensjonelle doser av IMURAN. Pasienter med lav eller fraværende TPMT-aktivitet har økt risiko for å utvikle alvorlig, livstruende myelotoksisitet hvis de får konvensjonelle doser av IMURAN.4-9 TPMT genotyping eller fenotyping (røde blodlegemer TPMT-aktivitet) kan bidra til å identifisere pasienter som har økt risiko for å utvikle IMURAN 25mg toksisitet.2,3,7,8,9 Nøyaktige fenotypingsresultater (TPMT-aktivitet av røde blodlegemer) er ikke mulig hos pasienter som nylig har fått blodtransfusjoner. Se ADVARSLER , FORHOLDSREGLER : NARKOTIKAHANDEL , FORHOLDSREGLER : Laboratorietester og BIVIRKNINGER seksjoner.
Figur 1 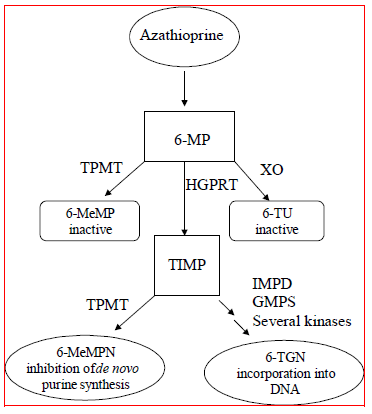 Figur 1. Metabolismevei for azatioprin: konkurrerende veier resulterer i inaktivering av TPMT eller XO, eller inkorporering av cytotoksiske nukleotider i DNA.
Figur 1. Metabolismevei for azatioprin: konkurrerende veier resulterer i inaktivering av TPMT eller XO, eller inkorporering av cytotoksiske nukleotider i DNA.
GMPS: Guanosinmonofosfatsyntetase; HGPRT: Hypoksantin-guanin-fosforibosyl-transferase; IMPD: Inosinmonofosfatdehydrogenase; MeMP: Metylmerkaptopurin; MeMPN: Metylmerkaptopurin-nukleotid; TGN: tioguaninnukleotider; TIMP: Tioinosinmonofosfat; TPMT: Tiopurin S-metyltransferase; TU Thiouric acid; XO: Xanthine oxidase (tilpasset fra Pharmacogenomics 2002; 3:89-98; og Cancer Res 2001; 61:5810-5816.)
En annen inaktiveringsvei er oksidasjon, som katalyseres av xanthinoksidase (XO) for å danne 6-tiourinsyre. Hemmingen av xantinoksidase hos pasienter som får allopurinol (ZYLOPRIM®) er grunnlaget for den azatioprindosereduksjonen som kreves hos disse pasientene (se FORHOLDSREGLER : NARKOTIKAHANDEL ). Andelene av metabolitter er forskjellige hos individuelle pasienter, og dette står antagelig for variabel størrelse og varighet av medikamenteffekter. Renal clearance er sannsynligvis ikke viktig for å forutsi biologisk effektivitet eller toksisitet, selv om dosereduksjon praktiseres hos pasienter med dårlig nyrefunksjon.
Homograft overlevelse
Bruken av azatioprin for hemming av renal homograftavstøtning er veletablert, mekanismen(e) for denne virkningen er noe uklar. Legemidlet undertrykker overfølsomhet av cellemediert type og forårsaker variable endringer i antistoffproduksjonen. Undertrykkelse av T-celleeffekter, inkludert ablasjon av T-celleundertrykkelse, er avhengig av det tidsmessige forholdet til antigen stimulus eller engraftment. Dette middelet har liten effekt på etablerte graftavstøtninger eller sekundære responser.
Endringer i spesifikke immunresponser eller immunologiske funksjoner hos transplanterte er vanskelig å relatere spesifikt til immunsuppresjon av azatioprin. Disse pasientene har subnormale responser på vaksiner, lavt antall T-celler og unormal fagocytose fra perifere blodceller, men deres mitogene responser, serumimmunoglobuliner og sekundære antistoffresponser er vanligvis normale.
Immuninflammatorisk respons
Azatioprin undertrykker sykdomsmanifestasjoner så vel som underliggende patologi i dyremodeller av autoimmun sykdom. For eksempel reduseres alvorlighetsgraden av adjuvant leddgikt av azatioprin.
Mekanismene som gjør at azatioprin påvirker autoimmune sykdommer er ikke kjent. Azatioprin er immunsuppressivt, forsinket overfølsomhet og cellulære cytotoksisitetstester undertrykkes i større grad enn antistoffresponser. I rottemodellen for adjuvant leddgikt har azatioprin vist seg å hemme lymfeknutehyperplasi, som går forut for utbruddet av tegn på sykdommen. Både de immunsuppressive og terapeutiske effektene i dyremodeller er doserelaterte. Azatioprin anses som et saktevirkende legemiddel og effektene kan vedvare etter at legemidlet er seponert.
REFERANSER
1. Lennard L. Den kliniske farmakologien til 6-merkaptopurin. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Tiopurin farmakogenetikk: kliniske og molekylære studier av tiopurin metyltransferase. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Tiopurin S-metyltransferase-genet - implikasjoner for klinisk farmakogenomikk. Farmakogenomikk. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et al. Pancytopeni relatert til azatioprin - en enzymmangel forårsaket av en vanlig genetisk polymorfisme: en gjennomgang. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et al. Redusert tiopurinmetyltransferaseaktivitet og utvikling av bivirkninger av azatioprinbehandling hos pasienter med revmatoid artritt. Leddgikt Reum. 1998; 41:18581866.
6. Data på fil, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et al. Molekylær diagnose av tiopurin S-metyltransferase-mangel: genetisk grunnlag for azatioprin- og merkaptopurinintoleranse. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et al. Tiopurin-metyltransferase-genotype forutsier terapibegrensende alvorlig toksisitet fra azatioprin. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Relevansen av tiopurinmetyltransferasestatus hos revmatologiske pasienter som får azatioprin. Revmatologi. 2004; 43:13-18.
PASIENTINFORMASJON
Pasienter som starter på IMURAN bør informeres om nødvendigheten av periodiske blodtellinger mens de får legemidlet og bør oppfordres til å rapportere uvanlige blødninger eller blåmerker til legen. De bør informeres om faren for infeksjon mens de får IMURAN og bedt om å rapportere tegn og symptomer på infeksjon til legen sin. Pasienten bør gis nøye doseringsinstruksjoner, spesielt når IMURAN administreres ved nedsatt nyrefunksjon eller samtidig med allopurinol (se NARKOTIKAHANDEL underseksjon og DOSERING OG ADMINISTRASJON ). Pasienter bør informeres om den potensielle risikoen ved bruk av IMURAN 50 mg under graviditet og i ammeperioden. Den økte risikoen for malignitet etter behandling med IMURAN bør forklares for pasienten.
