Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Neurontin og hvordan brukes det?
Neurontin 400mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på nervesmerter og anfall. Neurontin kan brukes alene eller sammen med andre medisiner.
Neurontin er et GABA-analogt, antiepileptisk legemiddel.
Det er ikke kjent om Neurontin er trygt og effektivt hos barn yngre enn 3 år.
Hva er de mulige bivirkningene av Neurontin 400mg?
Neurontin kan forårsake alvorlige bivirkninger, inkludert:
- . økte anfall . alvorlig svakhet eller tretthet . problemer med balanse eller muskelbevegelse . smerter i øvre mage . brystsmerter . ny eller forverret hoste med feber . problemer med å puste . alvorlig prikking eller nummenhet . rask øyebevegelse . lite eller ingen vannlating . smertefulle eller vanskeligheter med vannlating . hevelse i føttene eller anklene
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Neurontin inkluderer:
- . hodepine . svimmelhet . døsighet . tretthet . hevelse i hender eller føtter . problemer med øynene dine . koordinasjonsproblemer . De vanligste bivirkningene av Neurontin 600mg hos barn inkluderer: . feber . kvalme . oppkast . endringer i atferd . hukommelsesproblemer . problemer med å konsentrere seg . opptrer rastløs, fiendtlig eller aggressiv
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Neurontin. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Den aktive ingrediensen i NEURONTIN kapsler, tabletter og mikstur er gabapentin, som har det kjemiske navnet 1-(aminometyl)cykloheksaneddiksyre.
Molekylformelen til gabapentin er C9H17NO2 og molekylvekten er 171,24. Strukturformelen til gabapentin er:
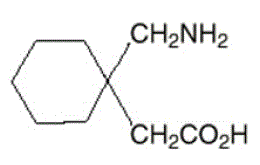
Gabapentin er et hvitt til off-white krystallinsk fast stoff med en pKa1 på 3,7 og en pKa2 på 10,7. Det er fritt løselig i vann og både basiske og sure vandige løsninger. Loggen til fordelingskoeffisienten (noktanol/0,05M fosfatbuffer) ved pH 7,4 er –1,25.
Hver Neurontin 100 mg kapsel inneholder 100 mg, 300 mg eller 400 mg gabapentin og følgende inaktive ingredienser: laktose, maisstivelse, talkum, gelatin, titandioksid, FD&C Blue No. 2, gult jernoksid (kun 300 mg og 400 mg) , og rødt jernoksid (kun 400 mg).
Hver Neurontin-tablett inneholder 600 mg eller 800 mg gabapentin og følgende inaktive ingredienser: poloxamer 407, copovidon, maisstivelse, magnesiumstearat, hydroksypropylcellulose, talkum og candelillavoks
Neurontin mikstur inneholder 250 mg gabapentin per 5 ml (50 mg per ml) og følgende inaktive ingredienser: glyserin, xylitol, renset vann og kunstig kjølig jordbæranismak.
INDIKASJONER
NEURONTIN® er indisert for:
- . Behandling av postherpetisk nevralgi hos voksne . Tilleggsbehandling ved behandling av partielle anfall, med og uten sekundær generalisering, hos voksne og pediatriske pasienter 3 år og eldre med epilepsi
DOSERING OG ADMINISTRASJON
Dosering for postherpetisk nevralgi
Hos voksne med postherpetisk nevralgi kan NEURONTIN initieres på dag 1 som en enkeltdose på 300 mg, på dag 2 som 600 mg/dag (300 mg to ganger daglig), og på dag 3 som 900 mg/dag (300 mg tre). ganger om dagen). Dosen kan deretter titreres opp etter behov for smertelindring til en dose på 1800 mg/dag (600 mg tre ganger daglig). I kliniske studier ble effekt påvist over en rekke doser fra 1800 mg/dag til 3600 mg/dag med sammenlignbare effekter over hele doseområdet; i disse kliniske studiene ble imidlertid ikke den ekstra fordelen ved å bruke doser større enn 1800 mg/dag vist.
Dosering for epilepsi med partielle anfall
Pasienter 12 år og oppover
Startdosen er 300 mg tre ganger daglig. Den anbefalte vedlikeholdsdosen av NEURONTIN er 300 mg til 600 mg tre ganger daglig. Doser opp til 2400 mg/dag har blitt godt tolerert i langtids kliniske studier. Doser på 3600 mg/dag har også blitt administrert til et lite antall pasienter i relativt kort varighet, og har blitt godt tolerert. Administrer NEURONTIN tre ganger daglig med 300 mg eller 400 mg kapsler, eller 600 mg eller 800 mg tabletter. Maksimal tid mellom doser bør ikke overstige 12 timer.
Pediatriske pasienter i alderen 3 til 11 år
Startdoseområdet er 10 mg/kg/dag til 15 mg/kg/dag, gitt i tre oppdelte doser, og anbefalt vedlikeholdsdose oppnås ved oppovertitrering over en periode på ca. 3 dager. Den anbefalte vedlikeholdsdosen av NEURONTIN hos pasienter i alderen 3 til 4 år er 40 mg/kg/dag, gitt i tre oppdelte doser. Den anbefalte vedlikeholdsdosen av NEURONTIN 100 mg hos pasienter i alderen 5 til 11 år er 25 mg/kg/dag til 35 mg/kg/dag, gitt i tre oppdelte doser. NEURONTIN 300 mg kan administreres som mikstur, kapsel eller tablett, eller ved bruk av kombinasjoner av disse formuleringene. Doser opp til 50 mg/kg/dag har blitt godt tolerert i en langtids klinisk studie. Det maksimale tidsintervallet mellom dosene bør ikke overstige 12 timer.
Dosejustering hos pasienter med nedsatt nyrefunksjon
Dosejustering hos pasienter 12 år og eldre med nedsatt nyrefunksjon eller som gjennomgår hemodialyse anbefales, som følger (se doseringsanbefalinger ovenfor for effektive doser for hver indikasjon):
TABELL 1: NEURONTIN-dosering basert på nyrefunksjon
Kreatininclearance (CLCr) er vanskelig å måle hos polikliniske pasienter. Hos pasienter med stabil nyrefunksjon kan kreatininclearance estimeres rimelig godt ved å bruke ligningen til Cockcroft og Gault:
Bruk av NEURONTIN hos pasienter under 12 år med nedsatt nyrefunksjon er ikke studert.
Dosering hos eldre
Fordi det er mer sannsynlig at eldre pasienter har nedsatt nyrefunksjon, bør det utvises forsiktighet ved dosevalg, og dosen bør justeres basert på kreatininclearance-verdier hos disse pasientene.
Administrasjonsinformasjon
Administrer NEURONTIN oralt med eller uten mat.
NEURONTIN 100 mg kapsler skal svelges hele med vann.
Informer pasientene om at dersom de deler den skårede 600 mg eller 800 mg NEURONTIN tabletten for å administrere en halv tablett, bør de ta den ubrukte halvtabletten som neste dose. Halve tabletter som ikke er brukt innen 28 dager etter deling av den skårede tabletten skal kastes.
Hvis NEURONTIN-dosen reduseres, seponeres eller erstattes med en alternativ medisin, bør dette gjøres gradvis over minimum 1 uke (en lengre periode kan være nødvendig etter forskriverens skjønn).
HVORDAN LEVERES
Doseringsformer og styrker
Kapsler
- . 100 mg: hvite harde gelatinkapsler merket med "PD" på kroppen og "Neurontin/100 mg" på hetten . 300 mg: gule harde gelatinkapsler merket med "PD" på kroppen og "Neurontin/300 mg" på hetten . 400 mg: oransje harde gelatinkapsler trykket med "PD" på kroppen og "Neurontin/400 mg" på hetten
Nettbrett
- . 600 mg: hvite elliptiske filmdrasjerte tabletter med skårekår preget med "NT" og "16" på den ene siden . 800 mg: hvite, elliptiske filmdrasjerte tabletter med skåre, merket med “NT” og “26” på den ene siden
Muntlig løsning
- . 250 mg per 5 ml (50 mg per ml), klar fargeløs til svakt gul løsning
Oppbevaring og håndtering
NEURONTIN (gabapentin) kapsler, tabletter og mikstur leveres som følger:
100 mg kapsler
Hvite harde gelatinkapsler merket med "PD" på kroppen og "Neurontin/100 mg" på hetten; tilgjengelig i:
Flasker på 100: NDC 0071-0803-24
300 mg kapsler
Gule harde gelatinkapsler trykket med "PD" på kroppen og "Neurontin/300 mg" på hetten; tilgjengelig i:
Flasker på 100: NDC 0071-0805-24 Enhetsdose 50's: NDC 0071-0805-40
400 mg kapsler
Oransje harde gelatinkapsler trykket med "PD" på kroppen og "Neurontin/400 mg" på hetten; tilgjengelig i:
Flasker på 100: NDC 0071-0806-24 Enhetsdose 50's: NDC 0071-0806-40
600 mg tabletter
Hvite elliptiske filmdrasjerte tabletter med skårne deler preget med "NT" og "16" på den ene siden; tilgjengelig i:
Flasker på 100: NDC 0071-0513-24
800 mg tabletter
Hvite elliptiske filmdrasjerte tabletter med skårestrek preget med "NT" og "26" på den ene siden; tilgjengelig i:
Flasker på 100: NDC 0071-0401-24
250 mg per 5 ml oral oppløsning
Klar fargeløs til svakt gul løsning; hver 5 ml mikstur inneholder 250 mg gabapentin; tilgjengelig i:
Glassflasker som inneholder 470 ml: NDC 0071-2012-23 Flasker som inneholder 470 ml: NDC 0071-2012-44
Oppbevar NEURONTIN 400mg tabletter og kapsler ved 25°C (77°F); utflukter tillatt mellom 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ].
Oppbevar NEURONTIN mikstur i kjøleskap, 2°C til 8°C (36°F til 46°F).
Distribuert av: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Revidert: Des 2020
BIVIRKNINGER
Følgende alvorlige bivirkninger er omtalt mer detaljert i andre avsnitt:
- . Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS)/multiorganoverfølsomhet [se ADVARSLER OG FORHOLDSREGLER ] . Anafylaksi og angioødem [se ADVARSLER OG FORHOLDSREGLER ] . Somnolens/Sedasjon og svimmelhet [se ADVARSLER OG FORHOLDSREGLER ] . Seponering Utløst anfall, Status Epilepticus [se ADVARSLER OG FORHOLDSREGLER ] . Selvmordsatferd og ideer [se ADVARSLER OG FORHOLDSREGLER ] . Respirasjonsdepresjon [se ADVARSLER OG FORHOLDSREGLER ] . Nevropsykiatriske bivirkninger (pediatriske pasienter i alderen 3 til 12 år) [se ADVARSLER OG FORHOLDSREGLER ] . Plutselig og uforklarlig død hos pasienter med epilepsi [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Postherpetisk nevralgi
De vanligste bivirkningene assosiert med bruk av NEURONTIN hos voksne, som ikke ble sett med tilsvarende frekvens blant placebo-behandlede pasienter, var svimmelhet, somnolens og perifert ødem.
de 2 kontrollerte studiene med postherpetisk nevralgi, avbrøt 16 % av de 336 pasientene som fikk NEURONTIN og 9 % av de 227 pasientene som fikk placebo behandlingen på grunn av en bivirkning. Bivirkningene som oftest førte til seponering hos NEURONTIN-behandlede pasienter var svimmelhet, søvnighet og kvalme.
Tabell 3 viser bivirkninger som oppsto hos minst 1 % av NEURONTIN-behandlede pasienter med postherpetisk nevralgi som deltok i placebokontrollerte studier og som var numerisk hyppigere i NEURONTIN-gruppen enn i placebogruppen.
TABELL 3: Bivirkninger i sammenslåtte placebokontrollerte forsøk ved postherpetisk nevralgi
Andre reaksjoner hos mer enn 1 % av pasientene, men like eller hyppigere i placebogruppen, inkluderte smerte, skjelving, nevralgi, ryggsmerter, dyspepsi, dyspné og influensasyndrom.
Det var ingen klinisk viktige forskjeller mellom menn og kvinner i typen og forekomsten av bivirkninger. Fordi det var få pasienter hvis rase ble rapportert som annen enn hvit, er det utilstrekkelig data til å støtte en påstand om fordelingen av bivirkninger etter rase.
Epilepsi med partielle anfall (tilleggsterapi)
De vanligste bivirkningene med NEURONTIN 300 mg i kombinasjon med andre antiepileptika hos pasienter >12 år, som ikke ble sett med tilsvarende frekvens blant placebobehandlede pasienter, var søvnighet, svimmelhet, ataksi, tretthet og nystagmus.
De vanligste bivirkningene med NEURONTIN i kombinasjon med andre antiepileptika hos pediatriske pasienter i alderen 3 til 12 år, ikke sett like hyppig blant placebobehandlede pasienter, var virusinfeksjon, feber, kvalme og/eller oppkast, somnolens og fiendtlighet [se ADVARSLER OG FORHOLDSREGLER ].
Omtrent 7 % av de 2074 pasientene >12 år og omtrent 7 % av de 449 pediatriske pasientene i alderen 3 til 12 år som fikk NEURONTIN i kliniske studier før markedsføring, avbrøt behandlingen på grunn av en bivirkning. Bivirkningene som oftest er forbundet med seponering hos pasienter >12 år var søvnighet (1,2 %), ataksi (0,8 %), tretthet (0,6 %), kvalme og/eller oppkast (0,6 %) og svimmelhet (0,6 %). . Bivirkningene som oftest er forbundet med abstinens hos pediatriske pasienter var emosjonell labilitet (1,6 %), fiendtlighet (1,3 %) og hyperkinesi (1,1 %).
Tabell 4 viser bivirkninger som oppsto hos minst 1 % av NEURONTIN-behandlede pasienter >12 år med epilepsi som deltok i placebokontrollerte studier og var numerisk mer vanlige i NEURONTIN-gruppen. I disse studiene ble enten NEURONTIN 300 mg eller placebo lagt til pasientens nåværende antiepileptikabehandling.
TABELL 4: Bivirkninger i sammenslåtte placebokontrollerte tilleggsforsøk hos epilepsipasienter >12 år
Blant bivirkningene som oppstod med en forekomst på minst 10 % hos pasienter behandlet med NEURONTIN, så det ut til at somnolens og ataksi viste en positiv dose-respons-relasjon.
Den totale forekomsten av bivirkninger og typene av bivirkninger som ble sett var lik blant menn og kvinner behandlet med NEURONTIN. Forekomsten av bivirkninger økte litt med økende alder hos pasienter behandlet med enten NEURONTIN eller placebo. Fordi bare 3 % av pasientene (28/921) i placebokontrollerte studier ble identifisert som ikke-hvite (svarte eller andre), er det utilstrekkelig data til å støtte en påstand om fordelingen av bivirkninger etter rase.
Tabell 5 viser bivirkninger som oppsto hos minst 2 % av NEURONTIN-behandlede pasienter i alderen 3 til 12 år med epilepsi som deltok i placebokontrollerte studier, og som var numerisk mer vanlige i NEURONTIN-gruppen.
TABELL 5: Bivirkninger i en placebokontrollert tilleggsforsøk hos pediatriske epilepsipasienter i alderen 3 til 12 år
Andre reaksjoner hos mer enn 2 % av pediatriske pasienter i alderen 3 til 12 år, men like eller hyppigere i placebogruppen, inkluderte: faryngitt, øvre luftveisinfeksjon, hodepine, rhinitt, kramper, diaré, anoreksi, hoste og mellomørebetennelse.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av NEURONTIN etter markedsføring. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Lever og galleveier: gulsott
Undersøkelser: forhøyet kreatinkinase, forhøyede leverfunksjonstester
Metabolisme og ernæringsforstyrrelser: hyponatremi
Muskel- og bindevevslidelser: rabdomyolyse
Forstyrrelser i nervesystemet: bevegelsesforstyrrelse
Psykiatriske lidelser: opphisselse
Reproduksjonssystem og brystsykdommer: brystforstørrelse, endringer i libido, ejakulasjonsforstyrrelser og anorgasmi
Hud- og subkutane vevssykdommer: angioødem [se ADVARSLER OG FORHOLDSREGLER ], bulløs pemfigoid, erythema multiforme, Stevens-Johnsons syndrom.
Det er rapporter etter markedsføring om livstruende eller dødelig respirasjonsdepresjon hos pasienter som tar NEURONTIN sammen med opioider eller andre CNS-depressiva, eller i sammenheng med underliggende respirasjonssvikt [se ADVARSLER OG FORHOLDSREGLER ].
Bivirkninger etter brå seponering av gabapentin er også rapportert. De hyppigst rapporterte reaksjonene var angst, søvnløshet, kvalme, smerte og svette.
NARKOTIKAHANDEL
Opioider
Respirasjonsdepresjon og sedasjon, noen ganger med døden til følge, er rapportert etter samtidig administrering av gabapentin og opioider (f.eks. morfin, hydrokodon, oksykodon, buprenorfin) [se ADVARSLER OG FORHOLDSREGLER ].
Hydrokodon
Samtidig administrering av NEURONTIN 300 mg og hydrokodon reduserer eksponeringen for hydrokodon [se KLINISK FARMAKOLOGI ]. Potensialet for endring i hydrokodoneksponering og effekt bør vurderes når NEURONTIN 100 mg startes eller seponeres hos en pasient som tar hydrokodon.
Morfin
Når gabapentin administreres sammen med morfin, bør pasienter observeres for tegn på CNS-depresjon, som somnolens, sedasjon og respirasjonsdepresjon [se KLINISK FARMAKOLOGI ].
Andre antiepileptika
Gabapentin metaboliseres ikke nevneverdig og forstyrrer heller ikke metabolismen av vanlige samtidig administrerte antiepileptika [se KLINISK FARMAKOLOGI ].
Maalox® (aluminiumhydroksid, magnesiumhydroksid)
Gjennomsnittlig biotilgjengelighet av gabapentin ble redusert med ca. 20 % ved samtidig bruk av et syrenøytraliserende middel (Maalox) som inneholder magnesium- og aluminiumhydroksid. Det anbefales at gabapentin tas minst 2 timer etter administrering av Maalox [se KLINISK FARMAKOLOGI ].
Interaksjoner med legemiddel/laboratorietest
Fordi falske positive målinger ble rapportert med Ames N-Multistix SG peilepinnetesten for urinprotein når gabapentin ble tilsatt andre antiepileptika, anbefales den mer spesifikke sulfosalisylsyreutfellingsprosedyren for å bestemme tilstedeværelsen av urinprotein.
Narkotikamisbruk og avhengighet
Kontrollert stoff
Gabapentin er ikke et planlagt legemiddel.
Misbruke
Misbruk er tilsiktet, ikke-terapeutisk bruk av et stoff, selv én gang, for dets ønskelige psykologiske eller fysiologiske effekter. Misbruk er forsettlig bruk, for terapeutiske formål, av et legemiddel av en person på en annen måte enn foreskrevet av en helsepersonell eller som det ikke er foreskrevet for.
Gabapentin viser ikke affinitet for benzodiazepin, opioid (mu, delta eller kappa), eller cannabinoid 1 reseptorsteder. Misbruk og misbruk av gabapentin har blitt rapportert etter markedsføring og publisert litteratur. De fleste av personene beskrevet i disse rapportene hadde en historie med misbruk av flere stoffer. Noen av disse personene tok høyere enn anbefalte doser av gabapentin for ikke-godkjent bruk. Når du foreskriver NEURONTIN, evaluer pasientene nøye for en historie med narkotikamisbruk og observer dem for tegn og symptomer på misbruk eller misbruk av gabapentin (f.eks. selvdoseeskalering og legemiddelsøkende atferd). Misbrukspotensialet til gabapentin har ikke blitt evaluert i studier på mennesker.
Avhengighet
Fysisk avhengighet er en tilstand som utvikler seg som et resultat av fysiologisk tilpasning som respons på gjentatt medikamentbruk, manifestert ved abstinenstegn og symptomer etter brå seponering eller en betydelig dosereduksjon av et legemiddel. Det er sjeldne rapporter etter markedsføring om personer som opplever abstinenssymptomer kort tid etter seponering av høyere enn anbefalte doser av gabapentin som brukes til å behandle sykdommer som legemidlet ikke er godkjent for. Slike symptomer inkluderte agitasjon, desorientering og forvirring etter plutselig seponering av gabapentin som forsvant etter restart av gabapentin. Avhengighetspotensialet til gabapentin har ikke blitt evaluert i studier på mennesker.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) / multiorgan overfølsomhet
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS), også kjent som multiorgan-overfølsomhet, har oppstått med NEURONTIN. Noen av disse reaksjonene har vært dødelige eller livstruende. DRESS viser seg vanligvis, men ikke utelukkende, med feber, utslett og/eller lymfadenopati, i forbindelse med andre organsystempåvirkninger, som hepatitt, nefritt, hematologiske abnormiteter, myokarditt eller myositt som noen ganger ligner en akutt virusinfeksjon. Eosinofili er ofte tilstede. Denne lidelsen er variabel i uttrykket, og andre organsystemer som ikke er nevnt her kan være involvert.
Det er viktig å merke seg at tidlige manifestasjoner av overfølsomhet, som feber eller lymfadenopati, kan være tilstede selv om utslett ikke er tydelig. Hvis slike tegn eller symptomer er tilstede, bør pasienten evalueres umiddelbart. NEURONTIN bør seponeres hvis en alternativ etiologi for tegn eller symptomer ikke kan fastslås.
Anafylaksi og angioødem
NEURONTIN kan forårsake anafylaksi og angioødem etter den første dosen eller når som helst under behandlingen. Tegn og symptomer i rapporterte tilfeller har inkludert pustevansker, hevelse i lepper, svelg og tunge, og hypotensjon som krever akuttbehandling. Pasienter bør instrueres om å seponere NEURONTIN 300 mg og søke øyeblikkelig medisinsk hjelp dersom de opplever tegn eller symptomer på anafylaksi eller angioødem.
Effekter på kjøring og bruk av tunge maskiner
Pasienter som tar NEURONTIN bør ikke kjøre bil før de har fått tilstrekkelig erfaring til å vurdere om NEURONTIN 100 mg svekker deres evne til å kjøre bil. Kjøreprestasjonsstudier utført med et prodrug av gabapentin (gabapentin enacarbil tablett, forlenget frigjøring) indikerer at gabapentin kan forårsake betydelig svekkelse av kjøreegenskapene. Forskrivere og pasienter bør være oppmerksomme på at pasienter' evne til å vurdere egen kjørekompetanse, samt deres evne til å vurdere graden av somnolens forårsaket av NEURONTIN, kan være ufullkommen. Varigheten av nedsatt kjøreevne etter oppstart av behandling med NEURONTIN 300 mg er ukjent. Hvorvidt svekkelsen er relatert til somnolens [se ADVARSLER OG FORHOLDSREGLER ] eller andre effekter av NEURONTIN er ukjent.
Dessuten, fordi NEURONTIN 300mg forårsaker søvnighet og svimmelhet [se ADVARSLER OG FORHOLDSREGLER ], bør pasienter rådes til ikke å bruke komplekse maskiner før de har fått tilstrekkelig erfaring med NEURONTIN til å vurdere om NEURONTIN 300 mg svekker deres evne til å utføre slike oppgaver.
Somnolens/Sedasjon og svimmelhet
Under kontrollerte epilepsistudier hos pasienter over 12 år som fikk doser av NEURONTIN 100 mg opp til 1800 mg daglig, ble søvnighet, svimmelhet og ataksi rapportert i større grad hos pasienter som fikk NEURONTIN sammenlignet med placebo: dvs. 19 % i legemidlet. mot 9 % i placebo for somnolens, 17 % i medikament mot 7 % i placebo for svimmelhet, og 13 % i medikament mot 6 % i placebo for ataksi. I disse studiene var søvnighet, ataksi og tretthet vanlige bivirkninger som førte til seponering av NEURONTIN hos pasienter eldre enn 12 år, med henholdsvis 1,2 %, 0,8 % og 0,6 % som avsluttet på grunn av disse hendelsene.
Under de kontrollerte studiene med pasienter med postherpetisk nevralgi, ble søvnighet og svimmelhet rapportert i større grad enn placebo hos pasienter som fikk NEURONTIN, i doser opptil 3600 mg per dag: dvs. 21 % hos NEURONTIN-behandlede pasienter versus 5 % hos placebobehandlede pasienter for somnolens og 28 % hos NEURONTIN-behandlede pasienter mot 8 % hos placebobehandlede pasienter for svimmelhet. Svimmelhet og somnolens var blant de vanligste bivirkningene som førte til seponering av NEURONTIN.
Pasienter bør observeres nøye for tegn på depresjon av sentralnervesystemet (CNS), som somnolens og sedasjon, når NEURONTIN 400 mg brukes sammen med andre legemidler med beroligende egenskaper på grunn av potensiell synergi. I tillegg kan pasienter som trenger samtidig behandling med morfin oppleve økninger i gabapentinkonsentrasjoner og kan trenge dosejustering [se NARKOTIKAHANDEL ].
Seponering Utløst anfall, Status Epilepticus
Antiepileptika bør ikke seponeres brått på grunn av muligheten for økende anfallsfrekvens.
I de placebokontrollerte epilepsistudiene hos pasienter >12 år, var forekomsten av status epilepticus hos pasienter som fikk NEURONTIN 0,6 % (3 av 543) mot 0,5 % hos pasienter som fikk placebo (2 av 378). Blant de 2074 pasientene >12 år som ble behandlet med NEURONTIN 300 mg i alle epilepsistudier (kontrollerte og ukontrollerte), hadde 31 (1,5 %) status epilepticus. Av disse hadde 14 pasienter ingen tidligere historie med status epilepticus verken før behandling eller mens de brukte andre medisiner. Fordi tilstrekkelige historiske data ikke er tilgjengelige, er det umulig å si om behandling med NEURONTIN er assosiert med en høyere eller lavere forekomst av status epilepticus enn det som forventes å forekomme i en lignende populasjon som ikke er behandlet med NEURONTIN.
Selvmordsatferd og ideer
Antiepileptika (AED), inkludert NEURONTIN 100 mg, øker risikoen for selvmordstanker eller selvmordsatferd hos pasienter som tar disse legemidlene for enhver indikasjon. Pasienter som behandles med en AED for enhver indikasjon bør overvåkes for oppkomst eller forverring av depresjon, selvmordstanker eller -adferd og/eller uvanlige endringer i humør eller atferd.
Sammenslåtte analyser av 199 placebokontrollerte kliniske studier (mono- og tilleggsbehandling) av 11 forskjellige hjertestartere viste at pasienter randomisert til en av hjertestarterne hadde omtrent dobbelt så stor risiko (justert relativ risiko 1,8, 95 % KI: 1,2, 2,7) for selvmordstanker. tenkning eller atferd sammenlignet med pasienter randomisert til placebo. I disse studiene, som hadde en median behandlingsvarighet på 12 uker, var den estimerte forekomsten av selvmordsatferd eller ideer blant 27 863 AED-behandlede pasienter 0,43 %, sammenlignet med 0,24 % blant 16 029 placebo-behandlede pasienter, noe som representerer en økning på ca. tilfelle av selvmordstanker eller -adferd for hver 530 behandlede pasient. Det var fire selvmord hos medikamentbehandlede pasienter i studiene og ingen hos placebobehandlede pasienter, men antallet er for lite til å tillate noen konklusjon om medikamentets effekt på selvmord.
Den økte risikoen for selvmordstanker eller selvmordsatferd med AED-er ble observert så tidlig som en uke etter oppstart av medikamentell behandling med AED-er og vedvarte i den vurderte behandlingen. Fordi de fleste studier inkludert i analysen ikke strekker seg utover 24 uker, kunne ikke risikoen for selvmordstanker eller selvmordsatferd utover 24 uker vurderes.
Risikoen for selvmordstanker eller selvmordsatferd var generelt konsistent blant medikamentene i de analyserte dataene. Funnet av økt risiko med AED-er med varierende virkningsmekanismer og på tvers av en rekke indikasjoner antyder at risikoen gjelder alle AED-er som brukes for enhver indikasjon. Risikoen varierte ikke vesentlig etter alder (5–100 år) i de analyserte kliniske studiene. Tabell 2 viser absolutt og relativ risiko etter indikasjon for alle evaluerte AED-er.
TABELL 2: Risiko etter indikasjon for antiepileptika i den samlede analysen
Den relative risikoen for selvmordstanker eller selvmordsatferd var høyere i kliniske studier for epilepsi enn i kliniske studier for psykiatriske eller andre tilstander, men de absolutte risikoforskjellene var like for epilepsi og psykiatriske indikasjoner.
Alle som vurderer å foreskrive NEURONTIN 100mg eller en annen hjertestarter, må balansere risikoen for selvmordstanker eller selvmordsatferd med risikoen for ubehandlet sykdom. Epilepsi og mange andre sykdommer som AED er foreskrevet for er i seg selv assosiert med sykelighet og dødelighet og økt risiko for selvmordstanker og selvmordsatferd. Hvis selvmordstanker og selvmordsatferd skulle dukke opp under behandlingen, må forskriveren vurdere om fremveksten av disse symptomene hos en gitt pasient kan være relatert til sykdommen som behandles.
Pasienter, deres omsorgspersoner og familier bør informeres om at AED-er øker risikoen for selvmordstanker og selvmordsatferd og bør informeres om behovet for å være på vakt for opptreden eller forverring av tegn og symptomer på depresjon, eventuelle uvanlige endringer i humør eller atferd. , eller fremveksten av selvmordstanker, atferd eller tanker om selvskading. Bekymringsadferd bør rapporteres umiddelbart til helsepersonell.
Respirasjonsdepresjon
Det er bevis fra kasusrapporter, studier på mennesker og dyrestudier som assosierer gabapentin med alvorlig, livstruende eller dødelig respirasjonsdepresjon når det administreres sammen med CNS-depressiva, inkludert opioider, eller i sammenheng med underliggende respirasjonssvikt. Når beslutningen tas om å forskrive NEURONTIN 100 mg sammen med et annet CNS-dempende middel, spesielt et opioid, eller å forskrive NEURONTIN 100 mg til pasienter med underliggende respirasjonssvikt, overvåk pasienter for symptomer på respirasjonsdepresjon og sedasjon, og vurder å starte NEURONTIN med en lav dose . Behandlingen av respirasjonsdepresjon kan omfatte nøye observasjon, støttende tiltak og reduksjon eller seponering av CNS-depressiva (inkludert NEURONTIN).
Nevropsykiatriske bivirkninger (pediatriske pasienter i alderen 3 til 12 år)
Bruk av gabapentin hos pediatriske pasienter med epilepsi i alderen 3 til 12 år er assosiert med forekomsten av CNS-relaterte bivirkninger. Den mest betydningsfulle av disse kan klassifiseres i følgende kategorier: 1) emosjonell labilitet (primært atferdsproblemer), 2) fiendtlighet, inkludert aggressiv atferd, 3) tankeforstyrrelse, inkludert konsentrasjonsproblemer og endringer i skoleprestasjoner, og 4) hyperkinesi ( primært rastløshet og hyperaktivitet). Blant de gabapentinbehandlede pasientene var de fleste reaksjonene milde til moderate i intensitet.
kontrollerte kliniske epilepsistudier hos pediatriske pasienter i alderen 3 til 12 år var forekomsten av disse bivirkningene: emosjonell labilitet 6 % (gabapentinbehandlede pasienter) versus 1,3 % (placebobehandlede pasienter); fiendtlighet 5,2 % mot 1,3 %; hyperkinesi 4,7 % mot 2,9 %; og tankeforstyrrelse 1,7 % mot 0 %. En av disse reaksjonene, en rapport om fiendtlighet, ble ansett som alvorlig. Seponering av gabapentinbehandling forekom hos 1,3 % av pasientene som rapporterte emosjonell labilitet og hyperkinesi og 0,9 % av gabapentinbehandlede pasienter rapporterte fiendtlighet og tankeforstyrrelser. Én placebobehandlet pasient (0,4 %) trakk seg på grunn av emosjonell labilitet.
Tumorogent potensial
I en oral karsinogenitetsstudie økte gabapentin forekomsten av acinarcelletumorer i bukspyttkjertelen hos rotter [se Ikke-klinisk toksikologi ]. Den kliniske betydningen av dette funnet er ukjent. Klinisk erfaring under utviklingen av gabapentin før markedsføring gir ingen direkte midler til å vurdere potensialet for å indusere svulster hos mennesker.
I kliniske studier i tilleggsterapi ved epilepsi som omfattet 2085 pasientår med eksponering hos pasienter >12 år, ble nye svulster rapportert hos 10 pasienter (2 bryst, 3 hjerner, 2 lunger, 1 binyre, 1 ikke-Hodgkin' s lymfom, 1 endometriekarsinom in situ), og eksisterende svulster forverret seg hos 11 pasienter (9 hjerner, 1 bryst, 1 prostata) i løpet av eller opptil 2 år etter seponering av NEURONTIN. Uten kunnskap om bakgrunnsforekomst og residiv i en tilsvarende populasjon som ikke er behandlet med NEURONTIN 100mg, er det umulig å vite om forekomsten sett i denne kohorten er eller ikke påvirkes av behandling.
Plutselig og uforklarlig død hos pasienter med epilepsi
løpet av premarketingutviklingen av NEURONTIN 400 mg, ble det registrert 8 plutselige og uforklarlige dødsfall blant en kohort på 2203 epilepsipasienter behandlet (2103 pasientår med eksponering) med NEURONTIN.
Noen av disse kan representere anfallsrelaterte dødsfall der anfallet ikke ble observert, for eksempel om natten. Dette representerer en insidens på 0,0038 dødsfall per pasientår. Selv om denne frekvensen overstiger det som forventes i en frisk populasjon matchet for alder og kjønn, er den innenfor rekkevidden av estimater for forekomsten av plutselige uforklarlige dødsfall hos pasienter med epilepsi som ikke får NEURONTIN (som varierer fra 0,0005 for den generelle populasjonen av epileptikere til 0,003 for en klinisk studiepopulasjon som ligner på NEURONTIN-programmet, til 0,005 for pasienter med refraktær epilepsi). Om disse tallene er betryggende eller vekker ytterligere bekymring, avhenger følgelig av sammenlignbarheten av populasjonene rapportert til NEURONTIN-kohorten og nøyaktigheten av estimatene som er gitt.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning ).
Administrasjonsinformasjon
Informer pasientene om at NEURONTIN tas oralt med eller uten mat. Informer pasientene om at dersom de deler den skårede 600 mg eller 800 mg tabletten for å administrere en halv tablett, bør de ta den ubrukte halvtabletten som neste dose. Råd pasientene til å kaste halvtabletter som ikke er brukt innen 28 dager etter deling av den skårede tabletten.
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) / multiorgan overfølsomhet
Før oppstart av behandling med NEURONTIN, instruer pasientene om at utslett eller andre tegn eller symptomer på overfølsomhet (som feber eller lymfadenopati) kan varsle en alvorlig medisinsk hendelse, og at pasienten bør rapportere enhver slik hendelse til en lege umiddelbart [se ADVARSLER OG FORHOLDSREGLER ].
Anafylaksi og angioødem
Råd pasienter til å seponere NEURONTIN 300 mg og søke medisinsk hjelp hvis de utvikler tegn eller symptomer på anafylaksi eller angioødem [se ADVARSLER OG FORHOLDSREGLER ].
Svimmelhet og somnolens og effekter på kjøring og bruk av tunge maskiner
Informer pasienter om at NEURONTIN 100 mg kan forårsake svimmelhet, søvnighet og andre symptomer og tegn på CNS-depresjon. Andre legemidler med beroligende egenskaper kan øke disse symptomene. Følgelig, selv om pasienter' evnen til å bestemme nivået av svekkelse kan være upålitelig, råd dem til å verken kjøre bil eller bruke andre komplekse maskiner før de har fått tilstrekkelig erfaring med NEURONTIN til å måle om det påvirker deres mentale og/eller motoriske ytelse negativt eller ikke. Informer pasientene om at det ikke er kjent hvor lenge denne effekten varer [se ADVARSLER OG FORHOLDSREGLER og ADVARSLER OG FORHOLDSREGLER ].
Selvmordstenkning og -adferd
Rådfør pasienten, deres omsorgspersoner og familier om at AED-er, inkludert NEURONTIN, kan øke risikoen for selvmordstanker og selvmordsatferd. Informer pasienter om behovet for å være på vakt for opptreden eller forverring av symptomer på depresjon, eventuelle uvanlige endringer i humør eller atferd, eller fremveksten av selvmordstanker, atferd eller tanker om selvskading. Instruer pasienter om å rapportere bekymringsfull atferd umiddelbart til helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Respirasjonsdepresjon
Informer pasienter om risikoen for respirasjonsdepresjon. Ta med informasjon om at risikoen er størst for de som samtidig bruker CNS-depressiva (som opioidanalgetika) eller de med underliggende respirasjonssvikt. Lær pasienter hvordan de gjenkjenner respirasjonsdepresjon og råd dem til å søke lege umiddelbart hvis det oppstår [se ADVARSLER OG FORHOLDSREGLER ].
Bruk under graviditet
Instruer pasienter om å varsle legen sin hvis de blir gravide eller har tenkt å bli gravide under behandlingen, og å varsle legen hvis de ammer eller har tenkt å amme under behandlingen [se Bruk i spesifikke populasjoner ].
Oppmuntre pasienter til å registrere seg i NAAED Pregnancy Registry hvis de blir gravide. Dette registeret samler inn informasjon om sikkerheten til antiepileptika under graviditet. For å registrere seg kan pasienter ringe gratisnummeret 1-888-233-2334 [se Bruk i spesifikke populasjoner ].
Merkingen av dette produktet kan ha blitt oppdatert. For den nyeste forskrivningsinformasjonen, vennligst besøk www.pfizer.com.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Gabapentin ble administrert oralt til mus og rotter i 2-årige karsinogenitetsstudier. Ingen tegn på legemiddelrelatert karsinogenitet ble observert hos mus behandlet med doser opp til 2000 mg/kg/dag. Ved 2000 mg/kg var plasmagabapentineksponeringen (AUC) hos mus omtrent 2 ganger høyere enn hos mennesker ved MRHD på 3600 mg/dag. Hos rotter ble det funnet økning i forekomsten av pankreas acinarcelleadenom og karsinom hos hannrotter som fikk den høyeste dosen (2000 mg/kg), men ikke ved doser på 250 eller 1000 mg/kg/dag. Ved 1000 mg/kg var plasmagabapentineksponeringen (AUC) hos rotter omtrent 5 ganger høyere enn hos mennesker ved MRHD.
Studier designet for å undersøke mekanismen for gabapentin-indusert bukspyttkjertelkarsinogenese hos rotter indikerer at gabapentin stimulerer DNA-syntese i rottepankreatiske acinarceller in vitro og dermed kan fungere som en tumorpromoter ved å øke mitogen aktivitet. Det er ikke kjent om gabapentin har evnen til å øke celleproliferasjonen i andre celletyper eller hos andre arter, inkludert mennesker.
Mutagenese
Gabapentin viste ikke mutagent eller genotoksisk potensiale in vitro (Ames-test, HGPRT-forovermutasjonsanalyse i kinesisk hamster-lungeceller) og in vivo (kromosomavvik og mikronukleustest i benmarg fra kinesisk hamster, mikronukleus hos mus, ikke-planlagt DNA-syntese i rottehepatocytter) analyser.
Nedsatt fruktbarhet
Ingen uønskede effekter på fertilitet eller reproduksjon ble observert hos rotter ved doser opp til 2000 mg/kg. Ved 2000 mg/kg er plasmagabapentineksponeringen (AUC) hos rotter omtrent 8 ganger høyere enn hos mennesker ved MRHD.
Bruk i spesifikke populasjoner
Svangerskap
Eksponeringsregister for graviditet
Det er et graviditetseksponeringsregister som overvåker graviditetsutfall hos kvinner som er eksponert for antiepileptika (AED), som NEURONTIN 300 mg, under graviditet. Oppmuntre kvinner som tar NEURONTIN under graviditet til å registrere seg i North American Antiepileptic Drug (NAAED) Pregnancy Registry ved å ringe gratisnummeret 1-888-233-2334 eller besøke http://www.aedpregnancyregistry.org/.
Risikosammendrag
Det finnes ikke tilstrekkelige data om utviklingsrisiko forbundet med bruk av NEURONTIN hos gravide kvinner. I ikke-kliniske studier på mus, rotter og kaniner var gabapentin utviklingstoksisk (økte føtale skjelett- og viscerale abnormiteter og økt embryoføtal dødelighet) når det ble administrert til gravide dyr i doser tilsvarende eller lavere enn de som ble brukt klinisk [se Data ].
den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 til 4 % og 15 til 20 %. Bakgrunnsrisikoen for store fødselsskader og spontanabort for den angitte befolkningen er ukjent.

Data
Dyredata
Når gravide mus fikk orale doser av gabapentin (500, 1000 eller 3000 mg/kg/dag) i løpet av organogeneseperioden, ble embryoføtal toksisitet (økt forekomst av skjelettvariasjoner) observert ved de to høyeste dosene. Ingen-effektdosen for embryoføtal utviklingstoksisitet hos mus (500 mg/kg/dag) er mindre enn maksimal anbefalt human dose (MRHD) på 3600 mg på basis av kroppsoverflate (mg/m²).
I studier der rotter fikk orale doser av gabapentin (500 til 2000 mg/kg/dag) under graviditet, ble det observert ugunstig effekt på avkoms utvikling (økt forekomst av hydroureter og/eller hydronefrose) ved alle doser. Den laveste dosen som er testet er lik MRHD på mg/m²-basis.
Når gravide kaniner ble behandlet med gabapentin i løpet av organogeneseperioden, ble det observert en økning i embryoføtal dødelighet ved alle testede doser (60, 300 eller 1500 mg/kg). Den laveste dosen som er testet er mindre enn MRHD på mg/m²-basis.
I en publisert studie ble gabapentin (400 mg/kg/dag) administrert ved intraperitoneal injeksjon til neonatale mus i løpet av den første postnatale uken, en periode med synaptogenese hos gnagere (tilsvarende siste trimester av svangerskapet hos mennesker). Gabapentin forårsaket en markant reduksjon i nevronal synapsedannelse i hjernen til intakte mus og unormal nevronal synapsedannelse i en musemodell for synaptisk reparasjon. Gabapentin har vist seg in vitro å forstyrre aktiviteten til α2δ-underenheten til spenningsaktiverte kalsiumkanaler, en reseptor involvert i nevronal synaptogenese. Den kliniske betydningen av disse funnene er ukjent.
Amming
Risikosammendrag
Gabapentin skilles ut i morsmelk etter oral administrering. Effekten på spedbarnet som ammes og på melkeproduksjonen er ukjent. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for NEURONTIN og eventuelle skadelige effekter på det ammede spedbarnet fra NEURONTIN eller fra den underliggende mors tilstand.
Pediatrisk bruk
Sikkerhet og effektivitet av NEURONTIN 600 mg i behandlingen av postherpetisk nevralgi hos pediatriske pasienter er ikke fastslått.
Sikkerhet og effektivitet som tilleggsbehandling ved behandling av partielle anfall hos pediatriske pasienter under 3 år har ikke blitt fastslått [se Kliniske studier ].
Geriatrisk bruk
Det totale antallet pasienter behandlet med NEURONTIN i kontrollerte kliniske studier med pasienter med postherpetisk nevralgi var 336, hvorav 102 (30 %) var 65 til 74 år og 168 (50 %) var 75 år og eldre. Det var en større behandlingseffekt hos pasienter 75 år og eldre sammenlignet med yngre pasienter som fikk samme dose. Siden gabapentin nesten utelukkende elimineres ved nyreutskillelse, kan den større behandlingseffekten observert hos pasienter ≥75 år være en konsekvens av økt gabapentineksponering for en gitt dose som skyldes en aldersrelatert reduksjon i nyrefunksjonen. Andre faktorer kan imidlertid ikke utelukkes. Typen og forekomsten av bivirkninger var lik på tvers av aldersgrupper bortsett fra perifert ødem og ataksi, som hadde en tendens til å øke i forekomst med alderen.
Kliniske studier av NEURONTIN ved epilepsi inkluderte ikke tilstrekkelig antall personer i alderen 65 år og over til å avgjøre om de responderte annerledes enn yngre personer. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Generelt bør dosevalg for en eldre pasient være forsiktig, vanligvis fra den lave enden av doseringsområdet, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling.
Dette legemidlet er kjent for å utskilles i stor grad av nyrene, og risikoen for toksiske reaksjoner på dette legemidlet kan være større hos pasienter med nedsatt nyrefunksjon. Fordi eldre pasienter har større sannsynlighet for å ha nedsatt nyrefunksjon, bør det utvises forsiktighet ved dosevalg, og dosen bør justeres basert på kreatininclearance-verdier hos disse pasientene [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER , og KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
Dosejustering hos voksne pasienter med nedsatt nyrefunksjon er nødvendig [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ]. Pediatriske pasienter med nedsatt nyrefunksjon har ikke blitt undersøkt.
Dosejustering hos pasienter som gjennomgår hemodialyse er nødvendig [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
OVERDOSE
Tegn på akutt toksisitet hos dyr inkluderte ataksi, anstrengt pust, ptose, sedasjon, hypoaktivitet eller eksitasjon.
Akutte orale overdoser av NEURONTIN 300 mg er rapportert. Symptomer har inkludert dobbeltsyn, skjelving, sløret tale, døsighet, endret mental status, svimmelhet, sløvhet og diaré. Fatal respirasjonsdepresjon er rapportert med NEURONTIN 400 mg overdose, alene og i kombinasjon med andre CNS-depressiva.
Gabapentin kan fjernes ved hemodialyse.
Hvis overeksponering oppstår, ring giftkontrollsenteret på 1-800-222-1222.
KONTRAINDIKASJONER
NEURONTIN er kontraindisert hos pasienter som har vist overfølsomhet overfor legemidlet eller dets ingredienser.
KLINISK FARMAKOLOGI
Virkningsmekanismen
De nøyaktige mekanismene som gabapentin produserer sin smertestillende og antiepileptiske virkning er ukjent. Gabapentin er strukturelt relatert til nevrotransmitteren gamma-aminosmørsyre (GABA), men har ingen effekt på GABA-binding, opptak eller nedbrytning. In vitro-studier har vist at gabapentin binder seg med høy affinitet til α2δ-underenheten til spenningsaktiverte kalsiumkanaler; Forholdet mellom denne bindingen og de terapeutiske effektene av gabapentin er imidlertid ukjent.
Farmakokinetikk
Alle farmakologiske virkninger etter administrering av gabapentin skyldes aktiviteten til moderforbindelsen; gabapentin metaboliseres ikke nevneverdig hos mennesker.
Oral biotilgjengelighet
Gabapentins biotilgjengelighet er ikke doseproporsjonal; dvs. når dosen økes, reduseres biotilgjengeligheten. Biotilgjengeligheten av gabapentin er ca. 60 %, 47 %, 34 %, 33 % og 27 % etter henholdsvis 900, 1200, 2400, 3600 og 4800 mg/dag gitt i 3 oppdelte doser. Mat har bare en liten effekt på hastigheten og omfanget av absorpsjon av gabapentin (14 % økning i AUC og Cmax).
Fordeling
Mindre enn 3 % av gabapentin sirkulerer bundet til plasmaprotein. Det tilsynelatende distribusjonsvolumet av gabapentin etter 150 mg intravenøs administrering er 58±6 L (gjennomsnittlig ±SD). Hos pasienter med epilepsi var steady-state predose (Cmin) konsentrasjoner av gabapentin i cerebrospinalvæske omtrent 20 % av de tilsvarende plasmakonsentrasjonene.
Eliminering
Gabapentin elimineres fra den systemiske sirkulasjonen ved nyreutskillelse som uendret legemiddel. Gabapentin metaboliseres ikke nevneverdig hos mennesker.
Eliminasjonshalveringstid for gabapentin er 5 til 7 timer og er uendret av dose eller etter gjentatt dosering. Gabapentin eliminasjonshastighetskonstant, plasmaclearance og renal clearance er direkte proporsjonale med kreatininclearance. Hos eldre pasienter og hos pasienter med nedsatt nyrefunksjon er plasmaclearance for gabapentin redusert. Gabapentin kan fjernes fra plasma ved hemodialyse.
Spesifikke populasjoner
Alder
Effekten av alder ble studert hos forsøkspersoner i alderen 20–80 år. Tilsynelatende oral clearance (CL/F) av gabapentin avtok etter hvert som alderen økte, fra ca. 225 ml/min hos de under 30 år til ca. 125 ml/min hos de over 70 år. Renal clearance (CLr) og CLr justert for kroppsoverflate avtok også med alderen; reduksjonen i renal clearance av gabapentin med alderen kan imidlertid i stor grad forklares med reduksjonen i nyrefunksjonen. [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Kjønn
Selv om det ikke er utført noen formell studie for å sammenligne farmakokinetikken til gabapentin hos menn og kvinner, ser det ut til at de farmakokinetiske parametrene for menn og kvinner er like og det er ingen signifikante kjønnsforskjeller.
Løp
Farmakokinetiske forskjeller på grunn av rase er ikke studert. Fordi gabapentin primært utskilles renalt og det ikke er noen viktige raseforskjeller i kreatininclearance, forventes ikke farmakokinetiske forskjeller på grunn av rase.
Pediatrisk
Gabapentins farmakokinetikk ble bestemt hos 48 pediatriske personer mellom 1 måned og 12 år etter en dose på ca. 10 mg/kg. Maksimal plasmakonsentrasjon var lik for hele aldersgruppen og inntraff 2 til 3 timer etter dosering. Generelt oppnådde pediatriske personer mellom 1 måned og
En populasjonsfarmakokinetisk analyse ble utført hos 253 pediatriske personer mellom 1 måned og 13 år. Pasientene fikk 10 til 65 mg/kg/dag gitt tre ganger daglig. Tilsynelatende oral clearance (CL/F) var direkte proporsjonal med kreatininclearance og dette forholdet var likt etter en enkeltdose og ved steady-state. Høyere orale clearance-verdier ble observert hos barn
Disse farmakokinetiske dataene indikerer at den effektive daglige dosen hos pediatriske pasienter med epilepsi i alderen 3 og 4 år bør være 40 mg/kg/dag for å oppnå gjennomsnittlige plasmakonsentrasjoner tilsvarende de som oppnås hos pasienter 5 år og eldre som får gabapentin på 30 mg/dag. kg/dag [se DOSERING OG ADMINISTRASJON ].
Voksne pasienter med nedsatt nyrefunksjon
Personer (N=60) med nedsatt nyrefunksjon (gjennomsnittlig kreatininclearance varierende fra 13–114 ml/min) ble administrert enkeltdoser på 400 mg gabapentin. Gjennomsnittlig halveringstid for gabapentin varierte fra ca. 6,5 timer (pasienter med kreatininclearance >60 ml/min) til 52 timer (kreatininclearance 60 ml/min. gruppe) til ca. 10 ml/min ( DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ]. Pediatriske pasienter med nedsatt nyrefunksjon har ikke blitt undersøkt.
Hemodialyse
en studie med anuriske voksne personer (N=11), var den tilsynelatende eliminasjonshalveringstiden for gabapentin på dager uten dialyse ca. 132 timer; under dialyse ble den tilsynelatende halveringstiden for gabapentin redusert til 3,8 timer. Hemodialyse har dermed en signifikant effekt på eliminering av gabapentin hos anuriske personer [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Leversykdom
Fordi gabapentin ikke metaboliseres, ble det ikke utført noen studier hos pasienter med nedsatt leverfunksjon.
Narkotikahandel
In vitro studier
In vitro-studier ble utført for å undersøke potensialet til gabapentin til å hemme de viktigste cytokrom P450-enzymene (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 og CYP3A4) som medierer medikament- og xenobiotiske preparater selektiv metabolisme ved bruk av isomobiotisk liver-markør. . Bare ved den høyeste konsentrasjonen som ble testet (171 mcg/ml; 1 mM) ble det observert en liten grad av hemming (14 % til 30 %) av isoform CYP2A6. Ingen hemming av noen av de andre isoformene som ble testet ble observert ved gabapentinkonsentrasjoner opp til 171 mcg/ml (ca. 15 ganger C ved 3600 mg/dag) observert isoform CYP2A6. Ingen hemming av noen av de andre isoformene som ble testet ble observert ved gabapentinkonsentrasjoner opp til 171 mcg/ml (ca. 15 ganger Cmax ved 3600 mg/dag).
In vivo-studier
Legemiddelinteraksjonsdataene beskrevet i denne delen ble hentet fra studier som involverte friske voksne og voksne pasienter med epilepsi.
Fenytoin
en enkelt (400 mg) og multippel dose (400 mg tre ganger daglig) studie av NEURONTIN 400 mg hos epileptiske pasienter (N=8) som ble opprettholdt på fenytoin monoterapi i minst 2 måneder, hadde gabapentin ingen effekt på steady-state bunnen. plasmakonsentrasjoner av fenytoin og fenytoin hadde ingen effekt på gabapentins farmakokinetikk.
Karbamazepin
Steady-state bunnplasma karbamazepin og karbamazepin 10, 11 epoksidkonsentrasjoner ble ikke påvirket av samtidig gabapentin (400 mg tre ganger daglig; N=12). På samme måte var gabapentins farmakokinetikk uendret ved administrering av karbamazepin.
Valproinsyre
Gjennomsnittlig steady-state bunnkonsentrasjon av valproinsyre i serum før og under samtidig administrering av gabapentin (400 mg tre ganger daglig; N=17) var ikke forskjellige, og gabapentins farmakokinetiske parametere ble heller ikke påvirket av valproinsyre.
Fenobarbital
Estimater av steady-state farmakokinetiske parametere for fenobarbital eller gabapentin (300 mg tre ganger daglig; N=12) er identiske enten legemidlene administreres alene eller sammen.
Naproxen
Samtidig administrering (N=18) av naproxennatriumkapsler (250 mg) med NEURONTIN (125 mg) ser ut til å øke mengden gabapentin absorbert med 12 % til 15 %. Gabapentin hadde ingen effekt på naproksens farmakokinetiske parametere. Disse dosene er lavere enn de terapeutiske dosene for begge legemidlene. Størrelsen på interaksjonen innenfor de anbefalte doseområdene for begge legemidlene er ikke kjent.
Hydrokodon
Samtidig administrering av NEURONTIN (125 til 500 mg; N=48) reduserer hydrokodon (10 mg; N=50) Cmax og AUC-verdier på en doseavhengig måte i forhold til administrering av hydrokodon alene; Cmax- og AUC-verdier er henholdsvis 3 % til 4 % lavere etter administrering av 125 mg NEURONTIN og 21 % til 22 % lavere, henholdsvis etter administrering av 500 mg NEURONTIN. Mekanismen for denne interaksjonen er ukjent. Hydrokodon øker AUC-verdiene for gabapentin med 14 %. Størrelsen på interaksjonen ved andre doser er ikke kjent.
Morfin
En litteraturartikkel rapporterte at når en 60 mg morfinkapsel med kontrollert frigivelse ble administrert 2 timer før en 600 mg NEURONTIN-kapsel (N=12), økte gjennomsnittlig AUC for gabapentin med 44 % sammenlignet med gabapentin administrert uten morfin. Farmakokinetiske parameterverdier for morfin ble ikke påvirket av administrering av NEURONTIN 2 timer etter morfin. Størrelsen på interaksjonen ved andre doser er ikke kjent.
Cimetidin
nærvær av cimetidin ved 300 mg fire ganger daglig (N=12), falt den gjennomsnittlige tilsynelatende orale clearance av gabapentin med 14 % og kreatininclearance falt med 10 %. Dermed så det ut til at cimetidin endret den renale utskillelsen av både gabapentin og kreatinin, en endogen markør for nyrefunksjon. Denne lille reduksjonen i utskillelse av gabapentin med cimetidin forventes ikke å være av klinisk betydning. Effekten av gabapentin på cimetidin ble ikke evaluert.
Oral prevensjon
Basert på AUC og halveringstid var flerdose-farmakokinetiske profiler for noretindron og etinyløstradiol etter administrering av tabletter som inneholder 2,5 mg noretindronacetat og 50 mcg etinyløstradiol lik med og uten samtidig administrering av gabapentin (400 mg tre ganger daglig; N=13). Cmax for noretindron var 13 % høyere når det ble administrert samtidig med gabapentin; denne interaksjonen forventes ikke å være av klinisk betydning.
Antacida (Maalox®) (aluminiumhydroksid, magnesiumhydroksid)
Antacida (Maalox®) som inneholder magnesium og aluminiumhydroksid reduserte gjennomsnittlig biotilgjengelighet av gabapentin (N=16) med ca. 20 %. Denne reduksjonen i biotilgjengelighet var ca. 10 % når gabapentin ble administrert 2 timer etter Maalox.
Probenecid
Probenecid er en blokkering av renal tubulær sekresjon. Gabapentins farmakokinetiske parametere uten og med probenecid var sammenlignbare. Dette indikerer at gabapentin ikke gjennomgår renal tubulær sekresjon av veien som er blokkert av probenecid.
Kliniske studier
Postherpetisk nevralgi
NEURONTIN ble evaluert for behandling av postherpetisk nevralgi (PHN) i to randomiserte, dobbeltblindede, placebokontrollerte, multisenterstudier. Intent-to-treat-populasjonen (ITT) besto av totalt 563 pasienter med smerte i mer enn 3 måneder etter tilheling av herpes zoster-hudutslettet (tabell 6).
TABELL 6. Kontrollerte PHN-studier: Varighet, doser og antall pasienter
Hver studie inkluderte en 7- eller 8-ukers dobbeltblind fase (3 eller 4 uker med titrering og 4 uker med fast dose). Pasienter startet behandling med titrering til maksimalt 900 mg/dag gabapentin over 3 dager. Dosene skulle deretter titreres i trinn på 600 til 1200 mg/dag med 3- til 7-dagers intervaller til måldosen over 3 til 4 uker. Pasienter registrerte smertene sine i en daglig dagbok ved å bruke en 11-punkts numerisk smerteskala som strekker seg fra 0 (ingen smerte) til 10 (verst mulig smerte). En gjennomsnittlig smertescore under baseline på minst 4 var nødvendig for randomisering. Analyser ble utført ved bruk av ITT-populasjonen (alle randomiserte pasienter som fikk minst én dose studiemedisin).
Begge studiene viste effekt sammenlignet med placebo ved alle testede doser.
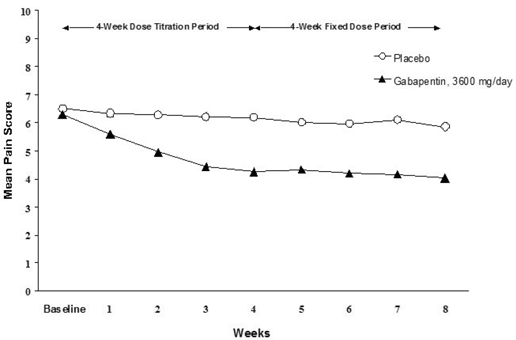
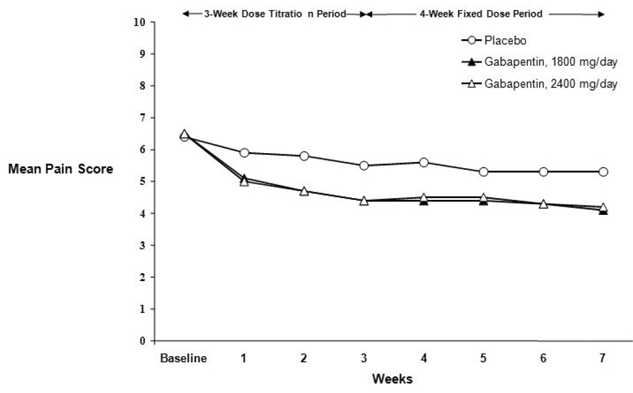
Reduksjonen i ukentlig gjennomsnittlig smerteskår ble sett ved uke 1 i begge studiene, og ble opprettholdt til slutten av behandlingen. Sammenlignbare behandlingseffekter ble observert i alle aktive behandlingsarmer. Farmakokinetisk/farmakodynamisk modellering ga bekreftende bevis på effekt på tvers av alle doser. Figur 1 og 2 viser smerteintensitetsscore over tid for studie 1 og 2.
Figur 1. Ukentlig gjennomsnittlig smertescore (observerte tilfeller i ITT-populasjon): Studie 1
Figur 2. Ukentlig gjennomsnittlig smertescore (observerte tilfeller i ITT-populasjon): Studie 2
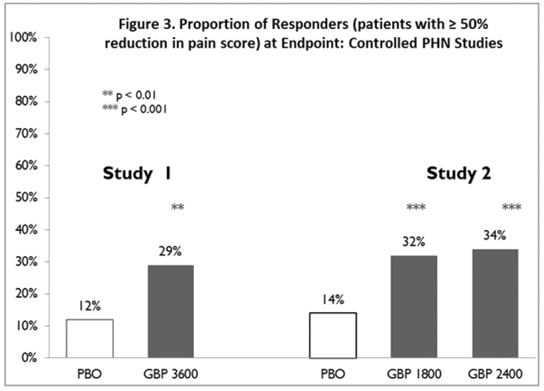
Andelen respondere (de pasientene som rapporterte minst 50 % forbedring i endepunktssmertescore sammenlignet med baseline) ble beregnet for hver studie (figur 3).
Figur 3. Andel av respondenter (pasienter med ≥50 % reduksjon i smerteskår) ved endepunkt: kontrollerte PHN-studier
Epilepsi for partielle anfall (tilleggsterapi)
Effektiviteten av NEURONTIN 400 mg som tilleggsbehandling (i tillegg til andre antiepileptika) ble fastslått i multisenter placebokontrollerte, dobbeltblindede, parallellgruppe kliniske studier hos voksne og pediatriske pasienter (3 år og eldre) med refraktære partielle anfall.
Bevis på effektivitet ble oppnådd i tre studier utført med 705 pasienter (12 år og eldre) og en studie utført med 247 pediatriske pasienter (3 til 12 år). Pasientene som ble registrert hadde en historie med minst 4 partielle anfall per måned til tross for at de fikk ett eller flere antiepileptika på terapeutiske nivåer og ble observert på deres etablerte antiepileptiske legemiddelregime i løpet av en 12-ukers baselineperiode (6 uker i studien av pediatrisk pasienter). Hos pasienter som fortsetter å ha minst 2 (eller 4 i noen studier) anfall per måned, ble NEURONTIN 300 mg eller placebo deretter lagt til den eksisterende behandlingen i løpet av en 12-ukers behandlingsperiode. Effektiviteten ble først og fremst vurdert på grunnlag av prosentandelen av pasienter med 50 % eller mer reduksjon i anfallsfrekvens fra baseline til behandling ("responderfrekvensen") og et avledet mål kalt responsratio, et mål på endring definert som (T - B)/(T + B), der B er pasientens baseline anfallsfrekvens og T er pasientens anfallsfrekvens under behandling. Responsforholdet er fordelt innenfor området -1 til +1. En nullverdi indikerer ingen endring mens fullstendig eliminering av anfall ville gi en verdi på -1; økte beslagsprosent ville gi positive verdier. En responsrate på -0,33 tilsvarer en 50 % reduksjon i anfallsfrekvens. Resultatene gitt nedenfor er for alle partielle anfall i intent-to-treat-populasjonen (alle pasienter som fikk noen behandlingsdoser) i hver studie, med mindre annet er angitt.
En studie sammenlignet NEURONTIN 1200 mg/dag, i tre delte doser med placebo. Svarfrekvensen var 23 % (14/61) i NEURONTIN 600 mg-gruppen og 9 % (6/66) i placebogruppen; forskjellen mellom gruppene var statistisk signifikant. Responsratio var også bedre i NEURONTIN-gruppen (-0,199) enn i placebogruppen (-0,044), en forskjell som også oppnådde statistisk signifikans.
En andre studie sammenlignet primært NEURONTIN 1200 mg/dag, i tre delte doser (N=101), med placebo (N=98). Ytterligere mindre NEURONTIN 300 mg doseringsgrupper (600 mg/dag, N=53; 1800 mg/dag, N=54) ble også studert for informasjon om doserespons. Svarfrekvensen var høyere i NEURONTIN 1200 mg/dag-gruppen (16 %) enn i placebogruppen (8 %), men forskjellen var ikke statistisk signifikant. Responsraten ved 600 mg (17 %) var heller ikke signifikant høyere enn hos placebo, men responderfrekvensen i 1800 mg-gruppen (26 %) var statistisk signifikant overlegen placebofrekvensen. Responsratioen var bedre i NEURONTIN 1200 mg/dag-gruppen (-0,103) enn i placebogruppen (-0,022); men denne forskjellen var heller ikke statistisk signifikant (p = 0,224). En bedre respons ble sett i NEURONTIN 600 mg/dag-gruppen (-0,105) og 1800 mg/dag-gruppen (-0,222) enn i 1200 mg/dag-gruppen, med 1800 mg/dag-gruppen som oppnådde statistisk signifikans sammenlignet med placebo gruppe.
En tredje studie sammenlignet NEURONTIN 900 mg/dag, i tre delte doser (N=111), og placebo (N=109). En ekstra NEURONTIN 1200 mg/dag doseringsgruppe (N=52) ga dose-responsdata. En statistisk signifikant forskjell i responsrate ble sett i NEURONTIN 900 mg/dag-gruppen (22 %) sammenlignet med den i placebogruppen (10 %). Responsratioen var også statistisk signifikant overlegen i NEURONTIN 900 mg/dag-gruppen (-0,119) sammenlignet med den i placebogruppen (-0,027), og det samme var responsratioen i 1200 mg/dag NEURONTIN (-0,184) sammenlignet med placebo.
Analyser ble også utført i hver studie for å undersøke effekten av NEURONTIN 300mg på forebygging av sekundært generaliserte tonisk-kloniske anfall. Pasienter som opplevde et sekundært generalisert tonisk-klonisk anfall enten i baseline eller i behandlingsperioden i alle de tre placebokontrollerte studiene, ble inkludert i disse analysene. Det var flere sammenligninger av responsratio som viste en statistisk signifikant fordel for NEURONTIN sammenlignet med placebo og gunstige trender for nesten alle sammenligninger.
Analyse av responderrate ved bruk av kombinerte data fra alle tre studiene og alle doser (N=162, NEURONTIN; N=89, placebo) viste også en signifikant fordel for NEURONTIN fremfor placebo ved å redusere frekvensen av sekundært generaliserte tonisk-kloniske anfall.
to av de tre kontrollerte studiene ble mer enn én dose NEURONTIN brukt. Innenfor hver studie viste ikke resultatene en konsekvent økt respons på dosen. Ser man imidlertid på tvers av studier, er en trend mot økende effekt med økende dose tydelig (se figur 4).
Figur 4. Responderfrekvens hos pasienter som får NEURONTIN 600 mg uttrykt som en forskjell fra placebo etter dose og studie: Studier med tilleggsterapi hos pasienter ≥12 år med partielle anfall
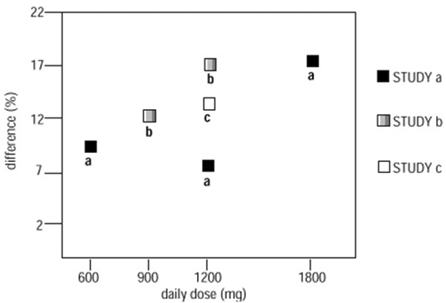
I figuren er behandlingseffektstørrelsen, målt på Y-aksen i form av forskjellen i andelen gabapentin og placebo-tildelte pasienter som oppnår en 50 % eller mer reduksjon i anfallsfrekvens fra baseline, plottet mot den daglige dosen av gabapentin administrert. (X-aksen).
Selv om ingen formell analyse etter kjønn er utført, indikerer estimater av respons (responsratio) utledet fra kliniske studier (398 menn, 307 kvinner) at det ikke eksisterer noen viktige kjønnsforskjeller. Det var ikke noe konsistent mønster som indikerte at alder hadde noen effekt på responsen på NEURONTIN. Det var utilstrekkelig antall pasienter av andre raser enn kaukasiske til å tillate en sammenligning av effekt blant rasegrupper.
En fjerde studie med pediatriske pasienter i alderen 3 til 12 år sammenlignet 25 –35 mg/kg/dag NEURONTIN (N=118) med placebo (N=127). For alle partielle anfall i intent-to-treat-populasjonen var responsratioen statistisk signifikant bedre for NEURONTIN-gruppen (-0,146) enn for placebogruppen (-0,079). For den samme populasjonen var responsraten for NEURONTIN (21 %) ikke signifikant forskjellig fra placebo (18 %).
En studie med pediatriske pasienter i alderen 1 måned til 3 år sammenlignet 40 mg/kg/dag NEURONTIN (N=38) med placebo (N=38) hos pasienter som fikk minst ett markedsført antiepileptika og hadde minst ett partielt anfall under screeningsperioden (innen 2 uker før baseline). Pasientene hadde opptil 48 timer med baseline og opptil 72 timer med dobbeltblind video EEG-overvåking for å registrere og telle forekomsten av anfall. Det var ingen statistisk signifikante forskjeller mellom behandlinger i verken responsraten eller responsraten.
PASIENTINFORMASJON
NEURONTIN (Neu ron' tin) (Gabapentin) Kapsler, tabletter og mikstur
Hva er den viktigste informasjonen jeg bør vite om NEURONTIN?
Ikke slutt å ta NEURONTIN 300mg uten først å snakke med helsepersonell.
Å stoppe NEURONTIN plutselig kan forårsake alvorlige problemer.
NEURONTIN 400mg kan forårsake alvorlige bivirkninger inkludert:
1. Selvmordstanker. Som andre antiepileptika, kan NEURONTIN 100 mg forårsake selvmordstanker eller -handlinger hos et svært lite antall mennesker, omtrent 1 av 500.
Ring en helsepersonell med en gang hvis du har noen av disse symptomene, spesielt hvis de er nye, verre eller bekymrer deg:
- . tanker om selvmord eller å dø . forsøk på å begå selvmord . ny eller verre depresjon . ny eller verre angst . føler seg urolig eller rastløs . panikk anfall . problemer med å sove (søvnløshet) . ny eller verre irritabilitet . opptrer aggressivt, er sint eller voldelig . handler på farlige impulser . en ekstrem økning i aktivitet og prat (mani) . andre uvanlige endringer i atferd eller humør
Hvordan kan jeg se etter tidlige symptomer på selvmordstanker og -handlinger?
- . Vær oppmerksom på eventuelle endringer, spesielt plutselige endringer, i humør, atferd, tanker eller følelser.
- . Hold alle oppfølgingsbesøk hos helsepersonell som planlagt.
Ring helsepersonell mellom besøkene etter behov, spesielt hvis du er bekymret for symptomer.
Ikke slutt å ta NEURONTIN uten først å snakke med en helsepersonell.
- . Å stoppe NEURONTIN 100mg plutselig kan forårsake alvorlige problemer. Å stoppe en anfallsmedisin plutselig hos en pasient som har epilepsi kan gi anfall som ikke stopper (status epilepticus). . Selvmordstanker eller -handlinger kan være forårsaket av andre ting enn medisiner. Hvis du har selvmordstanker eller selvmordshandlinger, kan helsepersonell se etter andre årsaker.
2. Endringer i atferd og tenkning - Bruk av NEURONTIN 100 mg hos barn i alderen 3 til 12 år kan forårsake følelsesmessige endringer, aggressiv atferd, problemer med konsentrasjon, rastløshet, endringer i skoleprestasjoner og hyperaktivitet.
3. NEURONTIN kan forårsake alvorlige eller livstruende allergiske reaksjoner som kan påvirke huden din eller andre deler av kroppen din, for eksempel leveren eller blodcellene. Dette kan føre til at du blir innlagt på sykehus eller slutter med NEURONTIN. Du kan ha eller ikke ha utslett med en allergisk reaksjon forårsaket av NEURONTIN. Ring en helsepersonell med en gang hvis du har noen av følgende symptomer:
- . hudutslett . utslett . pustevansker . feber . hovne kjertler som ikke går bort . hevelse i ansiktet, leppene, halsen eller tungen . gulfarging av huden din eller det hvite i øynene . uvanlige blåmerker eller blødninger . alvorlig tretthet eller svakhet . uventede muskelsmerter . hyppige infeksjoner
Disse symptomene kan være de første tegnene på en alvorlig reaksjon. En helsepersonell bør undersøke deg for å avgjøre om du skal fortsette å ta NEURONTIN.
4. Alvorlige pusteproblemer. Alvorlige pusteproblemer kan oppstå når NEURONTIN tas sammen med andre legemidler som kan forårsake alvorlig søvnighet eller redusert bevissthet, eller når det tas av noen som allerede har pusteproblemer. Se etter økt søvnighet eller redusert pust når du starter NEURONTIN 300 mg eller når dosen økes. Få hjelp med en gang hvis det oppstår pusteproblemer.
Hva er NEURONTIN 400mg?
NEURONTIN 400mg er et reseptbelagt legemiddel som brukes til å behandle:
- . Smerter fra skadede nerver (postherpetisk smerte) som følger tilheling av helvetesild (et smertefullt utslett som kommer etter en herpes zoster-infeksjon) hos voksne. . Delvise anfall når det tas sammen med andre legemidler hos voksne og barn 3 år og eldre med anfall.
Hvem bør ikke ta NEURONTIN?
Ikke bruk NEURONTIN hvis du er allergisk overfor gabapentin eller noen av de andre innholdsstoffene i NEURONTIN. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser i NEURONTIN.
Hva bør jeg fortelle helsepersonell før jeg tar NEURONTIN 300mg?
Før du tar NEURONTIN 400mg, fortell helsepersonell dersom du:
- . har eller har hatt nyreproblemer eller er på hemodialyse . har eller har hatt depresjon, humørproblemer eller selvmordstanker eller -adferd . har diabetes . har pusteproblemer . er gravid eller planlegger å bli gravid. Det er ikke kjent om NEURONTIN kan skade det ufødte barnet ditt. Fortell legen din med en gang hvis du blir gravid mens du tar NEURONTIN. Du og helsepersonell vil avgjøre om du skal ta NEURONTIN 100 mg mens du er gravid. Svangerskapsregister: Hvis du blir gravid mens du tar NEURONTIN, snakk med helsepersonell om registrering hos North American Antiepileptic Drug (NAAED) Pregnancy Registry. Formålet med dette registeret er å samle informasjon om sikkerheten til antiepileptika under graviditet. Du kan registrere deg i dette registeret ved å ringe 1-888-233-2334. . ammer eller planlegger å amme. NEURONTIN kan gå over i morsmelk. Du og helsepersonell bør bestemme hvordan du vil mate babyen din mens du tar NEURONTIN.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Fortell spesielt helsepersonell dersom du tar smertestillende opioidmedisiner (som oksykodon), medisiner mot angst (som lorazepam) eller søvnløshet (som zolpidem), eller medisiner som gjør deg søvnig.
Du kan ha større sjanse for svimmelhet, søvnighet eller pusteproblemer hvis disse medisinene tas sammen med NEURONTIN.
Å ta NEURONTIN 100 mg sammen med visse andre legemidler kan forårsake bivirkninger eller påvirke hvor godt de virker. Ikke start eller stopp andre medisiner uten å snakke med helsepersonell.
Kjenn til medisinene du tar. Hold en liste over dem og vis den til helsepersonell og apotek når du får en ny medisin.
Hvordan skal jeg ta NEURONTIN 400mg?
- . Ta NEURONTIN nøyaktig som foreskrevet. Helsepersonell vil fortelle deg hvor mye NEURONTIN 600mg du skal ta.
- . Ikke endre dosen av NEURONTIN uten å snakke med helsepersonell. . Hvis du tar NEURONTIN tabletter og bryter en tablett i to, bør den ubrukte halvdelen av tabletten tas ved neste planlagte dose. Halve tabletter som ikke er brukt innen 28 dager etter brudd skal kastes. . Ta NEURONTIN kapsler med vann.
Hva bør jeg unngå mens jeg tar NEURONTIN?
- . Ikke drikk alkohol eller ta andre medisiner som gjør deg trøtt eller svimmel mens du tar NEURONTIN uten først å snakke med helsepersonell. Å ta NEURONTIN 600mg sammen med alkohol eller medikamenter som forårsaker søvnighet eller svimmelhet kan gjøre søvnighet eller svimmelhet verre. . Ikke kjør bil, bruk tunge maskiner eller gjør andre farlige aktiviteter før du vet hvordan NEURONTIN 100mg påvirker deg. NEURONTIN 600mg kan bremse din tenkning og motoriske ferdigheter.
Hva er de mulige bivirkningene av NEURONTIN 300mg?
NEURONTIN 100mg kan forårsake alvorlige bivirkninger inkludert:
Se "Hva er den viktigste informasjonen jeg bør vite om NEURONTIN?"
- . problemer med å kjøre mens du bruker NEURONTIN. Se "Hva jeg bør unngå mens jeg tar Neurontin 600mg?" . søvnighet og svimmelhet, som kan øke forekomsten av utilsiktet skade, inkludert fall . De vanligste bivirkningene av NEURONTIN 100mg inkluderer:
- . mangel på koordinering . virusinfeksjon . føler seg døsig . kvalme og oppkast . problemer med å snakke . skjelving . hevelse, vanligvis i ben og føtter . føler seg sliten . feber . rykkende bevegelser . problemer med koordinering . dobbeltsyn . uvanlige øyebevegelser
Fortell helsepersonell dersom du har noen bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av NEURONTIN. For mer informasjon, spør helsepersonell eller apotek.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare NEURONTIN?
- . Oppbevar NEURONTIN 400 mg kapsler og tabletter mellom 20 °C til 25 °C. . Oppbevar NEURONTIN 400 mg mikstur i kjøleskapet mellom 2 °C og 8 °C (36 °F til 46 °F).
Oppbevar NEURONTIN 600mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av NEURONTIN
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk NEURONTIN 300mg for en tilstand det ikke er foreskrevet for. Ikke gi NEURONTIN til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Denne medisinguiden oppsummerer den viktigste informasjonen om NEURONTIN. Hvis du vil ha mer informasjon, snakk med helsepersonell. Du kan spørre helsepersonell eller apotek om informasjon om NEURONTIN 100mg som er skrevet for helsepersonell.
For mer informasjon gå til http://www.pfizer.com eller ring 1-800-438-1985.
Hva er ingrediensene i NEURONTIN 400mg?
Aktiv ingrediens: gabapentin
Inaktive ingredienser i kapslene: laktose, maisstivelse, talkum, gelatin, titandioksid og FD&C Blue No. 2.
Kapselskallet på 300 mg inneholder også: gult jernoksid.
Kapselskallet på 400 mg inneholder også: rødt jernoksid og gult jernoksid.
Inaktive ingredienser i tablettene: poloxamer 407, copovidon, maisstivelse, magnesiumstearat, hydroksypropylcellulose, talkum og candelillavoks
Inaktive ingredienser i mikstur: glyserin, xylitol, renset vann og kunstig smak.
Denne medisinveiledningen er godkjent av US Food and Drug Administration.
