Smertelindring legemidler: Lioresal 10mg, 25mg Baclofen Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Lioresal 10mg Intrathecal og hvordan brukes det?
Lioresal Intrathecal er en reseptbelagt medisin som brukes til å behandle symptomene på spastisitet. Lioresal Intrathecal kan brukes alene eller sammen med andre medisiner.
Lioresal Intrathecal tilhører en klasse legemidler som kalles skjelettmuskelavslappende midler.
Det er ikke kjent om Lioresal Intrathecal er trygt og effektivt hos barn under 12 år.
Hva er de mulige bivirkningene av Lioresal 25mg Intrathecal?
Lioresal 10mg Intrathecal kan forårsake alvorlige bivirkninger inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . alvorlig døsighet, . svak eller grunn pust, . forvirring, . hallusinasjoner, . kløe, prikking eller rykninger i hender, armer, føtter eller ben, . feber, og . anfall
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Lioresal 25mg Intrathecal inkluderer:
- . døsighet, . svimmelhet, . svakhet, . tretthet, . hodepine, . søvnproblemer (søvnløshet), . kvalme, . forstoppelse, og . tisser oftere enn vanlig
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Lioresal Intrathecal. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Brå seponering av intratekal baklofen, uavhengig av årsak, har resultert i følgetilstander som inkluderer høy feber, endret mental status, overdreven rebound spastisitet og muskelstivhet, som i sjeldne tilfeller har utviklet seg til rabdomyolyse, multippel organsystemsvikt og død.
Forebygging av brå seponering av intratekal baklofen krever nøye oppmerksomhet til programmering og overvåking av infusjonssystemet, påfyllingsplanlegging og prosedyrer og pumpealarmer. Pasienter og omsorgspersoner bør informeres om viktigheten av å holde planlagte påfyllingsbesøk og bør informeres om de tidlige symptomene på baklofenabstinens. Spesiell oppmerksomhet bør gis til pasienter med tilsynelatende risiko (f.eks. ryggmargsskader ved T-6 eller høyere, kommunikasjonsvansker, anamnese med abstinenssymptomer fra oral eller intratekal baklofen). Se den tekniske håndboken til det implanterbare infusjonssystemet for ytterligere informasjon om postimplantatklinikker og pasient (se ADVARSLER ).
BESKRIVELSE
LIORESAL INTRATHECAL (baklofen-injeksjon) er et muskelavslappende og antispastisk middel. Dens kjemiske navn er 4-amino-3-(4-klorfenyl) butansyre, og dens strukturformel er:
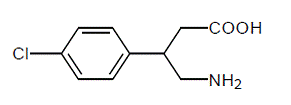
Baklofen er et hvitt til off-white, luktfritt eller praktisk talt luktfritt krystallinsk pulver, med en molekylvekt på 213,66. Det er litt løselig i vann, veldig lite løselig i metanol og uløselig i kloroform.
LIORESAL INTRATHECAL er en steril, pyrogenfri, isotonisk løsning fri for antioksidanter, konserveringsmidler eller andre potensielt nevrotoksiske tilsetningsstoffer kun indisert for intratekal administrering. Legemidlet er stabilt i oppløsning ved 37°C og kompatibelt med CSF. Hver milliliter LIORESAL INTRATHECAL inneholder baklofen USP 50 mcg, 500 mcg eller 2000 mcg og natriumklorid 9 mg i vann til injeksjon; pH-området er 5,0 - 7,0. Hver ampulle er kun beregnet for ENKELBRUK. Kast ubrukt del. IKKE AUTOKLAVE.
INDIKASJONER
LIORESAL 10mg INTRATHECAL (baklofeninjeksjon) er indisert for bruk ved behandling av alvorlig spastisitet. Pasienter bør først respondere på en screeningsdose av intratekal baklofen før de vurderes for langtidsinfusjon via en implanterbar pumpe. For spastisitet av ryggmargsopprinnelse, bør kronisk infusjon av LIORESAL INTRATHECAL via en implanterbar pumpe reserveres til pasienter som ikke reagerer på oral baklofenbehandling, eller de som opplever utålelige CNS-bivirkninger ved effektive doser. Pasienter med spastisitet på grunn av traumatisk hjerneskade bør vente minst ett år etter skaden før langvarig intratekal baklofenbehandling vurderes. LIORESAL INTRATHECAL er beregnet for bruk intratekal i enkeltbolustestdoser (via spinalkateter eller lumbalpunksjon) og, for kronisk bruk, kun i implanterbare pumper godkjent av FDA spesifikt for administrering av LIORESAL INTRATHECAL i det intratekale rommet.
Spastisitet av ryggmargsopprinnelse
Bevis som støtter effekten av LIORESAL INTRATHECAL ble oppnådd i randomiserte, kontrollerte undersøkelser som sammenlignet effekten av enten en enkelt intratekal dose eller en tre dagers intratekal infusjon av LIORESAL INTRATHECAL med placebo hos pasienter med alvorlig spastisitet og spasmer på grunn av enten ryggmargstraumer eller multiple sklerose. LIORESAL 10 mg INTRATHECAL var overlegen placebo på begge de viktigste utfallsmålene som ble brukt: endring fra baseline i Ashworth-vurderingen av spastisitet og frekvensen av spasmer.
Spastisitet av cerebral opprinnelse
Effekten av LIORESAL INTRATHECAL ble undersøkt i tre kontrollerte kliniske studier; to påmeldte pasienter med cerebral parese og en påmeldte pasienter med spastisitet på grunn av tidligere hjerneskade. Den første studien, en randomisert kontrollert cross-over studie av 51 pasienter med cerebral parese, ga sterke, statistisk signifikante resultater; LIORESAL INTRATHECAL var overlegen placebo når det gjaldt å redusere spastisitet målt ved Ashworth-skalaen. En andre cross-over-studie ble utført på 11 pasienter med spastisitet som følge av hjerneskade. Til tross for den lille prøvestørrelsen, ga studien en nesten signifikant teststatistikk (p= 0,066) og ga retningsmessig gunstige resultater. Den siste studien ga imidlertid ikke data som kunne analyseres pålitelig.
LIORESAL 10mg INTRATEKAL terapi kan betraktes som et alternativ til destruktive nevrokirurgiske prosedyrer. Før implantasjon av en enhet for kronisk intratekal infusjon av LIORESAL 10mg INTRATHECAL, må pasienter vise respons på LIORESAL 10mg INTRATHECAL i en screeningstudie (se DOSERING OG ADMINISTRASJON ).
DOSERING OG ADMINISTRASJON
Se produsentens håndbok for den implanterbare pumpen som er godkjent for intratekal infusjon for spesifikke instruksjoner og forholdsregler for programmering av pumpen og/eller etterfylling av reservoaret. Det finnes ulike pumper med varierende reservoarvolum og det finnes ulike påfyllingssett tilgjengelig. Det er viktig å være kjent med alle disse produktene for å velge riktig påfyllingssett for den aktuelle pumpen.
Screeningsfase
Før pumpeimplantasjon og initiering av kronisk infusjon av LIORESAL INTRATHECAL (baklofeninjeksjon), må pasienter demonstrere en positiv klinisk respons på en LIORESAL INTRATHECAL bolusdose administrert intratekalt i en screeningstudie. Screeningstudien bruker LIORESAL INTRATHECAL i en konsentrasjon på 50 mcg/ml. En 1 mL ampulle (50 mcg/mL) er tilgjengelig for bruk i screeningforsøket. Screeningsprosedyren er som følger. En initial bolus som inneholder 50 mikrogram i et volum på 1 milliliter administreres i det intratekale rommet ved hjelp av barbotasje over en periode på ikke mindre enn ett minutt. Pasienten observeres i løpet av de påfølgende 4 til 8 timer. En positiv respons består av en signifikant reduksjon i muskeltonus og/eller hyppighet og/eller alvorlighetsgrad av spasmer. Hvis den initiale responsen er mindre enn ønsket, kan en andre bolusinjeksjon gis 24 timer etter den første. Den andre screeningsbolusdosen består av 75 mikrogram i 1,5 milliliter. Igjen bør pasienten observeres i et intervall på 4 til 8 timer. Hvis responsen fortsatt er utilstrekkelig, kan en siste bolusscreeningsdose på 100 mikrogram i 2 milliliter gis 24 timer senere.
Pediatriske pasienter
Startdosen for screening for pediatriske pasienter er den samme som for voksne pasienter, dvs. 50 mcg. For svært små pasienter kan imidlertid en screeningsdose på 25 mcg prøves først. Pasienter som ikke responderer på en 100 mcg intratekal bolus bør ikke betraktes som kandidater for en implantert pumpe for kronisk infusjon.
Post-implantat dosetitreringsperiode
For å bestemme den initiale totale daglige dosen av LIORESAL INTRATHECAL etter implantasjon, bør screeningsdosen som ga positiv effekt dobles og administreres over en 24-timers periode, med mindre effekten av bolusdosen ble opprettholdt i mer enn 8 timer, hvor I tilfelle den daglige startdosen bør være screeningsdosen gitt over en 24-timers periode. Ingen doseøkninger skal gis i løpet av de første 24 timene (dvs. inntil steady state er oppnådd).
Voksne pasienter med spastisitet av ryggmargsopprinnelse
Etter de første 24 timene, for voksne pasienter, bør den daglige dosen økes sakte med 10-30 % trinn og kun én gang hver 24. time, inntil ønsket klinisk effekt er oppnådd.
Voksne pasienter med spastisitet av cerebral opprinnelse
Etter de første 24 timene bør den daglige dosen økes sakte med 5-15 % kun én gang hver 24. time, inntil ønsket klinisk effekt er oppnådd.
Pediatriske pasienter
Etter de første 24 timene bør den daglige dosen økes sakte med 5-15 % kun én gang hver 24. time, inntil ønsket klinisk effekt er oppnådd. Hvis det ikke er en reell klinisk respons på økninger i den daglige dosen, sjekk for riktig pumpefunksjon og kateter åpenhet. Pasienter må overvåkes nøye i et fullt utstyrt og bemannet miljø under screeningsfasen og dosetitreringsperioden umiddelbart etter implantasjon. Gjenopplivningsutstyr bør være umiddelbart tilgjengelig for bruk i tilfelle livstruende eller utålelige bivirkninger.
Vedlikeholdsterapi
Spastisitet hos pasienter med ryggmargsopprinnelse
Det kliniske målet er å opprettholde muskeltonus så nær normal som mulig, og å minimere hyppigheten og alvorlighetsgraden av spasmer i den grad det er mulig, uten å indusere utålelige bivirkninger. Svært ofte må vedlikeholdsdosen justeres i løpet av de første månedene av behandlingen mens pasientene tilpasser seg endringer i livsstil på grunn av lindring av spastisitet. Ved periodiske påfyllinger av pumpen kan den daglige dosen økes med 10-40 %, men ikke mer enn 40 %, for å opprettholde tilstrekkelig symptomkontroll. Den daglige dosen kan reduseres med 10-20 % dersom pasienter opplever bivirkninger. De fleste pasienter krever gradvis økning i dose over tid for å opprettholde optimal respons under kronisk behandling. Et plutselig stort behov for doseeskalering antyder en kateterkomplikasjon (dvs. kateterknekk eller løsrivelse).
Vedlikeholdsdosering for langvarig kontinuerlig infusjon av LIORESAL 10 mg INTRATHECAL (baklofeninjeksjon) har variert fra 12 mikrogram/dag til 2003 mikrogram/dag, med de fleste pasienter tilstrekkelig vedlikeholdt på 300 mikrogram til 800 mikrogram per dag. Det er begrenset erfaring med daglige doser større enn 1000 mcg/dag. Bestemmelse av den optimale dosen LIORESAL INTRATEKAL krever individuell titrering. Den laveste dosen med optimal respons bør brukes.
Spastisitet hos pasienter med cerebral opprinnelse
Det kliniske målet er å opprettholde muskeltonus så nær normal som mulig og å minimere hyppigheten og alvorlighetsgraden av spasmer i den grad det er mulig, uten å indusere utålelige bivirkninger, eller å titrere dosen til ønsket grad av muskeltonus for optimale funksjoner. Svært ofte må vedlikeholdsdosen justeres i løpet av de første månedene av behandlingen mens pasientene tilpasser seg endringer i livsstil på grunn av lindring av spastisitet. Ved periodisk etterfylling av pumpen kan den daglige dosen økes med 5-20 %, men ikke mer enn 20 %, for å opprettholde tilstrekkelig symptomkontroll. Den daglige dosen kan reduseres med 10-20 % dersom pasienter opplever bivirkninger. Mange pasienter krever gradvis økning i dose over tid for å opprettholde optimal respons under kronisk behandling. Et plutselig stort behov for doseeskalering antyder en kateterkomplikasjon (dvs. kateterknekk eller løsrivelse).
Vedlikeholdsdosering for langvarig kontinuerlig infusjon av LIORESAL 25 mg INTRATHECAL (baklofeninjeksjon) har variert fra 22 mikrogram/dag til 1400 mikrogram/dag, med de fleste pasienter tilstrekkelig vedlikeholdt på 90 mikrogram til 703 mikrogram per dag. I kliniske studier trengte bare 3 av 150 pasienter daglige doser større enn 1000 mcg/dag.
Pediatriske pasienter
Bruk samme doseringsanbefalinger for pasienter med spastisitet av cerebral opprinnelse. Pediatriske pasienter under 12 år så ut til å trenge en lavere daglig dose i kliniske studier. Gjennomsnittlig daglig dose for pasienter under 12 år var 274 mcg/dag, med et område på 24 til 1199 mcg/dag. Dosekravet for pediatriske pasienter over 12 år ser ikke ut til å være forskjellig fra det for voksne pasienter. Bestemmelse av den optimale dosen LIORESAL INTRATEKAL krever individuell titrering. Den laveste dosen med optimal respons bør brukes.
Potensielt behov for dosejusteringer ved kronisk bruk
Under langtidsbehandling blir omtrent 5 % (28/627) av pasientene refraktære overfor økende doser. Det er ikke tilstrekkelig erfaring til å gi klare anbefalinger for toleransebehandling; Imidlertid har denne "toleransen" av og til blitt behandlet på sykehus med en "medikamentferie" bestående av gradvis reduksjon av LIORESAL 25 mg INTRATHECAL over en 2 til 4 ukers periode og bytte til alternative metoder for spastisitetsbehandling. Etter "medikamentferien" kan LIORESAL INTRATHECAL startes på nytt ved den første kontinuerlige infusjonsdosen.
Stabilitet
Parenterale legemidler bør inspiseres for partikler og misfarging før administrering, når oppløsning og beholder tillater det.
Leveringsspesifikasjoner
Den spesifikke konsentrasjonen som skal brukes avhenger av den totale daglige dosen som kreves, samt pumpens leveringshastighet. LIORESAL 10mg INTRATHECAL kan kreve fortynning når det brukes med visse implanterbare pumper. Se produsentens håndbok for spesifikke anbefalinger.
Forberedelsesinstruksjon
Screening
Bruk kun 1 mL screening-ampullen (50 mcg/ml) for bolusinjeksjon i subaraknoidalrommet. For en 50 mcg bolusdose, bruk 1 ml av screeningampullen. Bruk 1,5 mL 50 mcg/ml baklofen-injeksjon for en 75 mcg bolusdose. For maksimal screeningsdose på 100 mcg, bruk 2 mL 50 mcg/ml baklofeninjeksjon (2 screeningampuller).
Vedlikehold
For pasienter som trenger andre konsentrasjoner enn 500 mcg/ml eller 2000 mcg/ml, LIORESAL INTRATHECAL må fortynnes .
LIORESAL 10mg INTRATEKAL må fortynnes med sterilt konserveringsmiddelfritt natriumklorid for injeksjon, USP
Leveringsregime
LIORESAL 10mg INTRATHECAL administreres oftest i en kontinuerlig infusjonsmodus umiddelbart etter implantasjon. For pasienter implantert med programmerbare pumper som har oppnådd relativt tilfredsstillende kontroll ved kontinuerlig infusjon, kan ytterligere fordeler oppnås ved å bruke mer komplekse tidsplaner for LIORESAL INTRATHECAL-tilførsel. For eksempel kan pasienter som har økte spasmer om natten kreve en 20 % økning i timeinfusjonshastigheten. Endringer i strømningshastighet bør programmeres til å starte to timer før tidspunktet for ønsket klinisk effekt.
HVORDAN LEVERES
LIORESAL INTRATHECAL (baklofen injeksjon) er pakket i engangsampuller som inneholder 0,05 mg/1 mL (50 mcg/ml), 10 mg/20 mL (500 mcg/mL), 10 mg/5 mL (2000 mcg/mL) eller 40 mg/20 mL ( 2000 mcg/mL) leveres som følger:
Screeningsdose (modell 8563s): fem ampuller som hver inneholder 0,05 mg/1 ml (50 mcg/ml) ( NDC 70257-562-55).
LIORESAL INTRATHECAL (baklofen-injeksjon) påfyllingssett Hvert påfyllingssett inkluderer den angitte mengden LIORESAL INTRATHECAL, et medikamentforberedelsesett, et pumpepåfyllingssett med tilbehør som er kompatibelt med Medtronic SynchroMed® infusjonssystemer, og tilhørende instruksjoner.
Modell 8561 : én ampulle som inneholder 10 mg/20 mL (500 mcg/mL) ( NDC 70257-560-01).
Modell 8562 : to ampuller, hver inneholder 10 mg/5 mL (2000 mcg/mL) ( NDC 70257-561-02).
Modell 8564 : én ampulle som inneholder 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-01).
Modell 8565 : to ampuller, hver inneholder 10 mg/20 ml (500 mcg/ml) ( NDC 70257-560-02).
Modell 8566 : to ampuller, hver inneholder 40 mg/20 ml (2000 mcg/ml) ( NDC 70257-563-02).
Oppbevaring
Krever ikke nedkjøling.
Oppbevares ikke over 30°C (86°F).
Må ikke fryses.
Ikke varmesteriliser.
Distribuert av: Saol Therapeutics Inc. Saol Therapeutics Inc., Roswell, GA 30076. Revidert: Jan 2019
BIVIRKNINGER
Spastisitet av ryggmargsopprinnelse - kliniske studier
Ofte observert hos pasienter med spastisitet av spinal opprinnelse
I kliniske studier før og etter markedsføring var de vanligst observerte bivirkningene assosiert med bruk av LIORESAL 25 mg INTRATHECAL (baklofeninjeksjon) som ikke ble sett med en tilsvarende forekomst blant placebobehandlede pasienter: somnolens, svimmelhet, kvalme, hypotensjon, hodepine, kramper og hypotoni.
Assosiert med seponering av behandling
8/474 pasienter med spastisitet av ryggmargsopprinnelse som fikk langtidsinfusjon av LIORESAL 25 mg INTRATHECAL i kliniske studier før og etter markedsføring i USA, avbrøt behandlingen på grunn av bivirkninger. Disse inkluderer: pumpelommeinfeksjoner (3), meningitt (2), såravfall (1), gynekologiske fibromer (1) og pumpeovertrykk (1) med ukjente, om noen, følgetilstander. Elleve pasienter som utviklet koma sekundært til overdose fikk behandlingen midlertidig suspendert, men alle ble deretter startet på nytt og ble derfor ikke ansett for å være reelle seponeringer.
Dødsfall
Se ADVARSLER .
Forekomst i kontrollerte forsøk
Erfaring med LIORESAL INTRATHECAL (baklofen-injeksjon) oppnådd i parallelle, placebokontrollerte, randomiserte studier gir bare et begrenset grunnlag for å estimere forekomsten av uønskede hendelser fordi studiene var av svært kort varighet (opptil tre dager med infusjon) og involverte kun en totalt 63 pasienter. Følgende hendelser inntraff blant de 31 pasientene som fikk LIORESAL INTRATHECAL (baklofeninjeksjon) i to randomiserte, placebokontrollerte studier: hypotensjon (2), svimmelhet (2), hodepine (2), dyspné (1). Ingen bivirkninger ble rapportert blant de 32 pasientene som fikk placebo i disse studiene.
Hendelser observert under evalueringen av LIORESAL INTRATHECAL før og etter markedsføring
Bivirkninger assosiert med bruk av LIORESAL 25 mg INTRATHECAL reflekterer erfaring oppnådd med 576 pasienter som ble fulgt prospektivt i USA. De fikk LIORESAL INTRATHECAL i perioder på én dag (screening) (N = 576) til over åtte år (vedlikehold) (N = 10). Den vanlige screeningsbolusdosen administrert før pumpeimplantasjon i disse studiene var typisk 50 mcg. Vedlikeholdsdosen varierte fra 12 mcg til 2003 mcg per dag. På grunn av opplevelsens åpne, ukontrollerte natur, kan en årsakssammenheng mellom observerte hendelser og administrering av LIORESAL INTRATHECAL ikke vurderes pålitelig i mange tilfeller, og mange av de rapporterte bivirkningene er kjent for å oppstå i forbindelse med de underliggende tilstandene som behandles. Ikke desto mindre ser mange av de mer vanlig rapporterte reaksjonene - hypotoni, somnolens, svimmelhet, parestesi, kvalme/oppkast og hodepine - klart ut som medikamentrelaterte.
Bivirkninger rapportert under alle amerikanske studier (både kontrollerte og ukontrollerte) er vist i følgende tabell. Åtte av 474 pasienter som fikk kronisk infusjon via implanterte pumper, hadde bivirkninger som førte til seponering av langtidsbehandling i pre- og post-markedsføringsstudiene.
FOREKOMST AV FYKSTE (≥1 %) BIVIRKNINGER HOS PASIENTER MED SPASTISITET AV RYGGERBARHET I PROSPEKTIVT OVERVÅKTE KLINISKE FORSØK
I tillegg til de mer vanlige (1 % eller flere) bivirkningene rapportert hos de prospektivt fulgte 576 innenlandske pasientene i studier før og etter markedsføring, har erfaring fra ytterligere 194 pasienter eksponert for LIORESAL 25 mg INTRATHECAL (baklofen-injeksjon) fra utenlandske studier. blitt rapportert. Følgende uønskede hendelser, som ikke er beskrevet i tabellen, og ordnet i avtagende frekvens, og klassifisert etter kroppssystem, ble rapportert:
Nervesystemet: Unormal gange, tenkning unormalt, skjelving, hukommelsestap, rykninger, vasodilitasjon, cerebrovaskulær ulykke, nystagmus, personlighetsforstyrrelse, psykotisk depresjon, cerebral iskemi, emosjonell labilitet, eufori, hypertoni, ileus, medikamentavhengighet, inkoordinasjon, paranoid reaksjon og ptose.
Fordøyelsessystemet: Flatulens, dysfagi, dyspepsi og gastroenteritt.
Kardiovaskulær: Postural hypotensjon, bradykardi, hjertebank, synkope, ventrikulær arytmi, dyp tromboflebitt, blekhet og takykardi.
Luftveiene: Luftveisforstyrrelser, aspirasjonspneumoni, hyperventilering, lungeemboli og rhinitt.
Urogenital: Hematuri og nyresvikt.
Hud og vedheng: Alopecia og svette.
Metabolske og ernæringsforstyrrelser: Vekttap, albuminuri, dehydrering og hyperglykemi.
Spesielle sanser: Unormalt syn, unormal akkommodasjon, fotofobi, smakstap og tinnitus.
Kroppen som helhet: Selvmord, manglende medikamentell effekt, magesmerter, hypotermi, nakkestivhet, brystsmerter, frysninger, ansiktsødem, influensasyndrom og overdose.
Hemisk og lymfesystem: Anemi.
Spastisitet av cerebral opprinnelse - kliniske studier
Vanlig observert
I kliniske studier før markedsføring, inkluderte de vanligst observerte bivirkningene assosiert med bruk av LIORESAL 25 mg INTRATHECAL (baklofeninjeksjon) som ikke ble sett med en tilsvarende forekomst blant placebobehandlede pasienter: agitasjon, forstoppelse, somnolens, leukocytose, frysninger, urinveier. retensjon og hypotoni.
Assosiert med seponering av behandling
Ni av 211 pasienter som fikk LIORESAL INTRATHECAL i kliniske studier før markedsføring i USA, avbrøt langtidsinfusjon på grunn av bivirkninger forbundet med intratekal behandling.
De ni bivirkningene som førte til seponering var: infeksjon (3), CSF-lekkasjer (2), meningitt (2), drenering (1) og uhåndterlig trunkkontroll (1).
Dødsfall
Tre dødsfall, hvorav ingen ble tilskrevet LIORESAL 10 mg INTRATHECAL, ble rapportert hos pasienter i kliniske studier som involverte pasienter med spastisitet av cerebral opprinnelse. Se Advarsler om andre dødsfall rapportert hos pasienter med spinal spastisitet .
Forekomst i kontrollerte forsøk
Erfaring med LIORESAL INTRATHECAL (baklofen-injeksjon) oppnådd i parallelle, placebokontrollerte, randomiserte studier gir kun et begrenset grunnlag for å estimere forekomsten av uønskede hendelser fordi studiene involverte totalt 62 pasienter eksponert for en enkelt 50 mikrogram intratekal bolus. Følgende hendelser skjedde blant de 62 pasientene som fikk LIORESAL 10 mg INTRATHECAL i to randomiserte, placebokontrollerte studier som involverte henholdsvis cerebral parese og hodeskadepasienter: agitasjon, forstoppelse, somnolens, leukocytose, kvalme, oppkast, nystagmus, urinretensjon, kulde. hypotoni.
Hendelser observert under evalueringen av LIORESAL 25mg INTRATHECAL før markedsføring
Bivirkninger assosiert med bruk av LIORESAL INTRATHECAL gjenspeiler erfaring oppnådd med totalt 211 amerikanske pasienter med spastisitet av cerebral opprinnelse, hvorav 112 var pediatriske pasienter (under 16 år ved registrering). De fikk LIORESAL INTRATHECAL i perioder på én dag (screening) (N= 211) til 84 måneder (vedlikehold) (N= 1). Den vanlige screeningsbolusdosen administrert før pumpeimplantasjon i disse studiene var 50-75 mikrogram. Vedlikeholdsdosen varierte fra 22 mcg til 1400 mcg per dag. Doser brukt i denne pasientpopulasjonen for langtidsinfusjon er generelt lavere enn de som kreves for pasienter med spastisitet av ryggmargsopprinnelse.
På grunn av opplevelsens åpne, ukontrollerte natur, kan en årsakssammenheng mellom observerte hendelser og administrering av LIORESAL INTRATHECAL ikke vurderes pålitelig i mange tilfeller. Ikke desto mindre ser mange av de mer vanlig rapporterte reaksjonene - somnolens, svimmelhet, hodepine, kvalme, hypotensjon, hypotoni og koma - klart ut medikamentrelaterte.
De hyppigste (≥1%) bivirkningene rapportert under alle kliniske studier er vist i følgende tabell. Ni pasienter avbrøt langtidsbehandling på grunn av uønskede hendelser.
FOREKOMST AV FYKSTE (≥ 1 %) BIVIRKNINGER HOS PASIENTER MED SPASTISITET AV CEREBRAL OPPRINNELSE I PROSPEKTIVT OVERVÅKTE KLINISKE FORSØK
De mer vanlige (1 % eller flere) bivirkningene rapportert hos de prospektivt fulgte 211 pasientene eksponert for LIORESAL 25 mg INTRATHECAL (baklofeninjeksjon) er rapportert. I den totale kohorten ble følgende uønskede hendelser, som ikke er beskrevet i tabellen, og ordnet i fallende frekvens og klassifisert etter kroppssystem, rapportert:
Nervesystemet: Akatisi, ataksi, forvirring, depresjon, opisthotonos, hukommelsestap, angst, hallusinasjoner, hysteri, søvnløshet, nystagmus, personlighetsforstyrrelse, reduserte reflekser og vasodilitasjon.
Fordøyelsessystemet: Dysfagi, fekal inkontinens, gastrointestinal blødning og tungelidelse.
Kardiovaskulær: Bradykardi.
Luftveiene: Apné, dyspné og hyperventilering.
Urogenital: Unormal ejakulasjon, nyresten, oliguri og vaginitt.
Hud og vedheng: Utslett, svette, alopecia, kontakteksem og hudsår.
Spesielle sanser: Unormal innkvartering.
Kroppen som helhet: Dødsfall, feber, magesmerter, karsinom, ubehag og hypotermi.
Hemisk og lymfesystem: Leukocytose og petechialt utslett.
Postmarketing-erfaring
Følgende bivirkninger er rapportert under bruk av LIORESAL INTRATHECAL etter godkjenning. Fordi disse hendelsene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke mulig å pålitelig estimere frekvensen.
Muskuloskeletal
Utbruddet av skoliose eller forverring av en allerede eksisterende skoliose er rapportert.
Urogenital
Seksuell dysfunksjon hos menn og kvinner, inkludert nedsatt libido og orgasmedysfunksjon, er rapportert. Erektil dysfunksjon hos menn er også rapportert. Priapisme er rapportert etter uttak av baklofen.
NARKOTIKAHANDEL
Det er utilstrekkelig systematisk erfaring med bruk av LIORESAL INTRATHECAL i kombinasjon med andre medisiner for å forutsi spesifikke legemiddelinteraksjoner. Interaksjoner som tilskrives kombinert bruk av LIORESAL INTRATHECAL og epidural morfin inkluderer hypotensjon og dyspné.
ADVARSLER
LIORESAL INTRATHECAL er til bruk i enkeltbolus intratekale injeksjoner (via et kateter plassert i det lumbale intratekale rommet eller injeksjon ved lumbalpunksjon) og i implanterbare pumper godkjent av FDA spesielt for intratekal administrering av baklofen. På grunn av muligheten for potensielt livstruende CNS-depresjon, kardiovaskulær kollaps og/eller respirasjonssvikt, må leger være tilstrekkelig opplært og utdannet i kronisk intratekal infusjonsbehandling.
Pumpesystemet skal ikke implanteres før pasientens respons på bolus LIORESAL 10 mg INTRATHECAL-injeksjon er tilstrekkelig evaluert. Evaluering (bestående av en screeningprosedyre: se DOSERING OG ADMINISTRASJON krever at LIORESAL 25mg INTRATHECAL administreres inn i det intratekale rommet via et kateter eller lumbalpunksjon. På grunn av risikoen forbundet med screeningsprosedyren og justeringen av dosen etter pumpeimplantasjon, må disse fasene utføres i et medisinsk overvåket og tilstrekkelig utstyrt miljø i henhold til instruksjonene skissert i avsnittet Dosering og administrasjon.
Gjenopplivningsutstyr skal være tilgjengelig.
Etter kirurgisk implantasjon av pumpen, spesielt i de innledende fasene av pumpebruk, bør pasienten overvåkes nøye inntil det er sikkert at pasientens respons på infusjonen er akseptabel og rimelig stabil.
Hver gang pumpens doseringshastighet og/eller konsentrasjonen av LIORESAL INTRATHECAL (baklofen-injeksjon) i reservoaret justeres, kreves tett medisinsk overvåking inntil det er sikkert at pasientens respons på infusjonen er akseptabel og rimelig stabil.
Det er obligatorisk at pasienten, alle pasientomsorgspersoner og legene som er ansvarlige for pasienten får tilstrekkelig informasjon om risikoen ved denne behandlingsmåten. Alt medisinsk personell og omsorgspersoner bør instrueres i 1) tegn og symptomer på overdosering, 2) prosedyrer som skal følges ved overdosering og 3) riktig hjemmepleie av pumpen og innføringsstedet.
Overdose
Tegn på overdose kan dukke opp plutselig eller snikende. Akutt massiv overdose kan vise seg som koma. Mindre plutselige og/eller mindre alvorlige former for overdosering kan vise seg med tegn på døsighet, svimmelhet, svimmelhet, døsighet, respirasjonsdepresjon, anfall, rostral progresjon av hypotoni og bevissthetstap som utvikler seg til koma. Skulle overdosering virke sannsynlig, bør pasienten umiddelbart tas til sykehus for vurdering og tømming av pumpebeholderen. I tilfeller rapportert til dags dato, har overdosering generelt vært relatert til pumpefeil, utilsiktet subkutan injeksjon eller doseringsfeil. (Se Overdosesymptomer og behandling .)
Ekstrem forsiktighet må utvises ved fylling av en FDA-godkjent implanterbar pumpe. Slike pumper bør kun etterfylles gjennom reservoarpåfyllingsskilleveggen. Utilsiktet injeksjon i det subkutane vevet kan forekomme hvis reservoarpåfyllingsskilleveggen ikke er riktig tilgjengelig. Noen pumper er også utstyrt med en katetertilgangsport som gir direkte tilgang til det intratekale kateteret. Direkte injeksjon i denne katetertilgangsporten eller utilsiktet injeksjon i det subkutane vevet kan forårsake en livstruende overdose.
Uttak
Brå seponering av intratekal baklofen, uavhengig av årsak, har resultert i følgetilstander som inkluderte høy feber, endret mental status, overdreven rebound spastisitet og muskelstivhet som i sjeldne tilfeller utviklet seg til rabdomyolyse, multippel organsystemsvikt og død. I løpet av de første 9 årene med erfaring etter markedsføring ble det rapportert 27 tilfeller av seponering midlertidig relatert til seponering av baklofenbehandling; seks pasienter døde. I de fleste tilfeller dukket abstinenssymptomer opp i løpet av timer til noen dager etter avbrudd av baklofenbehandlingen. Vanlige årsaker til brå avbrudd av intratekal baklofenbehandling inkluderte funksjonsfeil i kateteret (spesielt frakobling), lavt volum i pumpebeholderen og slutten av pumpens batterilevetid; menneskelige feil kan ha spilt en årsakssammenheng eller medvirkende rolle i noen tilfeller. Tilfeller av intratekal masse på tuppen av det implanterte kateteret som fører til abstinenssymptomer er også rapportert, de fleste av dem involverer apotekkomponerte smertestillende blandinger (se FORHOLDSREGLER ).
Forebygging av brå seponering av intratekal baklofen krever nøye oppmerksomhet til programmering og overvåking av infusjonssystemet, påfyllingsplanlegging og prosedyrer og pumpealarmer. Pasienter og omsorgspersoner bør informeres om viktigheten av å holde planlagte påfyllingsbesøk og bør informeres om de tidlige symptomene på baklofenabstinens.
Alle pasienter som får intratekal baklofenbehandling er potensielt utsatt for seponering. Tidlige symptomer på tilbaketrekning av baklofen kan inkludere tilbakevending av spastisitet ved baseline, pruritus, hypotensjon og parestesier. Priapisme kan utvikles eller gjenta seg hvis behandlingen med intratekal baklofen avbrytes. Noen kliniske kjennetegn ved det avanserte intratekale baklofenabstinenssyndromet kan ligne autonom dysrefleksi, infeksjon (sepsis), ondartet hypertermi, nevroleptika-malignt syndrom eller andre tilstander assosiert med en hypermetabolsk tilstand eller utbredt rabdomyolyse.
Rask, nøyaktig diagnose og behandling på akuttmottak eller intensivavdeling er viktig for å forhindre potensielt livstruende sentralnervesystem og systemiske effekter av intratekal baklofenabstinens. Den foreslåtte behandlingen for seponering av intratekal baklofen er gjenoppretting av intratekal baklofen ved eller nær samme dosering som før behandlingen ble avbrutt. Imidlertid, hvis gjenoppretting av intratekal levering er forsinket, kan behandling med GABA-erge agonistmedisiner som oralt eller enteralt baklofen eller orale, enterale eller intravenøse benzodiazepiner forhindre potensielt dødelige følgetilstander. Oralt eller enteralt baklofen alene bør ikke stole på for å stoppe progresjonen av intratekal baklofenabstinens.
Anfall har blitt rapportert under overdosering og ved seponering fra LIORESAL 25 mg INTRATHECAL, så vel som hos pasienter som opprettholdes på terapeutiske doser av LIORESAL INTRATHECAL.
Dødsfall
Spastisitet av ryggmargsopprinnelse
Det ble rapportert 16 dødsfall blant de 576 amerikanske pasientene behandlet med LIORESAL 10 mg INTRATHECAL (baklofen-injeksjon) i pre- og post-markedsføringsstudier evaluert i desember 1992. Fordi disse pasientene ble behandlet under ukontrollerte kliniske omgivelser, er det umulig å fastslå definitivt hva rolle, hvis noen, LIORESAL INTRATHECAL spilte i deres dødsfall.
Som gruppe var pasientene som døde relativt unge (gjennomsnittsalder var 47 med en rekkevidde fra 25 til 63), men flertallet led av alvorlig spastisitet av mange års varighet, var ikke-nambulerende, hadde ulike medisinske komplikasjoner som lungebetennelse, urinveier infeksjoner og decubiti, og/eller hadde fått flere samtidige medisiner. En gjennomgang fra sak til sak av det kliniske forløpet til de 16 pasientene som døde klarte ikke å avsløre noen unike tegn, symptomer eller laboratorieresultater som tyder på at behandling med LIORESAL INTRATHECAL forårsaket deres død. To pasienter led imidlertid plutselig og uventet død innen 2 uker etter pumpeimplantasjon, og en pasient døde uventet etter screening.
En pasient, en 44 år gammel mann med MS, døde på sykehus den andre dagen etter pumpeimplantasjon. En obduksjon viste alvorlig fibrose i koronarledningssystemet. En annen pasient, en 52 år gammel kvinne med MS og en historie med et hjerteinfarkt i inferior vegg, ble funnet død i sengen 12 dager etter pumpeimplantasjon, 2 timer etter å ha hatt dokumenterte normale vitale tegn. En obduksjon avslørte lungetetthet og bilaterale pleurale effusjoner. Det er umulig å fastslå om LIORESAL INTRATHECAL bidro til disse dødsfallene. Den tredje pasienten gjennomgikk tre baklofen-screeningsforsøk. Hans medisinske historie inkluderte SCI, aspirasjonspneumoni, septisk sjokk, disseminert intravaskulær koagulopati, alvorlig metabolsk acidose, hepatisk toksisitet og status epilepticus. Tolv dager etter screening (han ble ikke implantert) opplevde han igjen status epilepticus med påfølgende betydelig nevrologisk forverring. Basert på tidligere instruksjoner ble det ikke iverksatt ekstraordinære gjenopplivningstiltak og pasienten døde.
Spastisitet av cerebral opprinnelse
Det var tre dødsfall som skjedde blant de 211 pasientene som ble behandlet med LIORESAL INTRATHECAL i førmarkedsføringsstudier i mars 1996. Disse dødsfallene ble ikke tilskrevet terapien.
Overinfusjon
Tilførsel av mer medikamentvolum enn den programmerte hastigheten (overinfusjon) kan resultere i uventet overdose, eller uttak forårsaket av tidlig tømming av pumpebeholderen. Se produsentens pumpehåndbok og instruksjoner for etterfylling av reservoaret.
FORHOLDSREGLER
Barn bør ha tilstrekkelig kroppsmasse til å romme den implanterbare pumpen for kronisk infusjon. Se pumpeprodusentens håndbok for spesifikke anbefalinger.
Sikkerhet og effektivitet hos pediatriske pasienter under 4 år er ikke fastslått.
Screening
Pasienter bør være infeksjonsfrie før screeningstudien med LIORESAL INTRATHECAL (baklofeninjeksjon) fordi tilstedeværelsen av en systemisk infeksjon kan forstyrre en vurdering av pasientens respons på bolus LIORESAL 10 mg INTRATHECAL.
Pumpeimplantasjon
Pasienter bør være infeksjonsfrie før pumpeimplantasjon fordi tilstedeværelse av infeksjon kan øke risikoen for kirurgiske komplikasjoner. Dessuten kan en systemisk infeksjon komplisere doseringen.
Justering og titrering av pumpedose
Hos de fleste pasienter vil det være nødvendig å øke dosen gradvis over tid for å opprettholde effektiviteten; et plutselig behov for betydelig doseøkning indikerer typisk en kateterkomplikasjon (dvs. kateterknekk eller løsrivelse).
Påfylling av reservoar må utføres av fullt opplært og kvalifisert personell etter instruksjonene gitt av pumpeprodusenten. Utilsiktet injeksjon i det subkutane vevet kan forekomme hvis reservoarpåfyllingsskilleveggen ikke er riktig tilgjengelig. Subkutan injeksjon kan resultere i symptomer på en systemisk overdose eller tidlig uttømming av reservoaret. Etterfyllingsintervaller bør beregnes nøye for å forhindre uttømming av reservoaret, da dette vil føre til tilbakevending av alvorlig spastisitet og muligens abstinenssymptomer.
Streng aseptisk teknikk ved fylling er nødvendig for å unngå bakteriell kontaminering og alvorlig infeksjon. En observasjonsperiode tilpasset den kliniske situasjonen bør følge hver påfylling eller manipulering av medikamentreservoaret.
Ekstrem forsiktighet må utvises ved fylling av en FDA-godkjent implanterbar pumpe utstyrt med en injeksjonsport som gir direkte tilgang til det intratekale kateteret. Direkte injeksjon inn i kateteret gjennom katetertilgangsporten kan forårsake en livstruende overdose.
Ytterligere hensyn knyttet til doseringsjustering
Det kan være viktig å titrere dosen for å opprettholde en viss grad av muskeltonus og la sporadiske spasmer: 1) bidra til å støtte sirkulasjonsfunksjonen, 2) muligens forhindre dannelsen av dyp venetrombose, 3) optimalisere dagliglivets aktiviteter og enkel pleie. .
Bortsett fra i nødstilfeller relatert til overdosering, bør dosen av LIORESAL 25 mg INTRATHECAL vanligvis reduseres sakte dersom legemidlet seponeres av en eller annen grunn.
Det bør gjøres et forsøk på å seponere samtidig oral antispastisitetsmedisin for å unngå mulig overdose eller uønskede legemiddelinteraksjoner, enten før screening eller etter implantasjon og initiering av kronisk LIORESAL INTRATEKAL infusjon. Reduksjon og seponering av orale antispasmotika bør gjøres sakte og med nøye overvåking av legen. Brå reduksjon eller seponering av samtidige antispastika bør unngås.
Døsighet
Døsighet er rapportert hos pasienter på LIORESAL INTRATHECAL. Pasienter bør advares om bruk av biler eller andre farlige maskiner, og aktiviteter som kan gjøres farlige på grunn av redusert årvåkenhet. Pasienter bør også advares om at de sentralnervesystemdempende effektene av LIORESAL INTRATHECAL (baklofeninjeksjon) kan være additive til effekten av alkohol og andre CNS-depressiva.
Intratekal messe
Tilfeller av intratekal masse ved tuppen av det implanterte kateteret er rapportert, de fleste av dem involverer apotekkomponerte smertestillende blandinger. De hyppigste symptomene assosiert med intratekal masse er: 1) redusert terapeutisk respons (forverret spastisitet, tilbakevending av spastisitet når tidligere godt kontrollert, abstinenssymptomer, dårlig respons på økende doser eller hyppige eller store doseøkninger), 2) smerte, 3) nevrologisk underskudd/dysfunksjon. Klinikere bør overvåke pasienter på intraspinal terapi nøye for nye nevrologiske tegn eller symptomer. Hos pasienter med nye nevrologiske tegn eller symptomer som tyder på en intratekal masse, bør du vurdere en nevrokirurgisk konsultasjon, siden mange av symptomene på inflammatorisk masse ikke er ulik symptomene som oppleves av pasienter med alvorlig spastisitet fra sykdommen. I noen tilfeller kan utførelse av en avbildningsprosedyre være hensiktsmessig for å bekrefte eller utelukke diagnosen av en intratekal masse.
Forholdsregler i spesielle pasientpopulasjoner
Nøye dosetitrering av LIORESAL 10mg INTRATHECAL er nødvendig når spastisitet er nødvendig for å opprettholde oppreist holdning og balanse i bevegelse eller når spastisitet brukes for å oppnå optimal funksjon og pleie.
Pasienter som lider av psykotiske lidelser, schizofreni eller forvirringstilstander bør behandles forsiktig med LIORESAL INTRATHECAL og holdes under nøye overvåking, fordi forverring av disse tilstandene har blitt observert ved oral administrering.
LIORESAL INTRATHECAL bør brukes med forsiktighet hos pasienter med en historie med autonom dysrefleksi. Tilstedeværelsen av nociseptive stimuli eller brå seponering av LIORESAL 10mg INTRATHECAL (baklofeninjeksjon) kan forårsake en autonom dysrefleksiv episode.
Fordi LIORESAL hovedsakelig utskilles uendret via nyrene, bør det gis med forsiktighet til pasienter med nedsatt nyrefunksjon, og det kan være nødvendig å redusere dosen.
Laboratorietester
Ingen spesifikke laboratorietester anses som avgjørende for behandling av pasienter på LIORESAL INTRATHECAL.
Karsinogenese, mutagenese og svekkelse av fruktbarhet
Ingen økning i svulster ble sett hos rotter som fikk baklofen oralt i to år. Adekvate genotoksisitetsanalyser av baklofen er ikke utført.
Svangerskap
Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. I dyrestudier hadde baklofen negative effekter på embryoføtal utvikling når det ble gitt oralt til drektige rotter. LIORESAL 25mg INTRATHECAL skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Baclofen gitt oralt økte forekomsten av føtale strukturelle abnormiteter (omphaloceles) hos rotter. Reduksjoner i matinntak og kroppsvektøkning ble observert i dammene. Fetale strukturelle abnormiteter ble ikke observert hos mus eller kaniner
Ammende mødre
Hos mødre som behandles med oral LIORESAL (baklofen USP) i terapeutiske doser, går det aktive stoffet over i melken. Det er ikke kjent om påvisbare nivåer av medikament er tilstede i melk fra ammende mødre som får LIORESAL 25 mg INTRATHECAL. Som en generell regel bør pleie utføres mens en pasient får LIORESAL 25 mg INTRATHECAL bare hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for spedbarnet.
Pediatrisk bruk
Barn bør ha tilstrekkelig kroppsmasse til å romme den implanterbare pumpen for kronisk infusjon. Se pumpeprodusentens håndbok for spesifikke anbefalinger.
Sikkerhet og effektivitet hos pediatriske pasienter under 4 år er ikke fastslått.
Betraktninger basert på erfaring med oral LIORESAL (baklofen USP)
En doserelatert økning i forekomst av ovariecyster ble observert hos hunnrotter behandlet kronisk med oral LIORESAL. Ovariecyster er funnet ved palpasjon hos ca. 4 % av multippel sklerosepasientene som ble behandlet med oral LIORESAL 25 mg i opptil ett år. I de fleste tilfeller forsvant disse cystene spontant mens pasientene fortsatte å få stoffet. Ovariecyster anslås å oppstå spontant hos omtrent 1 % til 5 % av den normale kvinnelige befolkningen.
OVERDOSE
Spesiell oppmerksomhet må gis for å gjenkjenne tegn og symptomer på overdosering, spesielt under den innledende screenings- og dosetitreringsfasen av behandlingen, men også under gjeninnføring av LIORESAL INTRATHECAL etter en periode med avbrudd i behandlingen.
Symptomer på LIORESAL INTRATEKAL overdose
Døsighet, svimmelhet, svimmelhet, somnolens, respirasjonsdepresjon, hypotermi, anfall, rostral progresjon av hypotoni og bevissthetstap som utvikler seg til koma på opptil 72 timer. varighet. I de fleste rapporterte tilfeller var koma reversibel uten følgetilstander etter at legemidlet ble seponert. Symptomer på LIORESAL 25 mg INTRATEKAL overdose ble rapportert hos en sensitiv voksen pasient etter å ha fått en 25 mcg intratekal bolus.
Behandlingsforslag for overdose
Det finnes ingen spesifikk motgift for behandling av overdoser av LIORESAL INTRATHECAL (baklofen-injeksjon); Følgende trinn bør imidlertid vanligvis utføres:
. Resterende LIORESAL 25 mg INTRATHECAL-oppløsning bør fjernes fra pumpen så snart som mulig. . Pasienter med respirasjonsdepresjon bør intuberes om nødvendig, inntil medikamentet er eliminert.Hvis lumbalpunksjon ikke er kontraindisert, bør det vurderes å trekke ut 30-40 ml CSF for å redusere CSF-baklofenkonsentrasjonen.
KONTRAINDIKASJONER
Overfølsomhet for baklofen. LIORESAL INTRATHECAL anbefales ikke for intravenøs, intramuskulær, subkutan eller epidural administrering.
KLINISK FARMAKOLOGI
Den nøyaktige virkningsmekanismen til baklofen som et muskelavslappende middel og antispastisitetsmiddel er ikke fullt ut forstått. Baklofen hemmer både monosynaptiske og polysynaptiske reflekser på spinalnivå, muligens ved å redusere eksitatorisk nevrotransmitterfrigjøring fra primære afferente terminaler, selv om virkninger på supraspinale steder også kan forekomme og bidra til dens kliniske effekt. Baklofen er en strukturell analog av den hemmende nevrotransmitteren gamma-aminosmørsyre (GABA), og kan utøve sine effekter ved stimulering av GABAB-reseptorsubtypen.
LIORESAL INTRATHECAL når den introduseres direkte i det intratekale rommet tillater effektive CSF-konsentrasjoner å oppnås med resulterende plasmakonsentrasjoner 100 ganger mindre enn de som oppstår ved oral administrering.
Hos mennesker, så vel som hos dyr, har baklofen vist seg å ha generelle CNS-depressive egenskaper som indikert ved produksjon av sedasjon med toleranse, somnolens, ataksi og respiratorisk og kardiovaskulær depresjon.
Farmakodynamikk av LIORESAL INTRATEKAL
Intratekal bolus
Voksne pasienter
Virkningen begynner vanligvis en halv time til en time etter en intratekal bolus. Maksimal spasmolytisk effekt sees omtrent fire timer etter dosering, og effekten kan vare fire til åtte timer. Debut, maksimal respons og virkningsvarighet kan variere med individuelle pasienter avhengig av dose og alvorlighetsgrad av symptomene.
Pediatriske pasienter
Utbruddet, maksimal respons og virkningsvarighet er lik de som er sett hos voksne pasienter.
Kontinuerlig infusjon
LIORESAL 25mg INTRATHECALs antispastiske virkning sees først 6 til 8 timer etter initiering av kontinuerlig infusjon. Maksimal aktivitet observeres etter 24 til 48 timer.
Kontinuerlig infusjon
Ingen tilleggsinformasjon er tilgjengelig for pediatriske pasienter.
Farmakokinetikk av LIORESAL 25mg INTRATEKAL
Farmakokinetikken til CSF-clearance av LIORESAL 25 mg INTRATHECAL, beregnet fra intratekale bolus- eller kontinuerlige infusjonsstudier, tilnærmer CSF-omsetningen, noe som antyder at eliminering skjer ved bulk-flow-fjerning av CSF.
Intratekal bolus
Etter en lumbal bolusinjeksjon på 50 eller 100 mcg LIORESAL 10 mg INTRATHECAL hos syv pasienter, var gjennomsnittlig CSF-eliminasjonshalveringstid 1,51 timer i løpet av de første fire timene og gjennomsnittlig CSF-clearance var ca. 30 ml/time.
Kontinuerlig infusjon
Gjennomsnittlig CSF-clearance for LIORESAL 10 mg INTRATHECAL (baklofeninjeksjon) var ca. 30 ml/time i en studie som involverte ti pasienter på kontinuerlig intratekal infusjon. Samtidige plasmakonsentrasjoner av baklofen under intratekal administrering forventes å være lave (0-5 ng/ml).
Begrensede farmakokinetiske data tyder på at en lumbal-cisternal konsentrasjonsgradient på ca. 4:1 etableres langs nevroaksen under baklofeninfusjon. Dette er basert på samtidig CSF-prøvetaking via cisternal og lumbal tap hos 5 pasienter som får kontinuerlig baklofeninfusjon på lumbalnivå ved doser assosiert med terapeutisk effekt; variasjonen mellom pasientene var stor. Gradienten ble ikke endret av posisjon.
Seks pediatriske pasienter (alder 8-18 år) som fikk kontinuerlig intratekal baklofeninfusjon i doser på 77-400 mcg/dag, hadde plasmanivåer av baklofen nær eller under 10 ng/ml.
PASIENTINFORMASJON
PrLIORESAL Intrathecal (baklofen) Injeksjon 0,05 mg/ml, 0,5 mg/ml og 2 mg/ml
Kun for intratekal injeksjon og infusjon
Denne brosjyren er del III av en tredelt "Produktmonografi" publisert da LIORESAL IT ble godkjent for salg i Canada og er designet spesielt for forbrukere. Dette pakningsvedlegget er et sammendrag og vil ikke fortelle deg alt om LIORESAL 10mg IT. Kontakt legen din eller apoteket hvis du har spørsmål om stoffet.
OM DENNE MEDISIEN
Hva medisinen brukes til:
LIORESAL 25mg Intrathecal tilhører en gruppe legemidler som kalles muskelavslappende midler. Det brukes til å redusere og lindre overdreven stivhet og/eller spasmer som oppstår ved ulike sykdommer som for eksempel multippel sklerose, sykdommer eller skader i ryggmargen og visse hjernesykdommer.
Hva det gjør:
Løsningen injiseres eller infunderes i væskerommet rundt ryggmargen ved hjelp av en spesiell pumpe som er implantert under huden på magen. Fra pumpen leveres en konstant mengde av løsningen inn i væskerommet rundt ryggmargen gjennom et lite rør.
På grunn av den gunstige effekten på muskelsammentrekninger og den påfølgende lindring av smerte, forbedrer LIORESAL Intrathecal din mobilitet og din evne til å håndtere dine daglige aktiviteter uten hjelp. LIORESAL 25mg hjelper deg også å få mer utbytte av fysioterapi.
Når den ikke skal brukes:
Du bør ikke behandles med LIORESALIT hvis du:
- . er allergisk (overfølsom) overfor LIORESAL 25mg Intrathecal eller noen av de andre innholdsstoffene i LIORESAL 10mg Intrathecal oppført nedenfor.
Hva den medisinske ingrediensen er:
baklofen.
Hva er de ikke-medisinske ingrediensene:
LIORESAL 25mg IT inneholder: natriumklorid og vann til injeksjonsvæsker
Hvilke doseringsformer kommer den i:
LIORESAL 25mg Intrathecal (baklofeninjeksjon) 0,05 mg/ml: Hver 1 ml ampulle inneholder 0,05 mg baklofen for intratekal administrering.
LIORESAL Intrathecal (baklofeninjeksjon) 0,5 mg/ml: Hver 20 ml ampulle inneholder 10 mg baklofen for intratekal administrering.
LIORESAL 25 mg intratekal (baklofeninjeksjon) 2 mg/ml: Hver 5 ml ampulle inneholder 10 mg baklofen for intratekal administrering.
ADVARSLER OG FORHOLDSREGLER
LIORESAL 10mg Intrathecal passer for mange, men ikke alle, pasienter med muskelspasmer.
FØR du bruker LIORESAL 25mgIT, snakk med legen din eller apoteket dersom du:
- . har noen form for infeksjon . har Parkinsons sykdom eller visse psykiske lidelser ledsaget av forvirring . har epilepsi (anfall) . har diabetes . noen gang hatt hjerteproblemer . noen gang hatt nyreproblemer . har pusteproblemer . har akutte smerter i magen eller tarmen . har forstyrret blodsirkulasjonen i hjernen din . noen gang har opplevd plutselige episoder med høyt blodtrykk, angst, overdreven svetting, "gåsekjøtt", dunkende hodepine og uvanlig langsom hjerterytme på grunn av en overreaksjon av nervesystemet på stimuli som utvidelse av blæren og tarmen, hudirritasjon og smerte
Hvis noe av dette gjelder deg, kan det hende at legen din ikke ønsker å gi deg dette legemidlet eller vil kanskje ta spesielle forholdsregler. Hvis du ikke har fortalt legen din om noen av disse tingene, fortell ham/henne før du starter LIORESAL 25 mg intratekal behandling.
Hvis du tror du kan være allergisk, spør legen din om råd.
Kjøring og bruk av maskiner: LIORESAL Intrathecal kan få deg til å føle deg trøtt eller svimmel. Vær forsiktig når du kjører bil eller bruker maskin eller gjør ting som trenger nøye oppmerksomhet til du føler deg normal igjen.
INTERAKSJONER MED DENNE MEDISIEN
Fortell legen din eller apoteket dersom du bruker eller nylig har brukt andre legemidler, inkludert urtemedisiner og reseptfrie legemidler (reseptfri). Noen andre legemidler kan interagere med LIORESAL 10mgIT. Legen din kan endre doseringen eller noen ganger stoppe en av medisinene. Dette er spesielt viktig for følgende medisiner:
- . andre medisiner for din spastiske tilstand . medisiner mot Parkinsons sykdom . medisiner mot epilepsi . medisiner som brukes til å behandle stemningslidelser som antidepressiva og litium . medisiner for høyt blodtrykk . andre legemidler som påvirker nyrene, f.eks. ibuprofen . opiater for smertelindring . medisiner som brukes for å hjelpe deg med å sove eller roe deg ned . medisiner som bremser sentralnervesystemet, f.eks. antihistaminer og beroligende midler (noen av disse kan kjøpes reseptfritt)
Fortell alltid legen din eller sykepleieren om alle medisinene du tar. Dette betyr medisiner du har kjøpt selv, samt medisiner på resept fra legen din.
Vær forsiktig hvis du drikker alkoholholdige drikker under behandling med LIORESAL 25mg Intrathecal, da du kan føle deg mer søvnig eller svimmel enn vanlig.
RIKTIG BRUK AV DENNE MEDISIEN
Vanlig dose
LIORESAL Intrathecal kan kun gis av erfarne leger som bruker spesialmedisinsk utstyr. Du må bli på sykehus, i det minste i begynnelsen av behandlingen.
Legen din vil injisere en liten mengde LIORESAL Intrathecal i ryggmargen for å se om det forbedrer muskelspasmene dine. Hvis den gjør det, vil en spesiell pumpe implanteres under huden din. Pumpen vil gi deg en liten mengde medisin hele tiden.
Det kan ta flere dager å finne ut hvor mye medisin som passer deg best, legen din vil følge nøye med på deg i løpet av denne tiden.
Etter det vil legen din fortsatt ønske å se deg regelmessig for å sjekke fremgangen din og sørge for at pumpen din fungerer bra.
DET ER AV YTTE VIKTIG AT AVTALER FOR Å FYLLE PUMPE OVERHOLDES, ELLER KAN SPASMENE OPPTAKES FORDI DU IKKE FÅR EN HØY NOK DOSE LIORESAL INTRATHECAL. MUSKELSPASTISITET KAN IKKE FORBEDRES ELLER KAN FORVERRE SOM RESULTAT.
Hvis muskelspastisiteten ikke blir bedre eller hvis du begynner å få spasmer igjen, enten gradvis eller plutselig, kontakt legen din umiddelbart.
Se pumpeprodusentens litteratur for informasjon om riktig hjemmepleie av pumpen og innsettingsstedet.
Overvåking under behandling med LIORESAL 10mg Intrathecal
Du vil bli overvåket nøye i et fullt utstyrt og bemannet miljø under screeningsfasen og dosetitreringsperioden umiddelbart etter pumpeimplantasjon. Du vil regelmessig bli vurdert for dine dosekrav, for mulige bivirkninger eller tegn på infeksjon. Funksjonen til leveringssystemet vil også bli kontrollert.
Graviditet og amming
Du bør fortelle legen din dersom du er gravid eller planlegger å bli gravid, da LIORESAL 25mg Intrathecal ikke skal brukes under graviditet, eller hvis du ammer. Spør legen din eller apoteket om råd før du tar noen medisin.
Legen din vil diskutere med deg den potensielle risikoen ved å ta LIORESAL 25mg Intrathecal under graviditet.
Legen vil avgjøre om du kan få LIORESAL 10mg Intrathecal i disse spesielle situasjonene. Bare svært små mengder LIORESAL 10mg går over i morsmelk. Spør legen din om du ønsker å amme.
Overdose
I tilfelle av overdose av medikamenter, kontakt en helsepersonell, akuttmottak på sykehus eller regionalt giftkontrollsenter umiddelbart, selv om det ikke er noen symptomer.
Tegn på overdose kan dukke opp plutselig eller snikende, f.eks. ved feil på pumpen. Det er svært viktig at du og de som tar vare på deg kjenner igjen tegn på overdosering. Hvis du opplever ett eller en kombinasjon av følgende symptomer, fortell legen din uten forsinkelse da mengden medikament du får kan være for høy:
- . uvanlig muskelsvakhet (for lite muskeltonus) . søvnighet . svimmelhet eller svimmelhet . overdreven salivasjon . kvalme eller oppkast . pustevansker, anfall eller tap av bevissthet . unormal lav kroppstemperatur
Glemt dose
Bråstopp av LIORESAL 10mg Intrathecal kan føre til alvorlige medisinske problemer og har i sjeldne tilfeller vært dødelig.
Tegn på at pumpen din ikke fungerer som den skal eller at den ikke gir riktig mengde medisiner inkluderer økt eller tilbakevending av spastisitet, kløe, lavt blodtrykk, svimmelhet, prikkende følelse, høy feber, endret mental status og muskelstivhet eller ny. muskelsvakhet eller lammelse. Det er viktig å fortelle legen din umiddelbart hvis du opplever noen av symptomene ovenfor.
BIVIRKNINGER OG HVA SKAL GJØRES MED DEM
Som med alle legemidler kan pasienter som behandles med LIORESAL 25mg Intrathecal, oppleve noen bivirkninger, selv om ikke alle får dem. Disse forekommer oftere ved starten av behandlingen under sykehusoppholdet, men de kan også oppstå senere og bør sjekkes med legen din.
Veldig vanlig: Døsighet, muskelsvakhet
Vanlig: Følelse av angst, sedasjon og tretthet (utmattelse), svakhet i bena, stivhet i muskler, svimmelhet/ørhet, hodepine, søvnighet, kvalme og/eller oppkast, prikking i hender og føtter, søvnløshet, sløret tale, lungebetennelse , svakhet, frysninger, tretthet, smerte, munntørrhet, hudutslett og/eller kløe, hevelse i ankler, føtter eller underben, hovne ansikt, uvanlig nervøsitet eller rastløshet, forvirring/desorientering, forstoppelse, diaré, nedsatt appetitt, overdreven salivasjon, feber/skjelving, urinproblemer, seksuelle vansker.
Uvanlig: Humør eller mentale endringer, paranoia, følelse av ekstrem lykke (eufori), tap av muskelkoordinasjon (ataksi), unormalt lav kroppstemperatur, hukommelsestap, kontinuerlige ukontrollerbare øyebevegelser, nedsatt smakssans, problemer med å svelge, magesmerter, hårtap, overdreven svetting.
Sjelden: Rastløshet, unormalt langsom pustehastighet.
Fortell legen din dersom du merker annen effekt. Noen bivirkninger kan være assosiert med leveringssystemet.
ALVORLIGE BIVIRKNINGER, HVOR OFTE SKJER DE OG HVA SKAL GJØRES MED DEM
Dette er ikke en fullstendig liste over bivirkninger. For eventuelle uventede effekter mens du tar LIORESAL IT kontakt legen din eller apoteket.
HVORDAN OPPBEVARER DEN
Oppbevar LIORESAL 10mg IT ampuller mellom 15-30°C (beskyttes mot varme). Må ikke fryses. Ikke varmesteriliser.
Oppbevar alle legemidler utilgjengelig for barn.
Dette legemidlet er foreskrevet for ditt spesifikke medisinske problem og kun til eget bruk. Ikke gi til andre mennesker.
Ikke bruk utdaterte medisiner. Kast dem trygt utilgjengelig for barn eller ta dem med til apoteket som vil kaste dem for deg.
RAPPORTERE MISTENTLIGE BIVIRKNINGER
Du kan rapportere alle mistenkte bivirkninger forbundet med bruk av helseprodukter til Canada Vigilance Program på en av følgende tre måter:
- . Rapporter online på www.healthcanada.gc.ca/medeffect . Ring gratis på 1-866-234-2345 . Fyll ut et rapporteringsskjema for Canada Vigilance og:
- . Faks gratis til 1-866-678-6789, eller . Send e-post til: Canada Vigilance Program, Health Canada, Postal Locator 0701E, Ottawa, Ontario, K1A 0K9
Portobetalte etiketter, Canada Vigilance Reporting Form og retningslinjene for bivirkningsrapportering er tilgjengelig på MedEffect™ Canadas nettsted på www.healthcanada.gc.ca/medeffect.
MERK: Hvis du trenger informasjon relatert til behandling av bivirkninger, kontakt helsepersonell. Canada Vigilance Program gir ikke medisinske råd.
MER INFORMASJON
Dette dokumentet pluss hele produktmonografien, utarbeidet for helsepersonell, kan finnes på: http://www.novartis.ca eller ved å kontakte sponsoren, Novartis Pharmaceuticals Canada Inc, på: 1-800-363-8883
