Abilify 10mg, 15mg, 20mg Aripiprazole Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.

Hva er Abilify 20mg og hvordan brukes det?
Abilify er en reseptbelagt medisin som brukes til å behandle symptomene på schizofreni, bipolar lidelse I (manisk depresjon) og alvorlig depressiv lidelse. Abilify 10mg kan brukes alene eller sammen med andre medisiner. Abilify er et antipsykotisk, antimanisk middel.
- . Det er ikke kjent om Abilify er trygt og effektivt hos barn under 6 år.
Hva er de mulige bivirkningene av Abilify 15mg?
Abilify 15mg kan forårsake alvorlige bivirkninger, inkludert:
- . alvorlig agitasjon eller angst, . føler seg rastløs, . rykninger eller ukontrollerbare bevegelser av øyne, lepper, tunge, ansikt, armer eller ben, . maskelignende utseende av ansiktet, . problemer med å svelge, . taleproblemer, . anfall (kramper), . tanker om selvmord eller selvskading, . stive eller stive muskler, . høy feber, . svette, . forvirring, . raske eller ujevne hjerteslag, . skjelvinger (risting), . føler seg svimmel, . frysninger, . sår hals, . munnsår, . hudsår, . hoste, . pustevansker, . økt tørst, . økt vannlating, . tørr munn, og . fruktig pust lukt
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Abilify 20mg inkluderer:
- . ukontrollerte muskelbevegelser, . angst, . føler seg rastløs, . vektøkning, . kvalme, . oppkast, . forstoppelse, . økt appetitt, . hodepine, . svimmelhet, . døsighet, . føler meg sliten, . søvnproblemer (søvnløshet), . tett nese, og . sår hals
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle de mulige bivirkningene av Abilify. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
ØKT DØDELIGHET HOS ELDRE PASIENTER MED DEMENSRELATTER PSYKOSE og SUicidale tanker og adferd med antidepressiva
Eldre pasienter med demensrelatert psykose behandlet med antipsykotiske legemidler har økt risiko for død. ABILIFY 20mg er ikke godkjent for behandling av pasienter med demensrelatert psykose [se ADVARSLER OG FORHOLDSREGLER].
Antidepressiva økte risikoen for selvmordstanker og -adferd hos barn, ungdom og unge voksne i korttidsstudier. Disse studiene viste ikke en økning i risikoen for selvmordstanker og -adferd ved bruk av antidepressiva hos pasienter over 24 år; det var en reduksjon i risiko ved bruk av antidepressiva hos pasienter i alderen 65 år og eldre [se ADVARSLER OG FORHOLDSREGLER].
Hos pasienter i alle aldre som starter på antidepressiv behandling, overvåk nøye for forverring og for fremveksten av selvmordstanker og -adferd. Informer familier og omsorgspersoner om behovet for tett observasjon og kommunikasjon med forskriveren [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
Aripiprazol er et psykotropisk legemiddel som er tilgjengelig som ABILIFY® (aripiprazol) tabletter, ABILIFY DISCMELT® (aripiprazol) oralt desintegrerende tabletter, ABILIFY® (aripiprazol) oral oppløsning og ABILIFY® (aripiprazol) injeksjon, en oppløsning for intramuskulær injeksjon. Aripiprazol er 7-[4-[4-(2,3diklorfenyl)-1-piperazinyl]butoksy]-3,4-dihydrokarbostyril. Den empiriske formelen er C23H27Cl2N3O2 og dens molekylvekt er 448,38. Den kjemiske strukturen er:
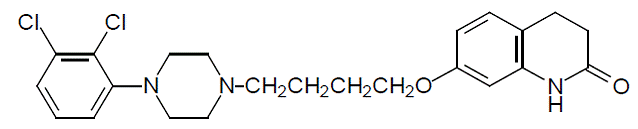
ABILIFY tabletter er tilgjengelige i styrker på 2 mg, 5 mg, 10 mg, 15 mg, 20 mg og 30 mg. Inaktive ingredienser inkluderer maisstivelse, hydroksypropylcellulose, laktosemonohydrat, magnesiumstearat og mikrokrystallinsk cellulose. Fargestoffer inkluderer jernoksid (gul eller rød) og FD&C Blue No. 2 Aluminium Lake.
ABILIFY 20 mg DISCMELT oralt desintegrerende tabletter er tilgjengelige i styrker på 10 mg og 15 mg. Inaktive ingredienser inkluderer acesulfamkalium, aspartam, kalsiumsilikat, croscarmellose natrium, crospovidon, crème de vanilla (naturlige og kunstige smaker), magnesiumstearat, mikrokrystallinsk cellulose, silisiumdioksid, vinsyre og xylitol. Fargestoffer inkluderer jernoksid (gul eller rød) og FD&C Blue No. 2 Aluminium Lake.
ABILIFY mikstur er en klar, fargeløs til lysegul oppløsning tilgjengelig i en konsentrasjon på 1 mg/ml. De inaktive ingrediensene i denne løsningen inkluderer dinatriumedetat, fruktose, glyserin, dl-melkesyre, metylparaben, propylenglykol, propylparaben, natriumhydroksid, sukrose og renset vann. Den orale løsningen er smaksatt med naturlig appelsinkrem og andre naturlige smaker.
ABILIFY Injection er tilgjengelig i enkeltdose hetteglass som en klar til bruk, 9,75 mg/1,3 ml (7,5 mg/ml) klar, fargeløs, steril, vandig oppløsning kun for intramuskulær bruk. Inaktive ingredienser for denne løsningen inkluderer 199,5 mg sulfobutyleter β-cyklodekstrin (SBECD), 10,4 mg vinsyre, qs til pH 4,3 av natriumhydroksid og qs til 1,33 ml vann til injeksjon.
INDIKASJONER
ABILIFY orale tabletter, oralt desintegrerende tabletter og oral oppløsning er indisert for behandling av:
- . Schizofreni [se Kliniske studier ] . Akutt behandling av maniske og blandede episoder assosiert med bipolar I-lidelse [se Kliniske studier ] . Tilleggsbehandling av alvorlig depressiv lidelse [se Kliniske studier ] . Irritabilitet assosiert med autistisk lidelse [se Kliniske studier ] . Behandling av Tourettes lidelse [se Kliniske studier ]
ABILIFY injeksjon er indisert for behandling av:
- . Agitasjon assosiert med schizofreni eller bipolar mani [se Kliniske studier ]
DOSERING OG ADMINISTRASJON
Schizofreni
Voksne
Den anbefalte start- og måldosen for ABILIFY er 10 eller 15 mg/dag administrert én gang daglig uten hensyn til måltider. ABILIFY har blitt systematisk evaluert og vist å være effektiv i et doseområde på 10 til 30 mg/dag, når det administreres som tablettformuleringen; doser høyere enn 10 eller 15 mg/dag var imidlertid ikke mer effektive enn 10 eller 15 mg/dag. Doseøkninger bør vanligvis ikke gjøres før 2 uker, den tiden som trengs for å oppnå steady-state [se Kliniske studier ].
Vedlikeholdsbehandling: Vedlikehold av effekt ved schizofreni ble vist i en studie som involverte pasienter med schizofreni som hadde vært symptomatisk stabile på andre antipsykotiske medisiner i perioder på 3 måneder eller lenger. Disse pasientene ble seponert fra disse medisinene og randomisert til enten ABILIFY 15 mg/dag eller placebo, og observert for tilbakefall [se Kliniske studier ]. Pasienter bør regelmessig revurderes for å fastslå det fortsatte behovet for vedlikeholdsbehandling.
Ungdom
Den anbefalte måldosen av ABILIFY er 10 mg/dag. Aripiprazol ble studert hos ungdomspasienter i alderen 13 til 17 år med schizofreni ved daglige doser på 10 mg og 30 mg. Den daglige startdosen av tablettformuleringen hos disse pasientene var 2 mg, som ble titrert til 5 mg etter 2 dager og til måldosen på 10 mg etter ytterligere 2 dager. Påfølgende doseøkninger bør administreres i trinn på 5 mg. Dosen på 30 mg/dag ble ikke vist å være mer effektiv enn dosen på 10 mg/dag. ABILIFY kan administreres uten hensyn til måltider [se Kliniske studier ]. Pasienter bør med jevne mellomrom revurderes for å fastslå behovet for vedlikeholdsbehandling.
Bytte fra andre antipsykotika
Det er ingen systematisk innsamlet data for å spesifikt adressere bytte av pasienter med schizofreni fra andre antipsykotika til ABILIFY 20 mg eller om samtidig administrering med andre antipsykotika. Mens umiddelbar seponering av den tidligere antipsykotiske behandlingen kan være akseptabel for noen pasienter med schizofreni, kan mer gradvis seponering være mest hensiktsmessig for andre. I alle tilfeller bør perioden med overlappende antipsykotisk administrering minimeres.
Bipolar I lidelse
Akutt behandling av maniske og blandede episoder
Voksne
Anbefalt startdose hos voksne er 15 mg gitt én gang daglig som monoterapi og 10 mg til 15 mg gitt én gang daglig som tilleggsbehandling med litium eller valproat. ABILIFY 10mg kan gis uten hensyn til måltider. Den anbefalte måldosen av ABILIFY er 15 mg/dag, som monoterapi eller som tilleggsbehandling med litium eller valproat. Dosen kan økes til 30 mg/dag basert på klinisk respons. Sikkerheten til doser over 30 mg/dag har ikke blitt evaluert i kliniske studier.
Pediatri
Anbefalt startdose hos pediatriske pasienter (10 til 17 år) som monoterapi er 2 mg/dag, med titrering til 5 mg/dag etter 2 dager, og en måldose på 10 mg/dag etter 2 ekstra dager. Anbefalt dosering som tilleggsbehandling til litium eller valproat er den samme. Påfølgende doseøkninger, om nødvendig, bør administreres i trinn på 5 mg/dag. ABILIFY kan gis uten hensyn til måltider [se Kliniske studier ].
Tilleggsbehandling av alvorlig depressiv lidelse
Voksne
Den anbefalte startdosen for ABILIFY som tilleggsbehandling for pasienter som allerede tar et antidepressivum er 2 til 5 mg/dag. Anbefalt doseringsområde er 2 til 15 mg/dag. Dosejusteringer på opptil 5 mg/dag bør skje gradvis, med intervaller på ikke mindre enn 1 uke [se Kliniske studier ]. Pasienter bør regelmessig revurderes for å fastslå det fortsatte behovet for vedlikeholdsbehandling.
Irritabilitet assosiert med autistisk lidelse
Pediatriske pasienter (6 til 17 år)
Det anbefalte doseringsområdet for behandling av pediatriske pasienter med irritabilitet assosiert med autistisk lidelse er 5 til 15 mg/dag.
Dosering bør startes med 2 mg/dag. Dosen bør økes til 5 mg/dag, med påfølgende økning til 10 eller 15 mg/dag om nødvendig. Dosejusteringer på opptil 5 mg/dag bør skje gradvis, med intervaller på ikke mindre enn 1 uke [se Kliniske studier ]. Pasienter bør regelmessig revurderes for å fastslå det fortsatte behovet for vedlikeholdsbehandling.
Tourettes lidelse
Pediatriske pasienter (6 til 18 år)
Det anbefalte doseringsområdet for Tourettes lidelse er 5 til 20 mg/dag.
For pasienter som veier mindre enn 50 kg, bør doseringen startes med 2 mg/dag med en måldose på 5 mg/dag etter 2 dager. Dosen kan økes til 10 mg/dag hos pasienter som ikke oppnår optimal kontroll av tics. Dosejusteringer bør skje gradvis med intervaller på ikke mindre enn 1 uke.
For pasienter som veier 50 kg eller mer bør doseringen startes med 2 mg/dag i 2 dager, og deretter økes til 5 mg/dag i 5 dager, med en måldose på 10 mg/dag på dag 8. Dosen kan økt opp til 20 mg/dag for pasienter som ikke oppnår optimal kontroll av tics. Dosejusteringer bør skje gradvis i trinn på 5 mg/dag med intervaller på ikke mindre enn 1 uke. [Se Kliniske studier ].
Pasienter bør regelmessig revurderes for å fastslå det fortsatte behovet for vedlikeholdsbehandling.
Agitasjon assosiert med schizofreni eller bipolar mani (intramuskulær injeksjon)
Voksne
Anbefalt dose hos disse pasientene er 9,75 mg. Det anbefalte doseringsområdet er 5,25 til 15 mg. Ingen ytterligere fordel ble vist for 15 mg sammenlignet med 9,75 mg. En lavere dose på 5,25 mg kan vurderes når kliniske faktorer tilsier det. Hvis agitasjon som tilsier en ny dose vedvarer etter startdosen, kan kumulative doser opp til totalt 30 mg/dag gis. Effekten av gjentatte doser av ABILIFY 10 mg injeksjon hos opprørte pasienter har imidlertid ikke blitt systematisk evaluert i kontrollerte kliniske studier. Sikkerheten til totale daglige doser større enn 30 mg eller injeksjoner gitt oftere enn hver 2. time har ikke blitt tilstrekkelig evaluert i kliniske studier [se Kliniske studier ].
Hvis pågående ABILIFY-behandling er klinisk indisert, bør oral ABILIFY i et område på 10 til 30 mg/dag erstatte ABILIFY-injeksjon så snart som mulig [se DOSERING OG ADMINISTRASJON ].
Administrering av ABILIFY-injeksjon
For å administrere ABILIFY 10 mg injeksjon, trekk opp det nødvendige volumet av oppløsningen i sprøyten som vist i tabell 1. Kast ubrukt del.
ABILIFY injeksjon er kun beregnet for intramuskulær bruk. Ikke administrer intravenøst eller subkutant. Injiser sakte, dypt inn i muskelmassen.
Parenterale legemidler bør inspiseres visuelt for partikler og misfarging før administrering, når oppløsning og beholder tillater det.
Dosejusteringer for Cytochrome P450-hensyn
Dosejusteringer anbefales hos pasienter som er kjente CYP2D6-fattige metaboliserere og hos pasienter som samtidig tar CYP3A4-hemmere eller CYP2D6-hemmere eller sterke CYP3A4-induktorer (se tabell 2). Når det samtidig administrerte legemidlet trekkes ut av kombinasjonsbehandlingen, bør ABILIFY 10 mg-dosen justeres til det opprinnelige nivået. Når den samtidig administrerte CYP3A4-induktoren seponeres, bør ABILIFY-dosen reduseres til det opprinnelige nivået i løpet av 1 til 2 uker. Pasienter som kan få en kombinasjon av sterke, moderate og svake hemmere av CYP3A4 og CYP2D6 (f.eks. en sterk CYP3A4-hemmer og en moderat CYP2D6-hemmer eller en moderat CYP3A4-hemmer med en moderat CYP2D6-hemmer), kan dosen reduseres til én. -kvart (25 %) av den vanlige dosen innledningsvis og deretter justert for å oppnå en gunstig klinisk respons.
Når tillegg ABILIFY gis til pasienter med alvorlig depressiv lidelse, bør ABILIFY 10 mg administreres uten dosejustering som spesifisert i Dosering og administrasjon (2.3).
Dosering av oral løsning
Den orale oppløsningen kan erstattes med tabletter på en mg-per-mg basis opp til 25 mg dosenivå. Pasienter som får 30 mg tabletter bør få 25 mg av oppløsningen [se KLINISK FARMAKOLOGI ].
Dosering av oralt desintegrerende tabletter
Doseringen for ABILIFY 10 mg oralt desintegrerende tabletter er den samme som for orale tabletter [se avsnittene ovenfor ].
HVORDAN LEVERES
Doseringsformer og styrker
ABILIFY® (aripiprazol) tabletter er tilgjengelige som beskrevet i tabell 3.
ABILIFY DISCMELT® (aripiprazol) oralt desintegrerende tabletter er tilgjengelige som beskrevet i tabell 4.
ABILIFY® (aripiprazol) oral oppløsning (1 mg/ml) er en klar, fargeløs til lysegul oppløsning, levert i barnesikre flasker sammen med en kalibrert oral doseringskopp.
ABILIFY® (aripiprazol) injeksjon for intramuskulær bruk er en klar, fargeløs oppløsning tilgjengelig som en bruksklar, 9,75 mg/1,3 ml (7,5 mg/ml) oppløsning i klare, Type 1-glass hetteglass.
Oppbevaring og håndtering
ABILIFY® (aripiprazol) tabletter har markeringer på den ene siden og er tilgjengelige i styrker og pakker oppført i tabell 32.
ABILIFY 15mg DISCMELT® (aripiprazol) oralt desintegrerende tabletter er runde tabletter med markeringer på hver side. ABILIFY 15mg DISCMELT er tilgjengelig i styrker og pakker oppført i Tabell 33.
ABILIFY® (aripiprazol) oral oppløsning (1 mg/ml) leveres i barnesikre flasker sammen med en kalibrert oral doseringskopp. ABILIFY 20 mg oral oppløsning er tilgjengelig som følger:
150 mL flaske NDC 59148-013-15
ABILIFY® (aripiprazol) Injeksjon for intramuskulær bruk er tilgjengelig som en bruksklar, 9,75 mg/1,3 ml (7,5 mg/ml) oppløsning i klare type 1 hetteglass som følger:
9,75 mg/1,3 mL enkeltdose hetteglass NDC 59148-016-65
Oppbevaring
Nettbrett
Oppbevares ved 25°C (77°F); utflukter tillatt mellom 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ].
Oral løsning
Oppbevares ved 25°C (77°F); utflukter tillatt mellom 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ]. Åpnede flasker med ABILIFY mikstur kan brukes i opptil 6 måneder etter åpning, men ikke etter utløpsdatoen på flasken. Flasken og innholdet skal kastes etter utløpsdatoen.
Injeksjon
Oppbevares ved 25°C (77°F); utflukter tillatt mellom 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ]. Beskytt mot lys ved å oppbevare i originalbeholderen. Oppbevar i kartong til bruk.
Distribuert og markedsført av Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA. Otsuka America Pharmaceutical, Inc.,. Rev. august 2019
BIVIRKNINGER
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Følgende bivirkninger er omtalt mer detaljert i andre deler av merkingen:
- . Økt dødelighet hos eldre pasienter med demensrelatert psykose [se ADVARSEL i boks og ADVARSLER OG FORHOLDSREGLER ] . Cerebrovaskulære bivirkninger, inkludert hjerneslag [se ADVARSLER OG FORHOLDSREGLER ] . Selvmordstanker og -atferd hos barn, ungdom og unge voksne [se ADVARSEL i boks og ADVARSLER OG FORHOLDSREGLER ] . Malignt nevroleptikasyndrom (NMS) [se ADVARSLER OG FORHOLDSREGLER ] . Tardiv dyskinesia [se ADVARSLER OG FORHOLDSREGLER ] . Metabolske endringer [se ADVARSLER OG FORHOLDSREGLER ] . Patologisk gambling og annen tvangsmessig atferd [se ADVARSLER OG FORHOLDSREGLER ] . Ortostatisk hypotensjon [se ADVARSLER OG FORHOLDSREGLER ] . Falls [se ADVARSLER OG FORHOLDSREGLER ] . Leukopeni, nøytropeni og agranulocytose [se ADVARSLER OG FORHOLDSREGLER ] . Anfall/kramper [se ADVARSLER OG FORHOLDSREGLER ] . Potensial for kognitiv og motorisk svekkelse [se ADVARSLER OG FORHOLDSREGLER ] . Kroppstemperaturregulering [se ADVARSLER OG FORHOLDSREGLER ] . Selvmord [se ADVARSLER OG FORHOLDSREGLER ] . Dysfagi [se ADVARSLER OG FORHOLDSREGLER ]
De vanligste bivirkningene hos voksne pasienter i kliniske studier (≥10 %) var kvalme, oppkast, forstoppelse, hodepine, svimmelhet, akatisi, angst, søvnløshet og rastløshet.
De vanligste bivirkningene i de pediatriske kliniske studiene (≥10 %) var søvnighet, hodepine, oppkast, ekstrapyramidale lidelser, tretthet, økt appetitt, søvnløshet, kvalme, nasofaryngitt og vektøkning.
ABILIFY har blitt evaluert for sikkerhet hos 13 543 voksne pasienter som deltok i flere doser, kliniske studier med schizofreni, bipolar lidelse, alvorlig depressiv lidelse, demens av Alzheimers type, Parkinsons sykdom og alkoholisme, og som hadde ca. 7619 pasientår med eksponering for oral ABILIFY 10 mg og 749 pasienter med eksponering for ABILIFY-injeksjon. Totalt 3390 pasienter ble behandlet med oral ABILIFY i minst 180 dager og 1933 pasienter behandlet med oral ABILIFY hadde minst 1 års eksponering.
ABILIFY 15mg har blitt evaluert for sikkerhet hos 1 686 pasienter (6 til 18 år) som deltok i flere doser, kliniske studier med schizofreni, bipolar mani, autistisk lidelse eller Tourettes lidelse og som hadde omtrent 1 342 pasientår med eksponering for oral ABILIFY . Totalt 959 pediatriske pasienter ble behandlet med oral ABILIFY i minst 180 dager og 556 pediatriske pasienter behandlet med oral ABILIFY 10 mg hadde minst 1 års eksponering.
Betingelsene og varigheten av behandlingen med ABILIFY (monoterapi og tilleggsbehandling med antidepressiva eller stemningsstabilisatorer) inkluderte (i overlappende kategorier) dobbeltblinde, komparative og ikke-komparative åpne studier, stasjonære og polikliniske studier, studier med faste og fleksible doser, og kort- og langtidseksponering.
Erfaring fra kliniske forsøk
Voksne pasienter med schizofreni
Følgende funn er basert på en samling av fem placebokontrollerte studier (fire 4-ukers og en 6-ukers) der oral ABILIFY 15 mg ble administrert i doser fra 2 til 30 mg/dag.
Vanlige observerte bivirkninger
Den eneste vanlig observerte bivirkningen assosiert med bruk av ABILIFY 20 mg hos pasienter med schizofreni (insidens på 5 % eller høyere og ABILIFY-insidens minst dobbelt så stor som for placebo) var akatisi (ABILIFY 8 %; placebo 4 %).
Voksne pasienter med bipolar mani
Monoterapi
Følgende funn er basert på en samling av 3-ukers, placebokontrollerte, bipolar manistudier der oral ABILIFY 15 mg ble administrert i doser på 15 eller 30 mg/dag.
Vanlige observerte bivirkninger
Vanlige observerte bivirkninger assosiert med bruk av ABILIFY hos pasienter med bipolar mani (insidens på 5 % eller mer og ABILIFY 15 mg forekomst minst dobbelt så stor som for placebo) er vist i tabell 16.
Mindre vanlige bivirkninger hos voksne
Tabell 17 oppregner den samlede forekomsten, avrundet til nærmeste prosent, av bivirkninger som oppstod under akuttbehandling (opptil 6 uker ved schizofreni og opptil 3 uker ved bipolar mani), inkludert bare de reaksjonene som oppstod hos 2 % eller mer av pasienter behandlet med ABILIFY (doser ≥2 mg/dag) og hvor forekomsten hos pasienter behandlet med ABILIFY 20 mg var høyere enn forekomsten hos pasienter behandlet med placebo i det kombinerte datasettet.
En undersøkelse av populasjonsundergrupper avslørte ingen klare bevis for forskjellig forekomst av bivirkninger på grunnlag av alder, kjønn eller rase.
Voksne pasienter med tilleggsterapi med bipolar mani
Følgende funn er basert på en placebokontrollert studie med voksne pasienter med bipolar lidelse der ABILIFY 15 mg ble administrert i doser på 15 eller 30 mg/dag som tilleggsbehandling med litium eller valproat.
Bivirkninger forbundet med seponering av behandling
I en studie med pasienter som allerede tolererte enten litium eller valproat som monoterapi, var seponeringsfrekvensen på grunn av bivirkninger 12 % for pasienter behandlet med tilleggsmiddel ABILIFY sammenlignet med 6 % for pasienter behandlet med tilleggs placebo. De vanligste bivirkningene forbundet med seponering hos pasienter som ble behandlet med ABILIFY som tilleggsmiddel sammenlignet med placebo-behandlede pasienter var akatisi (henholdsvis 5 % og 1 %) og tremor (henholdsvis 2 % og 1 %).
Vanlige observerte bivirkninger
De vanlige observerte bivirkningene assosiert med tilleggsmiddel ABILIFY og litium eller valproat hos pasienter med bipolar mani (forekomst på 5 % eller mer og forekomst minst dobbelt så stor som for tilleggs placebo) var: akatisi, søvnløshet og ekstrapyramidal lidelse.
Mindre vanlige bivirkninger hos voksne pasienter med tilleggsterapi ved bipolar mani
Tabell 18 oppregner forekomsten, avrundet til nærmeste prosent, av bivirkninger som oppsto under akutt behandling (opptil 6 uker), inkludert bare de reaksjonene som oppstod hos 2 % eller flere av pasientene behandlet med tilleggsmiddel ABILIFY (doser på 15 eller 30 mg/dag) og litium eller valproat og hvor forekomsten hos pasienter behandlet med denne kombinasjonen var høyere enn forekomsten hos pasienter behandlet med placebo pluss litium eller valproat.
Pediatriske pasienter (13 til 17 år) med schizofreni
Følgende funn er basert på en 6-ukers, placebokontrollert studie der oral ABILIFY ble administrert i doser fra 2 til 30 mg/dag.
Bivirkninger forbundet med seponering av behandling
Forekomsten av seponering på grunn av bivirkninger mellom ABILIFY-behandlede og placebo-behandlede pediatriske pasienter (13 til 17 år) var henholdsvis 5 % og 2 %.
Vanlige observerte bivirkninger
Vanlige observerte bivirkninger assosiert med bruk av ABILIFY 10 mg hos ungdomspasienter med schizofreni (forekomst på 5 % eller høyere og ABILIFY-insidens minst dobbelt så høy som for placebo) var ekstrapyramidale lidelser, somnolens og tremor.
Pediatriske pasienter (10 til 17 år) med bipolar mani
Følgende funn er basert på en 4-ukers, placebokontrollert studie der oral ABILIFY ble administrert i doser på 10 eller 30 mg/dag.
Bivirkninger forbundet med seponering av behandling
Forekomsten av seponering på grunn av bivirkninger mellom ABILIFY-behandlede og placebobehandlede pediatriske pasienter (10 til 17 år) var henholdsvis 7 % og 2 %.
Vanlige observerte bivirkninger
Vanlige observerte bivirkninger assosiert med bruk av ABILIFY 20 mg hos pediatriske pasienter med bipolar mani (insidens på 5 % eller høyere og ABILIFY-insidens minst dobbelt så stor som for placebo) er vist i tabell 19.
Pediatriske pasienter (6 til 17 år) med autistisk lidelse
Følgende funn er basert på to 8-ukers, placebokontrollerte studier der oral ABILIFY 20 mg ble administrert i doser på 2 til 15 mg/dag.
Bivirkninger forbundet med seponering av behandling
Forekomsten av seponering på grunn av bivirkninger mellom ABILIFY-behandlede og placebo-behandlede pediatriske pasienter (6 til 17 år) var henholdsvis 10 % og 8 %.
Vanlige observerte bivirkninger
Vanlige observerte bivirkninger assosiert med bruk av ABILIFY hos pediatriske pasienter med autistisk lidelse (insidens på 5 % eller mer og ABILIFY 10 mg forekomst minst dobbelt så stor som for placebo) er vist i tabell 20.
Pediatriske pasienter (6 til 18 år) med Tourettes lidelse
Følgende funn er basert på en 8-ukers og en 10-ukers, placebokontrollerte studier der oral ABILIFY 15 mg ble administrert i doser på 2 til 20 mg/dag.
Bivirkninger forbundet med seponering av behandling
Forekomsten av seponering på grunn av bivirkninger mellom ABILIFY-behandlede og placebo-behandlede pediatriske pasienter (6 til 18 år) var henholdsvis 7 % og 1 %.
Vanlige observerte bivirkninger
Vanlige observerte bivirkninger assosiert med bruk av ABILIFY hos pediatriske pasienter med Tourettes lidelse (insidens på 5 % eller mer og ABILIFY 10 mg forekomst minst det dobbelte av placebo) er vist i tabell 21.
Mindre vanlige bivirkninger hos pediatriske pasienter (6 til 18 år) med schizofreni, bipolar mani, autistisk lidelse eller Tourettes lidelse
Tabell 22 viser den samlede forekomsten, avrundet til nærmeste prosent, av bivirkninger som oppsto under akuttbehandling (opptil 6 uker ved schizofreni, opptil 4 uker ved bipolar mani, opptil 8 uker ved autistisk lidelse og opptil 10 uker. i Tourettes lidelse), inkludert bare de reaksjonene som oppstod hos 2 % eller flere av pediatriske pasienter behandlet med ABILIFY (doser ≥2 mg/dag) og hvor forekomsten hos pasienter behandlet med ABILIFY 10 mg var høyere enn forekomsten hos pasienter behandlet med placebo.
Voksne pasienter som mottar ABILIFY som tilleggsbehandling av alvorlig depressiv lidelse
Følgende funn er basert på en samling av to placebokontrollerte studier av pasienter med alvorlig depressiv lidelse der ABILIFY 20 mg ble administrert i doser på 2 mg til 20 mg som tilleggsbehandling til fortsatt antidepressiv behandling.
Bivirkninger forbundet med seponering av behandling
Forekomsten av seponering på grunn av bivirkninger var 6 % for pasienter som ble behandlet med ABILIFY og 2 % for pasienter som ble behandlet med ekstra placebo.
Vanlige observerte bivirkninger
De vanlig observerte bivirkningene assosiert med bruk av tilleggsmiddel ABILIFY 15 mg hos pasienter med alvorlig depressiv lidelse (forekomst på 5 % eller høyere og ABILIFY 15 mg forekomst minst dobbelt så stor som for placebo) var: akatisi, rastløshet, søvnløshet, forstoppelse, tretthet og tåkesyn.
Mindre vanlige bivirkninger hos voksne pasienter med alvorlig depressiv lidelse
Tabell 23 oppregner den samlede forekomsten, avrundet til nærmeste prosent, av bivirkninger som oppsto under akuttbehandling (opptil 6 uker), inkludert bare de bivirkningene som oppstod hos 2 % eller flere av pasientene behandlet med tilleggs-ABILIFY (doser ≥2) mg/dag) og hvor forekomsten hos pasienter behandlet med tilleggsmiddel ABILIFY 10 mg var høyere enn forekomsten hos pasienter behandlet med tilleggs placebo i det kombinerte datasettet.
Pasienter med agitasjon assosiert med schizofreni eller bipolar mani (intramuskulær injeksjon)
Følgende funn er basert på en samling av tre placebokontrollerte studier av pasienter med agitasjon assosiert med schizofreni eller bipolar mani der ABILIFY 20 mg injeksjon ble administrert i doser på 5,25 mg til 15 mg.
Vanlige observerte bivirkninger
Det var en vanlig observert bivirkning (kvalme) forbundet med bruk av ABILIFY 10 mg injeksjon hos pasienter med agitasjon assosiert med schizofreni og bipolar mani (insidens på 5 % eller mer og ABILIFY 20 mg forekomst minst det dobbelte av placebo).
Mindre vanlige bivirkninger hos pasienter med agitasjon assosiert med schizofreni eller bipolar mani
Tabell 24 viser den samlede forekomsten, avrundet til nærmeste prosent, av bivirkninger som oppsto under akuttbehandling (24-timers), inkludert bare de bivirkningene som oppstod hos 2 % eller flere av pasientene behandlet med ABILIFY-injeksjon (doser ≥5,25 mg). /dag) og hvor forekomsten hos pasienter behandlet med ABILIFY 15 mg injeksjon var høyere enn forekomsten hos pasienter behandlet med placebo i det kombinerte datasettet.
Doserelaterte bivirkninger
Schizofreni
Doseresponsforhold for forekomsten av behandlingsutløste bivirkninger ble evaluert fra fire studier med voksne pasienter med schizofreni som sammenlignet ulike faste doser (2, 5, 10, 15, 20 og 30 mg/dag) av oral ABILIFY med placebo. Denne analysen, stratifisert etter studie, indikerte at den eneste bivirkningen som hadde et mulig doseresponsforhold, og da mest fremtredende bare med 30 mg, var somnolens [inkludert sedasjon]; (forekomstene var placebo, 7,1 %; 10 mg, 8,5 %; 15 mg, 8,7 %; 20 mg, 7,5 %; 30 mg, 12,6 %).
I studien av pediatriske pasienter (13 til 17 år) med schizofreni, så det ut til at tre vanlige bivirkninger har et mulig doseresponsforhold: ekstrapyramidal lidelse (forekomsten var placebo, 5,0 %; 10 mg, 13,0 %; 30 mg, 21,6 %); somnolens (forekomstene var placebo, 6,0 %; 10 mg, 11,0 %; 30 mg, 21,6 %); og tremor (forekomstene var placebo, 2,0 %; 10 mg, 2,0 %; 30 mg, 11,8 %).
Bipolar mani
studien av pediatriske pasienter (10 til 17 år) med bipolar mani, hadde fire vanlige bivirkninger et mulig doseresponsforhold etter 4 uker; ekstrapyramidal lidelse (forekomsten var placebo, 3,1 %; 10 mg, 12,2 %; 30 mg, 27,3 %); somnolens (forekomsten var placebo, 3,1 %; 10 mg, 19,4 %; 30 mg, 26,3 %); akatisi (forekomstene var placebo, 2,1 %; 10 mg, 8,2 %; 30 mg, 11,1 %); og spytthypersekresjon (forekomsten var placebo, 0 %; 10 mg, 3,1 %; 30 mg, 8,1 %).
Autistisk lidelse
I en studie av pediatriske pasienter (6 til 17 år) med autistisk lidelse, hadde en vanlig bivirkning et mulig doseresponsforhold: tretthet (forekomsten var placebo, 0 %; 5 mg, 3,8 %; 10 mg, 22,0 %; 15 mg, 18,5 %).
Tourettes lidelse
I en studie av pediatriske pasienter (7 til 17 år) med Tourettes lidelse, hadde ingen vanlige bivirkning(er) et doseresponsforhold.
Ekstrapyramidale symptomer
Schizofreni
kortsiktige, placebokontrollerte studier med schizofreni hos voksne, var forekomsten av rapporterte EPS-relaterte hendelser, ekskludert hendelser relatert til akatisi, for ABILIFY-behandlede pasienter 13 % vs. 12 % for placebo; og forekomsten av akatisi-relaterte hendelser for ABILIFY-behandlede pasienter var 8 % vs. 4 % for placebo. I den kortsiktige, placebokontrollerte studien av schizofreni hos pediatriske pasienter (13 til 17 år), var forekomsten av rapporterte EPS-relaterte hendelser, ekskludert hendelser relatert til akatisi, for ABILIFY-behandlede pasienter 25 % vs. 7 % for placebo; og forekomsten av akatisi-relaterte hendelser for ABILIFY-behandlede pasienter var 9 % vs. 6 % for placebo.
Objektivt innsamlede data fra disse forsøkene ble samlet inn på Simpson Angus Rating Scale (for EPS), Barnes Akathisia Scale (for akathisia) og Assessments of Involuntary Movement Scales (for dyskinesier). I schizofrenistudiene for voksne viste de objektivt innsamlede dataene ingen forskjell mellom ABILIFY 10 mg og placebo, med unntak av Barnes Akathisia Scale (ABILIFY 20 mg, 0,08; placebo, -0,05). I den pediatriske (13 til 17 år) schizofrenistudien, viste objektivt innsamlede data ingen forskjell mellom ABILIFY 20 mg og placebo, med unntak av Simpson Angus Rating Scale (ABILIFY 20 mg, 0,24; placebo, -0,29).
Tilsvarende, i en langsiktig (26-ukers), placebokontrollert studie av schizofreni hos voksne, objektivt samlet inn data om Simpson Angus Rating Scale (for EPS), Barnes Akathisia Scale (for akathisia) og Assessments of Involuntary. Bevegelsesskalaer (for dyskinesier) viste ingen forskjell mellom ABILIFY og placebo.
Bipolar mani
kortsiktige, placebokontrollerte studier med bipolar mani hos voksne, var forekomsten av rapporterte EPS-relaterte hendelser, ekskludert hendelser relatert til akatisi, for ABILIFY-behandlede monoterapipasienter 16 % vs. 8 % for placebo og insidensen av akatisi-relaterte hendelser for monoterapi ABILIFY-behandlede pasienter var 13 % vs. 4 % for placebo. I den 6-ukers, placebokontrollerte studien med bipolar mani for tilleggsbehandling med litium eller valproat, var forekomsten av rapporterte EPS-relaterte hendelser, ekskludert hendelser relatert til akatisi for pasienter som ble behandlet med ABILIFY som tilleggsbehandling, 15 % vs. 8 % for tilleggsbehandling. placebo og forekomsten av akatisi-relaterte hendelser for pasienter behandlet med ABILIFY som tilleggsbehandling var 19 % vs. 5 % for tilleggs placebo. I den kortsiktige, placebokontrollerte studien med bipolar mani hos pediatriske (10 til 17 år) pasienter, var forekomsten av rapporterte EPS-relaterte hendelser, ekskludert hendelser relatert til akatisi, for ABILIFY-behandlede pasienter 26 % vs. 5 % for placebo og forekomsten av akatisi-relaterte hendelser for ABILIFY-behandlede pasienter var 10 % vs. 2 % for placebo.
de bipolare manistudiene for voksne med ABILIFY monoterapi, viste Simpson Angus Rating Scale og Barnes Akathisia Scale en signifikant forskjell mellom ABILIFY 15mg og placebo (ABILIFY, 0,50; placebo, -0,01 og ABILIFY 10mg, 0,20,0; placebo, -5). Endringer i vurderingene av ufrivillige bevegelsesskalaer var like for ABILIFY 15 mg og placebogruppene. I studiene med bipolar mani med ABILIFY 20 mg som tilleggsbehandling med enten litium eller valproat, viste Simpson Angus Rating Scale og Barnes Akathisia Scale en signifikant forskjell mellom tilleggs ABILIFY og tilleggs placebo (ABILIFY 20mg, 0,703, 0,70, ABILg og placebo). 0,30; placebo, 0,11). Endringer i vurderingene av ufrivillige bevegelsesskalaer var like for tilleggs ABILIFY 20 mg og tilleggs placebo. I den pediatriske (10 til 17 år), kortsiktige, bipolar mani-studien, viste Simpson Angus Rating Scale en signifikant forskjell mellom ABILIFY 10 mg og placebo (ABILIFY 15 mg, 0,90; placebo, -0,05). Endringer i Barnes Akathisia-skalaen og vurderingene av ufrivillige bevegelsesskalaer var like for ABILIFY 20 mg og placebogruppene.
Major depressiv lidelse
I kortsiktige, placebokontrollerte studier med alvorlig depressiv lidelse, var forekomsten av rapporterte EPS-relaterte hendelser, ekskludert hendelser relatert til akatisi, for pasienter som ble behandlet med ABILIFY som tilleggsbehandling, 8 % vs. 5 % for pasienter som ble behandlet med tilleggsbehandling med placebo; og forekomsten av akatisi-relaterte hendelser for pasienter som ble behandlet med ABILIFY var 25 % vs. 4 % for pasienter som ble behandlet med placebo.
I studiene med alvorlige depressive lidelser, viste Simpson Angus Rating Scale og Barnes Akathisia Scale en signifikant forskjell mellom tilleggs ABILIFY og tilleggs placebo (ABILIFY 10 mg, 0,31; placebo, 0,03 og ABILIFY, 0,22; placebo, 0,02). Endringer i vurderingene av ufrivillige bevegelsesskalaer var like for de adjunktive ABILIFY- og adjunktive placebogruppene.
Autistisk lidelse
kortsiktige, placebokontrollerte studier med autistiske lidelser hos pediatriske pasienter (6 til 17 år), var forekomsten av rapporterte EPS-relaterte hendelser, ekskludert hendelser relatert til akatisi, for ABILIFY-behandlede pasienter 18 % vs. 2 % for placebo og forekomsten av akatisi-relaterte hendelser for ABILIFY-behandlede pasienter var 3 % vs. 9 % for placebo.
I pediatriske (6 til 17 år) kortsiktige autistiske lidelser, viste Simpson Angus Rating Scale en signifikant forskjell mellom ABILIFY og placebo (ABILIFY 20 mg, 0,1; placebo, -0,4). Endringer i Barnes Akathisia-skalaen og vurderingene av ufrivillige bevegelsesskalaer var like for ABILIFY 10 mg og placebogruppene.
Tourettes lidelse
kortsiktige, placebokontrollerte studier av Tourettes lidelse hos pediatriske pasienter (6 til 18 år), var forekomsten av rapporterte EPS-relaterte hendelser, ekskludert hendelser relatert til akatisi, for ABILIFY-behandlede pasienter 7 % vs. 6 % for placebo og forekomsten av akatisi-relaterte hendelser for ABILIFY-behandlede pasienter var 4 % vs. 6 % for placebo.
I de pediatriske (6 til 18 år) korttidsstudiene med Tourettes lidelse var endringer i Simpson Angus Rating Scale, Barnes Akathisia Scale og Assessments of Involuntary Movement Scale ikke klinisk meningsfullt forskjellige for ABILIFY 15 mg og placebo.
Agitasjon assosiert med schizofreni eller bipolar mani
de placebokontrollerte studiene med pasienter med agitasjon assosiert med schizofreni eller bipolar mani, var forekomsten av rapporterte EPS-relaterte hendelser ekskludert hendelser relatert til akatisi for ABILIFY-behandlede pasienter 2 % vs. 2 % for placebo og forekomsten av akatisi- relaterte hendelser for ABILIFY-behandlede pasienter var 2 % vs. 0 % for placebo. Objektivt innsamlede data på Simpson Angus Rating Scale (for EPS) og Barnes Akathisia Scale (for akathisia) for alle behandlingsgrupper viste ingen forskjell mellom ABILIFY 10 mg og placebo.
Dystoni
Symptomer på dystoni, langvarige unormale sammentrekninger av muskelgrupper, kan forekomme hos følsomme individer i løpet av de første dagene av behandlingen. Dystoniske symptomer inkluderer: spasmer i nakkemusklene, noen ganger utvikler seg til tetthet i halsen, svelgevansker, pustevansker og/eller tungefremspring. Selv om disse symptomene kan oppstå ved lave doser, forekommer de hyppigere og med større alvorlighetsgrad med høy styrke og ved høyere doser av førstegenerasjons antipsykotiske legemidler. En forhøyet risiko for akutt dystoni er observert hos menn og yngre aldersgrupper.
Ytterligere funn observert i kliniske studier
Bivirkninger i langsiktige, dobbeltblindede, placebokontrollerte forsøk
Bivirkningene rapportert i en 26-ukers, dobbeltblind studie som sammenlignet oral ABILIFY 10 mg og placebo hos pasienter med schizofreni var generelt i samsvar med de som ble rapportert i de kortsiktige, placebokontrollerte studiene, bortsett fra en høyere forekomst av tremor [8 % (12/153) for ABILIFY 20 mg vs. 2 % (3/153) for placebo]. I denne studien var de fleste tilfellene av skjelving av mild intensitet (8/12 mild og 4/12 moderat), oppstod tidlig i behandlingen (9/12 ≤49 dager), og var av begrenset varighet (7/12 ≤ 10 dager). Tremor førte sjelden til seponering (
Andre uønskede reaksjoner observert under premarketing-evalueringen av ABILIFY
Følgende liste inkluderer ikke reaksjoner: 1) som allerede er oppført i tidligere tabeller eller andre steder i merking, 2) hvor en medikamentårsak var fjern, 3) som var så generelle at de var uinformative, 4) som ikke ble ansett for å ha signifikant kliniske implikasjoner, eller 5) som skjedde med en hastighet lik eller mindre enn placebo.
Reaksjoner er kategorisert etter kroppssystem i henhold til følgende definisjoner: hyppige bivirkninger er de som forekommer hos minst 1/100 pasienter; sjeldne bivirkninger er de som forekommer hos 1/100 til 1/1000 pasienter; sjeldne reaksjoner er de som forekommer hos færre enn 1/1000 pasienter:
Voksne - Muntlig administrasjon
Forstyrrelser i blod og lymfesystem: sjelden - trombocytopeni
Hjertelidelser: sjelden - bradykardi, hjertebank, sjeldne - atrieflutter, hjertestans, atrioventrikulær blokkering, atrieflimmer, angina pectoris, myokardiskemi, hjerteinfarkt, hjerte-lungesvikt
Øyelidelser: sjelden - fotofobi; sjelden - diplopi
Gastrointestinale lidelser: sjelden - gastroøsofageal reflukssykdom
Generelle lidelser og administrasjonsbetingelser: hyppig - asteni; sjelden - perifert ødem, brystsmerter; sjelden - ansiktsødem
Lever og gallesykdommer: sjelden - hepatitt, gulsott
Forstyrrelser i immunsystemet : sjelden - overfølsomhet
Skader, forgiftning og prosedyrekomplikasjoner: sjelden - fall; sjelden - heteslag
Undersøkelser: hyppig - vektreduksjon, sjeldne - økt leverenzym, økt blodsukker, økt laktatdehydrogenase i blod, økt gamma-glutamyltransferase; sjeldne - økt prolaktin i blodet, økt urea i blodet, økt kreatinin i blodet, økt bilirubin i blodet, forlenget elektrokardiogram QT, økt glykosylert hemoglobin
Metabolisme og ernæringsforstyrrelser: hyppig - anoreksi; sjeldne - hypokalemi, hyponatremi, hypoglykemi
Muskel- og bindevevslidelser: sjelden - muskelsvakhet, muskelstramhet; sjeldne - rabdomyolyse, redusert mobilitet
Forstyrrelser i nervesystemet: sjelden - parkinsonisme, hukommelsessvikt, tannhjulstivhet, hypokinesi, bradykinesi; sjeldne - akinesi, myoklonus, unormal koordinasjon, taleforstyrrelse, Grand Mal-kramper;
Psykiatriske lidelser: sjelden - aggresjon, tap av libido, delirium; sjelden - økt libido, anorgasmi, tic, drapstanker, katatoni, søvnvandring
Nyre- og urinveislidelser: sjeldne - urinretensjon, nokturi
Reproduktive system og brystsykdommer: sjelden - erektil dysfunksjon; sjeldne - gynekomasti, uregelmessig menstruasjon, amenoré, brystsmerter, priapisme
Respiratoriske, thorax- og mediastinumsykdommer: sjeldne - nesetetthet, dyspné
Hud- og subkutane vevslidelser: sjeldne - utslett, hyperhidrose, pruritus, lysfølsomhetsreaksjon, alopecia; sjelden - urticaria
Vaskulære lidelser: sjelden - hypotensjon, hypertensjon
Pediatriske pasienter - Oral administrasjon
De fleste bivirkningene observert i den samlede databasen med 1 686 pediatriske pasienter i alderen 6 til 18 år ble også observert i den voksne populasjonen. Ytterligere bivirkninger observert i den pediatriske populasjonen er listet opp nedenfor.
Øyelidelser sjelden - okuologisk krise
Gastrointestinale lidelser: sjeldne -tungen tørr, tungekrampe
Undersøkelser: hyppig - blodinsulin økt
Forstyrrelser i nervesystemet: sjelden - søvnsnakker
Nyre- og urinveislidelser hyppig - enuresis
Hud- og subkutane vevslidelser: sjelden - hirsutisme
Voksne - Intramuskulær injeksjon
De fleste bivirkningene observert i den samlede databasen med 749 voksne pasienter behandlet med ABILIFY-injeksjon, ble også observert i den voksne populasjonen behandlet med oral ABILIFY. Ytterligere bivirkninger observert i ABILIFY-injeksjonspopulasjonen er listet opp nedenfor.
Generelle lidelser og administrasjonsbetingelser: ≥1/100 pasienter - reaksjon på injeksjonsstedet; ≥1/1000 pasienter og
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av ABILIFY etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å etablere en årsakssammenheng med legemiddeleksponering: forekomster av allergisk reaksjon (anafylaktisk reaksjon, angioødem, laryngospasme, kløe/urticaria eller orofaryngeal spasme), patologisk gambling. , hikke og blodsukkersvingninger.
NARKOTIKAHANDEL
Legemidler som har klinisk viktige interaksjoner med ABILIFY
Legemidler som ikke har noen klinisk viktige interaksjoner med ABILIFY
Basert på farmakokinetiske studier er ingen dosejustering av ABILIFY nødvendig når det administreres samtidig med famotidin, valproat, litium, lorazepam.
I tillegg er det ikke nødvendig med dosejustering for substrater av CYP2D6 (f.eks. dekstrometorfan, fluoksetin, paroksetin eller venlafaksin), CYP2C9 (f.eks. warfarin), CYP2C19 (f.eks. omeprazol, warfarin, escitalopram), eller CYP3Ax4n når det administreres sammen med ABILIFY. I tillegg er det ikke nødvendig med dosejustering for valproat, litium, lamotrigin, lorazepam eller sertralin når det administreres sammen med ABILIFY [se KLINISK FARMAKOLOGI ].
Narkotikamisbruk og avhengighet
Kontrollert stoff
ABILIFY er ikke et kontrollert stoff.
Misbruke
ABILIFY har ikke blitt systematisk studert hos mennesker for potensialet for misbruk, toleranse eller fysisk avhengighet. Pasienter bør følgelig evalueres nøye for en historie med narkotikamisbruk, og slike pasienter bør observeres nøye for tegn på ABILIFY 20 mg misbruk eller misbruk (f.eks. utvikling av toleranse, økning i dose, legemiddelsøkende atferd).
Avhengighet
I fysiske avhengighetsstudier hos aper ble abstinenssymptomer observert ved brå opphør av dosering. Selv om de kliniske studiene ikke avdekket noen tendens til narkotikasøkende atferd, var disse observasjonene ikke systematiske, og det er ikke mulig å forutsi på grunnlag av denne begrensede erfaringen i hvilken grad et CNS-aktivt legemiddel vil bli misbrukt, avledet, og/eller misbrukt en gang markedsført.
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Økt dødelighet hos eldre pasienter med demensrelatert psykose
Økt dødelighet
Eldre pasienter med demensrelatert psykose behandlet med antipsykotiske legemidler har økt risiko for død. ABILIFY (aripiprazol) er ikke godkjent for behandling av pasienter med demensrelaterte psykoser [se ADVARSEL i boks].
Sikkerhetserfaring hos eldre pasienter med psykose assosiert med Alzheimers sykdom
I tre, 10-ukers, placebokontrollerte studier av ABILIFY 10mg hos eldre pasienter med psykose assosiert med Alzheimers sykdom (n=938; gjennomsnittsalder: 82,4 år; område: 56-99 år), var bivirkningene som var rapportert med en insidens på ≥3 % og ABILIFY 15 mg insidens minst to ganger den for placebo var sløvhet [placebo 2 %, ABILIFY 5 %], søvnighet (inkludert sedasjon) [placebo 3 %, ABILIFY 8 %] og inkontinens (primært , urininkontinens) [placebo 1 %, ABILIFY 5 %], overdreven salivasjon [placebo 0 %, ABILIFY 4 %] og svimmelhet [placebo 1 %, ABILIFY 4 %].
Sikkerhet og effekt av ABILIFY 15mg ved behandling av pasienter med psykose assosiert med demens er ikke fastslått. Hvis forskriveren velger å behandle slike pasienter med ABILIFY 15 mg, vurder for fremveksten av svelgevansker eller overdreven somnolens, som kan disponere for utilsiktet skade eller aspirasjon [se ADVARSEL i boks ].
Cerebrovaskulære bivirkninger, inkludert hjerneslag
I placebokontrollerte kliniske studier (to fleksible doser og en fastdosestudie) av demensrelatert psykose, var det en økt forekomst av cerebrovaskulære bivirkninger (f.eks. slag, forbigående iskemisk anfall), inkludert dødsfall, hos ABILIFY-behandlede pasienter ( gjennomsnittsalder: 84 år; område: 78-88 år). I fastdosestudien var det et statistisk signifikant doseresponsforhold for cerebrovaskulære bivirkninger hos pasienter behandlet med ABILIFY. ABILIFY er ikke godkjent for behandling av pasienter med demensrelatert psykose [se ADVARSEL i boks ].
Selvmordstanker og -adferd hos barn, ungdom og unge voksne
Pasienter med alvorlig depressiv lidelse (MDD), både voksne og barn, kan oppleve forverring av depresjonen og/eller fremveksten av selvmordstanker og -adferd (suicidalitet) eller uvanlige endringer i atferd, enten de tar antidepressive medisiner eller ikke, og dette risikoen kan vedvare inntil betydelig remisjon oppstår. Selvmord er en kjent risiko for depresjon og visse andre psykiatriske lidelser, og disse lidelsene er i seg selv de sterkeste prediktorene for selvmord. Det har imidlertid vært en langvarig bekymring for at antidepressiva kan ha en rolle i å indusere forverring av depresjon og fremveksten av suicidalitet hos visse pasienter i de tidlige faser av behandlingen. Samlede analyser av kortsiktige, placebokontrollerte studier av antidepressiva (SSRI og andre) viste at disse medikamentene øker risikoen for suicidal tenkning og atferd (suicidalitet) hos barn, ungdom og unge voksne (alder 18-24) med MDD og andre psykiatriske lidelser. Korttidsstudier viste ikke en økning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne over 24 år; det var en reduksjon med antidepressiva sammenlignet med placebo hos voksne i alderen 65 år og eldre.
De samlede analysene av placebokontrollerte studier hos barn og ungdom med MDD, Obsessive Compulsive Disorder (OCD) eller andre psykiatriske lidelser inkluderte totalt 24 korttidsstudier med 9 antidepressiva med over 4400 pasienter. De samlede analysene av placebokontrollerte studier hos voksne med MDD eller andre psykiatriske lidelser inkluderte totalt 295 korttidsstudier (median varighet på 2 måneder) med 11 antidepressiva med over 77 000 pasienter. Det var betydelig variasjon i risiko for suicidalitet blant legemidler, men en tendens til en økning i yngre pasienter for nesten alle legemidler som ble studert. Det var forskjeller i absolutt risiko for suicidalitet på tvers av de forskjellige indikasjonene, med høyest forekomst av MDD. Risikoforskjellene (legemiddel vs. placebo) var imidlertid relativt stabile innenfor aldersstrata og på tvers av indikasjoner. Disse risikoforskjellene (medikament-placebo-forskjell i antall tilfeller av suicidalitet per 1000 behandlede pasienter) er gitt i tabell 5.
Ingen selvmord skjedde i noen av de pediatriske studiene. Det var selvmord i voksenforsøkene, men antallet var ikke tilstrekkelig til å komme til noen konklusjon om legemiddeleffekt på selvmord.
Det er ukjent om suicidalitetsrisikoen strekker seg til langvarig bruk, dvs. utover flere måneder. Det er imidlertid betydelig bevis fra placebokontrollerte vedlikeholdsforsøk hos voksne med depresjon på at bruk av antidepressiva kan forsinke tilbakefall av depresjon.
Alle pasienter som behandles med antidepressiva for enhver indikasjon bør overvåkes hensiktsmessig og observeres nøye for klinisk forverring, suicidalitet og uvanlige endringer i atferd, spesielt i løpet av de første månedene av en medikamentell behandlingskur, eller ved doseendringer, enten økninger eller synker.
Følgende symptomer, angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshet), hypomani og mani, er rapportert hos voksne og pediatriske pasienter som behandles med antidepressiva for MDD samt for andre indikasjoner, både psykiatriske og ikke-psykiatriske. Selv om det ikke er etablert en årsakssammenheng mellom fremveksten av slike symptomer og enten forverring av depresjon og/eller fremveksten av selvmordsimpulser, er det bekymring for at slike symptomer kan representere forløpere til fremvoksende suicidalitet.
Det bør vurderes å endre det terapeutiske regimet, inkludert eventuelt seponering av medisinen, hos pasienter hvis depresjon er vedvarende verre, eller som opplever ny suicidalitet eller symptomer som kan være forløpere til forverring av depresjon eller suicidalitet, spesielt hvis disse symptomene er alvorlige, brå i debut, eller var ikke en del av pasientens symptomer.
Familier og omsorgspersoner til pasienter som behandles med antidepressiva for alvorlig depressiv lidelse eller andre indikasjoner, både psykiatriske og ikke-psykiatriske, bør varsles om behovet for å overvåke pasienter for fremveksten av agitasjon, irritabilitet, uvanlige endringer i atferd og de andre symptomene beskrevet ovenfor , samt fremveksten av suicidalitet, og å rapportere slike symptomer umiddelbart til helsepersonell. Slik overvåking bør inkludere daglig observasjon av familier og omsorgspersoner. Resepter for ABILIFY bør skrives ut for den minste mengde tabletter i samsvar med god pasientbehandling, for å redusere risikoen for overdosering.
Screening av pasienter for bipolar lidelse
En alvorlig depressiv episode kan være den første presentasjonen av bipolar lidelse. Det er generelt antatt (men ikke etablert i kontrollerte studier) at behandling av en slik episode med et antidepressivum alene kan øke sannsynligheten for utfelling av en blandet/manisk episode hos pasienter med risiko for bipolar lidelse. Hvorvidt noen av symptomene beskrevet ovenfor representerer en slik konvertering er ukjent. Før behandling med et antidepressivum startes, bør imidlertid pasienter med depressive symptomer undersøkes tilstrekkelig for å avgjøre om de har risiko for bipolar lidelse; slik screening bør inkludere en detaljert psykiatrisk historie, inkludert en familiehistorie med selvmord, bipolar lidelse og depresjon.
Det skal bemerkes at ABILIFY 20mg ikke er godkjent for bruk i behandling av depresjon hos den pediatriske befolkningen.
Malignt nevroleptikasyndrom (NMS)
Et potensielt dødelig symptomkompleks noen ganger referert til som malignt nevroleptisk syndrom (NMS) kan oppstå ved administrering av antipsykotiske legemidler, inkludert ABILIFY. sjeldne tilfeller av NMS oppstod under ABILIFY 15 mg-behandling i den verdensomspennende kliniske databasen. Kliniske manifestasjoner av NMS er hyperpyreksi, muskelstivhet, endret mental status og bevis på autonom ustabilitet (uregelmessig puls eller blodtrykk, takykardi, diaforese og hjerterytmeforstyrrelser). Ytterligere tegn kan inkludere forhøyet kreatinfosfokinase, myoglobinuri (rabdomyolyse) og akutt nyresvikt.
Den diagnostiske evalueringen av pasienter med dette syndromet er komplisert. For å komme frem til en diagnose er det viktig å utelukke tilfeller der den kliniske presentasjonen inkluderer både alvorlig medisinsk sykdom (f.eks. lungebetennelse, systemisk infeksjon) og ubehandlede eller utilstrekkelig behandlede ekstrapyramidale tegn og symptomer (EPS). Andre viktige hensyn i differensialdiagnosen inkluderer sentral antikolinergisk toksisitet, heteslag, medikamentfeber og primær patologi i sentralnervesystemet.
Behandlingen av NMS bør omfatte: 1) umiddelbar seponering av antipsykotiske legemidler og andre legemidler som ikke er avgjørende for samtidig behandling; 2) intensiv symptomatisk behandling og medisinsk overvåking; og 3) behandling av eventuelle samtidige alvorlige medisinske problemer som spesifikke behandlinger er tilgjengelige for. Det er ingen generell enighet om spesifikke farmakologiske behandlingsregimer for ukomplisert NMS.
Dersom en pasient trenger antipsykotisk medikamentbehandling etter bedring fra NMS, bør mulig gjeninnføring av medikamentell behandling vurderes nøye. Pasienten bør overvåkes nøye, siden tilbakefall av NMS er rapportert.
Tardiv dyskinesi
Et syndrom med potensielt irreversible, ufrivillige, dyskinetiske bevegelser kan utvikles hos pasienter som behandles med antipsykotiske legemidler. Selv om prevalensen av syndromet ser ut til å være høyest blant eldre, spesielt eldre kvinner, er det umulig å stole på prevalensestimater for å forutsi, ved starten av antipsykotisk behandling, hvilke pasienter som sannsynligvis vil utvikle syndromet. Hvorvidt antipsykotiske legemidler er forskjellige i deres potensial til å forårsake tardiv dyskinesi er ukjent.
Risikoen for å utvikle tardiv dyskinesi og sannsynligheten for at den blir irreversibel antas å øke etter hvert som behandlingens varighet og den totale kumulative dosen av antipsykotiske legemidler som gis til pasienten øker. Imidlertid kan syndromet utvikle seg, selv om det er mye mindre vanlig, etter relativt korte behandlingsperioder ved lave doser.
Tardiv dyskinesi kan gi seg, delvis eller fullstendig, hvis antipsykotisk behandling seponeres. Antipsykotisk behandling kan imidlertid i seg selv undertrykke (eller delvis undertrykke) tegn og symptomer på syndromet og kan derved muligens maskere den underliggende prosessen. Effekten som symptomatisk undertrykkelse har på det langsiktige forløpet av syndromet er ukjent.
Gitt disse hensynene bør ABILIFY forskrives på en måte som mest sannsynlig minimerer forekomsten av tardiv dyskinesi. Kronisk antipsykotisk behandling bør generelt være forbeholdt pasienter som lider av en kronisk sykdom som (1) er kjent for å reagere på antipsykotiske legemidler og (2) for hvem alternative, like effektive, men potensielt mindre skadelige behandlinger ikke er tilgjengelige eller hensiktsmessige. Hos pasienter som trenger kronisk behandling, bør den minste dosen og den korteste behandlingsvarigheten som gir en tilfredsstillende klinisk respons søkes. Behovet for fortsatt behandling bør revurderes med jevne mellomrom.
Hvis tegn og symptomer på tardiv dyskinesi vises hos en pasient på ABILIFY, bør seponering av medikamentet vurderes. Noen pasienter kan imidlertid trenge behandling med ABILIFY 15 mg til tross for tilstedeværelsen av syndromet.
Metabolske endringer
Atypiske antipsykotiske legemidler har vært assosiert med metabolske endringer som inkluderer hyperglykemi/diabetes mellitus, dyslipidemi og kroppsvektøkning. Mens alle legemidler i klassen har vist seg å gi noen metabolske endringer, har hvert legemiddel sin egen spesifikke risikoprofil.
Hyperglykemi/diabetes mellitus
Hyperglykemi, i noen tilfeller ekstrem og assosiert med ketoacidose eller hyperosmolar koma eller død, er rapportert hos pasienter behandlet med atypiske antipsykotika. Det har vært rapporter om hyperglykemi hos pasienter behandlet med ABILIFY [se BIVIRKNINGER ]. Vurdering av sammenhengen mellom atypisk antipsykotisk bruk og glukoseavvik kompliseres av muligheten for økt bakgrunnsrisiko for diabetes mellitus hos pasienter med schizofreni og den økende forekomsten av diabetes mellitus i befolkningen generelt. Gitt disse konfounderne, er forholdet mellom atypisk antipsykotisk bruk og hyperglykemi-relaterte bivirkninger ikke fullstendig forstått. Epidemiologiske studier tyder imidlertid på økt risiko for hyperglykemi-relaterte bivirkninger hos pasienter behandlet med de atypiske antipsykotika. Fordi ABILIFY ikke ble markedsført på det tidspunktet disse studiene ble utført, er det ikke kjent om ABILIFY er assosiert med denne økte risikoen. Nøyaktige risikoestimater for hyperglykemi-relaterte bivirkninger hos pasienter behandlet med atypiske antipsykotika er ikke tilgjengelig.
Pasienter med etablert diagnose diabetes mellitus som starter på atypiske antipsykotika bør overvåkes regelmessig for forverring av glukosekontrollen. Pasienter med risikofaktorer for diabetes mellitus (f.eks. fedme, familiehistorie med diabetes) som starter behandling med atypiske antipsykotika, bør gjennomgå fastende blodsukkertesting i begynnelsen av behandlingen og med jevne mellomrom under behandlingen. Alle pasienter som behandles med atypiske antipsykotika bør overvåkes for symptomer på hyperglykemi, inkludert polydipsi, polyuri, polyfagi og svakhet. Pasienter som utvikler symptomer på hyperglykemi under behandling med atypiske antipsykotika bør gjennomgå fastende blodsukkertesting. I noen tilfeller har hyperglykemi gått over når det atypiske antipsykotikaet ble seponert; noen pasienter trengte imidlertid fortsettelse av antidiabetisk behandling til tross for seponering av det mistenkte legemidlet.
Voksne
en analyse av 13 placebokontrollerte monoterapistudier hos voksne, primært med schizofreni eller bipolar lidelse, var gjennomsnittlig endring i fastende glukose hos ABILIFY-behandlede pasienter (+4,4 mg/dL; median eksponering 25 dager; N=1057) ikke signifikant annerledes enn hos placebobehandlede pasienter (+2,5 mg/dL; median eksponering 22 dager; N=799). Tabell 6 viser andelen ABILIFY-behandlede pasienter med normal og borderline fastende glukose ved baseline (median eksponering 25 dager) som hadde behandlingsfremkomne målinger av høy fastende glukose sammenlignet med placebo-behandlede pasienter (median eksponering 22 dager).
Ved 24 uker var den gjennomsnittlige endringen i fastende glukose hos ABILIFY-behandlede pasienter ikke signifikant forskjellig fra placebo-behandlede pasienter [henholdsvis +2,2 mg/dL (n=42) og +9,6 mg/dL (n=28)] .
Gjennomsnittlig endring i fastende glukose hos pasienter behandlet med tilleggs-ABILIFY med alvorlig depressiv lidelse (+0,7 mg/dL; median eksponering 42 dager; N=241) var ikke signifikant forskjellig fra placebo-behandlede pasienter (+0,8 mg/dL; median eksponering 42 dager; N=246). Tabell 7 viser andelen voksne pasienter med endringer i fastende glukosenivåer fra to placebokontrollerte, tilleggsstudier (median eksponering 42 dager) hos pasienter med alvorlig depressiv lidelse.
Pediatriske pasienter og ungdom
I en analyse av to placebokontrollerte studier hos ungdom med schizofreni (13 til 17 år) og pediatriske pasienter med bipolar lidelse (10 til 17 år), den gjennomsnittlige endringen i fastende glukose hos ABILIFY-behandlede pasienter (+4,8 mg/dL; med en median eksponering på 43 dager; N=259) var ikke signifikant forskjellig fra placebobehandlede pasienter (+1,7 mg/dL; med en median eksponering på 42 dager; N=123).
en analyse av to placebokontrollerte studier hos pediatriske og ungdomspasienter med irritabilitet assosiert med autistisk lidelse (6 til 17 år) med median eksponering på 56 dager, viste gjennomsnittlig endring i fastende glukose hos pasienter behandlet med ABILIFY (–0,2 mg). /dL; N=83) var ikke signifikant annerledes enn hos placebobehandlede pasienter (–0,6 mg/dL; N=33).
I en analyse av to placebokontrollerte studier hos pediatriske og ungdomspasienter med Tourettes lidelse (6 til 18 år) med median eksponering på 57 dager, viste gjennomsnittlig endring i fastende glukose hos pasienter behandlet med ABILIFY (0,79 mg/dL; N=90) var ikke signifikant forskjellig fra placebobehandlede pasienter (–1,66 mg/dL; N=58).
Tabell 8 viser andelen pasienter med endringer i fastende glukosenivåer fra de sammenslåtte ungdomsschizofreni- og pediatriske bipolare pasientene (median eksponering på 42-43 dager), fra to placebokontrollerte studier med pediatriske pasienter (6 til 17 år) med irritabilitet assosiert med autistisk lidelse (median eksponering på 56 dager), og fra de to placebokontrollerte studiene på pediatriske pasienter (6 til 18 år) med Tourettes lidelse (median eksponering 57 dager).
Etter 12 uker i de samlede studiene med schizofreni og pediatrisk bipolar lidelse hos ungdom var den gjennomsnittlige endringen i fastende glukose hos ABILIFY-behandlede pasienter ikke signifikant forskjellig fra placebobehandlede pasienter [+2,4 mg/dL (n=81) og +0,1 mg /dL (n=15), henholdsvis].
Dyslipidemi
Uønskede endringer i lipider er observert hos pasienter behandlet med atypiske antipsykotika.
Det var ingen signifikante forskjeller mellom ABILIFY- og placebobehandlede pasienter i andelen med endringer fra normale til klinisk signifikante nivåer for fastende/ikke-fastende totalkolesterol, fastende triglyserider, fastende LDL-er og fastende/ikke-fastende HDL-er. Analyser av pasienter med minst 12 eller 24 ukers eksponering var begrenset av et lite antall pasienter.
Voksne
Tabell 9 viser andelen voksne pasienter, primært fra sammenslåtte schizofreni og bipolar lidelse monoterapi placebokontrollerte studier, med endringer i totalt kolesterol (sammenslått fra 17 studier; median eksponering 21 til 25 dager), fastende triglyserider (samlet fra åtte studier; median eksponering 42 dager), fastende LDL-kolesterol (samlet fra åtte studier; median eksponering 39 til 45 dager, bortsett fra placebo-behandlede pasienter med normal fastende LDL-målinger ved baseline, som hadde median behandlingseksponering på 24 dager) og HDL-kolesterol (sammenslått fra ni forsøk; median eksponering 40 til 42 dager).
monoterapistudier hos voksne var andelen pasienter etter 12 uker og 24 uker med endringer fra Normal til Høy i totalkolesterol (fastende/ikke-fastende), fastende triglyserider og fastende LDL-kolesterol lik mellom ABILIFY- og placebobehandlede pasienter: kl. 12 uker, totalt kolesterol (fastende/ikke-fastende), 1/71 (1,4%) vs. 3/74 (4,1%); Fastende triglyserider, 8/62 (12,9%) vs. 5/37 (13,5%); Fastende LDL-kolesterol, henholdsvis 0/34 (0%) vs. 1/25 (4,0%); og ved 24 uker, totalt kolesterol (fastende/ikke-fastende), 1/42 (2,4%) vs. 3/37 (8,1%); Fastende triglyserider, 5/34 (14,7%) vs. 5/20 (25%); Fastende LDL-kolesterol, henholdsvis 0/22 (0 %) vs. 1/18 (5,6 %).
Tabell 10 viser andelen pasienter med endringer i totalkolesterol (fastende/ikke-fastende), fastende triglyserider, fastende LDL-kolesterol og HDL-kolesterol fra to placebokontrollerte tilleggsstudier hos voksne pasienter med alvorlig depressiv lidelse (median eksponering 42 dager).
Pediatriske pasienter og ungdom
Tabell 11 viser andelen ungdom med schizofreni (13 til 17 år) og pediatriske pasienter med bipolar lidelse (10 til 17 år) med endringer i totalt kolesterol og HDL-kolesterol (sammenslått fra to placebokontrollerte studier; median eksponering 42 til 43 dager ) og fastende triglyserider (sammenslått fra to placebokontrollerte studier; median eksponering 42 til 44 dager).

monoterapistudier med ungdom med schizofreni og pediatriske pasienter med bipolar lidelse, var andelen pasienter etter 12 uker og 24 uker med endringer fra Normal til Høy i totalkolesterol (fastende/ikke-fastende), fastende triglyserider og fastende LDL-kolesterol lik mellom ABILIFY - og placebobehandlede pasienter: ved 12 uker, totalkolesterol (fastende/ikke-fastende), 0/57 Â (0%) vs. 0/15 (0%); Fastende triglyserider, henholdsvis 2/72 (2,8 %) vs. 1/14 (7,1 %); og ved 24 uker, totalt kolesterol (fastende/ikke-fastende), 0/36 (0%) vs. 0/12 (0%); Fastende triglyserider, henholdsvis 1/47 (2,1 %) vs. 1/10 (10,0 %).
Tabell 12 viser andelen pasienter med endringer i totalkolesterol (fastende/ikke-fastende) og fastende triglyserider (median eksponering 56 dager) og HDL-kolesterol (median eksponering 55 til 56 dager) fra to placebokontrollerte studier hos pediatriske pasienter (6 til 17 dager) år) med irritabilitet assosiert med autistisk lidelse.
Tabell 13 viser andelen pasienter med endringer i totalkolesterol (fastende/ikke-fastende) og fastende triglyserider (median eksponering 57 dager) og HDL-kolesterol (median eksponering 57 dager) fra to placebokontrollerte studier hos pediatriske pasienter (6 til 18 år) med Tourettes lidelse.
Vektøkning
Vektøkning er observert ved atypisk antipsykotisk bruk. Klinisk overvåking av vekt anbefales.
Voksne
I en analyse av 13 placebokontrollerte monoterapistudier, primært fra samlet schizofreni og bipolar lidelse, med en median eksponering på 21 til 25 dager, var gjennomsnittlig endring i kroppsvekt hos ABILIFY-behandlede pasienter +0,3 kg (N=1673) sammenlignet med til 0,1 kg (N=1100) hos placebokontrollerte pasienter. Ved 24 uker var gjennomsnittlig endring fra baseline i kroppsvekt hos ABILIFY-behandlede pasienter –1,5 kg (n=73) sammenlignet med –0,2 kg (n=46) hos placebobehandlede pasienter.
forsøkene med å legge ABILIFY til antidepressiva, fikk pasientene først 8 uker med antidepressiv behandling etterfulgt av 6 uker med tilleggs ABILIFY 10 mg eller placebo i tillegg til deres pågående antidepressiva behandling. Gjennomsnittlig endring i kroppsvekt hos pasienter som fikk tilleggs ABILIFY var +1,7 kg (N=347) sammenlignet med +0,4 kg (N=330) hos pasienter som fikk tilleggs placebo.
Tabell 14 viser prosentandelen av voksne pasienter med vektøkning ≥7 % av kroppsvekten etter indikasjon.
Pediatriske pasienter og ungdom
I en analyse av to placebokontrollerte studier hos ungdom med schizofreni (13 til 17 år) og pediatriske pasienter med bipolar lidelse (10 til 17 år) med median eksponering på 42 til 43 dager, viste gjennomsnittlig endring i kroppsvekt hos ABILIFY-behandlede pasientene var +1,6 kg (N=381) sammenlignet med +0,3 kg (N=187) hos placebobehandlede pasienter. Ved 24 uker var gjennomsnittlig endring fra baseline i kroppsvekt i
ABILIFY-behandlede pasienter var +5,8 kg (n=62) sammenlignet med +1,4 kg (n=13) hos placebobehandlede pasienter.
to kortsiktige, placebokontrollerte studier med pasienter (6 til 17 år) med irritabilitet assosiert med autistisk lidelse med median eksponering på 56 dager, var gjennomsnittlig endring i kroppsvekt hos ABILIFY-behandlede pasienter +1,6 kg (n=209) ) sammenlignet med +0,4 kg (n=98) hos placebobehandlede pasienter.
I to kortsiktige, placebokontrollerte studier med pasienter (6 til 18 år) med Tourettes lidelse med median eksponering på 57 dager, var gjennomsnittlig endring i kroppsvekt hos ABILIFY-behandlede pasienter +1,5 kg (n=105) ) sammenlignet med +0,4 kg (n=66) hos placebobehandlede pasienter.
Tabell 15 viser prosentandelen av pediatriske og ungdomspasienter med vektøkning ≥7 % av kroppsvekten etter indikasjon.
en åpen studie som inkluderte pasienter fra de to placebokontrollerte studiene med ungdom med schizofreni (13 til 17 år) og pediatriske pasienter med bipolar lidelse (10 til 17 år), fullførte 73,2 % av pasientene (238/325) 26 uker med terapi med ABILIFY. Etter 26 uker økte 32,8 % av pasientene ≥7 % av kroppsvekten, ikke justert for normal vekst. For å justere for normal vekst ble z-score utledet (målt i standardavvik [SD]), som normaliserer den naturlige veksten til pediatriske pasienter og ungdom ved sammenligning med alders- og kjønnsmatchede populasjonsstandarder. En z-score endring
en åpen studie som inkluderte pasienter fra to kortsiktige, placebokontrollerte studier, pasienter (6 til 17 år) med irritabilitet assosiert med autistisk lidelse, samt de novo pasienter, fullførte 60,3 % (199/330) en års terapi med ABILIFY. Gjennomsnittlig endring i vekt z-score var 0,26 SD for pasienter som fikk >9 måneders behandling.
Ved behandling av pediatriske pasienter for enhver indikasjon, bør vektøkning overvåkes og vurderes mot det som forventes for normal vekst.
Patologisk gambling og annen tvangsmessig atferd
Kasusrapporter etter markedsføring tyder på at pasienter kan oppleve intense trang, spesielt for gambling, og manglende evne til å kontrollere disse trangene mens de tar aripiprazol. Andre tvangsmessige drifter, rapportert sjeldnere, inkluderer: seksuelle drifter, shopping, spising eller overspising og annen impulsiv eller tvangsmessig atferd. Fordi pasienter kanskje ikke gjenkjenner denne atferden som unormal, er det viktig for forskrivere å spørre pasienter eller deres omsorgspersoner spesifikt om utviklingen av nye eller intense spilletrang, tvangsmessige seksuelle trang, tvangshandlinger, overstadig eller tvangsmessig spising eller andre trang under behandling. med aripiprazol. Det bør bemerkes at impulskontrollsymptomer kan være assosiert med den underliggende lidelsen. I noen tilfeller, selv om ikke alle, ble trang rapportert å ha stoppet når dosen ble redusert eller medisinen ble seponert. Tvangsmessig atferd kan føre til skade på pasienten og andre hvis den ikke blir gjenkjent. Vurder dosereduksjon eller å stoppe medisinen hvis en pasient utvikler slike trang.
Ortostatisk hypotensjon
ABILIFY 20mg kan forårsake ortostatisk hypotensjon, kanskje på grunn av dens α1-adrenerge reseptorantagonisme. Forekomsten av ortostatisk hypotensjon-assosierte hendelser fra kortsiktige, placebokontrollerte studier av voksne pasienter på oral ABILIFY (n=2467) inkluderte (ABILIFY 20 mg forekomst, placeboforekomst) ortostatisk hypotensjon (1 %, 0,3 %), postural svimmelhet ( 0,5 %, 0,3 %) og synkope (0,5 %, 0,4 %); av pediatriske pasienter 6 til 18 år (n=732) på oral ABILIFY inkluderte ortostatisk hypotensjon (0,5 %, 0 %), postural svimmelhet (0,4 %, 0 %) og synkope (0,2 %, 0 %); og av pasienter på ABILIFY-injeksjon (n=501) inkluderte ortostatisk hypotensjon (0,6 %, 0 %), postural svimmelhet (0,2 %, 0,5 %) og synkope (0,4 %, 0 %) [se BIVIRKNINGER ].
Forekomsten av en signifikant ortostatisk endring i blodtrykk (definert som en reduksjon i systolisk blodtrykk ≥20 mmHg ledsaget av en økning i hjertefrekvens ≥25 slag/min ved sammenligning av stående og liggende verdier) for ABILIFY var ikke signifikant forskjellig fra placebo (ABILIFY-forekomst , placeboforekomst): hos voksne orale ABILIFY-behandlede pasienter (4 %, 2 %), hos pediatriske orale
ABILIFY-behandlede pasienter i alderen 6 til 18 år (0,4 %, 1 %) eller hos ABILIFY 15 mg injeksjonsbehandlede pasienter (3 %, 2 %).
ABILIFY 20 mg bør brukes med forsiktighet hos pasienter med kjent kardiovaskulær sykdom (historie med hjerteinfarkt eller iskemisk hjertesykdom, hjertesvikt eller ledningsforstyrrelser), cerebrovaskulær sykdom eller tilstander som kan disponere pasienter for hypotensjon (dehydrering, hypovolemi og behandling med antihypertensiva). medisiner) [se NARKOTIKAHANDEL ].
Hvis parenteral benzodiazepinbehandling anses nødvendig i tillegg til ABILIFY-injeksjonsbehandling, bør pasienter overvåkes for overdreven sedasjon og for ortostatisk hypotensjon [se NARKOTIKAHANDEL ].
Falls
Antipsykotika, inkludert ABILIFY 10 mg, kan forårsake somnolens, postural hypotensjon, motorisk og sensorisk ustabilitet, noe som kan føre til fall og følgelig brudd eller andre skader. For pasienter med sykdommer, tilstander eller medisiner som kan forverre disse effektene, fullfør fallrisikovurderinger ved oppstart av antipsykotisk behandling og gjentatte ganger for pasienter på langvarig antipsykotisk behandling.
Leukopeni, nøytropeni og agranulocytose
I kliniske studier og/eller erfaring etter markedsføring har hendelser med leukopeni og nøytropeni blitt rapportert tidsmessig relatert til antipsykotiske midler, inkludert ABILIFY. Agranulocytose er også rapportert.
Mulige risikofaktorer for leukopeni/nøytropeni inkluderer eksisterende lavt antall hvite blodlegemer (WBC)/absolutt nøytrofiltall (ANC) og historie med legemiddelindusert leukopeni/nøytropeni. Hos pasienter med en historie med klinisk signifikant lav WBC/ANC eller legemiddelindusert leukopeni/nøytropeni, utfør en fullstendig blodtelling (CBC) ofte i løpet av de første månedene av behandlingen. Vurder seponering av ABILIFY hos slike pasienter ved første tegn på en klinisk signifikant reduksjon i WBC i fravær av andre årsaksfaktorer.
Overvåk pasienter med klinisk signifikant nøytropeni for feber eller andre symptomer eller tegn på infeksjon og behandle umiddelbart dersom slike symptomer eller tegn oppstår. Seponer ABILIFY 20 mg hos pasienter med alvorlig nøytropeni (absolutt nøytrofiltall
Kramper/kramper
kortsiktige, placebokontrollerte studier forekom pasienter med en historie med anfall ekskluderte anfall/kramper hos 0,1 % (3/2467) av udiagnostiserte voksne pasienter behandlet med oral ABILIFY 20 mg, hos 0,1 % (1/732) av pediatriske pasienter. (6 til 18 år), og hos 0,2 % (1/501) av voksne ABILIFY 15 mg injeksjonsbehandlede pasienter.
Som med andre antipsykotiske legemidler, bør ABILIFY 15 mg brukes med forsiktighet hos pasienter med tidligere anfall eller med tilstander som senker krampeterskelen. Tilstander som senker anfallsterskelen kan være mer utbredt i en befolkning på 65 år eller eldre.
Potensial for kognitiv og motorisk svikt
ABILIFY kan, som andre antipsykotika, ha potensial til å svekke dømmekraft, tenkning eller motoriske ferdigheter. For eksempel, i kortsiktige, placebokontrollerte studier, ble somnolens (inkludert sedasjon) rapportert som følger (ABILIFY-forekomst, placeboforekomst): hos voksne pasienter (n=2467) behandlet med oral ABILIFY (11 %, 6 %), hos pediatriske pasienter i alderen 6 til 17 (n=611) (24 %, 6 %), og hos voksne pasienter (n=501) på ABILIFY-injeksjon (9 %, 6 %). Somnolens (inkludert sedasjon) førte til seponering hos 0,3 % (8/2467) av voksne pasienter og 3 % (20/732) av pediatriske pasienter (6 til 18 år) på oral ABILIFY 10 mg i kortsiktige, placebokontrollerte studier, men førte ikke til seponering av noen voksne pasienter på ABILIFY-injeksjon.
Til tross for den relativt beskjedne økte forekomsten av disse hendelsene sammenlignet med placebo, bør pasienter advares mot bruk av farlige maskiner, inkludert biler, inntil de er rimelig sikre på at behandling med ABILIFY 15 mg ikke påvirker dem negativt.
Kroppstemperaturregulering
Forstyrrelse av kroppens evne til å redusere kjernekroppstemperaturen er blitt tilskrevet antipsykotiske midler. Passende forsiktighet anbefales ved forskrivning av ABILIFY 10 mg til pasienter som vil oppleve tilstander som kan bidra til en økning i kjernekroppstemperatur, (f.eks. å trene hardt, eksponering for ekstrem varme, samtidig motta medisiner med antikolinerg aktivitet, eller være utsatt for dehydrering) [se BIVIRKNINGER ].
Selvmord
Muligheten for et selvmordsforsøk er iboende i psykotiske sykdommer, bipolar lidelse og alvorlig depressiv lidelse, og tett oppfølging av høyrisikopasienter bør følge medikamentell behandling. Resepter for ABILIFY bør skrives ut for den minste mengde i samsvar med god pasientbehandling for å redusere risikoen for overdose [se BIVIRKNINGER ].
Dysfagi
Esophageal dysmotilitet og aspirasjon har vært assosiert med bruk av antipsykotiske legemidler, inkludert ABILIFY. Aspirasjonspneumoni er en vanlig årsak til sykelighet og dødelighet hos eldre pasienter, spesielt de med avansert Alzheimers demens. ABILIFY og andre antipsykotiske legemidler bør brukes med forsiktighet hos pasienter med risiko for aspirasjonspneumoni [se Økt dødelighet hos eldre pasienter med demensrelatert psykose  og BIVIRKNINGER ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning ).
Diskuter følgende problemer med pasienter som er foreskrevet ABILIFY:
Klinisk forverring av depresjon og selvmordsrisiko
Pasienter, deres familier og deres omsorgspersoner bør oppmuntres til å være oppmerksomme på fremveksten av angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshet), hypomani, mani, andre uvanlige endringer i atferd. , forverring av depresjon og selvmordstanker, spesielt tidlig under antidepressiv behandling og når dosen justeres opp eller ned. Familier og omsorgspersoner til pasienter bør rådes til å se etter forekomsten av slike symptomer på daglig basis, siden endringer kan være brå. Slike symptomer bør rapporteres til pasientens forskriver eller helsepersonell, spesielt hvis de er alvorlige, plutselige eller ikke var en del av pasientens symptomer. Symptomer som disse kan være assosiert med økt risiko for suicidal tenkning og atferd og indikerer behov for svært nøye overvåking og muligens endringer i medisinen [se ADVARSLER OG FORHOLDSREGLER ].
Forskrivere eller annet helsepersonell bør informere pasienter, deres familier og deres omsorgspersoner om fordelene og risikoene forbundet med behandling med ABILIFY og bør gi dem råd om riktig bruk. En pasientmedisineringsveiledning inkludert informasjon om "Antidepressive medisiner, depresjon og andre alvorlige psykiske sykdommer, og selvmordstanker eller handlinger" er tilgjengelig for ABILIFY. Forskriveren eller helsepersonell bør instruere pasienter, deres familier og deres omsorgspersoner om å lese medisinveiledningen og bør hjelpe dem med å forstå innholdet. Pasienter bør gis mulighet til å diskutere innholdet i legemiddelveiledningen og få svar på spørsmål de måtte ha. Det skal bemerkes at ABILIFY ikke er godkjent som enkeltmiddel for behandling av depresjon og ikke har blitt evaluert ved pediatrisk alvorlig depressiv lidelse.
Patologisk gambling og annen tvangsmessig atferd
Informer pasienter og deres omsorgspersoner om muligheten for at de kan oppleve tvangstanker til å handle, intens trang til å spille, tvangsmessig seksuell trang, overspising og/eller andre tvangstanker og manglende evne til å kontrollere disse trangene mens de tar aripiprazol. I noen tilfeller, men ikke alle, ble trangene rapportert å ha stoppet når dosen ble redusert eller stoppet [se ADVARSLER OG FORHOLDSREGLER ].
Bruk av oralt desintegrerende tablett
Ikke åpne blisterpakningen før den er klar til administrering. For fjerning av en enkelt tablett, åpne pakken og trekk av folien på blisterpakningen for å avsløre tabletten. Ikke skyv tabletten gjennom folien fordi dette kan skade tabletten. Umiddelbart etter åpning av blisterpakningen, bruk tørre hender, fjern tabletten og plasser hele ABILIFY DISCMELT oralt desintegrerende tablett på tungen. Tablettdesintegrasjon skjer raskt i spytt. Det anbefales at ABILIFY DISCMELT tas uten væske. Men om nødvendig kan den tas med væske. Ikke prøv å dele nettbrettet.
Interferens med kognitiv og motorisk ytelse
Fordi ABILIFY kan ha potensial til å svekke dømmekraft, tenkning eller motoriske ferdigheter, bør pasienter advares mot å betjene farlige maskiner, inkludert biler, inntil de er rimelig sikre på at ABILIFY-terapi ikke påvirker dem negativt [se ADVARSLER OG FORHOLDSREGLER ].
Samtidig medisinering
Pasienter bør rådes til å informere legen om de tar, eller planlegger å ta, reseptbelagte eller reseptfrie legemidler, siden det er potensial for interaksjoner [se NARKOTIKAHANDEL ].
Varmeeksponering og dehydrering
Pasienter bør informeres om passende omsorg for å unngå overoppheting og dehydrering [se ADVARSLER OG FORHOLDSREGLER ].
Sukkerinnhold
Pasienter bør informeres om at hver ml ABILIFY 10 mg oral oppløsning inneholder 400 mg sukrose og 200 mg fruktose.
Svangerskap
Råd pasienter til å varsle helsepersonell dersom de blir gravide eller har tenkt å bli gravide under behandling med ABILIFY. Informer pasienter om at ABILIFY 20 mg kan forårsake ekstrapyramidale og/eller abstinenssymptomer (agitasjon, hypertoni, hypotoni, skjelving, somnolens, pustebesvær og matforstyrrelser) hos en nyfødt. Gi pasienter beskjed om at det finnes et graviditetsregister som overvåker graviditetsutfall hos kvinner eksponert for ABILIFY 15 mg under graviditet [se Bruk i spesifikke populasjoner ].
Fenylketonurika
Fenylalanin er en komponent i aspartam. Hver ABILIFY DISCMELT oralt desintegrerende tablett inneholder følgende mengder: 10 mg, 1,12 mg fenylalanin og 15 mg, 1,68 mg fenylalanin.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Livstids karsinogenitetsstudier ble utført i ICR-mus, F344-rotter og Sprague-Dawley (SD)-rotter. Aripiprazol ble administrert i 2 år i dietten i doser på 1, 3, 10 og 30 mg/kg/dag til ICR-mus og 1, 3 og 10 mg/kg/dag til F344-rotter (0,2, 0,5, 2 og 5 ganger og henholdsvis 0,3, 1 og 3 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate). I tillegg ble SD-rotter doseret oralt i 2 år med 10, 20, 40 og 60 mg/kg/dag, som er 3, 6, 13 og 19 ganger MRHD basert på mg/m² kroppsoverflate. Aripiprazol induserte ikke svulster hos hannmus eller hannrotter. Hos hunnmus økte forekomsten av hypofyseadenomer og brystkjerteladenokarsinomer og adenoakantomer ved diettdoser på 3 til 30 mg/kg/dag (0,5 til 5 ganger MRHD). Hos hunnrotter ble forekomsten av brystkjertelfibroadenomer økt ved en diettdose på 10 mg/kg/dag (3 ganger MRHD); og forekomsten av binyrebarkkarsinomer og kombinerte adrenokortikale adenomer/karsinomer ble økt ved en oral dose på 60 mg/kg/dag (19 ganger MRHD).
En økning i bryst-, hypofyse- og endokrine bukspyttkjertelneoplasmer er funnet hos gnagere etter kronisk administrering av andre antipsykotiske legemidler og anses å være mediert av forlenget dopamin D2-reseptorantagonisme og hyperprolaktinemi. Serumprolaktin ble ikke målt i karsinogenitetsstudiene for aripiprazol. Økninger i serumprolaktinnivåer ble imidlertid observert hos hunnmus i en 13-ukers diettstudie ved doser assosiert med brystkjertel- og hypofysetumorer. Serumprolaktin ble ikke økt hos hunnrotter i 4-ukers og 13-ukers diettstudier ved dosen assosiert med brystkjertelsvulster. Relevansen for menneskelig risiko av funn av prolaktin-medierte endokrine svulster hos gnagere er uklar.
Mutagenese
Det mutagene potensialet til aripiprazol ble testet i in vitro bakteriell revers-mutasjonsanalyse, in vitro bakteriell DNA-reparasjonsanalyse, in vitro forover-genmutasjonsanalyse i muselymfomceller, in vitro kromosomavviksanalyse i kinesisk hamsterlunge (CHL) celler, mikronukleusanalysen in vivo hos mus og den ikke-planlagte DNA-synteseanalysen hos rotter. Aripiprazol og en metabolitt (2,3-DCPP) var klastogene i in vitro-kromosomavviksanalysen i CHL-celler med og uten metabolsk aktivering. Metabolitten, 2,3DCPP, økte numeriske aberrasjoner i in vitro-analysen i CHL-celler i fravær av metabolsk aktivering. En positiv respons ble oppnådd i in vivo mikronukleusanalysen i mus; responsen skyldtes imidlertid en mekanisme som ikke ble ansett som relevant for mennesker.
Nedsatt fruktbarhet
Hunnrotter ble behandlet oralt med aripiprazol fra 2 uker før paring til og med svangerskapsdag 7 i doser på 2, 6 og 20 mg/kg/dag, som er 0,6, 2 og 6 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate. Uregelmessigheter i estrussyklus og økt corpora lutea ble sett ved alle doser, men ingen svekkelse av fertilitet ble sett. Økt pre-implantasjonstap ble sett ved 2 og 6 ganger MRHD, og redusert fostervekt ble sett ved 6 ganger MRHD.
Hannrotter ble behandlet oralt med aripiprazol fra 9 uker før paring til parring med doser på 20, 40 og 60 mg/kg/dag, som er 6, 13 og 19 ganger MRHD på 30 mg/dag basert på mg/ m² kroppsoverflate. Forstyrrelser i spermatogenese ble sett ved 19 ganger MRHD og prostataatrofi ble sett ved 13 og 19 ganger MRHD uten svekkelse av fertilitet.
Bruk i spesifikke populasjoner
Svangerskap
Eksponeringsregister for graviditet
Det finnes et graviditetseksponeringsregister som overvåker graviditetsutfall hos kvinner som eksponeres for atypiske antipsykotika, inkludert ABILIFY, under graviditet. Helsepersonell oppfordres til å registrere pasienter ved å kontakte National Pregnancy Registry for Atypical Antipsychotics på 1-866-961-2388 eller besøk http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/.
Risikosammendrag
Nyfødte eksponert for antipsykotiske legemidler, inkludert ABILIFY 20 mg, i løpet av tredje trimester av svangerskapet er i fare for ekstrapyramidale og/eller abstinenssymptomer etter fødsel (se Kliniske betraktninger ). Samlet tilgjengelige data fra publiserte epidemiologiske studier av gravide kvinner eksponert for aripiprazol har ikke etablert en medikamentassosiert risiko for alvorlige fødselsskader, spontanabort eller ugunstige utfall hos mor eller foster (se Data ). Det er risiko for moren forbundet med ubehandlet schizofreni, bipolar lidelse I eller alvorlig depressiv lidelse, og med eksponering for antipsykotika, inkludert ABILIFY, under graviditet (se Kliniske betraktninger ).
I reproduksjonsstudier på dyr ble oral og intravenøs administrering av aripiprazol under organogenese hos rotter og/eller kaniner i doser på henholdsvis 10 og 19 ganger, den maksimale anbefalte humane dosen (MRHD) på 30 mg/dag basert på mg/m² kroppsoverflate. fosterdød, redusert fostervekt, testikler som ikke har gått ned, forsinket skjelettforbening, skjelettavvik og diafragmabrokk. Oral og intravenøs administrering av aripiprazol i den pre- og postnatale perioden hos rotter ved doser 10 ganger MRHD basert på mg/m² kroppsoverflate, ga forlenget svangerskap, dødfødsler, redusert valpevekt og redusert valpeoverlevelse (se Data ).
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2-4 % og 15-20 %.
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-/fosterrisiko
Det er en risiko for mor fra ubehandlet schizofreni eller bipolar lidelse I, inkludert økt risiko for tilbakefall, sykehusinnleggelse og selvmord. Schizofreni og bipolar lidelse I er assosiert med økte uønskede perinatale utfall, inkludert prematur fødsel. Det er ikke kjent om dette er et direkte resultat av sykdommen eller andre komorbide faktorer.
En prospektiv, longitudinell studie fulgte 201 gravide kvinner med en historie med alvorlig depressiv lidelse som var euthymic og tok antidepressiva i begynnelsen av svangerskapet. Kvinnene som sluttet med antidepressiva under svangerskapet hadde større sannsynlighet for å få tilbakefall av alvorlig depresjon enn kvinner som fortsatte med antidepressiva. Vurder risikoen for ubehandlet depresjon når du avbryter eller endrer behandling med antidepressiva under graviditet og etter fødsel.
Fetale/neonatale bivirkninger
Ekstrapyramidale og/eller abstinenssymptomer, inkludert agitasjon, hypertoni, hypotoni, skjelving, somnolens, pustebesvær og matforstyrrelser er rapportert hos nyfødte som ble eksponert for antipsykotiske legemidler (inkludert ABILIFY) i løpet av tredje trimester av svangerskapet. Disse symptomene har variert i alvorlighetsgrad. Overvåk nyfødte for ekstrapyramidale og/eller abstinenssymptomer, og håndter symptomene på riktig måte. Noen nyfødte kom seg i løpet av timer eller dager uten spesifikk behandling; andre krevde langvarig sykehusinnleggelse.
Data
Menneskelige data
Publiserte data fra observasjonsstudier, fødselsregistre og kasusrapporter om bruk av atypiske antipsykotika under graviditet rapporterer ikke en klar sammenheng med antipsykotika og store fødselsskader. En retrospektiv studie fra en Medicaid-database med 9258 kvinner eksponert for antipsykotika under graviditet, indikerte ikke en samlet økt risiko for alvorlige fødselsskader.
Dyredata
dyrestudier viste aripiprazol utviklingstoksisitet, inkludert mulige teratogene effekter hos rotter og kaniner.
Hos drektige rotter behandlet oralt med aripiprazol under organogenese i doser på 3, 10 og 30 mg/kg/dag, som er omtrent 1, 3 og 10 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate, en svak forlengelse av svangerskapet og forsinkelse i fosterutviklingen, som bevist ved redusert fostervekt og ikke-nedgang i testiklene, ble observert ved 10 ganger MRHD. Forsinket skjelettforbening ble observert ved 3 og 10 ganger MRHD. Født avkom hadde økt forekomst av hepatodiafragmatiske knuter og diafragmabrokk ble observert ved 10 ganger MRHD (de andre dosegruppene ble ikke undersøkt for disse funnene). Postnatalt ble forsinket skjedeåpning sett ved 3 og 10 ganger MRHD. Nedsatt reproduksjonsevne (redusert fruktbarhetsrate, corpora lutea, implantater, levende fostre og økt post-implantasjonstap, sannsynligvis mediert gjennom effekter på kvinnelige avkom) ble observert ved 10 ganger MRHD; Det var imidlertid ingen bevis som tyder på at disse utviklingseffektene var sekundære til maternell toksisitet.
Hos gravide rotter injisert intravenøst med aripiprazol under organogenese i doser på 3, 9 og 27 mg/kg/dag, som er 1, 3 og 9 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate fostervekt og forsinket skjelettforbening ble observert ved 9 ganger MRHD; denne dosen forårsaket også maternell toksisitet.
Hos gravide kaniner behandlet oralt med aripiprazol under organogenese i doser på 10, 30 og 100 mg/kg/dag som er 6, 19 og 65 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate, redusert maternal matforbruk, og økte aborter samt økt fosterdødelighet ble observert ved 65 ganger MHRD. Redusert fostervekt og økt forekomst av sammenvoksede brystben ble observert ved 19 og 65 ganger MRHD.
Hos gravide kaniner injisert intravenøst med aripiprazol under organogenese i doser på 3, 10 og 30 mg/kg/dag, som er 2, 6 og 19 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate fostervekt, økte føtale abnormiteter (primært skjelett) og redusert føtal skjelettforbening ble observert ved 19 ganger MRHD; denne dosen forårsaket også maternell toksisitet. Fosterets ingen-effektdose var 10 mg/kg/dag, som er 6 ganger MRHD.
Hos rotter behandlet oralt med aripiprazol peri- og postnatalt fra drektighetsdag 17 til og med postpartum dag 21 i doser på 3, 10 og 30 mg/kg/dag som er 1, 3 og 10 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate ble lett maternell toksisitet og lett forlenget svangerskap observert ved 10 ganger MHRD. En økning i dødfødsler og reduksjon i valpevekt (vedvarer inn i voksen alder) og overlevelse ble også sett ved denne dosen.
Hos rotter injisert intravenøst med aripiprazol fra drektighetsdag 6 til og med ammedag 20 i doser på 3, 8 og 20 mg/kg/dag, som er 1, 3 og 6 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate, økte dødfødsler ble observert ved 3 og 6 ganger MRHD; og reduksjoner i tidlig postnatal ungvekt og overlevelse ble observert ved 6 ganger MRHD; disse dosene forårsaket også en viss maternell toksisitet. Det var ingen effekter på postnatal atferds- og reproduktiv utvikling.
Amming
Risikosammendrag
Begrensede data fra publisert litteratur rapporterer tilstedeværelsen av aripiprazol i morsmelk hos mennesker, ved relative spedbarnsdoser som varierer mellom 0,7 % og 8,3 % av den maternelle vektjusterte dosen. Det er rapporter om dårlig vektøkning hos spedbarn som ammes som er eksponert for aripiprazol og rapporter om utilstrekkelig melketilførsel hos ammende kvinner som tar aripiprazol.
Utviklingen og helsegevinstene ved amming bør vurderes sammen med morens kliniske behov for ABILIFY og eventuelle skadelige effekter på det ammede spedbarnet fra ABILIFY eller fra den underliggende morstilstanden.
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter med alvorlig depressiv lidelse eller agitasjon assosiert med schizofreni eller bipolar mani er ikke fastslått.
Farmakokinetikken til aripiprazol og dehydro-aripiprazol hos pediatriske pasienter, 10 til 17 år, var lik den hos voksne etter korrigering for forskjellene i kroppsvekt [se KLINISK FARMAKOLOGI ].
Schizofreni
Sikkerhet og effektivitet hos pediatriske pasienter med schizofreni ble etablert i en 6-ukers, placebokontrollert klinisk studie med 202 pediatriske pasienter i alderen 13 til 17 år [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER , og Kliniske studier ]. Selv om vedlikeholdseffekten hos pediatriske pasienter ikke har blitt systematisk evaluert, kan vedlikeholdseffekten ekstrapoleres fra voksne data sammen med sammenligninger av aripiprazols farmakokinetiske parametere hos voksne og pediatriske pasienter.
Bipolar I lidelse
Sikkerhet og effektivitet hos pediatriske pasienter med bipolar mani ble etablert i en 4-ukers, placebokontrollert klinisk studie med 197 pediatriske pasienter i alderen 10 til 17 år [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER , og Kliniske studier ]. Selv om vedlikeholdseffekten hos pediatriske pasienter ikke har blitt systematisk evaluert, kan vedlikeholdseffekten ekstrapoleres fra voksne data sammen med sammenligninger av aripiprazols farmakokinetiske parametere hos voksne og pediatriske pasienter.
Effekten av tillegg ABILIFY 10 mg med samtidig litium eller valproat ved behandling av maniske eller blandede episoder hos pediatriske pasienter har ikke blitt systematisk evaluert. Slik effekt og mangel på farmakokinetisk interaksjon mellom aripiprazol og litium eller valproat kan imidlertid ekstrapoleres fra voksne data, sammen med sammenligninger av aripiprazols farmakokinetiske parametere hos voksne og pediatriske pasienter.
Irritabilitet assosiert med autistisk lidelse
Sikkerhet og effektivitet hos pediatriske pasienter som viser irritabilitet assosiert med autistisk lidelse ble etablert i to 8-ukers, placebokontrollerte kliniske studier med 212 pediatriske pasienter i alderen 6 til 17 år [se INDIKASJONER OG BRUK , DOSERING OG ADMINISTRASJON , BIVIRKNINGER , og Kliniske studier ]. En vedlikeholdsstudie ble utført hos pediatriske pasienter (6 til 17 år) med irritabilitet assosiert med autistisk lidelse. Den første fasen av denne studien var en åpen, fleksibelt dosert (aripiprazol 2 til 15 mg/dag) fase der pasientene ble stabilisert (definert som > 25 % forbedring på ABC-I-subskalaen, og en CGI-I-vurdering på "mye forbedret" eller "svært mye forbedret") på ABILIFY i 12 påfølgende uker. Totalt sett ble 85 pasienter stabilisert og gikk inn i den andre, 16-ukers, dobbeltblinde fasen hvor de ble randomisert til enten å fortsette ABILIFY-behandling eller bytte til placebo. I denne studien ble effekten av ABILIFY for vedlikeholdsbehandling av irritabilitet assosiert med autistisk lidelse ikke fastslått.
Tourettes lidelse
Sikkerhet og effektivitet av aripiprazol hos pediatriske pasienter med Tourettes lidelse ble fastslått i en 8-ukers (i alderen 7 til 17) og en 10-ukers studie (i alderen 6 til 18) med 194 pediatriske pasienter [se DOSERING OG ADMINISTRASJON , BIVIRKNINGER , og Kliniske studier ]. Vedlikeholdseffekt hos pediatriske pasienter har ikke blitt systematisk evaluert.
Studier på ungdomsdyr
Aripiprazol hos unge rotter forårsaket dødelighet, CNS kliniske tegn, svekket hukommelse og læring og forsinket seksuell modning når det ble administrert i orale doser på 10, 20, 40 mg/kg/dag fra avvenning (21 dager gammel) til modenhet (80 dager gammel) . Ved 40 mg/kg/dag ble dødelighet, nedsatt aktivitet, spredte baklemmer, bøyd holdning, ataksi, skjelvinger og andre CNS-tegn observert hos begge kjønn. I tillegg ble forsinket kjønnsmodning observert hos menn. Ved alle doser og på en doseavhengig måte, svekket hukommelse og læring, økt motorisk aktivitet og histopatologiske endringer i hypofysen (atrofi), binyrene (binyrebarkhypertrofi), brystkjertler (hyperplasi og økt sekresjon) og kvinnelige reproduksjonsorganer ( vaginal mucification, endometrieatrofi, reduksjon i ovarial corpora lutea) ble observert. Endringene i kvinnelige reproduksjonsorganer ble ansett som sekundære til økningen i serumnivået av prolaktin. No Observed Adverse Effect Level (NOAEL) kunne ikke bestemmes, og ved den laveste testede dosen på 10 mg/kg/dag er det ingen sikkerhetsmargin i forhold til systemisk eksponering (AUC0-24) for aripiprazol eller dets viktigste aktive metabolitt hos ungdom med maksimal anbefalt pediatrisk dose på 15 mg/dag. Alle legemiddelrelaterte effekter var reversible etter en 2-måneders restitusjonsperiode, og de fleste av legemiddeleffektene hos unge rotter ble også observert hos voksne rotter fra tidligere utførte studier.
Aripiprazol hos unge hunder (2 måneder gamle) forårsaket CNS kliniske tegn på skjelvinger, hypoaktivitet, ataksi, tilbakelenthet og begrenset bruk av baklemmer når det ble administrert oralt i 6 måneder med 3, 10, 30 mg/kg/dag. Gjennomsnittlig kroppsvekt og vektøkning ble redusert med opptil 18 % hos kvinner i alle legemiddelgrupper i forhold til kontrollverdier. NOAEL kunne ikke bestemmes, og ved den laveste testede dosen på 3 mg/kg/dag er det ingen sikkerhetsmargin i forhold til systemisk eksponering (AUC0-24) for aripiprazol eller dets viktigste aktive metabolitt hos ungdom ved maksimalt anbefalt pediatrisk nivå. dose på 15 mg/dag. Alle legemiddelrelaterte effekter var reversible etter en 2-måneders restitusjonsperiode.
Geriatrisk bruk
Ingen dosejustering anbefales for eldre pasienter [se ADVARSEL i boks , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ].
Av de 13 543 pasientene som ble behandlet med oral ABILIFY 15 mg i kliniske studier, var 1073 (8%) ≥65 år og 799 (6%) var ≥75 år. Placebokontrollerte studier av oral ABILIFY 10 mg ved schizofreni, bipolar mani eller alvorlig depressiv lidelse inkluderte ikke tilstrekkelig antall personer i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre personer.
Av de 749 pasientene som ble behandlet med ABILIFY-injeksjon i kliniske studier, var 99 (13%) ≥65 år og 78 (10%) var ≥75 år. Placebokontrollerte studier av ABILIFY-injeksjon hos pasienter med agitasjon assosiert med schizofreni eller bipolar mani inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner.
ABILIFY 15mg er ikke godkjent for behandling av pasienter med psykose assosiert med Alzheimers sykdom [se ADVARSEL i boks og ADVARSLER OG FORHOLDSREGLER ].
CYP2D6 Dårlige metabolisatorer
Dosejustering anbefales hos kjente CYP2D6-fattige metabolisatorer på grunn av høye aripiprazolkonsentrasjoner. Omtrent 8 % av kaukasiere og 3–8 % av svarte/afroamerikanere kan ikke metabolisere CYP2D6-substrater og er klassifisert som dårlige metaboliserere (PM) [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
Nedsatt lever- og nyrefunksjon
Ingen dosejustering for ABILIFY er nødvendig på grunnlag av en pasients leverfunksjon (mild til alvorlig nedsatt leverfunksjon, Child-Pugh-score mellom 5 og 15), eller nyrefunksjon (mild til alvorlig nedsatt nyrefunksjon, glomerulær filtrasjonshastighet mellom 15 og 90 ml/minutt) [se KLINISK FARMAKOLOGI ].
Andre spesifikke populasjoner
Ingen dosejustering for ABILIFY er nødvendig på grunnlag av en pasients kjønn, rase eller røykestatus [se KLINISK FARMAKOLOGI ].
OVERDOSE
MedDRA-terminologi har blitt brukt for å klassifisere bivirkningene.
Menneskelig erfaring
kliniske studier og erfaring etter markedsføring har bivirkninger av bevisst eller utilsiktet overdosering med oral ABILIFY blitt rapportert over hele verden. Disse inkluderer overdoser med oral ABILIFY 20 mg alene og i kombinasjon med andre stoffer. Ingen dødsfall ble rapportert med ABILIFY alene. Den største kjente dosen med kjent utfall involverte akutt inntak av 1260 mg oral ABILIFY (42 ganger maksimal anbefalt daglig dose) av en pasient som ble helt frisk. Forsettlig eller utilsiktet overdosering ble også rapportert hos barn (12 år og yngre) som involverte oral ABILIFY 10 mg inntak opp til 195 mg uten dødsfall.
Vanlige bivirkninger (rapportert i minst 5 % av alle overdosetilfeller) rapportert ved oral ABILIFY-overdosering (alene eller i kombinasjon med andre stoffer) inkluderer oppkast, somnolens og skjelving. Andre klinisk viktige tegn og symptomer observert hos en eller flere pasienter med ABILIFY-overdoser (alene eller sammen med andre stoffer) inkluderer acidose, aggresjon, økt aspartataminotransferase, atrieflimmer, bradykardi, koma, konfusjonstilstand, kramper, økt kreatinfosfokinase i blodet, redusert nivå av bevissthet, hypertensjon, hypokalemi, hypotensjon, sløvhet, tap av bevissthet, QRS-kompleks forlenget, QT forlenget, lungebetennelse aspirasjon, respirasjonsstans, status epilepticus og takykardi.
Håndtering av overdosering
Ingen spesifikk informasjon er tilgjengelig om behandling av overdose med ABILIFY. Et elektrokardiogram bør tas i tilfelle overdosering og hvis QT-intervallforlengelse er tilstede, bør hjerteovervåking settes i gang. Ellers bør håndtering av overdosering konsentreres om støttende terapi, opprettholdelse av tilstrekkelige luftveier, oksygenering og ventilasjon og behandling av symptomer. Tett medisinsk tilsyn og overvåking bør fortsette til pasienten blir frisk.
Kull
Ved en overdose av ABILIFY 10 mg, kan en tidlig kulladministrasjon være nyttig for delvis å forhindre absorpsjon av aripiprazol. Administrering av 50 g aktivt kull, én time etter en enkelt 15 mg oral dose av ABILIFY, reduserte gjennomsnittlig AUC og Cmax for aripiprazol med 50 %.
Hemodialyse
Selv om det ikke er informasjon om effekten av hemodialyse ved behandling av en overdose med ABILIFY, er det usannsynlig at hemodialyse vil være nyttig ved overdosebehandling siden aripiprazol er sterkt bundet til plasmaproteiner.
KONTRAINDIKASJONER
ABILIFY 15mg er kontraindisert hos pasienter med en historie med overfølsomhetsreaksjoner overfor aripiprazol. Reaksjonene har variert fra kløe/urticaria til anafylaksi [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Virkningsmekanismen til aripiprazol ved schizofreni eller bipolar mani er uklar. Effekten av aripiprazol i de listede indikasjonene kan imidlertid medieres gjennom en kombinasjon av delvis agonistaktivitet ved D2- og 5-HT1A-reseptorer og antagonistaktivitet ved 5-HT2A-reseptorer.
Farmakodynamikk
Aripiprazol viser høy affinitet for dopamin D2 og D3, serotonin 5-HT1A og 5-HT2A reseptorer (Ki verdier på henholdsvis 0,34 nM, 0,8 nM, 1,7 nM og 3,4 nM), moderat affinitet for doptonamin D4, HT2C 5-HT7, alfa1-adrenerge og histamin H1-reseptorer (Ki-verdier på henholdsvis 44 nM, 15 nM, 39 nM, 57 nM og 61 nM), og moderat affinitet for serotonin-gjenopptaksstedet (Ki=98 nM). Aripiprazol har ingen merkbar affinitet for kolinerge muskarine reseptorer (IC50>1000 nM).
Farmakokinetikk
ABILIFY-aktivitet skyldes antagelig først og fremst hovedstoffet, aripiprazol, og i mindre grad, dets hovedmetabolitt, dehydro-aripiprazol, som har vist seg å ha affiniteter for D2-reseptorer som ligner på moderstoffet og representerer 40 % av moderstoffet. medikamenteksponering i plasma. Gjennomsnittlig eliminasjonshalveringstid er ca. 75 timer og 94 timer for henholdsvis aripiprazol og dehydro-aripiprazol. Steady-state-konsentrasjoner oppnås innen 14 dager etter dosering for begge aktive deler. Akkumulering av aripiprazol er forutsigbar fra enkeltdose-farmakokinetikk. Ved steady-state er farmakokinetikken til aripiprazol doseproporsjonal. Eliminering av aripiprazol skjer hovedsakelig gjennom levermetabolisme som involverer to P450-isozymer, CYP2D6 og CYP3A4. For CYP2D6-fattige metabolisatorer er gjennomsnittlig eliminasjonshalveringstid for aripiprazol ca. 146 timer.
Farmakokinetiske studier viste at ABILIFY 10 mg DISCMELT oralt desintegrerende tabletter er bioekvivalente med ABILIFY 15 mg tabletter.
Muntlig administrasjon
Absorpsjon
Tablett: Aripiprazol absorberes godt etter administrering av tabletten, med maksimal plasmakonsentrasjon innen 3 timer til 5 timer; den absolutte orale biotilgjengeligheten av tablettformuleringen er 87 %. ABILIFY 10mg kan administreres med eller uten mat. Administrering av en 15 mg ABILIFY-tablett sammen med et standard måltid med høyt fettinnhold påvirket ikke signifikant Cmax eller AUC for aripiprazol eller dets aktive metabolitt, dehydro-aripiprazol, men forsinket Tmax med 3 timer for aripiprazol og 12 timer for dehydro-aripiprazol.
Oral oppløsning: Aripiprazol absorberes godt når det gis oralt som oppløsning. Ved ekvivalente doser var plasmakonsentrasjonene av aripiprazol fra oppløsningen høyere enn fra tablettformuleringen. I en relativ biotilgjengelighetsstudie som sammenlignet farmakokinetikken til 30 mg aripiprazol som oral oppløsning med 30 mg aripiprazoltabletter hos friske forsøkspersoner, var forholdet mellom oppløsning og tablett for geometriske gjennomsnittlige Cmax- og AUC-verdier henholdsvis 122 % og 114 % [se DOSERING OG ADMINISTRASJON ]. Enkeltdose-farmakokinetikken til aripiprazol var lineær og doseproporsjonal mellom dosene på 5 mg til 30 mg.
Fordeling
Steady-state distribusjonsvolumet av aripiprazol etter intravenøs administrering er høyt (404 l eller 4,9 l/kg), noe som indikerer omfattende ekstravaskulær distribusjon. Ved terapeutiske konsentrasjoner er aripiprazol og dets hovedmetabolitt mer enn 99 % bundet til serumproteiner, primært til albumin. Hos friske frivillige som fikk 0,5 til 30 mg/dag aripiprazol i 14 dager, var det doseavhengig D2-reseptoropptak som indikerte hjernepenetrasjon av aripiprazol hos mennesker.
Metabolisme og eliminering
Aripiprazol metaboliseres primært ved tre biotransformasjonsveier: dehydrogenering, hydroksylering og N-dealkylering. Basert på in vitro-studier er CYP3A4- og CYP2D6-enzymer ansvarlige for dehydrogenering og hydroksylering av aripiprazol, og N-dealkylering katalyseres av CYP3A4. Aripiprazol er den dominerende legemiddeldelen i den systemiske sirkulasjonen. Ved steady-state representerer dehydro-aripiprazol, den aktive metabolitten, omtrent 40 % av aripiprazol AUC i plasma.
Etter en enkelt oral dose av [14C]-merket aripiprazol ble ca. 25 % og 55 % av administrert radioaktivitet gjenfunnet i henholdsvis urin og feces. Mindre enn 1 % av uendret aripiprazol ble skilt ut i urinen og ca. 18 % av den orale dosen ble gjenvunnet uendret i avføringen.
Legemiddelinteraksjonsstudier
Effekter av andre legemidler på eksponeringen av aripiprazol og dehydro-aripiprazol er oppsummert i henholdsvis figur 1 og figur 2. Basert på simulering forventes en 4,5 ganger økning i gjennomsnittlige Cmax- og AUC-verdier ved steady-state når omfattende metabolisatorer av CYP2D6 administreres med både sterke CYP2D6- og CYP3A4-hemmere. En 3 ganger økning i gjennomsnittlig Cmax og AUC-verdier ved steady-state forventes hos dårlige metabolisatorer av CYP2D6 administrert med sterke CYP3A4-hemmere.
Figur 1: Effekten av andre legemidler på aripiprazols farmakokinetikk 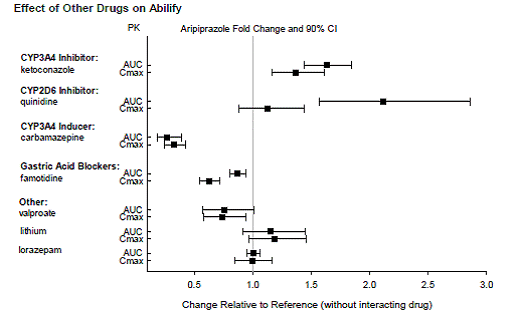
Figur 2: Effekten av andre legemidler på dehydro-aripiprazols farmakokinetikk 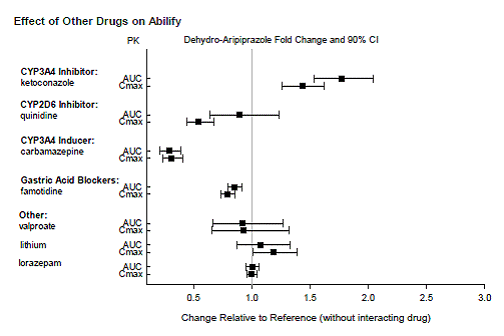
Effektene av ABILIFY 15 mg på eksponeringen av andre legemidler er oppsummert i figur 3. En populasjons-PK-analyse hos pasienter med alvorlig depressiv lidelse viste ingen vesentlig endring i plasmakonsentrasjoner av fluoksetin (20 eller 40 mg/dag), paroksetin CR (37,5 eller 50 mg/dag), eller sertralin (100 eller 150 mg/dag) dosert til steady-state. Steady-state plasmakonsentrasjonene av fluoksetin og norfluoksetin økte med henholdsvis ca. 18 % og 36 %, og konsentrasjonene av paroksetin sank med ca. 27 %. Steady-state plasmakonsentrasjonene av sertralin og desmetylsertralin ble ikke vesentlig endret når disse antidepressive terapiene ble administrert samtidig med aripiprazol.
Figur 3: Effekten av ABILIFY 15mg på farmakokinetikken til andre legemidler 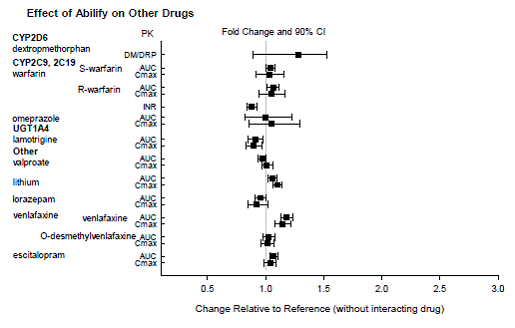
Studier i spesifikke populasjoner
Eksponeringer av aripiprazol og dehydro-aripiprazol i spesifikke populasjoner er oppsummert i henholdsvis figur 4 og figur 5. I tillegg, hos pediatriske pasienter (10 til 17 år) administrert med ABILIFY (20 mg til 30 mg), var den kroppsvektkorrigerte aripiprazolclearance lik den hos voksne.
Figur 4: Effekter av iboende faktorer på aripiprazols farmakokinetikk 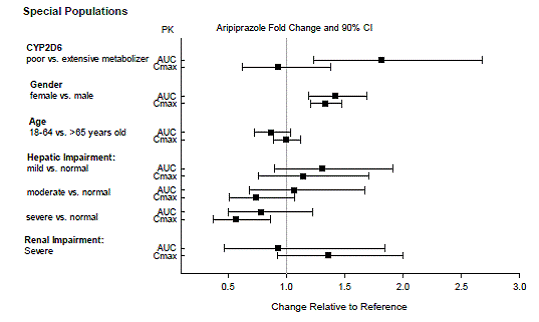
Figur 5: Effekter av indre faktorer på dehydro-aripiprazol farmakokinetikk 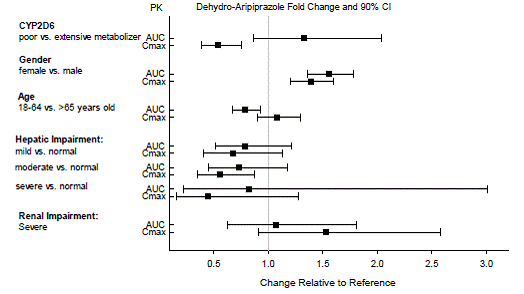
Intramuskulær administrasjon
to farmakokinetiske studier av aripiprazolinjeksjon administrert intramuskulært til friske forsøkspersoner, var mediantidene til maksimal plasmakonsentrasjon 1 time og 3 timer. En 5 mg intramuskulær injeksjon av aripiprazol hadde en absolutt biotilgjengelighet på 100 %. Den geometriske gjennomsnittlige maksimalkonsentrasjonen oppnådd etter en intramuskulær dose var i gjennomsnitt 19 % høyere enn Cmax for den orale tabletten. Mens den systemiske eksponeringen over 24 timer generelt var lik mellom aripiprazolinjeksjon gitt intramuskulært og etter oral tablettadministrasjon, var AUC for aripiprazol i de første 2 timene etter en intramuskulær injeksjon 90 % høyere enn AUC etter samme dose som en tablett. Hos stabile pasienter med schizofreni eller schizoaffektiv lidelse var farmakokinetikken til aripiprazol etter intramuskulær administrering lineær over et doseområde på 1 mg til 45 mg. Selv om metabolismen av aripiprazolinjeksjon ikke ble systematisk evaluert, forventes det ikke at den intramuskulære administrasjonsveien endrer metabolske veier.
Dyretoksikologi og/eller farmakologi
Aripiprazol ga retinal degenerasjon hos albinorotter i en 26-ukers kronisk toksisitetsstudie ved en dose på 60 mg/kg/dag og i en 2-årig karsinogenitetsstudie ved doser på 40 og 60 mg/kg/dag som er 13 og 19 ganger MRHD på 30 mg/dag basert på mg/m² kroppsoverflate. Evaluering av netthinnen til albinomus og aper avslørte ikke tegn på retinal degenerasjon. Ytterligere studier for ytterligere å evaluere mekanismen er ikke utført. Relevansen av dette funnet for menneskelig risiko er ukjent.
Kliniske studier
Effekten av de orale formuleringene av ABILIFY (aripiprazol) ble fastslått i følgende tilstrekkelige og godt kontrollerte studier:
- . Fire korttidsstudier og en vedlikeholdsstudie med voksne pasienter og en korttidsstudie hos ungdom (13-17 år) med schizofreni [se Kliniske studier ] . Fire kortsiktige monoterapistudier og en 6-ukers tilleggsstudie hos voksne pasienter og en korttids monoterapistudie hos pediatriske pasienter (alder 1017) med maniske eller blandede episoder [se Kliniske studier ] . Én vedlikeholdsstudie med monoterapi og én tilleggsstudie for vedlikehold hos voksne pasienter med bipolar lidelse I [se Kliniske studier ] . To korttidsstudier med voksne pasienter med MDD som hadde en utilstrekkelig respons på antidepressiv terapi under den aktuelle episoden [se Kliniske studier ] . To korttidsstudier hos pediatriske pasienter (alder 6-17 år) for behandling av irritabilitet assosiert med autistisk lidelse [se Kliniske studier ] . To korttidsstudier med pediatriske pasienter (alder 6-18 år) med Tourettes lidelse [se Kliniske studier ]
Effekten av den injiserbare formuleringen av ABILIFY (aripiprazol) ble fastslått i følgende tilstrekkelige og godt kontrollerte studier:
- . Tre 24-timers studier med opprørte voksne pasienter med schizofreni eller maniske/blandede episoder av bipolar I lidelse [se Kliniske studier ]
Schizofreni
Voksne
Effekten av ABILIFY 15 mg i behandlingen av schizofreni ble evaluert i fem kortsiktige (4-ukers og 6-ukers), placebokontrollerte studier med akutt residiverende pasienter som hovedsakelig oppfylte DSM-III/IV-kriteriene for schizofreni. Fire av de fem studiene klarte å skille ABILIFY fra placebo, men en studie, den minste, gjorde det ikke. Tre av disse studiene inkluderte også en aktiv kontrollgruppe bestående av enten risperidon (en studie) eller haloperidol (to studier), men de var ikke designet for å tillate en sammenligning av ABILIFY 20 mg og de aktive komparatorene.
de fire positive studiene for ABILIFY 10 mg ble fire primærmål brukt for å vurdere psykiatriske tegn og symptomer. Effekten ble evaluert ved å bruke den totale poengsummen på Positive and Negative Syndrome Scale (PANSS). PANSS er en skala med 30 elementer som måler positive symptomer på schizofreni (7 elementer), negative symptomer på schizofreni (7 elementer) og generell psykopatologi (16 elementer), hver vurdert på en skala fra 1 (fraværende) til 7 (ekstrem) ; total PANSS-skåre varierer fra 30 til 210. Clinical Global Impression (CGI)-vurderingen reflekterer inntrykket av en dyktig observatør, fullt kjent med manifestasjonene av schizofreni, om den generelle kliniske tilstanden til pasienten.
en 4-ukers studie (n=414) som sammenlignet to faste doser av ABILIFY (15 eller 30 mg/dag) med placebo, var begge dosene av ABILIFY 10 mg overlegne placebo i PANSS totalscore (studie 1 i tabell 26), PANSS positiv subskala, og CGI-alvorlighetsscore. I tillegg var 15 mg-dosen overlegen placebo i PANSS-negativ subskala.
I en 4-ukers studie (n=404) som sammenlignet to faste doser ABILIFY (20 eller 30 mg/dag) med placebo, var begge dosene av ABILIFY overlegne placebo i PANSS totalscore (studie 2 i tabell 26), PANSS positiv underskala, PANSS negativ underskala og CGI-alvorlighetsscore.
I en 6-ukers studie (n=420) som sammenlignet tre faste doser av ABILIFY (10, 15 eller 20 mg/dag) med placebo, var alle tre doser av ABILIFY overlegne placebo i PANSS totalscore (studie 3 i tabell). 26), PANSS positiv underskala og PANSS negativ underskala.
en 6-ukers studie (n=367) som sammenlignet tre faste doser ABILIFY (2, 5 eller 10 mg/dag) med placebo, var 10 mg-dosen av ABILIFY overlegen placebo i PANSS totalscore (Studie 4 i Tabell 26), studiens primære utfallsmål. Dosene på 2 og 5 mg viste ikke overlegenhet i forhold til placebo på det primære utfallsmålet.
Effekten av 10, 15, 20 og 30 mg daglige doser ble derfor etablert i to studier for hver dose. Blant disse dosene var det ingen bevis for at de høyere dosegruppene ga noen fordel fremfor den laveste dosegruppen av disse studiene.
En undersøkelse av populasjonsundergrupper avslørte ingen klare bevis på differensiell respons på grunnlag av alder, kjønn eller rase.
En langsiktig studie inkluderte 310 inneliggende pasienter eller polikliniske pasienter som oppfyller DSM-IV-kriteriene for schizofreni, som av historie var symptomatisk stabile på andre antipsykotiske medisiner i perioder på 3 måneder eller lenger. Disse pasientene ble avbrutt fra sine antipsykotiske medisiner og randomisert til ABILIFY 15 mg/dag eller placebo i opptil 26 ukers observasjon for tilbakefall. Tilbakefall under den dobbeltblinde fasen ble definert som CGI-forbedringsscore på ≥5 (minimalt dårligere), skårer ≥5 (moderat alvorlig) på fiendtlighets- eller manglende samarbeidsevne i PANSS, eller ≥20 % økning i PANSS totalskåre. Pasienter som fikk ABILIFY 15 mg/dag opplevde en betydelig lengre tid til tilbakefall i løpet av de påfølgende 26 ukene sammenlignet med de som fikk placebo (studie 5 i figur 6).
Pediatriske pasienter
Effekten av ABILIFY (aripiprazol) i behandling av schizofreni hos pediatriske pasienter (13 til 17 år) ble evaluert i en 6-ukers, placebokontrollert studie av polikliniske pasienter som oppfylte DSM-IV-kriteriene for schizofreni og hadde en PANSS-score. ≥70 ved baseline. I denne studien (n=302) som sammenlignet to faste doser av ABILIFY (10 eller 30 mg/dag) med placebo, ble ABILIFY 15 mg titrert fra 2 mg/dag til måldosen på 5 dager i behandlingsarmen på 10 mg/dag og etter 11 dager i 30 mg/dag behandlingsarmen. Begge dosene av ABILIFY var overlegne placebo i PANSS-totalskåren (studie 6 i tabell 26), studiens primære utfallsmål. 30 mg/dag-dosen ble ikke vist å være mer effektiv enn 10 mg/dag-dosen. Selv om vedlikeholdseffekten hos pediatriske pasienter ikke har blitt systematisk evaluert, kan vedlikeholdseffekten ekstrapoleres fra voksne data sammen med sammenligninger av aripiprazols farmakokinetiske parametere hos voksne og pediatriske pasienter.
Figur 6: Kaplan-Meier-estimering av kumulativ andel av pasienter med tilbakefall (schizofrenistudie 5) 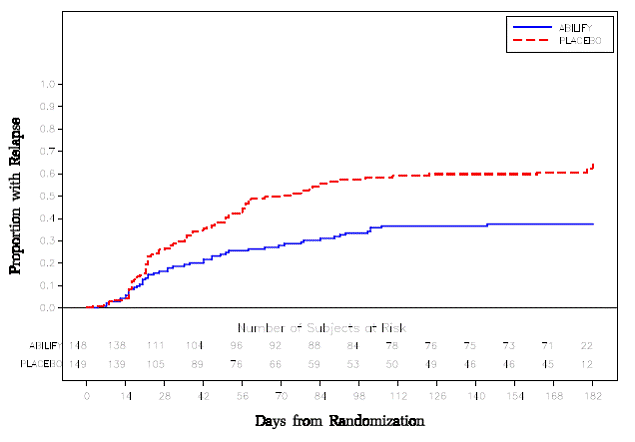
Bipolar lidelse
Akutt behandling av maniske og blandede episoder
Voksne
Monoterapi
Effekten av ABILIFY 10 mg som monoterapi ved akutt behandling av maniske episoder ble fastslått i fire 3-ukers, placebokontrollerte studier på sykehuspasienter som oppfylte DSM-IV-kriteriene for bipolar I lidelse med maniske eller blandede episoder. Disse studiene inkluderte pasienter med eller uten psykotiske trekk, og to av studiene inkluderte også pasienter med eller uten hurtigsyklingsforløp.
Det primære instrumentet som ble brukt for å vurdere maniske symptomer var Young Mania Rating Scale (Y-MRS), en 11-elements klinikervurdert skala som tradisjonelt ble brukt til å vurdere graden av manisk symptomatologi i et område fra 0 (ingen maniske trekk) til 60 ( maksimal poengsum). Et sentralt sekundært instrument inkluderte Clinical Global Impression-Bipolar (CGI-BP) Scale.
de fire positive, 3-ukers, placebokontrollerte studiene (n=268; n=248; n=480; n=485) som evaluerte ABILIFY i et område på 15 mg til 30 mg, én gang daglig (med startdose) på 30 mg/dag i to studier og 15 mg/dag i to studier), var ABILIFY 20 mg bedre enn placebo når det gjelder reduksjon av Y-MRS totalscore (studier 1-4 i tabell 27) og CGI-BP alvorlighetsgrad av sykdom. (mani). I de to studiene med en startdose på 15 mg/dag, var 48 % og 44 % av pasientene på 15 mg/dag ved endepunktet. I de to studiene med en startdose på 30 mg/dag, var 86 % og 85 % av pasientene på 30 mg/dag ved endepunktet.
Adjunktiv terapi
Effekten av tilleggs-ABILIFY med samtidig litium eller valproat i behandlingen av maniske eller blandede episoder ble fastslått i en 6-ukers, placebokontrollert studie (n=384) med en 2-ukers innledende stemningsstabiliserende monoterapifase hos voksne pasienter som oppfylte DSM-IV-kriteriene for bipolar I lidelse. Denne studien inkluderte pasienter med maniske eller blandede episoder og med eller uten psykotiske trekk.
Pasientene ble initiert med åpent litium (0,6 til 1,0 mEq/L) eller valproat (50 til 125 μg/ml) ved terapeutiske serumnivåer, og holdt seg på stabile doser i 2 uker. Ved slutten av 2 uker ble pasienter som viste utilstrekkelig respons (YMRS totalskår ≥16 og ≤25 % forbedring på Y-MRS totalskår) på litium eller valproat randomisert til å motta enten ABILIFY (15 mg/dag eller en økning til 30) mg/dag så tidlig som dag 7) eller placebo som tilleggsbehandling med åpent litium eller valproat. I den 6-ukers placebokontrollerte fasen var tilleggs-ABILIFY som startet med 15 mg/dag med samtidig litium eller valproat (i et terapeutisk område på henholdsvis 0,6 til 1,0 mEq/L eller 50 til 125 μg/mL) bedre enn litium eller valproat med tilleggs placebo i reduksjon av YMRS totalskåre (studie 5 i tabell 27) og CGI-BP alvorlighetsgrad av sykdom (mani). 71 prosent av pasientene som samtidig fikk valproat og 62 % av pasientene som ble administrert samtidig med litium var på 15 mg/dag ved 6-ukers endepunkt.
Pediatriske pasienter
Effekten av ABILIFY 15 mg i behandlingen av bipolar I lidelse hos pediatriske pasienter (10 til 17 år) ble evaluert i en 4-ukers, placebokontrollert studie (n=296) av polikliniske pasienter som oppfylte DSM-IV-kriteriene for bipolar I lidelse maniske eller blandede episoder med eller uten psykotiske trekk og hadde en Y-MRS-score ≥20 ved baseline. Denne dobbeltblinde, placebokontrollerte studien sammenlignet to faste doser av ABILIFY (10 eller 30 mg/dag) med placebo. ABILIFY 20 mg-dosen ble startet med 2 mg/dag, som ble titrert til 5 mg/dag etter 2 dager, og til måldosen etter 5 dager i 10 mg/dag-behandlingsarmen og etter 13 dager i 30 mg/dag dagbehandlingsarm. Begge doser av ABILIFY 10 mg var overlegne placebo i endring fra baseline til uke 4 på Y-MRS totalscore (studie 6 i tabell 27).
Vedlikeholdsbehandling av bipolar lidelse I
Monoterapi vedlikeholdsterapi
En vedlikeholdsstudie ble utført med voksne pasienter som oppfyller DSM-IV-kriteriene for bipolar I-lidelse med en nylig manisk eller blandet episode som hadde blitt stabilisert på åpen ABILIFY 20 mg og som hadde opprettholdt en klinisk respons i minst 6 uker. Den første fasen av denne studien var en åpen stabiliseringsperiode der innlagte og polikliniske pasienter ble klinisk stabilisert og deretter holdt på åpen ABILIFY (15 eller 30 mg/dag, med en startdose på 30 mg/dag) i minst 6 sammenhengende uker. 161 polikliniske pasienter ble deretter randomisert på en dobbeltblind måte, til enten den samme dosen av ABILIFY som de hadde ved slutten av stabiliserings- og vedlikeholdsperioden eller placebo og ble deretter overvåket for manisk eller depressivt tilbakefall. Under randomiseringsfasen var ABILIFY overlegen placebo i tide i forhold til antall kombinerte affektive tilbakefall (manisk pluss depressiv), det primære utfallsmålet for denne studien (studie 7 i figur 7). Totalt 55 humørhendelser ble observert under den dobbeltblindede behandlingsfasen. Nitten var fra ABILIFY-gruppen og 36 var fra placebogruppen. Antall observerte maniske episoder i ABILIFY 15 mg-gruppen (6) var færre enn i placebogruppen (19), mens antallet depressive episoder i ABILIFY-gruppen (9) var lik det i placebogruppen (11). .
En undersøkelse av populasjonsundergrupper avslørte ingen klare bevis på differensiell respons på grunnlag av alder og kjønn; Imidlertid var det utilstrekkelig antall pasienter i hver av de etniske gruppene til å kunne vurdere forskjeller mellom grupper på en adekvat måte.
Figur 7: Kaplan-Meier-estimering av kumulativ andel av pasienter med tilbakefall (bipolar studie 7) 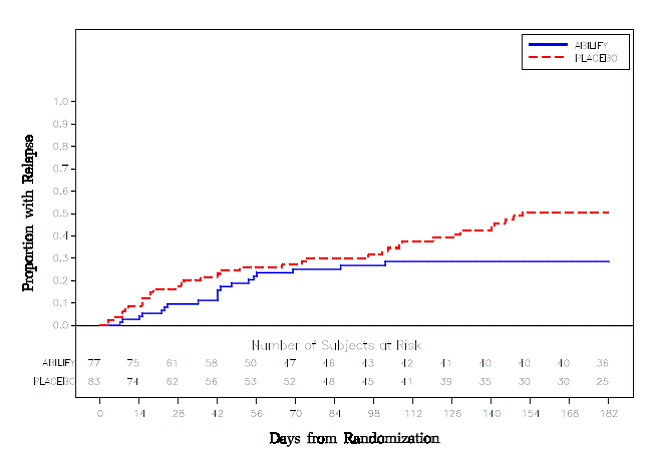
Tilleggsvedlikeholdsterapi
En tilleggsvedlikeholdsstudie ble utført med voksne pasienter som oppfyller DSMIV-kriteriene for bipolar I lidelse med en nylig manisk eller blandet episode. Pasientene ble initiert med åpent litium (0,6 til 1,0 mEq/L) eller valproat (50 til 125 μg/ml) ved terapeutiske serumnivåer, og holdt seg på stabile doser i 2 uker. Ved slutten av 2 uker fikk pasienter som viste utilstrekkelig respons (Y-MRS totalskår ≥16 og ≤35 % forbedring av Y-MRS totalskår) på litium eller valproat ABILIFY med en startdose på 15 mg/dag med opsjon. å øke til 30 mg eller redusere til 10 mg så tidlig som dag 4, som tilleggsbehandling med åpent litium eller valproat. Før randomisering var pasienter på kombinasjonen av enkeltblind ABILIFY og litium eller valproat nødvendig for å opprettholde stabilitet (Y-MRS og MADRS totalskår ≤12) i 12 påfølgende uker. Tre hundre og trettisju pasienter ble deretter randomisert på en dobbeltblind måte, til enten den samme dosen av ABILIFY 20 mg de hadde ved slutten av stabiliseringsperioden eller placebo pluss litium eller valproat og ble deretter overvåket for manisk, blandet eller depressivt tilbakefall i maksimalt 52 uker. ABILIFY 15 mg var overlegen placebo på det primære endepunktet, tid fra randomisering til tilbakefall til en hvilken som helst stemningsbegivenhet (studie 8 i figur 8). En stemningsbegivenhet ble definert som sykehusinnleggelse for en manisk, blandet eller depressiv episode, studieavbrudd på grunn av manglende effekt ledsaget av Y-MRS-score >16 og/eller MADRS >16, eller SAE av forverret sykdom ledsaget av Y- MRS-score >16 og/eller MADRS >16. Totalt 68 humørhendelser ble observert under den dobbeltblinde behandlingsfasen. 25 var fra ABILIFY 20 mg-gruppen og 43 var fra placebogruppen. Antall observerte maniske episoder i ABILIFY 15 mg-gruppen (7) var færre enn i placebogruppen (19), mens antallet depressive episoder i ABILIFY-gruppen (14) var lik det i placebogruppen (18). . Kaplan-Meier-kurvene for tiden fra randomisering til tilbakefall til enhver stemningsbegivenhet i løpet av den 52-ukers dobbeltblinde behandlingsfasen for ABILIFY 10 mg og placebogrupper er vist i figur 8.
Figur 8: Kaplan-Meier-estimering av kumulativ andel av pasienter med tilbakefall til enhver stemningsbegivenhet (bipolar studie 8) 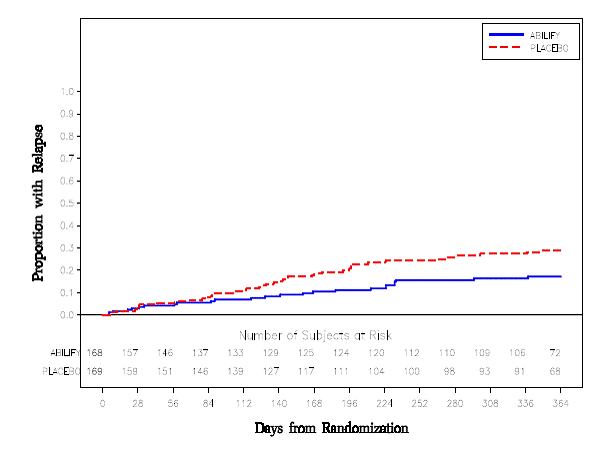
En undersøkelse av populasjonsundergrupper avslørte ingen klare bevis på differensiell respons på grunnlag av alder og kjønn; Imidlertid var det utilstrekkelig antall pasienter i hver av de etniske gruppene til å kunne vurdere forskjeller mellom grupper på en adekvat måte.
Tilleggsbehandling av alvorlig depressiv lidelse
Voksne
Effekten av ABILIFY 15 mg i tilleggsbehandling av alvorlig depressiv lidelse (MDD) ble vist i to kortsiktige (6 ukers), placebokontrollerte studier av voksne pasienter som oppfyller DSM-IV-kriteriene for MDD som hadde hatt en utilstrekkelig respons på tidligere antidepressiv behandling (1 til 3 kurer) i den aktuelle episoden og som også hadde vist en utilstrekkelig respons på 8 uker med prospektiv antidepressiv behandling (paroksetin kontrollert frigivelse, venlafaksin forlenget frigivelse, fluoksetin, escitalopram eller sertralin). Utilstrekkelig respons for prospektiv behandling ble definert som mindre enn 50 % forbedring på 17-elementversjonen av Hamilton Depression Rating Scale (HAMD17), minimal HAMD17-score på 14 og en Clinical Global Impressions Improvement-vurdering på ikke bedre enn minimal forbedring. Utilstrekkelig respons på tidligere behandling ble definert som mindre enn 50 % forbedring som oppfattet av pasienten etter minimum 6 uker med antidepressiv behandling ved eller over den minimale effektive dosen.
Det primære instrumentet som ble brukt for å vurdere depressive symptomer var Montgomery-Asberg Depression Rating Scale (MADRS), en 10-elements klinikervurdert skala som ble brukt til å vurdere graden av depressiv symptomatologi. Det sekundære nøkkelinstrumentet var Sheehan Disability Scale (SDS), et 3-elements selvvurdert instrument som ble brukt til å vurdere virkningen av depresjon på tre funksjonsdomener med hvert element scoret fra 0 (ikke i det hele tatt) til 10 (ekstremt).
I de to studiene (n=381, n=362) var ABILIFY 15mg bedre enn placebo når det gjaldt å redusere gjennomsnittlig MADRS-totalskår (studier 1, 2 i tabell 28). I en studie var ABILIFY også overlegen placebo når det gjaldt å redusere gjennomsnittlig SDS-score.
begge studiene fikk pasientene ABILIFY 15 mg i tillegg til antidepressiva i en dose på 5 mg/dag. Basert på tolerabilitet og effekt, kan dosene justeres i trinn på 5 mg, med én ukes mellomrom. Tillatte doser var: 2, 5, 10, 15 mg/dag, og for pasienter som ikke brukte potente CYP2D6-hemmere fluoksetin og paroksetin, 20 mg/dag. Gjennomsnittlig sluttdose ved sluttpunktet for de to studiene var 10,7 og 11,4 mg/dag.
En undersøkelse av populasjonsundergrupper avslørte ikke bevis på differensiell respons basert på alder, valg av potensielt antidepressivum eller rase. Når det gjelder kjønn, ble det sett en mindre gjennomsnittlig reduksjon på MADRS-totalskåren hos menn enn hos kvinner.
Irritabilitet assosiert med autistisk lidelse
Pediatriske pasienter
Effekten av ABILIFY (aripiprazol) i behandlingen av irritabilitet assosiert med autistisk lidelse ble fastslått i to 8-ukers, placebokontrollerte studier på pediatriske pasienter (6 til 17 år) som oppfylte DSM-IV-kriteriene for autistisk lidelse og demonstrert atferd som raserianfall, aggresjon, selvskadende atferd eller en kombinasjon av disse problemene. Over 75 % av disse forsøkspersonene var under 13 år.
Effekten ble evaluert ved hjelp av to vurderingsskalaer: Aberrant Behavior Checklist (ABC) og Clinical Global Impression-Improvement (CGI-I) skalaen. Det primære utfallsmålet i begge studiene var endringen fra baseline til endepunkt i Irritabilitetssubskalaen til ABC (ABC-I). ABC-I-underskalaen målte symptomer på irritabilitet ved autistisk lidelse.
Resultatene av disse forsøkene er som følger:
en av de 8-ukers placebokontrollerte studiene fikk barn og ungdom med autistisk lidelse (n=98), i alderen 6 til 17 år, daglige doser placebo eller ABILIFY 2 til 15 mg/dag. ABILIFY, som startet med 2 mg/dag med tillatte økninger på opptil 15 mg/dag basert på klinisk respons, forbedret skårene på ABC-I-subskalaen og på CGI-I-skalaen signifikant sammenlignet med placebo. Gjennomsnittlig daglig dose av ABILIFY 10 mg ved slutten av 8 ukers behandling var 8,6 mg/dag (studie 1 i tabell 29).
den andre 8-ukers, placebokontrollerte studien med barn og ungdom med autistisk lidelse (n=218), i alderen 6 til 17 år, tre faste doser av ABILIFY (5 mg/dag, 10 mg/dag eller 15 mg/dag). dag) ble sammenlignet med placebo. ABILIFY-dosering startet med 2 mg/dag og ble økt til 5 mg/dag etter en uke. Etter en annen uke ble den økt til 10 mg/dag for pasienter i 10- og 15 mg-dosearmene, og etter en tredje uke ble den økt til 15 mg/dag i 15 mg/dag-behandlingsarmen (Studie 2 i Tabell 29). Alle tre dosene av ABILIFY forbedret poengsummen betydelig på ABC-I-subskalaen sammenlignet med placebo.
Tourettes lidelse
Pediatriske pasienter
Effekten av ABILIFY (aripiprazol) i behandlingen av Tourettes lidelse ble fastslått i én 8-ukers (7 til 17 år) og én 10-ukers (6 til 18 år), placebokontrollerte studier i pediatriske pasienter (6 til 18 år) som oppfylte DSM-IV-kriteriene for Tourettes lidelse og hadde en total Tic-score (TTS) ≥ 20 - 22 på Yale Global Tic Severity Scale (YGTSS). YGTSS er en fullt validert skala designet for å måle gjeldende tic-alvorlighet. Effekten ble evaluert ved å bruke to vurderingsskalaer: 1) Total Tic-score (TTS) for YGTSS og 2) Clinical Global Impressions Scale for Tourettes Syndrome (CGI-TS), et klinikerbestemt oppsummeringsmål som tar hensyn til all tilgjengelig pasientinformasjon. Over 65 % av disse pasientene var under 13 år.
Det primære utfallsmålet i begge studiene var endringen fra baseline til endepunkt i TTS for YGTSS. Vurderinger for TTS er laget langs 5 forskjellige dimensjoner på en skala fra 0 til 5 for motoriske og vokale tics hver. Oppsummering av disse 10 poengsummene gir en TTS (dvs. 0-50).
Resultatene av disse forsøkene er som følger:
den 8-ukers placebokontrollerte studien med faste doser ble barn og ungdom med Tourettes lidelse (n=133), i alderen 7 til 17 år, randomisert 1:1:1 til lavdose ABILIFY, høy dose ABILIFY 15mg, eller placebo. Måldosene for gruppene med lav og høy dose ABILIFY 10 mg var basert på vekt. Pasienter
Figur 9: Minste kvadratiske middel for endring fra baseline i YGTSS TTS etter uke (Tourettes lidelsesstudie 1) 
I den 10-ukers placebokontrollerte studien med fleksibel dose hos barn og ungdom med Tourettes lidelse (n=61), i alderen 6 til 18 år, fikk pasienter daglige doser placebo eller ABILIFY, med start på 2 mg/ dag med tillatte økninger på opptil 20 mg/dag basert på klinisk respons. ABILIFY viste statistisk signifikant forbedrede skårer på YGTSS TTS-skalaen sammenlignet med placebo (studie 2 i tabell 30). Gjennomsnittlig daglig dose av ABILIFY ved slutten av 10-ukers behandling var 6,54 mg/dag.
Agitasjon assosiert med schizofreni eller bipolar mani
Effekten av intramuskulær ABILIFY til injeksjon for behandling av agitasjon ble fastslått i tre kortsiktige (24-timers), placebokontrollerte studier på opphissede inneliggende pasienter fra to diagnostiske grupper: schizofreni og bipolar I-lidelse (maniske eller blandede episoder, med eller uten psykotiske trekk). Hver av studiene inkluderte en enkelt aktiv komparatorbehandlingsarm av enten haloperidolinjeksjon (schizofrenistudier) eller lorazepaminjeksjon (bipolar manistudie). Pasienter kunne få opptil tre injeksjoner i løpet av de 24-timers behandlingsperiodene; pasienter kunne imidlertid ikke få den andre injeksjonen før etter den første 2-timers perioden da det primære effektmålet ble vurdert. Pasienter som ble registrert i studiene måtte: (1) bedømmes av de kliniske etterforskerne som klinisk opphisset og klinisk passende kandidater for behandling med intramuskulær medisin, og (2) utvise et nivå av agitasjon som nådde eller oversteg en terskelskåre på ≥15 på de fem elementene som består av positiv og negativ syndromskala (PANSS) Excited Component (dvs. dårlig impulskontroll, spenning, fiendtlighet, manglende samarbeidsevne og spenningselementer) med minst to individuelle elementscore ≥4 ved bruk av et 1-7 poengsystem (1 = fraværende, 4 = moderat, 7 = ekstrem). I studiene var gjennomsnittlig baseline PANSS Excited Component-skåre 19, med skårer fra 15 til 34 (av en maksimal score på 35), noe som tyder på overveiende moderate nivåer av agitasjon med noen pasienter som opplever milde eller alvorlige nivåer av agitasjon. Det primære effektmålet som ble brukt for å vurdere agitasjonstegn og -symptomer i disse studiene var endringen fra baseline i PANSS Excited Component 2 timer etter injeksjon. Et sentralt sekundært mål var Clinical Global Impression of Improvement (CGI-I) Scale. Resultatene av forsøkene følger:
en placebokontrollert studie med urolige inneliggende pasienter som hovedsakelig oppfyller DSM-IV-kriteriene for schizofreni (n=350), ble fire faste ABILIFY 20 mg injeksjonsdoser på 1 mg, 5,25 mg, 9,75 mg og 15 mg evaluert. 2 timer etter injeksjon var 5,25 mg, 9,75 mg og 15 mg dosene statistisk overlegne placebo i PANSS Excited Component (studie 1 i tabell 31) og på CGII-skalaen.
I en andre placebokontrollert studie med urolige inneliggende pasienter som hovedsakelig oppfyller DSM-IV-kriteriene for schizofreni (n=445), ble en fast ABILIFY 15 mg injeksjonsdose på 9,75 mg evaluert. 2 timer etter injeksjon var ABILIFY for injeksjon statistisk overlegen placebo i PANSS Excited Component (studie 2 i tabell 31) og på CGI-I-skalaen.
en placebokontrollert studie med urolige inneliggende pasienter som oppfyller DSMIV-kriteriene for bipolar I lidelse (manisk eller blandet) (n=291), ble to faste ABILIFY 10 mg injeksjonsdoser på 9,75 mg og 15 mg evaluert. 2 timer etter injeksjon var begge dosene statistisk overlegne placebo i PANSS Excited Component (studie 3 i tabell 31).
Undersøkelse av populasjonsundergrupper (alder, rase og kjønn) avslørte ingen differensiell respons på grunnlag av disse undergruppene.
PASIENTINFORMASJON
ABILIFY® (aripiprazol) Tabletter
ABILIFY DISCMELT® (aripiprazol) Oralt desintegrerende tabletter
ABILIFY® (aripiprazol) Oral oppløsning
ABILIFY® (aripiprazol) Injeksjon Kun til intramuskulær bruk
Hva er den viktigste informasjonen jeg bør vite om ABILIFY 20mg?
(For andre bivirkninger, se også "Hva er de mulige bivirkningene av ABILIFY?")
Alvorlige bivirkninger kan oppstå når du tar ABILIFY, inkludert:
- . Økt risiko for død hos eldre pasienter med demensrelatert psykose: Medisiner som ABILIFY 10mg kan øke risikoen for død hos eldre mennesker som har mistet kontakten med virkeligheten (psykose) på grunn av forvirring og hukommelsestap (demens). ABILIFY er ikke godkjent for behandling av pasienter med demensrelatert psykose. . Risiko for selvmordstanker eller -handlinger: Antidepressive medisiner, depresjon og andre alvorlige psykiske sykdommer, og selvmordstanker eller -handlinger:
1. Antidepressiva kan øke selvmordstanker eller -handlinger hos enkelte barn, tenåringer og unge voksne i løpet av de første månedene av behandlingen.
2. Depresjon og andre alvorlige psykiske lidelser er de viktigste årsakene til selvmordstanker og -handlinger. Noen mennesker kan ha en spesielt høy risiko for å ha selvmordstanker eller -handlinger. Disse inkluderer personer som har (eller har en familiehistorie med) bipolar sykdom (også kalt manisk-depressiv sykdom) eller selvmordstanker eller -handlinger.
3. Hvordan kan jeg se etter og prøve å forhindre selvmordstanker og -handlinger hos meg selv eller et familiemedlem?
- . Vær nøye med eventuelle endringer, spesielt plutselige endringer, i humør, atferd, tanker eller følelser. Dette er svært viktig når en antidepressiv medisin startes eller når dosen endres. . Ring helsepersonell med en gang for å rapportere nye eller plutselige endringer i humør, atferd, tanker eller følelser. . Hold alle oppfølgingsbesøk hos helsepersonell som planlagt. Ring helsepersonell mellom besøkene etter behov, spesielt hvis du har bekymringer om symptomer.
Ring en helsepersonell med en gang hvis du eller familiemedlemmet ditt har noen av følgende symptomer, spesielt hvis de er nye, verre eller bekymrer deg:
- . tanker om selvmord eller å dø . forsøk på å begå selvmord . ny eller verre depresjon . ny eller verre angst . føler meg veldig urolig eller rastløs . panikk anfall . problemer med å sove (søvnløshet) . ny eller verre irritabilitet . opptrer aggressivt, er sint eller voldelig . handler på farlige impulser . en ekstrem økning i aktivitet og prat (mani) . andre uvanlige endringer i atferd eller humør
Hva annet trenger jeg å vite om antidepressiva?
- . Slutt aldri en antidepressiv medisin uten først å snakke med en helsepersonell. Å stoppe en antidepressiv medisin plutselig kan forårsake andre symptomer. . Antidepressiva er medisiner som brukes til å behandle depresjon og andre sykdommer. Det er viktig å diskutere alle risikoene ved å behandle depresjon og også risikoen ved å ikke behandle den. Pasienter og deres familier eller andre omsorgspersoner bør diskutere alle behandlingsvalg med helsepersonell, ikke bare bruken av antidepressiva. . Antidepressiva har andre bivirkninger. Snakk med helsepersonell om bivirkningene av medisinen som er foreskrevet for deg eller ditt familiemedlem. . Antidepressiva kan samhandle med andre medisiner. Kjenn til alle medisinene du eller ditt familiemedlem tar. Hold en liste over alle medisiner for å vise helsepersonell. Ikke start nye medisiner uten først å sjekke med helsepersonell. . Ikke alle antidepressive medisiner foreskrevet for barn er FDA-godkjent for bruk hos barn. Snakk med barnets helsepersonell for mer informasjon.
Hva er ABILIFY?
- . ABILIFY 20mg orale tabletter, oralt disintegrerende tabletter og oral løsning er reseptbelagte medisiner som brukes til å behandle:
- . Schizofreni . maniske eller blandede episoder som skjer med bipolar lidelse I . alvorlig depressiv lidelse (MDD) når ABILIFY 20mg brukes sammen med antidepressiva . irritabilitet assosiert med autistisk lidelse . Tourettes lidelse
- . agitasjon assosiert med schizofreni eller bipolar mani
Det er ikke kjent om ABILIFY 10mg er trygt eller effektivt hos barn:
- . under 13 år med schizofreni . under 10 år med bipolar lidelse I . under 6 år med irritabilitet assosiert med autistisk lidelse . under 6 år med Tourettes lidelse
Ikke ta ABILIFY 20mg hvis du er allergisk mot aripiprazol eller noen av ingrediensene i ABILIFY. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser i ABILIFY.
Før du tar ABILIFY 15mg, fortell helsepersonell om alle dine medisinske tilstander, inkludert om du har eller hadde:
- . diabetes eller høyt blodsukker hos deg eller din familie; helsepersonell bør sjekke blodsukkeret ditt før du starter ABILIFY 10mg og også under behandlingen. . anfall (kramper). . lavt eller høyt blodtrykk. . hjerteproblemer eller hjerneslag. . graviditet eller planlegger å bli gravid. Det er ikke kjent om ABILIFY vil skade det ufødte barnet ditt.
- . Hvis du blir gravid mens du får ABILIFY 10mg, snakk med helsepersonell om registrering hos det nasjonale svangerskapsregisteret for atypiske antipsykotika. Du kan registrere deg ved å ringe 1-866-961-2388 eller gå til http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
ABILIFY og andre legemidler kan påvirke hverandre og forårsake mulige alvorlige bivirkninger. ABILIFY kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke hvordan ABILIFY virker.
Helsepersonell kan fortelle deg om det er trygt å ta ABILIFY sammen med andre legemidler. Ikke start eller stopp noen medisiner mens du tar ABILIFY uten å snakke med helsepersonell først. Kjenn til medisinene du tar. Hold en liste over medisinene dine for å vise helsepersonell og apotek når du får en ny medisin.
Hvordan bør jeg ta ABILIFY 20mg?
- . Ta ABILIFY 10mg nøyaktig slik helsepersonell ber deg ta det. Ikke endre dosen eller slutt å ta ABILIFY selv. . ABILIFY 20mg kan tas med eller uten mat. . ABILIFY tabletter skal svelges hele. . Hvis du glemmer en dose av ABILIFY 20 mg, ta den glemte dosen så snart du husker det. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og ta neste dose til vanlig tid. Ikke ta to doser ABILIFY 10mg samtidig. . Hvis du har blitt foreskrevet ABILIFY DISCMELT, ta det som følger:
- . Ikke åpne blisterpakningen før du er klar til å ta DISCMELT-tabletten. . For å fjerne én DISCMELT-tablett åpner du pakken og fjerner folien på blisterpakningen for å avsløre tabletten. . Ikke skyv tabletten gjennom folien fordi dette kan skade tabletten. . Umiddelbart etter åpning av blisterpakningen, bruk tørre hender, fjern tabletten og plasser hele ABILIFY DISCMELT oralt desintegrerende tablett på tungen. . Tablettdesintegrasjon skjer raskt i spytt. Det anbefales at ABILIFY 10mg DISCMELT tas uten væske. Men om nødvendig kan den tas med væske. . Ikke prøv å dele DISCMELT-tabletten.
Hva bør jeg unngå mens jeg tar ABILIFY 10mg?
- . Ikke kjør bil, bruk tunge maskiner eller gjør andre farlige aktiviteter før du vet hvordan ABILIFY 10mg påvirker deg. ABILIFY 20mg kan gjøre deg døsig. . Unngå å bli overopphetet eller dehydrert.
- . Ikke overtren. . I varmt vær, hold deg inne på et kjølig sted hvis mulig. . Hold deg unna solen. Ikke bruk for mye eller tunge klær. . Drikk mye vann.
Hva er de mulige bivirkningene av ABILIFY?
ABILIFY 10mg kan forårsake alvorlige bivirkninger, inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om ABILIFY 10mg?" . Hjerneslag hos eldre mennesker (cerebrovaskulære problemer) som kan føre til døden . Nevroleptisk malignt syndrom (NMS). Fortell helsepersonell med en gang hvis du har noen eller alle av følgende symptomer: høy feber, stive muskler, forvirring, svette, endringer i puls, hjertefrekvens og blodtrykk. Dette kan være symptomer på en sjelden og alvorlig tilstand som kan føre til døden. Ring helsepersonell med en gang hvis du har noen av disse symptomene. . Ukontrollerte kroppsbevegelser (tardiv dyskinesi). ABILIFY kan forårsake bevegelser du ikke kan kontrollere i ansiktet, tungen eller andre kroppsdeler. Tardiv dyskinesi forsvinner kanskje ikke, selv om du slutter å få ABILIFY. Tardiv dyskinesi kan også starte etter at du slutter å ta ABILIFY. . Problemer med stoffskiftet som:
- . Høyt blodsukker (hyperglykemi) og diabetes. Økning i blodsukker kan skje hos noen personer som tar ABILIFY. Ekstremt høyt blodsukker kan føre til koma eller død. Hvis du har diabetes eller risikofaktorer for diabetes (som overvekt eller en familiehistorie med diabetes), bør helsepersonell sjekke blodsukkeret ditt før du starter ABILIFY og under behandlingen.
Ring helsepersonell hvis du har noen av disse symptomene på høyt blodsukker mens du får ABILIFY:
- . føler meg veldig tørst . trenger å tisse mer enn vanlig . føler meg veldig sulten . føler seg svak eller sliten . får vondt i magen . føler deg forvirret, eller pusten din lukter fruktig
De vanligste bivirkningene av ABILIFY 10mg hos voksne inkluderer:
- . Kvalme . svimmelhet . oppkast . angst . forstoppelse . søvnløshet . hodepine . rastløshet . tåkesyn . øvre luftveissykdom . indre følelse av rastløshet/behov for å bevege seg (akatisi)
De vanligste bivirkningene av ABILIFY hos barn inkluderer:
- . Føle seg trøtt . søvnløshet . hodepine . kvalme . oppkast . tett nese . utmattelse . vektøkning . økt eller redusert appetitt . ukontrollerte bevegelser som rastløshet, skjelving . økt spytt eller sikling . muskelstivhet
Dette er ikke alle mulige bivirkninger av ABILIFY.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare ABILIFY?
- . Oppbevar ABILIFY 15mg ved romtemperatur, mellom 68°F til 77°F (20°C til 25°C). . Åpnede flasker med ABILIFY 10mg mikstur kan brukes i opptil 6 måneder etter åpning, men ikke etter utløpsdatoen på flasken.
Oppbevar ABILIFY og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av ABILIFY
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk ABILIFY 20mg for en tilstand det ikke er foreskrevet for. Ikke gi ABILIFY 20 mg til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem. Du kan spørre helsepersonell eller apotek om informasjon om ABILIFY 10mg som er skrevet for helsepersonell.
Hva er ingrediensene i ABILIFY?
Aktiv ingrediens: aripiprazol
Inaktive ingredienser:
maisstivelse, hydroksypropylcellulose, laktosemonohydrat, magnesiumstearat og mikrokrystallinsk cellulose. Fargestoffer inkluderer jernoksid (gul eller rød) og FD&C Blue No. 2 Aluminium Lake
ABILIFY 10mg DISCMELT oralt desintegrerende tabletter: acesulfam kalium, aspartam (som inneholder fenylalanin), kalsiumsilikat, croscarmellose natrium, crospovidon, crème de vanilla (naturlige og kunstige smaker), magnesiumstearat, mikrokrystallinsk cellulose, silisiumdioksid, vinsyre og xylitol. Fargestoffer inkluderer jernoksid (gul eller rød) og FD&C Blue No. 2 Aluminium Lake
ABILIFY oral løsning: dinatriumedetat, fruktose (200 mg per ml), glyserin, dl-melkesyre, metylparaben, propylenglykol, propylparaben, natriumhydroksid, sukrose (400 mg per ml) og renset vann. Den orale løsningen er smaksatt med naturlig appelsinkrem og andre naturlige smaker
For mer informasjon om ABILIFY, gå til www.abilify.com eller ring 1-800-438-6055.
Denne medisinveiledningen er godkjent av US Food and Drug Administration
