Effexor 37.5mg, 75mg Venlafaxine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
PASIENTINFORMASJON
Effexor (venlafaksin) (ven-la-fax-een) Nettbrett, USP
Les Medisineringsguiden som følger med venlafaksintabletter, USP før du begynner å ta den og hver gang du får påfyll. Det kan komme ny informasjon. Denne medisinveiledningen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller behandling. Snakk med helsepersonell hvis det er noe du ikke forstår eller ønsker å lære mer om.
Hva er den viktigste informasjonen jeg bør vite om Venlafaxine Tablets, USP?
Venlafaxin-tabletter, USP og andre antidepressiva kan forårsake alvorlige bivirkninger, inkludert:
1. Selvmordstanker eller -handlinger:
- . Venlafaksin-tabletter, USP og andre antidepressiva kan øke selvmordstanker eller -handlinger hos noen barn, tenåringer eller unge voksne i løpet av de første månedene av behandlingen eller når dosen endres. . Depresjon eller andre alvorlige psykiske lidelser er de viktigste årsakene til selvmordstanker eller -handlinger. . Se etter disse endringene og ring helsepersonell med en gang hvis du legger merke til: . Nye eller plutselige endringer i humør, atferd, handlinger, tanker eller følelser, spesielt hvis det er alvorlig. . Vær spesielt oppmerksom på slike endringer når venlafaksintabletter, USP startes eller når dosen endres.
Hold alle oppfølgingsbesøk hos helsepersonell og ring mellom besøkene hvis du er bekymret for symptomer.
Ring helsepersonell med en gang hvis du har noen av følgende symptomer, eller ring 911 hvis en nødsituasjon, spesielt hvis de er nye, verre eller bekymrer deg:
- . forsøk på å begå selvmord . handler på farlige impulser . opptrer aggressivt eller voldelig . tanker om selvmord eller å dø . ny eller verre depresjon . nye eller verre angst- eller panikkanfall . føler seg urolig, rastløs, sint eller irritabel . problemer med å sove . økt aktivitet eller å snakke mer enn det som er normalt for deg . andre uvanlige endringer i atferd eller humør
Ring helsepersonell med en gang hvis du har noen av følgende symptomer, eller ring 911 hvis en nødsituasjon. Venlafaxin tabletter, USP kan være assosiert med disse alvorlige bivirkningene:
2. Serotoninsyndrom
Denne tilstanden kan være livstruende og kan omfatte:
- . agitasjon, hallusinasjoner, koma eller andre endringer i mental status . koordinasjonsproblemer eller muskelrykninger (overaktive reflekser) . løpende hjerterytme, høyt eller lavt blodtrykk . svette eller feber . kvalme, oppkast eller diaré . muskelstivhet
3. Endringer i blodtrykket. Venlafaxin tabletter, USP kan:
- . øke blodtrykket. Kontroller høyt blodtrykk før du starter behandlingen og overvåk blodtrykket regelmessig
4. Forstørrede pupiller (mydriasis).
5. Angst og søvnløshet.
6. Endringer i appetitt eller vekt.
- . barn og ungdom bør ha høyde og vekt overvåket under behandlingen
7. Maniske/hypomane episoder:
- . kraftig økt energi . alvorlige søvnproblemer . racing tanker . hensynsløs oppførsel . uvanlig store ideer . overdreven lykke eller irritabilitet . snakker mer eller raskere enn vanlig
8. Lavt saltnivå (natrium) i blodet.
Eldre mennesker kan ha større risiko for dette. Symptomer kan omfatte:
- . hodepine . svakhet eller ustabilitet . forvirring, problemer med å konsentrere seg eller tenke eller hukommelsesproblemer
9. Kramper eller kramper.
10. Unormal blødning: venlafaksintabletter, USP og andre antidepressiva kan øke risikoen for blødninger eller blåmerker, spesielt hvis du tar blodfortynnende warfarin (Coumadin®, Jantoven®), et ikke-steroid antiinflammatorisk legemiddel (NSAIDs, som f.eks. ibuprofen eller naproxen), eller aspirin.
11. Forhøyet kolesterol.
12. Lungesykdom og lungebetennelse: venlafaksintabletter, USP kan forårsake sjeldne lungeproblemer. Symptomer inkluderer:
- . forverret kortpustethet . hoste . ubehag i brystet
13. Alvorlige allergiske reaksjoner:
- . problemer med å puste . hevelse i ansikt, tunge, øyne eller munn . utslett, kløende svulster (elveblest) eller blemmer, alene eller med feber eller leddsmerter
14. Synsproblemer:
- . øyesmerter . endringer i synet . hevelse eller rødhet i eller rundt øyet
Bare noen mennesker er i faresonen for disse problemene. Det kan være lurt å gjennomgå en øyeundersøkelse for å se om du er i faresonen og få forebyggende behandling hvis du er det.
Ikke stopp Venlafaxine Tablets, USP uten først å snakke med helsepersonell. Å stoppe venlafaksintabletter, USP for raskt eller bytte fra et annet antidepressivum for raskt kan forårsake alvorlige symptomer, inkludert:
- . angst, irritabilitet . trøtt, rastløs eller søvnproblemer . hodepine, svette, svimmelhet . elektrisk støt-lignende opplevelser, risting, forvirring, mareritt . oppkast, kvalme, diaré
Hva er Venlafaxine Tabletter, USP?
Venlafaxin tabletter, USP er en reseptbelagt medisin som brukes til å behandle depresjon. Det er viktig å snakke med helsepersonell om risikoen ved å behandle depresjon og også risikoen ved å ikke behandle den. Du bør diskutere alle behandlingsvalg med helsepersonell.
Snakk med helsepersonell hvis du ikke tror at tilstanden din blir bedre med venlafaksintabletter, USP-behandling.
Hvem bør ikke ta Venlafaxin Tabletter, USP?
- . Ikke ta venlafaksin tabletter, USP hvis du: . er allergisk mot venlafaksintabletter, USP eller noen av ingrediensene i venlafaksintabletter, USP. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser i venlafaksintabletter, USP. . har ukontrollert trangvinklet glaukom . ta en monoaminoksidasehemmer (MAOI). Spør helsepersonell eller apotek hvis du ikke er sikker på om du tar en MAO-hemmer, inkludert antibiotikum linezolid. . Ikke ta en MAO-hemmer innen 7 dager etter å ha stoppet venlafaxin tabletter, USP med mindre legen din har bedt om det. . Ikke start venlafaxin tabletter, USP hvis du sluttet å ta en MAO-hemmer i løpet av de siste 2 ukene med mindre legen din har bedt om det.
Personer som tar Venlafaxine Tabletter, USP nær en MAO-hemmer kan ha alvorlige eller til og med livstruende bivirkninger. Få medisinsk hjelp umiddelbart hvis du har noen av disse symptomene:
- . høy feber . ukontrollerte muskelspasmer . stive muskler . raske endringer i hjertefrekvens eller blodtrykk . forvirring . tap av bevissthet (besvimelse)
Hva bør jeg fortelle helsepersonell før jeg tar Venlafaxine Tablets, USP? Spør hvis du er usikker.
Før du begynner med venlafaxin tabletter, USP, fortell helsepersonell dersom du:
- . Tar visse legemidler som: . Medisiner som brukes til å behandle migrenehodepine som:
- . triptaner
- . trisykliske antidepressiva . litium . SSRI . SNRI-er . antipsykotiske legemidler
- . tramadol
- . warfarin
- . Cimetidin
- . har hjerteproblemer . har diabetes . har leverproblemer . har nyreproblemer . har problemer med skjoldbruskkjertelen . har glaukom . har eller hatt anfall eller kramper . har bipolar lidelse eller mani . har lave natriumnivåer i blodet . har høyt blodtrykk . har høyt kolesterol . har eller hatt blødningsproblemer
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Venlafaxin-tabletter, USP og noen medisiner kan interagere med hverandre, fungerer kanskje ikke like bra, eller kan forårsake alvorlige bivirkninger.
Helsepersonell eller apotek kan fortelle deg om det er trygt å ta venlafaksin tabletter, USP sammen med de andre medisinene dine. Ikke start eller stopp noen medisin mens du tar venlafaxin tabletter, USP uten å snakke med helsepersonell først.
Hvis du tar venlafaksin tabletter, USP, bør du ikke ta andre medisiner som inneholder (venlafaksin), inkludert: venlafaksin HCl.
Hvordan skal jeg ta Venlafaxine Tabletter, USP?
- . Ta venlafaksin tabletter, USP nøyaktig som foreskrevet. Det kan hende at helsepersonell må endre dosen av venlafaksintabletter, USP til det er riktig dose for deg. . Venlafaksin tabletter, USP skal tas sammen med mat. . Hvis du glemmer en dose venlafaksintabletter, USP, ta den glemte dosen så snart du husker det. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og ta neste dose til vanlig tid. Ikke ta to doser venlafaksintabletter, USP samtidig. . Hvis du tar for mye venlafaksintabletter, USP, ring helsepersonell eller giftkontrollsenter med en gang, eller få akuttbehandling. . Når du bytter fra et annet antidepressivt middel til venlafaksintabletter, kan det hende at legen din ønsker å senke dosen av det første antidepressiva først for å unngå bivirkninger
Hva bør jeg unngå mens jeg tar Venlafaxine Tabletter, USP?
Venlafaxine tabletter, USP kan forårsake søvnighet eller kan påvirke din evne til å ta beslutninger, tenke klart eller reagere raskt.
Du bør ikke kjøre bil, bruke tunge maskiner eller gjøre andre farlige aktiviteter før du vet hvordan venlafaxin tabletter, USP påvirker deg. Ikke drikk alkohol mens du bruker venlafaksintabletter, USP.
Hva er de mulige bivirkningene av Venlafaxine Tabletter, USP?
Venlafaxin tabletter, USP kan forårsake alvorlige bivirkninger, inkludert:
- . Se "Hva er den viktigste informasjonen jeg bør vite om Venlafaxine Tablets, USP?" . Økt kolesterol - få kolesterolet ditt sjekket regelmessig . Nyfødte hvis mødre tar venlafaksin tabletter, USP i tredje trimester kan ha problemer rett etter fødselen, inkludert:
- . problemer med mating og puste . anfall . skjelving, nervøsitet eller konstant gråt . Smalvinklet glaukom/forstørrede pupiller.
Sjekk øyetrykket regelmessig hvis du:
- . har en historie med økt øyetrykk . er i faresonen for visse typer glaukom
Vanlige mulige bivirkninger hos personer som tar venlafaksintabletter, USP inkluderer:
uvanlige drømmer
- . seksuelle problemer . tap av matlyst, forstoppelse, diaré, kvalme eller oppkast, eller tørr munn . føler seg trøtt, trøtt eller for trøtt . endring i søvnvaner, søvnproblemer . gjesper . skjelving eller skjelving . svimmelhet, tåkesyn . svette . føler seg engstelig, nervøs eller nervøs . hodepine . økning i hjertefrekvens
Fortell helsepersonell dersom du har noen bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av venlafaksintabletter, USP.
For mer informasjon, spør helsepersonell eller apotek.
RING DIN LEGE FOR MEDISINSK RÅD OM BIVIRKNINGER. DU KAN RAPPORTERE BIVIRKNINGER TIL FDA PÅ 1-800-FDA-1088.
Hvordan bør jeg oppbevare Venlafaxine Tabletter, USP?
- . Oppbevares ved 20° til 25°C (68° til 77°F) utflukter tillatt 15° til 30°C (59° til 86°F) [Se USP kontrollert romtemperatur ]. . Oppbevar velafaxine tabletter, USP på et tørt sted.
Hold Venlafaxin Tabletter, USP og alle medisiner utilgjengelig for barn.
Generell informasjon om venlafaksintabletter, USP Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinguide. Ikke bruk venlafaksin tabletter, USP for en tilstand som det ikke er foreskrevet for. Ikke gi venlafaksin tabletter, USP til andre mennesker, selv om de har samme tilstand. Det kan skade dem.
Denne medisinveiledningen oppsummerer den viktigste informasjonen om venlafaksintabletter, USP. Hvis du vil ha mer informasjon, snakk med helsepersonell. Du kan spørre helsepersonell eller apotek om informasjon om venlafaksin-tabletter, USP som er skrevet for helsepersonell.
For å rapportere MISTENTE BIVIRKNINGER, kontakt Sun Pharmaceutical Industries, Inc. på 1-800-818-4555.
Hva er ingrediensene i Venlafaxine Tabletter, USP?
Aktiv ingrediens: (venlafaksin)
Inaktive ingredienser:
- . Tabletter: mikrokrystallinsk cellulose, laktosemonohydrat, pregelatinisert stivelse, natriumstivelsesglykolat, rødt jernoksid, gult jernoksid, kolloidalt silisiumdioksid og magnesiumstearat
Denne medisinveiledningen er godkjent av US Food and Drug Administration for alle antidepressiva.
INDIKASJONER
Major depressiv lidelse
Effexor XR (venlafaksinhydroklorid) depotkapsler er indisert for behandling av alvorlig depressiv lidelse (MDD). Effekten ble etablert i tre kortsiktige (4, 8 og 12 uker) og to langsiktige vedlikeholdsforsøk.
Generalisert angstlidelse
Effexor XR er indisert for behandling av generalisert angstlidelse (GAD). Effekten ble etablert i to 8-ukers og to 26-ukers placebokontrollerte studier.
Sosial angst
Effexor XR er indisert for behandling av sosial angstlidelse (SAD), også kjent som sosial fobi. Effekten ble etablert i fire 12-ukers og en 26-ukers, placebokontrollerte studier.
Panikklidelse
Effexor XR er indisert for behandling av panikklidelse (PD), med eller uten agorafobi. Effekten ble etablert i to 12-ukers placebokontrollerte studier.
DOSERING OG ADMINISTRASJON
Effexor 37,5 mg XR bør administreres i en enkelt dose sammen med mat, enten om morgenen eller om kvelden til omtrent samme tid hver dag [se KLINISK FARMAKOLOGI ]. Hver kapsel skal svelges hel med væske og ikke deles, knuses, tygges eller legges i vann, eller den kan administreres ved å åpne kapselen forsiktig og drysse hele innholdet på en skje med eplemos. Denne medikament/matblandingen skal svelges umiddelbart uten å tygge og følges opp med et glass vann for å sikre fullstendig svelging av pellets (sfæroider).
Major depressiv lidelse
For de fleste pasienter er den anbefalte startdosen for Effexor 37,5 mg XR 75 mg per dag, administrert i en enkelt dose. For noen pasienter kan det være ønskelig å starte med 37,5 mg per dag i 4 til 7 dager for å la nye pasienter tilpasse seg medisinen før de øker til 75 mg per dag. Pasienter som ikke responderer på den initiale dosen på 75 mg per dag kan ha nytte av doseøkninger til maksimalt 225 mg per dag. Doseøkninger bør være i trinn på opptil 75 mg per dag, etter behov, og bør gjøres med intervaller på ikke mindre enn 4 dager, siden steady-state plasmanivåer av venlafaksin og dets hovedmetabolitter oppnås hos de fleste pasienter innen dag 4 [se KLINISK FARMAKOLOGI ]. I de kliniske studiene som påviste effekt, ble titrering oppover tillatt med intervaller på 2 uker eller mer.
Det bør bemerkes at mens den maksimale anbefalte dosen for moderat deprimerte polikliniske pasienter også er 225 mg per dag for Effexor (umiddelbar frigjøring), responderte mer alvorlig deprimerte pasienter i en studie av utviklingsprogrammet for det produktet på en gjennomsnittlig dose på 350 mg per dag (intervall fra 150 til 375 mg per dag). Hvorvidt høyere doser av Effexor 37,5 mg XR er nødvendig for mer alvorlig deprimerte pasienter er ukjent; Imidlertid er erfaringen med Effexor 75 mg XR doser høyere enn 225 mg per dag svært begrenset.
Generalisert angstlidelse
For de fleste pasienter er den anbefalte startdosen for Effexor XR 75 mg per dag, administrert i en enkelt dose. For noen pasienter kan det være ønskelig å starte med 37,5 mg per dag i 4 til 7 dager for å la nye pasienter tilpasse seg medisinen før de øker til 75 mg per dag. Pasienter som ikke responderer på den initiale dosen på 75 mg per dag kan ha nytte av doseøkninger til maksimalt 225 mg per dag. Doseøkninger bør være i trinn på opptil 75 mg per dag, etter behov, og bør gjøres med intervaller på ikke mindre enn 4 dager, siden steady-state plasmanivåer av venlafaksin og dets hovedmetabolitter oppnås hos de fleste pasienter innen dag 4 [se KLINISK FARMAKOLOGI ].
Sosial angstlidelse (sosial fobi)
Den anbefalte dosen er 75 mg per dag, administrert i en enkelt dose. Det var ingen bevis for at høyere doser gir noen ekstra fordel.
Panikklidelse
Anbefalt startdose er 37,5 mg per dag av Effexor 75 mg XR i 7 dager. Pasienter som ikke responderer på 75 mg per dag kan ha nytte av doseøkninger til maksimalt ca. 225 mg per dag. Doseøkninger bør være i trinn på opptil 75 mg per dag, etter behov, og bør gjøres med intervaller på ikke mindre enn 7 dager.
Bytte pasient fra Effexor 37,5 mg tabletter
Deprimerte pasienter som for tiden behandles med en terapeutisk dose med Effexor (umiddelbar frigjøring) kan byttes til Effexor 37,5 mg XR ved nærmeste ekvivalente dose (mg per dag), f.eks. 37,5 mg venlafaksin to ganger daglig til 75 mg Effexor 75 mg XR en gang om dagen. Individuelle dosejusteringer kan imidlertid være nødvendig.
Spesifikke populasjoner
Pasienter med nedsatt leverfunksjon
Den totale daglige dosen bør reduseres med 50 % hos pasienter med lett (Child-Pugh=5-6) til moderat (Child-Pugh=7-9) nedsatt leverfunksjon. Hos pasienter med alvorlig nedsatt leverfunksjon (Child-Pugh=10-15) eller levercirrhose kan det være nødvendig å redusere dosen med 50 % eller mer [se Bruk i spesifikke populasjoner ].
Pasienter med nedsatt nyrefunksjon
Den totale daglige dosen bør reduseres med 25 % til 50 % hos pasienter med lett (CLcr=60-89 ml/min) eller moderat (CLcr=30-59 ml/min) nedsatt nyrefunksjon. Hos pasienter som gjennomgår hemodialyse eller med alvorlig nedsatt nyrefunksjon (CLcr Bruk i spesifikke populasjoner ].
Vedlikeholdsbehandling
Det er ingen bevis tilgjengelig fra kontrollerte studier som indikerer hvor lenge pasienter med MDD, GAD, SAD eller PD bør behandles med Effexor 75mg XR.
Det er generelt enighet om at akutte episoder av MDD krever flere måneder eller lenger med vedvarende farmakologisk behandling utover respons på den akutte episoden. Effexor XR/Effexor har vist vedvarende respons i kliniske studier opp til 52 uker, ved samme dose som pasientene responderte på under den første behandlingen [se Kliniske studier ]. Det er ikke kjent om dosen av Effexor XR som er nødvendig for vedlikeholdsbehandling er identisk med dosen som trengs for å oppnå en initial respons. Pasienter bør regelmessig revurderes for å fastslå behovet for vedlikeholdsbehandling og passende dose for slik behandling.
Hos pasienter med GAD og SAD har Effexor 37,5 mg XR vist seg å være effektiv i 6-måneders kliniske studier. Behovet for fortsatt medisinering hos pasienter med GAD og SAD som blir bedre med Effexor XR-behandling bør vurderes på nytt med jevne mellomrom.
I en klinisk studie for PD opplevde pasienter som fortsatte med Effexor 75 mg XR i samme dose som de responderte i løpet av de første 12 ukene av behandlingen en statistisk signifikant lengre tid til tilbakefall enn pasienter randomisert til placebo [se Kliniske studier ]. Behovet for fortsatt medisinering hos pasienter med PD som forbedres med Effexor XR-behandling bør vurderes på nytt med jevne mellomrom.
Avvikler Effexor XR
En gradvis reduksjon i dosen, snarere enn brå seponering, anbefales ved seponering av behandling med Effexor 37,5 mg XR. I kliniske studier med Effexor 37,5 mg XR ble nedtrapping oppnådd ved å redusere den daglige dosen med 75 mg med én ukes mellomrom. Individualisering av nedtrapping kan være nødvendig [se ADVARSLER OG FORHOLDSREGLER ]. Hos noen pasienter kan det være nødvendig å seponere behandlingen over en periode på flere måneder.
Bytte pasienter til eller fra en monoaminoksidasehemmer (MAOI) beregnet på å behandle psykiatriske lidelser
Det bør gå minst 14 dager mellom seponering av en MAO-hemmer (ment å behandle psykiatriske lidelser) og oppstart av behandling med Effexor XR. I tillegg bør det tillates minst 7 dager etter seponering av Effexor XR før man starter en MAO-hemmer beregnet på å behandle psykiatriske lidelser [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER , og NARKOTIKAHANDEL ].
Bruk av Effexor XR med andre MAO-hemmere som Linezolid eller Intravenøs Methylene Blue
Ikke start Effexor 75mg XR hos en pasient som behandles med linezolid eller intravenøs metylenblått, fordi det er økt risiko for serotonergt syndrom. Hos en pasient som trenger mer akutt behandling av en psykiatrisk tilstand, bør andre intervensjoner, inkludert sykehusinnleggelse vurderes [se KONTRAINDIKASJONER ].
noen tilfeller kan en pasient som allerede får Effexor 37,5 mg XR-behandling trenge akuttbehandling med linezolid eller intravenøs metylenblått. Hvis akseptable alternativer til linezolid eller intravenøs metylenblått ikke er tilgjengelig og de potensielle fordelene med linezolid eller intravenøs metylenblåttbehandling vurderes å oppveie risikoen for serotonergt syndrom hos en bestemt pasient, bør Effexor XR stoppes umiddelbart, og linezolid eller intravenøs metylenblått kan administreres. Overvåk pasienten for symptomer på serotonergt syndrom i 7 dager eller inntil 24 timer etter siste dose linezolid eller intravenøs metylenblått, avhengig av hva som kommer først. Behandling med Effexor 75 mg XR kan gjenopptas 24 timer etter siste dose linezolid eller intravenøs metylenblått [se ADVARSLER OG FORHOLDSREGLER ].
Risikoen for å administrere metylenblått på ikke-intravenøse veier (som orale tabletter eller ved lokal injeksjon) eller i intravenøse doser mye lavere enn 1 mg/kg samtidig med Effexor XR er uklar. Legen bør likevel være klar over muligheten for nye symptomer på serotonergt syndrom ved slik bruk [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERES
Doseringsformer og styrker
Effexor 37,5 mg XR® (venlafaksinhydroklorid) kapsler med forlenget frigivelse er tilgjengelig i følgende styrker:
- . 37,5 mg kapsler (grå hette/fersken underdel med "W" og "Effexor 75mg XR" på hetten og "37,5" på underdelen) . 75 mg kapsler (ferskenhette og kropp med "W" og "Effexor 37,5mg XR" på hetten og "75" på kroppen) . 150 mg kapsler (mørk oransje hette og underdel med "W" og "Effexor 75mg XR" på hetten og "150" på kroppen)
Oppbevaring og håndtering
Effexor XR® (venlafaksinhydroklorid) kapsler med forlenget frigivelse er tilgjengelig som følger:
NDC 0008-0837-20, flaske med 15 kapsler i bruksenhetspakning. NDC 0008-0837-21, flaske med 30 kapsler i bruksenhetspakning. NDC 0008-0837-22, flaske med 90 kapsler i bruksenhetspakning. NDC 0008-0837-03, kartong med 10 Redipak®-blister med 10 kapsler hver.
NDC 0008-0833-20, flaske med 15 kapsler i bruksenhetspakning. NDC 0008-0833-21, flaske med 30 kapsler i bruksenhetspakning. NDC 0008-0833-22, flaske med 90 kapsler i bruksenhetspakning. NDC 0008-0833-03, kartong med 10 Redipak®-blister med 10 kapsler hver.
NDC 0008-0836-20, flaske med 15 kapsler i bruksenhetspakning. NDC 0008-0836-21, flaske med 30 kapsler i bruksenhetspakning. NDC 0008-0836-22, flaske med 90 kapsler i bruksenhetspakning. NDC 0008-0836-03, kartong med 10 Redipak®-blister med 10 kapsler hver.
- . 37,5 mg , grå hette/fersken kropp med "W" og "Effexor XR" på hetten og "37.5" på kroppen. . 75 mg , ferskenhette og kropp med "W" og "Effexor 37.5mg XR" på hetten og "75" på kroppen. . 150 mg mørk oransje hette og kropp med "W" og "Effexor XR" på hetten og "150" på kroppen.
Oppbevares ved kontrollert romtemperatur, 20° til 25°C (68° til 77°F).
Bruksenhetspakningen er ment å dispenseres som en enhet.
Distribuert av: Wyeth Pharmaceuticals LLC, et datterselskap av Pfizer Inc, Philadelpia, PA 19101. Revidert: nov 2021
BIVIRKNINGER
Følgende bivirkninger er omtalt mer detaljert i andre deler av etiketten:
- . Overfølsomhet [se KONTRAINDIKASJONER ] . Selvmordstanker og -atferd hos barn, ungdom og voksne [se ADVARSLER OG FORHOLDSREGLER ] . Serotoninsyndrom [se ADVARSLER OG FORHOLDSREGLER ] . Økninger i blodtrykk [se ADVARSLER OG FORHOLDSREGLER ] . Unormal blødning [se ADVARSLER OG FORHOLDSREGLER ] . Vinkellukking glaukom [se ADVARSLER OG FORHOLDSREGLER ] . Aktivering av mani/hypomani [se ADVARSLER OG FORHOLDSREGLER ] . Seponeringssyndrom [se ADVARSLER OG FORHOLDSREGLER ] . Anfall [se ADVARSLER OG FORHOLDSREGLER ] . Hyponatremi [se ADVARSLER OG FORHOLDSREGLER ] . Vekt- og høydeendringer hos pediatriske pasienter [se ADVARSLER OG FORHOLDSREGLER ] . Appetittendringer hos pediatriske pasienter [se ADVARSLER OG FORHOLDSREGLER ] . Interstitiell lungesykdom og eosinofil lungebetennelse [se ADVARSLER OG FORHOLDSREGLER ] . Seksuell dysfunksjon [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske studier
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
De vanligste bivirkningene
De vanligst observerte bivirkningene i den kliniske studiedatabasen i Effexor XR-behandlede pasienter i MDD, GAD, SAD og PD (insidens ≥ 5 % og minst dobbelt så høy som placebo) var: kvalme (30,0 %), somnolens (15,3) %), munntørrhet (14,8 %), svette (11,4 %), unormal utløsning (9,9 %), anoreksi (9,8 %), forstoppelse (9,3 %), impotens (5,3 %) og redusert libido (5,1 %).
Bivirkninger rapportert som årsaker til seponering av behandling
Kombinert på tvers av kortsiktige, placebokontrollerte premarketingstudier for alle indikasjoner, avbrøt 12 % av de 3 558 pasientene som fikk Effexor XR (37,5-225 mg) behandlingen på grunn av en uønsket opplevelse, sammenlignet med 4 % av de 2 197 placebobehandlede pasientene i disse studiene.De vanligste bivirkningene som førte til seponering hos ≥ 1 % av de Effexor XR-behandlede pasientene i korttidsstudiene (opptil 12 uker) på tvers av indikasjoner er vist i tabell 7.
Vanlige bivirkninger i placebokontrollerte studier
Antall pasienter som får flere doser av Effexor XR under vurderingen før markedsføring for hver godkjent indikasjon er vist i tabell 8. Betingelsene og varigheten av eksponeringen for venlafaksin i alle utviklingsprogrammer varierte sterkt, og inkluderte (i overlappende kategorier) åpne og dobbel- blinde studier, ukontrollerte og kontrollerte studier, stasjonære (kun Effexor) og polikliniske studier, fastdose- og titreringsstudier.
Forekomsten av vanlige bivirkninger (de som oppstod hos ≥ 2 % av Effexor XR-behandlede pasienter [357 MDD-pasienter, 1381 GAD-pasienter, 819 SAD-pasienter og 1001 PD-pasienter] og oftere enn placebo) hos Effexor XR-behandlede pasienter. - termin, placebokontrollerte, faste og fleksible kliniske studier (doser 37,5 til 225 mg per dag) er vist i tabell 9.
Bivirkningsprofilen var ikke vesentlig forskjellig mellom de forskjellige pasientpopulasjonene.
Andre bivirkninger observert i kliniske studier
Kroppen som helhet: Lysfølsomhetsreaksjon, frysninger
Sirkulasjonssystem: Postural hypotensjon, synkope, hypotensjon, takykardi
Fordøyelsessystemet: Gastrointestinal blødning [se ADVARSLER OG FORHOLDSREGLER ],
bruksisme Hemisk/lymfatisk system: Ekkymose [se ADVARSLER OG FORHOLDSREGLER ]
Metabolsk/ernæringsmessig: Hyperkolesterolemi, vektøkning [se ADVARSLER OG FORHOLDSREGLER ], vekttap [se ADVARSLER OG FORHOLDSREGLER ]
Nervesystemet: Anfall [se ADVARSLER OG FORHOLDSREGLER ], manisk reaksjon [se ADVARSLER OG FORHOLDSREGLER ], agitasjon, forvirring, akatisi, hallusinasjoner, hypertoni, myoklonus, depersonalisering, apati
Hud og vedheng: Urticaria, pruritus, utslett, alopecia
Spesielle sanser: Mydriasis, unormal akkommodasjon, tinnitus, smaksperversjon
Urogenital system: Urinretensjon, nedsatt vannlating, urininkontinens, økt urinfrekvens, menstruasjonsforstyrrelser forbundet med økt blødning eller økt uregelmessig blødning (f.eks. menorragi, metrorragi)
Endringer av vitale tegn
placebokontrollerte premarketingstudier var det økninger i gjennomsnittlig blodtrykk (se tabell 10). På tvers av de fleste indikasjoner var en doserelatert økning i gjennomsnittlig liggende systolisk og diastolisk blodtrykk tydelig hos pasienter behandlet med Effexor 37,5 mg XR. På tvers av alle kliniske studier i MDD, GAD, SAD og PD opplevde 1,4 % av pasientene i Effexor XR-gruppene en økning i SDBP på ≥15 mm Hg sammen med et blodtrykk ≥ 105 mm Hg, sammenlignet med 0,9 % av pasientene i placebogrupper. Tilsvarende opplevde 1 % av pasientene i Effexor 37,5 mg XR-gruppene en økning i SSBP på ≥ 20 mm Hg med et blodtrykk ≥ 180 mm Hg, sammenlignet med 0,3 % av pasientene i placebogruppene.
Effexor 37,5 mg XR-behandling var assosiert med vedvarende hypertensjon (definert som behandlingsoppstått diastolisk blodtrykk [SDBP] ≥ 90 mm Hg og ≥ 10 mm Hg over baseline for tre påfølgende behandlingsbesøk (se tabell 11). av pasientene mottok gjennomsnittlige doser av Effexor XR over 300 mg per dag i kliniske studier for fullt ut å evaluere forekomsten av vedvarende økning i blodtrykket ved disse høyere dosene.
Effexor 37,5 mg XR var assosiert med gjennomsnittlig økning i puls sammenlignet med placebo i placebokontrollerte studier før markedsføring (se tabell 12) [se ADVARSLER OG FORHOLDSREGLER ].
Laboratorieendringer
Serum kolesterol
Effexor XR var assosiert med gjennomsnittlig endelig økning i serumkolesterolkonsentrasjoner sammenlignet med gjennomsnittlig endelig reduksjon for placebo i premarketing MDD, GAD, SAD og PD kliniske studier (tabell 13).
Effexor 75 mg XR (venlafaksinhydroklorid) kapsler med forlenget frigivelse i opptil 12 uker i placebokontrollerte studier før markedsføring for alvorlig depressiv lidelse var assosiert med en gjennomsnittlig endelig økning i serumkolesterolkonsentrasjon på ca. 1,5 mg/dL under behandling med en gjennomsnittlig endelig reduksjon på 7,4 mg/dL for placebo. Effexor XR-behandling i opptil 8 uker og opptil 6 måneder i placebokontrollerte GAD-studier før markedsføring var assosiert med gjennomsnittlig endelig økning i serumkolesterolkonsentrasjonen på henholdsvis ca. gjennomsnittlig sluttreduksjon på henholdsvis 4,9 mg/dL og 7,7 mg/dL. Effexor XR-behandling i opptil 12 uker og opptil 6 måneder i placebokontrollerte studier med sosial angstlidelse før markedsføring var assosiert med gjennomsnittlig endelig økning i serumkolesterolkonsentrasjonen på henholdsvis ca. 7,9 mg/dL og 5,6 mg/dL under behandling. med gjennomsnittlig endelig reduksjon på henholdsvis 2,9 og 4,2 mg/dL for placebo. Effexor XR-behandling i opptil 12 uker i placebokontrollerte panikklidelsesstudier før markedsføring var assosiert med gjennomsnittlig endelig økning i serumkolesterolkonsentrasjonen på ca. 5,8 mg/dL på ca. 5,8 mg/dL sammenlignet med en gjennomsnittlig endelig reduksjon på 3,7 mg/dL for placebo.
Pasienter behandlet med Effexor (umiddelbar frigjøring) i minst 3 måneder i placebokontrollerte 12-måneders forlengelsesstudier hadde en gjennomsnittlig endelig økning i totalkolesterol under behandling på 9,1 mg/dL sammenlignet med en reduksjon på 7,1 mg/dL blant placebo- behandlede pasienter. Denne økningen var varighetsavhengig over studieperioden og hadde en tendens til å være større med høyere doser. Klinisk relevante økninger i serumkolesterol, definert som 1) en endelig økning i serumkolesterol under behandling ≥50 mg/dL fra baseline og til en verdi ≥261 mg/dL, eller 2) en gjennomsnittlig økning i serumkolesterol under behandling ≥ 50 mg/dL fra baseline og til en verdi ≥261 mg/dL ble registrert hos 5,3 % av venlafaksinbehandlede pasienter og 0,0 % av placebobehandlede pasienter.
Serum triglyserider
Effexor 75 mg XR var assosiert med gjennomsnittlig endelige økning i fastende serumtriglyserider sammenlignet med placebo i kliniske studier før markedsføring av SAD og PD i opptil 12 uker (sammenslåtte data) og 6 måneders varighet (tabell 14).
Pediatriske pasienter
Generelt var bivirkningsprofilen til venlafaksin (i placebokontrollerte kliniske studier) hos barn og ungdom (alder 6 til 17) lik den som ble sett for voksne. Som hos voksne ble nedsatt appetitt, vekttap, økt blodtrykk og økt serumkolesterol observert [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
I pediatriske kliniske studier ble bivirkningen, selvmordstanker, observert.
Spesielt ble følgende bivirkninger observert hos pediatriske pasienter: magesmerter, agitasjon, dyspepsi, ekkymose, neseblødning og myalgi.
Bivirkninger identifisert under bruk etter godkjenning
Følgende bivirkninger er identifisert under bruk av Effexor XR etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen eller etablere en årsakssammenheng med legemiddeleksponering:
Kroppen som helhet: Anafylaksi, angioødem
Sirkulasjonssystem: QT-forlengelse, ventrikkelflimmer, ventrikkeltakykardi (inkludert torsade de pointes), takotsubo kardiomyopati
Fordøyelsessystemet: Pankreatitt
Hemisk/lymfesystem: Slimhinneblødning [se ADVARSLER OG FORHOLDSREGLER ], bloddyskrasier (inkludert agranulocytose, aplastisk anemi, nøytropeni og pancytopeni), forlenget blødningstid, trombocytopeni
Metabolsk/ernæringsmessig: Hyponatremi [se ADVARSLER OG FORHOLDSREGLER ], Syndrom av upassende antidiuretisk hormon (SIADH) sekresjon [se ADVARSLER OG FORHOLDSREGLER ], unormale leverfunksjonstester, hepatitt, økt prolaktin
Muskuloskeletal: Rabdomyolyse
Nervesystemet: Malignt nevroleptikasyndrom (NMS) [se ADVARSLER OG FORHOLDSREGLER ], serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ], delirium, ekstrapyramidale reaksjoner (inkludert dystoni og dyskinesi), nedsatt koordinasjon og balanse, tardiv dyskinesi
Luftveiene: Dyspné, interstitiell lungesykdom, pulmonal eosinofili [se ADVARSLER OG FORHOLDSREGLER ]
Hud og vedheng: Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, erythema multiforme
Spesielle sanser: Vinkel-lukkende glaukom [se ADVARSLER OG FORHOLDSREGLER ]
NARKOTIKAHANDEL
Sentralnervesystemet (CNS)-aktive legemidler
Risikoen ved bruk av venlafaksin i kombinasjon med andre CNS-aktive legemidler er ikke systematisk evaluert. Følgelig tilrådes forsiktighet når Effexor XR tas i kombinasjon med andre CNS-aktive legemidler.
Monoaminoksidasehemmere
Bivirkninger, hvorav noen var alvorlige, har blitt rapportert hos pasienter som nylig har blitt seponert fra en MAO-hemmer og startet på antidepressiva med farmakologiske egenskaper som ligner på Effexor XR (SNRI eller SSRI), eller som nylig har hatt SNRI- eller SSRI-behandling seponert før til initiering av en MAOI [se DOSERING OG ADMINISTRASJON , KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Serotonerge legemidler
Basert på virkningsmekanismen til Effexor XR og potensialet for serotonergt syndrom, anbefales det å utvise forsiktighet når Effexor XR administreres sammen med andre legemidler som kan påvirke de serotonerge nevrotransmittersystemene, som triptaner, SSRI, andre SNRIer, linezolid (et antibiotikum som er en reversibel ikke-selektiv MAO-hemmer), litium, tramadol eller johannesurt. Hvis samtidig behandling med Effexor XR og disse legemidlene er klinisk berettiget, anbefales nøye observasjon av pasienten, spesielt under behandlingsstart og doseøkninger. Samtidig bruk av Effexor 75mg XR med tryptofantilskudd anbefales ikke [se DOSERING OG ADMINISTRASJON , KONTRAINDIKASJONER , og ADVARSLER OG FORHOLDSREGLER ].
Legemidler som forstyrrer hemostase (f.eks. NSAIDs, aspirin og warfarin)
Serotoninfrigjøring av blodplater spiller en viktig rolle i hemostase. Bruk av psykotrope medikamenter som forstyrrer serotoningjenopptak er assosiert med forekomst av øvre gastrointestinale blødninger og samtidig bruk av et NSAID eller aspirin kan potensere denne blødningsrisikoen [se ADVARSLER OG FORHOLDSREGLER ]. Endrede antikoagulerende effekter, inkludert økt blødning, er rapportert når SSRI og SNRI gis samtidig med warfarin. Pasienter som får warfarinbehandling bør overvåkes nøye når Effexor 37,5 mg XR startes eller seponeres.
Vekttapsmidler
Sikkerhet og effekt av venlafaksinbehandling i kombinasjon med vekttapmidler, inkludert fentermin, er ikke fastslått. Samtidig administrering av Effexor XR og vekttapmidler anbefales ikke. Effexor XR er ikke indisert for vekttap alene eller i kombinasjon med andre produkter.
Effekter av andre legemidler på Effexor XR
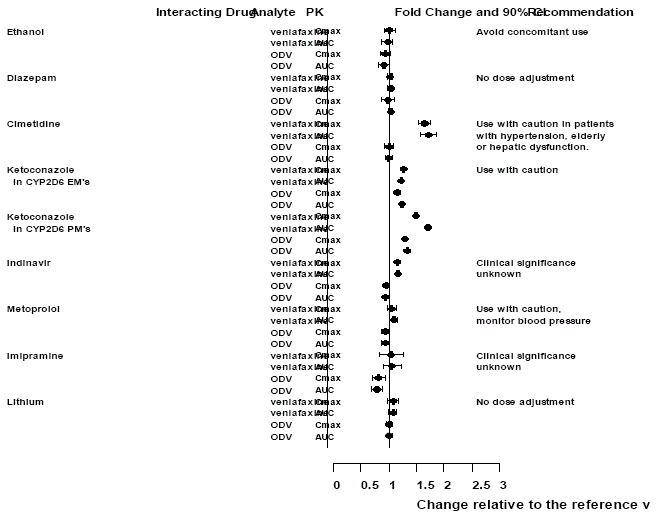
Figur 1: Effekt av interagerende legemidler på farmakokinetikken til venlafaksin og aktiv metabolitt O-desmetylvenlafaksin (ODV).
Effekter av Effexor XR på andre legemidler
Figur 2: Effekt av venlafaksin på farmakokinetikkinteragerende legemidler og deres aktive metabolitter.
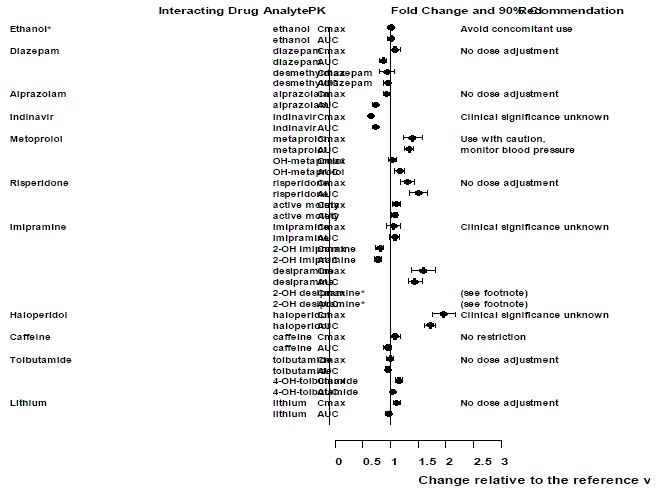
Merk
Administrering av venlafaksin i et stabilt regime overdrev ikke de psykomotoriske og psykometriske effektene indusert av etanol hos de samme pasientene når de ikke fikk venlafaksin.
Interaksjoner med legemiddel-laboratorietest
Falsk-positive urinimmunoassay-screeningstester for fencyklidin (PCP) og amfetamin er rapportert hos pasienter som tar venlafaksin. Dette skyldes manglende spesifisitet av screeningtestene. Falske positive testresultater kan forventes i flere dager etter seponering av venlafaksinbehandling. Bekreftende tester, som gasskromatografi/massespektrometri, vil skille venlafaksin fra PCP og amfetamin.
Narkotikamisbruk og avhengighet
Kontrollert stoff
Effexor 75mg XR er ikke et kontrollert stoff.
Misbruke
Mens venlafaksin ikke har blitt systematisk studert i kliniske studier for potensialet for misbruk, var det ingen indikasjon på legemiddelsøkende atferd i de kliniske studiene. Det er imidlertid ikke mulig å forutsi på grunnlag av erfaring før markedsføring i hvilken grad et CNS-aktivt legemiddel vil bli misbrukt, avledet og/eller misbrukt når det først er markedsført. Følgelig bør leger nøye vurdere pasienter for historie med narkotikamisbruk og følge slike pasienter nøye, observere dem for tegn på misbruk eller misbruk av venlafaksin (f.eks. utvikling av toleranse, økning av dose, legemiddelsøkende atferd).
Avhengighet
In vitro-studier viste at venlafaksin praktisk talt ikke har noen affinitet for opiat-, benzodiazepin-, fencyklidin (PCP) eller N-metyl-D-asparaginsyre (NMDA) reseptorer.
Venlafaksin ble ikke funnet å ha noen signifikant CNS-stimulerende aktivitet hos gnagere. I studier med diskriminering av primater viste venlafaksin ingen signifikant ansvar for misbruk av stimulerende eller dempende midler.
Seponeringseffekter er rapportert hos pasienter som får venlafaksin [se DOSERING OG ADMINISTRASJON ].
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Selvmordstanker og -adferd hos barn, ungdom og unge voksne
Pasienter med alvorlig depressiv lidelse (MDD), både voksne og barn, kan oppleve forverring av depresjonen og/eller fremveksten av selvmordstanker og -adferd (suicidalitet) eller uvanlige endringer i atferd, enten de tar antidepressive medisiner eller ikke, og dette risikoen kan vedvare inntil betydelig remisjon oppstår. Selvmord er en kjent risiko for depresjon og visse andre psykiatriske lidelser, og disse lidelsene er i seg selv de sterkeste prediktorene for selvmord. Det har imidlertid vært en langvarig bekymring for at antidepressiva kan ha en rolle i å indusere forverring av depresjon og fremveksten av suicidalitet hos visse pasienter i de tidlige faser av behandlingen. Samlede analyser av kortsiktige placebokontrollerte studier av antidepressiva (SSRI og andre) viste at disse medikamentene øker risikoen for suicidal tenkning og atferd (suicidalitet) hos barn, ungdom og unge voksne (alder 18-24) med MDD og andre psykiatriske lidelser. Korttidsstudier viste ikke en økning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne over 24 år; det var en reduksjon med antidepressiva sammenlignet med placebo hos voksne i alderen 65 år og eldre.
De samlede analysene av placebokontrollerte studier hos barn og ungdom med MDD, tvangslidelse (OCD) eller andre psykiatriske lidelser inkluderte totalt 24 korttidsstudier av 9 antidepressiva med over 4400 pasienter. De samlede analysene av placebokontrollerte studier hos voksne med MDD eller andre psykiatriske lidelser inkluderte totalt 295 korttidsstudier (median varighet på 2 måneder) av 11 antidepressiva med over 77 000 pasienter. Det var betydelig variasjon i risiko for suicidalitet blant legemidler, men en tendens til en økning i yngre pasienter for nesten alle legemidler som ble studert. Det var forskjeller i absolutt risiko for suicidalitet på tvers av de forskjellige indikasjonene, med høyest forekomst av MDD. Risikoforskjellene (legemiddel versus placebo) var imidlertid relativt stabile innenfor aldersstrata og på tvers av indikasjoner. Disse risikoforskjellene (medikament-placebo-forskjell i antall tilfeller av suicidalitet per 1000 behandlede pasienter) er gitt i tabell 1.
Ingen selvmord forekom i noen av de pediatriske studiene. Det var selvmord i voksenstudiene, men antallet var ikke tilstrekkelig til å komme til noen konklusjon om legemiddeleffekt på selvmord.
Det er ukjent om suicidalitetsrisikoen strekker seg til lengre tids bruk, dvs. utover flere måneder. Imidlertid er det betydelig bevis fra placebokontrollerte vedlikeholdsstudier hos voksne med depresjon på at bruk av antidepressiva kan forsinke tilbakefall av depresjon.
Alle pasienter som behandles med antidepressiva for enhver indikasjon bør overvåkes hensiktsmessig og observeres nøye for klinisk forverring, suicidalitet og uvanlige endringer i atferd, spesielt i løpet av de første månedene av en medikamentell behandlingskur, eller ved doseendringer, enten økninger eller synker.
Følgende symptomer, angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshet), hypomani og mani, er rapportert hos voksne og pediatriske pasienter som behandles med antidepressiva for MDD, samt for andre indikasjoner, både psykiatriske og ikke-psykiatriske. Selv om det ikke er etablert en årsakssammenheng mellom fremveksten av slike symptomer og enten forverring av depresjon og/eller fremveksten av selvmordsimpulser, er det bekymring for at slike symptomer kan representere forløpere til fremvoksende suicidalitet.
Det bør vurderes å endre det terapeutiske regimet, inkludert eventuelt seponering av medisinen, hos pasienter hvis depresjon er vedvarende verre, eller som opplever ny suicidalitet eller symptomer som kan være forløpere til forverring av depresjon eller suicidalitet, spesielt hvis disse symptomene er alvorlige, brå i debut, eller var ikke en del av pasientens symptomer.
Hvis beslutningen er tatt om å avbryte behandlingen, bør medisinen trappes ned så raskt som mulig, men med erkjennelse av at brå seponering kan være forbundet med visse symptomer [se Seponeringssyndrom og DOSERING OG ADMINISTRASJON ].
Familier og omsorgspersoner til pasienter som behandles med antidepressiva for MDD eller andre indikasjoner, både psykiatriske og ikke-psykiatriske, bør varsles om behovet for å overvåke pasienter for fremveksten av agitasjon, irritabilitet, uvanlige endringer i atferd og de andre symptomene beskrevet ovenfor, som så vel som fremveksten av suicidalitet, og å rapportere slike symptomer umiddelbart til helsepersonell. Slik overvåking bør inkludere daglig observasjon av familier og omsorgspersoner. Resepter for Effexor XR bør skrives ut for den minste mengde kapsler i samsvar med god pasientbehandling, for å redusere risikoen for overdosering.
Screening av pasienter for bipolar lidelse
En alvorlig depressiv episode kan være den første presentasjonen av bipolar lidelse. Det er generelt antatt (men ikke etablert i kontrollerte studier) at behandling av en slik episode med et antidepressivum alene kan øke sannsynligheten for utfelling av en blandet/manisk episode hos pasienter med risiko for bipolar lidelse. Hvorvidt noen av symptomene beskrevet ovenfor representerer en slik konvertering er ukjent. Før behandling med et antidepressivum startes, bør imidlertid pasienter med depressive symptomer undersøkes tilstrekkelig for å avgjøre om de har risiko for bipolar lidelse; slik screening bør inkludere en detaljert psykiatrisk historie, inkludert en familiehistorie med selvmord, bipolar lidelse og depresjon. Det skal bemerkes at Effexor XR ikke er godkjent for bruk ved behandling av bipolar depresjon.
Serotonin syndrom
Utvikling av et potensielt livstruende serotonergt syndrom er rapportert med serotonin-noradrenalin reopptakshemmere (SNRI) og SSRI, inkludert Effexor XR alene, men spesielt ved samtidig bruk av andre serotonerge legemidler (inkludert triptaner, trisykliske antidepressiva, lithium, lithium, tramadol, tryptofan, buspiron, amfetamin og johannesurt) og med legemidler som hemmer metabolismen av serotonin spesielt, MAO-hemmere, både de som er beregnet på å behandle psykiatriske lidelser og andre, som linezolid eller intravenøs metylenblått).
Symptomer på serotonergt syndrom kan omfatte endringer i mental status (f.eks. agitasjon, hallusinasjoner, delirium, koma) autonom ustabilitet (f.eks. takykardi, labilt blodtrykk, hypertermi, diaforese, rødme og svimmelhet), nevromuskulære symptomer (f.eks. skjelving, rigiditet, myoklonus). , hyperrefleksi, inkoordinasjon); anfall og gastrointestinale symptomer (f.eks. kvalme, oppkast, diaré). Pasienter bør overvåkes for fremveksten av serotonergt syndrom.
Samtidig bruk av Effexor XR og MAO-hemmere (ment å behandle psykiatriske lidelser) er kontraindisert. Effexor XR bør heller ikke startes hos en pasient som behandles med MAO-hemmere som linezolid eller intravenøs metylenblått. Alle rapporter med metylenblått som ga informasjon om administreringsveien involverte intravenøs administrering i doseområdet 1 mg/kg til 8 mg/kg. Ingen rapporter involverte administrering av metylenblått på andre måter (som orale tabletter eller lokal vevsinjeksjon) eller ved lavere doser. Det kan være omstendigheter når det er nødvendig å starte behandling med en MAO-hemmer som linezolid eller intravenøs metylenblått hos en pasient som tar Effexor 37,5 mg XR. Effexor XR bør seponeres før behandling med MAO-hemmeren startes [se KONTRAINDIKASJONER , DOSERING OG ADMINISTRASJON , og NARKOTIKAHANDEL ].
Hvis samtidig bruk av Effexor 37,5 mg XR med andre serotonerge legemidler (f.eks. triptaner, trisykliske antidepressiva, mirtazapin, fentanyl, litium, tramadol, buspiron, amfetamin, tryptofan eller johannesurt) er klinisk berettiget, nøye observasjon av pasienten anbefales, spesielt under behandlingsstart og doseøkninger [se NARKOTIKAHANDEL ]. Pasienter bør gjøres oppmerksomme på den potensielle risikoen for serotonergt syndrom. Behandling med Effexor XR og eventuelle samtidige serotonerge midler bør seponeres umiddelbart hvis ovennevnte hendelser oppstår, og støttende symptomatisk behandling bør startes.
Økninger i blodtrykk
I kontrollerte studier var det doserelaterte økninger i systolisk og diastolisk blodtrykk, samt tilfeller av vedvarende hypertensjon [se BIVIRKNINGER ].
Overvåk blodtrykket før du starter behandling med Effexor 37,5 mg XR og regelmessig under behandlingen. Kontroller allerede eksisterende hypertensjon før behandling med Effexor 75 mg XR startes. Vær forsiktig ved behandling av pasienter med eksisterende hypertensjon eller kardiovaskulære eller cerebrovaskulære tilstander som kan bli kompromittert av økt blodtrykk. Vedvarende blodtrykksøkning kan føre til uønskede utfall. Tilfeller av forhøyet blodtrykk som krever umiddelbar behandling er rapportert med Effexor XR. Vurder dosereduksjon eller seponering av behandling for pasienter som opplever en vedvarende økning i blodtrykket.
På tvers av alle kliniske studier med Effexor 37,5 mg opplevde 1,4 % av pasientene i de Effexor XR-behandlede gruppene en økning på ≥15 mm Hg i liggende diastolisk blodtrykk (SDBP) ≥ 105 mm Hg, sammenlignet med 0,9 % av pasientene i placebogruppene. Tilsvarende opplevde 1 % av pasientene i de Effexor 75 mg XR-behandlede gruppene en økning på ≥ 20 mm Hg i systolisk blodtrykk (SSBP) med blodtrykk ≥ 180 mm Hg, sammenlignet med 0,3 % av pasientene i placebogruppene [se tabell 10 i BIVIRKNINGER ]. Effexor 75 mg XR-behandling var assosiert med vedvarende hypertensjon (definert som behandlingsutløst SDBP ≥ 90 mm Hg og ≥ 10 mm Hg over baseline for tre påfølgende behandlingsbesøk [se tabell 11 i BIVIRKNINGER ]. Et utilstrekkelig antall pasienter mottok gjennomsnittlige doser av Effexor 37,5 mg XR over 300 mg per dag i kliniske studier for fullt ut å kunne evaluere forekomsten av vedvarende økning i blodtrykket ved disse høyere dosene.
Unormal blødning
SSRI og SNRI, inkludert Effexor 37,5 mg XR, kan øke risikoen for blødningshendelser, alt fra ekkymoser, hematomer, neseblødning, petekkier og gastrointestinale blødninger til livstruende blødninger. Samtidig bruk av aspirin, ikke-steroide antiinflammatoriske legemidler (NSAIDs), warfarin og andre antikoagulanter eller andre legemidler som er kjent for å påvirke blodplatefunksjonen kan øke denne risikoen. Kasusrapporter og epidemiologiske studier (kasuskontroll og kohortdesign) har vist en sammenheng mellom bruk av medikamenter som forstyrrer serotoningjenopptak og forekomst av gastrointestinal blødning. Forsiktig pasienter om risikoen for blødning forbundet med samtidig bruk av Effexor 75mg XR og NSAIDs, aspirin eller andre legemidler som påvirker koagulasjonen.
Vinkel-lukkende glaukom
Pupilledilasjonen som oppstår etter bruk av mange antidepressiva, inkludert Effexor XR, kan utløse et vinkelangrep hos en pasient med anatomisk smale vinkler som ikke har patentert iridektomi.
Aktivering av mani/hypomani
Mani eller hypomani ble rapportert hos pasienter behandlet med Effexor 37,5 mg XR i premarketingstudiene i MDD, SAD og PD (se tabell 2). Mani/hypomani er også rapportert hos en liten andel av pasienter med stemningslidelser som ble behandlet med andre markedsførte legemidler for å behandle MDD. Effexor 37,5 mg XR bør brukes med forsiktighet hos pasienter med en historie med mani eller hypomani.
Seponeringssyndrom
Seponeringssymptomer har blitt systematisk evaluert hos pasienter som tar venlafaksin, inkludert prospektive analyser av kliniske studier i GAD og retrospektive undersøkelser av studier i MDD og SAD. Brå seponering eller dosereduksjon av venlafaksin ved ulike doser har vist seg å være assosiert med opptreden av nye symptomer, hvis frekvens økte med økt dosenivå og med lengre behandlingsvarighet. Rapporterte symptomer inkluderer agitasjon, anoreksi, angst, forvirring, nedsatt koordinasjon og balanse, diaré, svimmelhet, munntørrhet, dysforisk stemning, fascikulasjon, tretthet, influensalignende symptomer, hodepine, hypomani, søvnløshet, kvalme, nervøsitet, mareritt, sanseforstyrrelser ( inkludert støtlignende elektriske opplevelser), søvnighet, svette, skjelving, svimmelhet og oppkast.
Det har vært rapporter etter markedsføring om alvorlige seponeringssymptomer som kan være langvarige og alvorlige. Fullført selvmord, selvmordstanker, aggresjon og voldelig atferd har blitt observert hos pasienter under reduksjon i Effexor 75 mg XR-dose, inkludert under seponering. Andre postmarkedsføringsrapporter beskriver visuelle endringer (som tåkesyn eller problemer med å fokusere) og økt blodtrykk etter å ha stoppet eller redusert dosen av Effexor XR.
Under markedsføring av Effexor XR, andre SNRI-er og SSRI-er har det vært spontane rapporter om andre uønskede hendelser som oppstår ved seponering av disse legemidlene, spesielt ved brå behandling, inkludert følgende: irritabilitet, sløvhet, emosjonell labilitet, tinnitus og anfall.
Pasienter bør overvåkes for disse symptomene når behandlingen med Effexor XR avsluttes. En gradvis reduksjon i dosen, snarere enn brå seponering, anbefales. Hvis det oppstår utålelige symptomer etter en dosereduksjon eller ved seponering av behandlingen, kan det vurderes å gjenoppta den tidligere foreskrevne dosen. Deretter kan helsepersonell fortsette å redusere dosen, men med en mer gradvis hastighet. Hos noen pasienter kan det være nødvendig å seponere behandlingen over en periode på flere måneder [se DOSERING OG ADMINISTRASJON ].
Anfall
Kramper har oppstått med venlafaksinbehandling. Effexor 75mg XR, som mange antidepressiva, bør brukes med forsiktighet hos pasienter med anfallshistorie og bør seponeres hos alle pasienter som utvikler anfall. [Må redusere risikoen: Risikofaktorer, samtidig medikamenter som senker krampeterskelen.]
Hyponatremi
Hyponatremi kan oppstå som følge av behandling med SSRI og SNRI, inkludert Effexor 37,5 mg XR. I mange tilfeller ser hyponatremien ut til å være et resultat av syndromet av upassende antidiuretisk hormon (SIADH) sekresjon. Tilfeller med serumnatrium lavere enn 110 mmol/L er rapportert. Eldre pasienter kan ha større risiko for å utvikle hyponatremi med SSRI og SNRI [se Bruk i spesifikke populasjoner ]. Pasienter som tar diuretika, eller de som på annen måte er volumfattige, kan ha større risiko. Vurder seponering av Effexor 37,5 mg XR hos pasienter med symptomatisk hyponatremi, og iverksett passende medisinsk intervensjon.
Tegn og symptomer på hyponatremi inkluderer hodepine, konsentrasjonsvansker, hukommelsessvikt, forvirring, svakhet og ustabilitet, som kan føre til fall. Tegn og symptomer assosiert med mer alvorlige og/eller akutte tilfeller har inkludert hallusinasjoner, synkope, anfall, koma, pustestans og død.
Vekt- og høydeendringer hos pediatriske pasienter
Vektendringer
Gjennomsnittlig endring i kroppsvekt og forekomst av vekttap (prosentandel av pasienter som mistet 3,5 % eller mer) i de placebokontrollerte pediatriske studiene i MDD, GAD og SAD er vist i tabell 3 og 4.
Vekttap var ikke begrenset til pasienter med behandlingsutløst anoreksi [se Appetittendringer hos pediatriske pasienter ].
Risikoen forbundet med langtidsbruk av Effexor 75 mg XR ble vurdert i en åpen MDD-studie av barn og ungdom som fikk Effexor XR i opptil seks måneder. Barna og ungdommene i studien hadde vektøkninger som var mindre enn forventet, basert på data fra alders- og kjønnsmatchede jevnaldrende. Forskjellen mellom observert vektøkning og forventet vektøkning var større for barn (
Høydeendringer
Tabell 5 viser gjennomsnittlig høydeøkning hos pediatriske pasienter i de kortsiktige, placebokontrollerte MDD-, GAD- og SAD-studiene. Forskjellene i høydeøkning i GAD- og MDD-studier var mest bemerkelsesverdige hos pasienter yngre enn tolv.
I den seks måneder lange, åpne MDD-studien, hadde barn og ungdom høydeøkninger som var mindre enn forventet, basert på data fra jevnaldrende med alder og kjønn. Forskjellen mellom observert og forventet veksthastighet var større for barn (
Appetittendringer hos pediatriske pasienter
Redusert appetitt (rapportert som behandlingsfremkallende anoreksi) ble oftere observert hos Effexor XR-behandlede pasienter sammenlignet med placebo-behandlede pasienter i premarketing-evalueringen av Effexor XR for MDD, GAD og SAD (se tabell 6).
Interstitiell lungesykdom og eosinofil lungebetennelse
Interstitiell lungesykdom og eosinofil lungebetennelse assosiert med venlafaksinbehandling er sjelden rapportert. Muligheten for disse bivirkningene bør vurderes hos venlafaksinbehandlede pasienter som har progressiv dyspné, hoste eller ubehag i brystet. Slike pasienter bør gjennomgå en rask medisinsk evaluering, og seponering av venlafaksinbehandling bør vurderes.
Seksuell dysfunksjon
Bruk av SNRI-er, inkludert Effexor XR, kan forårsake symptomer på seksuell dysfunksjon [se BIVIRKNINGER ]. Hos mannlige pasienter kan bruk av SNRI resultere i ejakulatorisk forsinkelse eller svikt, redusert libido og erektil dysfunksjon. Hos kvinnelige pasienter kan bruk av SNRI resultere i redusert libido og forsinket eller manglende orgasme.
Det er viktig for forskrivere å spørre om seksuell funksjon før oppstart av Effexor 37,5 mg XR og å spørre spesifikt om endringer i seksuell funksjon under behandlingen, fordi seksuell funksjon kanskje ikke er spontant rapportert. Ved evaluering av endringer i seksuell funksjon er det viktig å få en detaljert anamnese (inkludert tidspunkt for symptomdebut) fordi seksuelle symptomer kan ha andre årsaker, inkludert den underliggende psykiatriske lidelsen. Diskuter potensielle ledelsesstrategier for å støtte pasienter i å ta informerte beslutninger om behandling.
Informasjon om pasientveiledning
Se FDA-godkjent PASIENTINFORMASJON ( Medisinveiledning ).
Forskrivere eller annet helsepersonell bør informere pasienter, deres familier og deres omsorgspersoner om fordelene og risikoene forbundet med behandling med Effexor 37,5 mg XR og bør gi dem råd om riktig bruk. En pasientmedisineringsveiledning om "antidepressive medisiner, depresjon og andre alvorlige psykiske sykdommer og selvmordstanker eller handlinger" er tilgjengelig for Effexor 75mg XR. Forskriveren eller helsepersonell bør instruere pasienter, deres familier og deres omsorgspersoner om å lese medisinveiledningen og bør hjelpe dem med å forstå innholdet. Pasienter bør gis mulighet til å diskutere innholdet i legemiddelveiledningen og få svar på spørsmål de måtte ha. Den fullstendige teksten til medisinveiledningen er skrevet ut på nytt på slutten av dette dokumentet. Pasienter bør informeres om følgende problemer og bør bes om å varsle sin forskriver dersom disse oppstår mens de tar Effexor XR.
Selvmordstanker og -adferd
Råd pasienter, deres familier og omsorgspersoner til å se etter fremveksten av suicidalitet, forverring av depresjon og andre psykiatriske symptomer (angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi, psykomotorisk rastløshet, hypomani, mani, andre uvanlige endringer i atferd), spesielt tidlig under behandlingen og når dosen justeres opp eller ned. Slike symptomer bør rapporteres til pasientens forskriver eller helsepersonell, spesielt hvis de er alvorlige, plutselige eller ikke var en del av pasientens symptomer. Symptomer som disse kan være assosiert med økt risiko for suicidal tenkning og atferd og indikerer behov for svært nøye overvåking [se BOKS ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Samtidig medisinering
Råd pasienter som tar Effexor XR til å ikke bruke andre produkter som inneholder venlafaksin eller desvenlafaksin samtidig. Helsepersonell bør instruere pasienter om ikke å ta Effexor XR med en MAO-hemmer eller innen 14 dager etter seponering av en MAO-hemmer og å tillate 7 dager etter seponering av Effexor XR før man starter en MAO-hemmer [se KONTRAINDIKASJONER ].
Serotonin syndrom
Pasienter bør advares om risikoen for serotonergt syndrom, ved samtidig bruk av Effexor 75mg XR og triptaner, tramadol, amfetaminer, tryptofantilskudd, med antipsykotika eller andre dopaminantagonister, eller andre serotonerge midler [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ].
Forhøyet blodtrykk
Informer pasienter om at de bør ha regelmessig overvåking av blodtrykket når de tar Effexor XR [se ADVARSLER OG FORHOLDSREGLER ].
Unormal blødning
Pasienter bør advares om samtidig bruk av Effexor 75mg XR og NSAIDs, aspirin, warfarin eller andre legemidler som påvirker koagulasjonen siden kombinert bruk av psykotrope legemidler som forstyrrer serotoningjenopptaket og disse midlene har vært assosiert med økt risiko for blødning [se ADVARSLER OG FORHOLDSREGLER ].
Vinkellukkende glaukom
Pasienter bør informeres om at bruk av Effexor XR kan forårsake mild pupilledilatasjon, som hos følsomme personer kan føre til en episode med lukket vinkelglaukom. Eksisterende glaukom er nesten alltid åpenvinklet glaukom fordi vinkelglaukom, når det er diagnostisert, kan behandles definitivt med iridektomi. Åpenvinklet glaukom er ikke en risikofaktor for lukkevinkelglaukom. Pasienter kan ønske å bli undersøkt for å avgjøre om de er mottakelige for vinkellukking, og ha en profylaktisk prosedyre (f.eks. iridektomi), hvis de er mottakelige [se ADVARSLER OG FORHOLDSREGLER ].
Aktivering av mani/hypomani
Råd pasienter, deres familier og omsorgspersoner til å observere for tegn på aktivering av mani/hypomani [se ADVARSLER OG FORHOLDSREGLER ].
Kardiovaskulær/Cerebrovaskulær sykdom
Forsiktighet anbefales ved administrering av Effexor XR til pasienter med kardiovaskulære, cerebrovaskulære eller lipidmetabolismeforstyrrelser [se BIVIRKNINGER ].
Serumkolesterol og triglyseridøkning
Informer pasienter om at økninger i totalkolesterol, LDL og triglyserider kan forekomme og at måling av serumlipider kan vurderes [se ADVARSLER OG FORHOLDSREGLER ].
Seponeringssyndrom
Råd pasienter om å ikke slutte å ta Effexor 75mg XR uten å snakke med helsepersonell først. Pasienter bør være oppmerksomme på at seponeringseffekter kan oppstå ved seponering av Effexor XR [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Seksuell dysfunksjon
Informer pasienter om at bruk av Effexor XR kan forårsake symptomer på seksuell dysfunksjon hos både mannlige og kvinnelige pasienter. Informer pasienter om at de bør diskutere eventuelle endringer i seksuell funksjon og potensielle behandlingsstrategier med helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Interferens med kognitiv og motorisk ytelse
Forsiktig pasienter med å bruke farlige maskiner, inkludert biler, inntil de er rimelig sikre på at Effexor 37,5 mg XR-behandling ikke påvirker deres evne til å delta i slike aktiviteter negativt.
Alkohol
Råd pasienter til å unngå alkohol mens de tar Effexor 37,5 mg XR [se NARKOTIKAHANDEL ].
Allergiske reaksjoner
Råd pasienter til å varsle legen dersom de utvikler allergiske fenomener som utslett, elveblest, hevelse eller pustevansker.
Svangerskap
Råd pasientene til å varsle legen dersom de blir gravide eller har tenkt å bli gravide under behandlingen [se Bruk i spesifikke populasjoner ].
Sykepleie
Råd pasienter til å varsle legen sin hvis de ammer et spedbarn [se Bruk i spesifikke populasjoner ].
Resterende sfæroider
Effexor XR inneholder sfæroider, som frigjør stoffet sakte i fordøyelseskanalen. Den uløselige delen av disse sfæroidene elimineres, og pasienter kan legge merke til sfæroider som passerer i avføringen eller via kolostomi. Pasienter bør informeres om at den aktive medisinen allerede er absorbert når pasienten ser sfæroidene.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Tumorer ble ikke økt ved behandling med venlafaksin hos mus eller rotter. Venlafaksin ble gitt som oral sonde til mus i 18 måneder i doser på opptil 120 mg/kg per dag, som var 1,7 ganger den maksimale anbefalte humane dosen på mg/m2-basis. Venlafaksin ble også gitt til rotter ved oral sonde i 24 måneder i doser opp til 120 mg/kg per dag. Hos rotter som fikk dosen på 120 mg/kg, var plasmakonsentrasjonen av venlafaksin ved obduksjon 1 ganger (hannrotter) og 6 ganger (hunnrotter) plasmakonsentrasjonen til pasienter som fikk maksimal anbefalt human dose. Plasmanivåer av O-desmetylmetabolitten (ODV) var lavere hos rotter enn hos pasienter som fikk maksimal anbefalt dose. O-desmetylvenlafaksin (ODV), den viktigste humane metabolitten av venlafaksin, administrert ved oral sonde til mus og rotter i 2 år, økte ikke forekomsten av svulster i noen av studiene. Mus fikk ODV i doser opp til 500/300 mg/kg/dag (dosen ble redusert etter 45 ukers dosering). Eksponeringen ved dosen 300 mg/kg/dag er 9 ganger større enn en dose på 225 mg/dag til mennesker. Rotter fikk ODV i doser opp til 300 mg/kg/dag (hanner) eller 500 mg/kg/dag (hunn). Eksponeringen ved den høyeste dosen er ca. 8 (menn) eller 11 (kvinner) ganger den for en human dose på 225 mg/dag.
Mutagenese
Venlafaksin og den viktigste humane metabolitten, ODV, var ikke mutagent i Ames revers mutasjonsanalyse i Salmonella-bakterier eller kinesisk hamster ovarie/HGPRT pattedyrcelle videregående genmutasjonsanalyse. Venlafaksin var heller ikke mutagent eller klastogent i in vitro BALB/c-3T3-musecelletransformasjonsanalysen, søsterkromatidutvekslingsanalysen i dyrkede kinesiske hamsterovarieceller, eller i in vivo-kromosomavviksanalysen i rottebenmarg. ODV var ikke klastogent i in vitro ovariecelle-kromosomavviksanalysen i kinesisk hamster eller i in vivo-analysen av kromosomavvik hos rotter.
Nedsatt fruktbarhet
Reproduksjons- og fertilitetsstudier av venlafaksin hos rotter viste ingen bivirkninger av venlafaksin på mannlig eller kvinnelig fertilitet ved orale doser på opptil 2 ganger maksimal anbefalt human dose på 225 mg/dag på mg/m2 basis. Imidlertid ble redusert fertilitet observert i en studie der hann- og hunnrotter ble behandlet med O-desmetylvenlafaksin (ODV), den viktigste humane metabolitten av venlafaksin, før og under paring og svangerskap. Dette skjedde ved en ODV-eksponering (AUC) omtrent 2 til 3 ganger den som er forbundet med en human venlafaksindose på 225 mg/dag.
Bruk i spesifikke populasjoner
Svangerskap
Teratogene effekter
Graviditetskategori C
Venlafaksin forårsaket ikke misdannelser hos avkom av rotter eller kaniner gitt doser opptil 2,5 ganger (rotte) eller 4 ganger (kanin) den maksimale anbefalte daglige dosen til mennesker på mg/m2-basis. Hos rotter var det imidlertid en reduksjon i valpevekt, en økning i dødfødte valper og en økning i valpedødsfall i løpet av de første 5 dagene av diegivning, da doseringen startet under drektigheten og fortsatte til avvenning. Årsaken til disse dødsfallene er ikke kjent. Disse effektene oppsto ved 2,5 ganger (mg/m2) den maksimale daglige dosen til mennesker. Ingen effektdose for dødelighet av rotteunger var 0,25 ganger human dose på mg/m2-basis. I reproduktive utviklingsstudier på rotter og kaniner med O-desmetylvenlafaksin (ODV), den viktigste humane metabolitten av venlafaksin, ble det ikke observert tegn på teratogenisitet ved eksponeringsmarginer på 13 hos rotter og 0,3 hos kaniner. Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Effexor XR skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for menneskelig respons, bør dette legemidlet kun brukes under graviditet hvis det er klart nødvendig.
Ikke-teratogene effekter
Nyfødte eksponert for Effexor 37,5 mg XR, andre SNRI-er eller SSRI-er sent i tredje trimester har utviklet komplikasjoner som krever langvarig sykehusinnleggelse, pustestøtte og sondeernæring. Slike komplikasjoner kan oppstå umiddelbart etter levering. Rapporterte kliniske funn har inkludert pustebesvær, cyanose, apné, anfall, temperaturustabilitet, matvansker, oppkast, hypoglykemi, hypotoni, hypertoni, hyperrefleksi, skjelving, urolighet, irritabilitet og konstant gråt. Disse egenskapene stemmer overens med enten en direkte toksisk effekt av SSRI og SNRI, eller muligens et medikamentavbruddssyndrom. Det skal bemerkes at i noen tilfeller er det kliniske bildet i samsvar med serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ]. Ved behandling av en gravid kvinne med Effexor XR i tredje trimester, bør legen nøye vurdere potensielle risikoer og fordeler ved behandlingen.
Arbeid og levering
Effekten av venlafaksin på fødsel og fødsel hos mennesker er ukjent.
Ammende mødre
Venlafaksin og ODV er rapportert å bli utskilt i morsmelk. På grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn fra Effexor XR, bør det tas en beslutning om å avbryte ammingen eller å avbryte medikamentet, tatt i betraktning stoffets betydning for moren.
Pediatrisk bruk
To placebokontrollerte studier med 766 pediatriske pasienter med MDD og to placebokontrollerte studier med 793 pediatriske pasienter med GAD har blitt utført med Effexor XR, og dataene var ikke tilstrekkelige til å støtte en påstand om bruk hos pediatriske pasienter.
Alle som vurderer bruk av Effexor XR hos et barn eller ungdom må balansere den potensielle risikoen med det kliniske behovet [se BOKS ADVARSEL , ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Selv om det ikke er laget noen studier for primært å vurdere Effexor 37,5 mg XRs innvirkning på vekst, utvikling og modning hos barn og ungdom, tyder studiene som er gjort på at Effexor XR kan ha en negativ innvirkning på vekt og høyde [se ADVARSLER OG FORHOLDSREGLER ]. Dersom det tas beslutning om å behandle en pediatrisk pasient med Effexor XR, anbefales regelmessig overvåking av vekt og høyde under behandlingen, spesielt hvis behandlingen skal fortsette over lang tid [se ADVARSLER OG FORHOLDSREGLER ]. Sikkerheten til Effexor 75 mg XR-behandling for pediatriske pasienter har ikke blitt systematisk vurdert for kronisk behandling med lengre varighet enn seks måneder. I studiene utført på pediatriske pasienter (alder 6-17), var forekomsten av blodtrykk og kolesteroløkninger som ble ansett for å være klinisk relevante hos pediatriske pasienter lik den som ble observert hos voksne pasienter. Følgelig gjelder forholdsreglene for voksne for pediatriske pasienter [se ADVARSLER OG FORHOLDSREGLER ].
Geriatrisk bruk
Prosentandelen av pasienter i kliniske studier for Effexor 37,5 mg XR for MDD, GAD, SAD og PD som var 65 år eller eldre, er vist i tabell 15.
Ingen generelle forskjeller i effektivitet eller sikkerhet ble observert mellom geriatriske pasienter og yngre pasienter, og annen rapportert klinisk erfaring har generelt ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Større sensitivitet hos enkelte eldre individer kan imidlertid ikke utelukkes. SSRI og SNRI, inkludert Effexor XR, har vært assosiert med tilfeller av klinisk signifikant hyponatremi hos eldre pasienter, som kan ha større risiko for denne bivirkningen [se ADVARSLER OG FORHOLDSREGLER ].
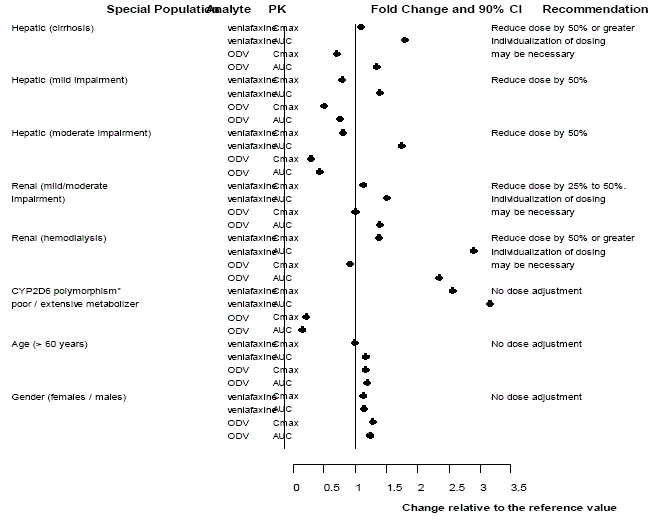
Farmakokinetikken til venlafaksin og ODV er ikke vesentlig endret hos eldre [se KLINISK FARMAKOLOGI ] (se figur 3). Ingen dosejustering anbefales for eldre på grunnlag av alder alene, selv om andre kliniske forhold, hvorav noen kan være mer vanlige hos eldre, slik som nedsatt nyre- eller leverfunksjon, kan berettige en dosereduksjon [se DOSERING OG ADMINISTRASJON ].
Alder Og Kjønn
En farmakokinetisk populasjonsanalyse av 404 Effexor-behandlede pasienter fra to studier som involverte regimer både to ganger daglig og tre ganger daglig, viste at dosenormaliserte bunnplasmanivåer av enten venlafaksin eller ODV var uendret av alder eller kjønnsforskjeller. Dosejustering basert på en pasients alder eller kjønn er vanligvis ikke nødvendig [se DOSERING OG ADMINISTRASJON ] (se tabell 15).
Bruk i pasientundergrupper
Figur 3: Farmakokinetikk av venlafaksin og dets metabolitt O-desmetylvenlafaksin (ODV) i spesielle populasjoner.
OVERDOSE
Menneskelig erfaring
Under premarketing-evalueringene av Effexor 75 mg XR (for MDD, GAD, SAD og PD) og Effexor (for MDD), var det tjue rapporter om akutt overdosering med Effexor (henholdsvis 6 og 14 rapporter hos Effexor XR og Effexor 75 mg pasienter) , enten alene eller i kombinasjon med andre rusmidler og/eller alkohol.
Somnolens var det hyppigst rapporterte symptomet. Blant de andre rapporterte symptomene var parestesi av alle fire lemmer, moderat svimmelhet, kvalme, nummen hender og føtter og varme-kulde perioder 5 dager etter overdosen. I de fleste tilfeller var ingen tegn eller symptomer assosiert med overdose. Flertallet av rapportene involverte inntak der den totale dosen av venlafaksin tatt ble estimert til å ikke være mer enn flere ganger høyere enn den vanlige terapeutiske dosen. En pasient som inntok 2,75 g venlafaksin ble observert å ha to generaliserte kramper og en forlengelse av QTc til 500 msek, sammenlignet med 405 msek ved baseline. Mild sinustakykardi ble rapportert hos to av de andre pasientene.
Tiltak iverksatt for å behandle overdosen inkluderte ingen behandling, sykehusinnleggelse og symptomatisk behandling, og sykehusinnleggelse pluss behandling med aktivt kull. Alle pasientene ble friske.
Etter markedsføring har overdosering med venlafaksin hovedsakelig forekommet i kombinasjon med alkohol og/eller andre legemidler. De hyppigst rapporterte hendelsene ved overdosering inkluderer takykardi, endringer i bevissthetsnivå (som spenner fra somnolens til koma), mydriasis, anfall og oppkast.
Elektrokardiogramforandringer (f.eks. forlengelse av QT-intervall, grenblokk, QRS-forlengelse), ventrikulær takykardi, bradykardi, hypotensjon, rabdomyolyse, vertigo, levernekrose, serotonergt syndrom og død er rapportert.
Publiserte retrospektive studier rapporterer at overdosering av venlafaksin kan være assosiert med økt risiko for dødelige utfall sammenlignet med det som er observert med SSRI-antidepressiva, men lavere enn for trisykliske antidepressiva. Epidemiologiske studier har vist at venlafaksinbehandlede pasienter har en høyere eksisterende byrde av selvmordsrisikofaktorer enn SSRI-behandlede pasienter. I hvilken grad funnet av økt risiko for dødelige utfall kan tilskrives toksisiteten til venlafaksin ved overdosering, i motsetning til enkelte karakteristika hos venlafaksinbehandlede pasienter, er ikke klart. Resepter for Effexor 75mg XR bør skrives ut for den minste mengde kapsler i samsvar med god pasientbehandling, for å redusere risikoen for overdosering.
Håndtering av overdosering
Kontakt et sertifisert giftkontrollsenter for oppdatert veiledning og råd (1-800-222-1222 eller www.poison.org). I tilfelle av overdose, gi støttende behandling, inkludert tett medisinsk tilsyn og overvåking. Behandlingen bør bestå av de generelle tiltakene som brukes i håndteringen av overdosering med et hvilket som helst legemiddel. Vurder muligheten for flere overdoser. Sørg for tilstrekkelig luftvei, oksygenering og ventilasjon. Overvåk hjerterytmen og vitale tegn. Gi støttende og symptomatiske tiltak.
KONTRAINDIKASJONER
Overfølsomhet
Overfølsomhet overfor venlafaksinhydroklorid, desvenlafaksinsuksinat eller noen hjelpestoffer i formuleringen
Samtidig bruk med monoaminoksidasehemmere (MAO-hemmere)
Bruk av MAO-hemmere (ment å behandle psykiatriske lidelser) samtidig med Effexor 75mg XR eller innen 7 dager etter avsluttet behandling med Effexor XR er kontraindisert på grunn av økt risiko for serotonergt syndrom. Bruk av Effexor 37,5 mg XR innen 14 dager etter avsluttet behandling med en MAO-hemmer (ment å behandle psykiatriske lidelser) er også kontraindisert [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , og NARKOTIKAHANDEL ].
Å starte Effexor XR hos en pasient som behandles med en MAO-hemmer som linezolid eller intravenøs metylenblått er også kontraindisert på grunn av økt risiko for serotonergt syndrom [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , og NARKOTIKAHANDEL ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Den nøyaktige mekanismen for den antidepressive virkningen til venlafaksin hos mennesker er ukjent, men antas å være relatert til potensering av serotonin og noradrenalin i sentralnervesystemet, gjennom hemming av gjenopptaket av dem. Ikke-kliniske studier har vist at venlafaksin og dets aktive metabolitt, ODV, er potente og selektive hemmere av nevronalt serotonin- og noradrenalin-reopptak og svake hemmere av dopamin-reopptak.
Farmakodynamikk
Venlafaksin og ODV har ingen signifikant affinitet for muskarin-kolinerge, H1-histaminerge eller α1-adrenerge reseptorer in vitro. Farmakologisk aktivitet ved disse reseptorene antas å være assosiert med de forskjellige antikolinerge, beroligende og kardiovaskulære effektene sett med andre psykotrope legemidler. Venlafaksin og ODV har ikke monoaminoksidase (MAO)-hemmende aktivitet.
Hjerteelektrofysiologi
Effekten av venlafaksin på QT-intervallet ble evaluert i en randomisert, dobbeltblind, placebo- og positivkontrollert tre-perioders crossover grundig QT-studie med 54 friske voksne personer. Ingen signifikant QT-forlengende effekt av venlafaksin 450 mg ble påvist.
Farmakokinetikk
Steady-state konsentrasjoner av venlafaksin og ODV i plasma oppnås innen 3 dager etter oral flerdosebehandling. Venlafaksin og ODV viste lineær kinetikk over doseområdet 75 til 450 mg per dag. Gjennomsnittlig ± SD steady-state plasmaclearance for venlafaksin og ODV er henholdsvis 1,3±0,6 og 0,4±0,2 l/time/kg; tilsynelatende eliminasjonshalveringstid er henholdsvis 5±2 og 11±2 timer; og tilsynelatende (steady-state) distribusjonsvolum er henholdsvis 7,5±3,7 og 5,7±1,8 L/kg. Venlafaksin og ODV er minimalt bundet ved terapeutiske konsentrasjoner til plasmaproteiner (henholdsvis 27 % og 30 %).
Absorpsjon og distribusjon
Venlafaksin absorberes godt og metaboliseres i stor grad i leveren. ODV er den viktigste aktive metabolitten. På grunnlag av massebalansestudier absorberes minst 92 % av en enkelt oral dose venlafaksin. Den absolutte biotilgjengeligheten til venlafaksin er omtrent 45 %.
Administrering av Effexor 37,5 mg XR (150 mg én gang daglig) resulterte generelt i lavere Cmax og senere Tmax-verdier enn for Effexor (umiddelbar frigjøring) administrert to ganger daglig (tabell 16). Når like daglige doser av venlafaksin ble administrert som enten en tablett med øyeblikkelig frigjøring eller kapsel med forlenget frigjøring, var eksponeringen for både venlafaksin og ODV lik for de to behandlingene, og fluktuasjonen i plasmakonsentrasjonen var litt lavere med Effexor 37,5 mg XR kapsel. Derfor gir Effexor XR en langsommere absorpsjonshastighet, men samme grad av absorpsjon sammenlignet med tabletten med umiddelbar frigjøring.
Mat påvirket ikke biotilgjengeligheten til venlafaksin eller dets aktive metabolitt, ODV. Administrasjonstidspunkt (AM versus PM) påvirket ikke farmakokinetikken til venlafaksin og ODV fra 75 mg Effexor 75 mg XR kapsel.
Venlafaksin er ikke sterkt bundet til plasmaproteiner; Derfor bør administrering av Effexor 37,5 mg XR til en pasient som tar et annet medikament som er sterkt proteinbundet ikke forårsake økte frie konsentrasjoner av det andre legemidlet.
Metabolisme og eliminering
Etter absorpsjon gjennomgår venlafaksin omfattende presystemisk metabolisme i leveren, primært til ODV, men også til N-desmetylvenlafaksin, N,O-didesmetylvenlafaksin og andre mindre metabolitter. In vitro-studier indikerer at dannelsen av ODV katalyseres av CYP2D6; dette har blitt bekreftet i en klinisk studie som viser at pasienter med lave CYP2D6-nivåer (dårlige metaboliserere) hadde økte nivåer av venlafaksin og reduserte nivåer av ODV sammenlignet med personer med normale CYP2D6-nivåer (utstrakte metabolisatorer) [se Bruk i spesifikke populasjoner ].
Omtrent 87 % av en venlafaksindose gjenfinnes i urinen innen 48 timer som uendret venlafaksin (5 %), ukonjugert ODV (29 %), konjugert ODV (26 %) eller andre mindre inaktive metabolitter (27 %). Renal eliminering av venlafaksin og dets metabolitter er derfor den primære utskillelsesveien.
Kliniske studier
Major depressiv lidelse
Effekten av Effexor 75 mg XR (venlafaksinhydroklorid) depotkapsler som behandling for alvorlig depressiv lidelse (MDD) ble fastslått i to placebokontrollerte, kortsiktige (8 uker for studie 1; 12 uker for studie 2), fleksible -dosestudier, med doser som starter på 75 mg per dag og varierer til 225 mg per dag hos voksne polikliniske pasienter som oppfyller DSM-III-R- eller DSM-IV-kriteriene for MDD. Hos moderat deprimerte polikliniske pasienter var startdosen venlafaksin 75 mg per dag. I begge studiene viste Effexor XR overlegenhet over placebo på det primære effektmålet definert som endring fra baseline i HAM-D-21 totalskåren til endepunktbesøket, Effexor XR viste også overlegenhet over placebo på det sentrale sekundære effektendepunktet, det kliniske Global Impressions (CGI) Alvorlighetsskala for sykdom. Undersøkelse av kjønnsundergrupper av befolkningen som ble studert, avdekket ingen forskjellig respons på grunnlag av kjønn.
En 4-ukers studie av inneliggende pasienter som oppfyller DSM-III-R-kriteriene for MDD med melankoli ved bruk av Effexor 37,5 mg i et område på 150 til 375 mg per dag (delt i en plan tre ganger om dagen) viste overlegenhet til Effexor i forhold til placebo basert på HAM-D-21 totalscore. Gjennomsnittlig dose hos fullfører var 350 mg per dag (studie 3).
en langtidsstudie ble voksne polikliniske pasienter med MDD som hadde respondert under en 8-ukers åpen studie på Effexor 37,5 mg XR (75, 150 eller 225 mg, én gang daglig hver morgen) randomisert til å fortsette med sin samme Effexor XR dose eller til placebo, i opptil 26 ukers observasjon for tilbakefall. Respons under den åpne fasen ble definert som en CGI-alvorlighetsgrad for sykdomselementscore på ≤3 og en HAM-D-21 totalscore på ≤10 ved evalueringen på dag 56. Tilbakefall under den dobbeltblinde fasen ble definert som følger: (1) en gjenopptreden av alvorlig depressiv lidelse som definert av DSM-IV-kriteriene og en CGI-alvorlighetsgrad på ≥4 (moderat syk), (2) 2 påfølgende CGI Score for alvorlighetsgrad av sykdom på ≥4, eller (3) en endelig CGI-alvorlighetsgrad på ≥4 for alle pasienter som trakk seg fra studien av en eller annen grunn. Pasienter som fikk fortsatt Effexor 37,5 mg XR-behandling opplevde statistisk signifikant lavere tilbakefallsrater i løpet av de påfølgende 26 ukene sammenlignet med de som fikk placebo (studie 4).
en andre langtidsstudie, voksne polikliniske pasienter med MDD, tilbakevendende type, som hadde respondert (HAM-D21 total score ≤ 12 ved evalueringen på dag 56) og fortsatte å bli forbedret [definert som følgende kriterier ble oppfylt for dag 56 til 180 : (1) ingen HAM-D-21 totalscore ≥ 20; (2) ikke mer enn 2 HAM39 D-21 totalskårer > 10, og (3) ingen enkelt CGI Alvorlighetsgrad av sykdom punktscore ≥ 4 (moderat syk)] i løpet av de første 26 ukers behandling med Effexor [100 til 200 mg pr. dag, på en plan to ganger daglig] ble randomisert til fortsettelse av sin samme Effexor-dose eller til placebo. Oppfølgingsperioden for å observere pasienter for tilbakefall, definert som en CGI-alvorlighetsgrad for sykdomselementscore ≥ 4, var i opptil 52 uker. Pasienter som fikk fortsatt Effexor-behandling opplevde statistisk signifikant lavere tilbakefallsrater over de påfølgende 52 ukene sammenlignet med de som fikk placebo (studie 5).
Generalisert angstlidelse
Effekten av Effexor XR som behandling for generalisert angstlidelse (GAD) ble fastslått i to 8-ukers, placebokontrollerte studier med faste doser (75 til 225 mg per dag), en 6-måneders, placebokontrollert, fleksibel -dosestudie (75 til 225 mg per dag), og en 6-måneders, placebokontrollert, fastdosestudie (37,5, 75 og 150 mg per dag) hos voksne polikliniske pasienter som oppfyller DSM-IV-kriteriene for GAD.
en 8-ukers studie viste Effexor XR overlegenhet over placebo for 75, 150 og 225 mg per dag doser målt ved Hamilton Rating Scale for Anxiety (HAM-A) totalscore, både HAM-A angst og spenning elementer og skalaen Clinical Global Impressions (CGI). Dosene på 75 og 150 mg per dag var imidlertid ikke like konsekvent effektive som den høyeste dosen (studie 1). En andre 8-ukers studie som evaluerte doser på 75 og 150 mg per dag og placebo viste at begge dosene var mer effektive enn placebo på noen av de samme resultatene; dosen på 75 mg per dag var imidlertid mer konsekvent effektiv enn dosen på 150 mg per dag (studie 2). En dose-respons-relasjon for effektivitet ved GAD ble ikke klart etablert i doseområdet på 75 til 225 mg per dag som ble studert.
To 6-måneders studier, en som evaluerte Effexor 75 mg XR-doser på 37,5, 75 og 150 mg per dag (studie 3) og den andre som evaluerte Effexor XR-doser på 75 til 225 mg per dag (studie 4), viste at daglige doser av 75 mg eller høyere var mer effektive enn placebo på HAM-A-total, både HAM-A-angst- og spenningselementer, og CGI-skalaen i løpet av 6 måneders behandling. Selv om det også var bevis for overlegenhet over placebo for 37,5 mg per dag dose, var denne dosen ikke like konsekvent effektiv som de høyere dosene.
Undersøkelse av kjønnsundergrupper av befolkningen som ble studert, avdekket ingen forskjellig respons på grunnlag av kjønn.
Sosial angstlidelse (også kjent som sosial fobi)
Effekten av Effexor 37,5 mg XR som behandling for sosial angstlidelse (SAD) ble fastslått i fire dobbeltblinde, parallellgruppe, 12-ukers, multisenter, placebokontrollerte, fleksible dosestudier (studier 1-4) og en dobbeltblind, parallellgruppe, 6-måneders, placebokontrollert, fast/fleksibel dosestudie, som inkluderte doser i området 75 til 225 mg per dag hos voksne polikliniske pasienter som oppfyller DSM-IV-kriteriene for SAD (studie 5 ).
I disse fem studiene var Effexor 75 mg XR statistisk signifikant mer effektiv enn placebo ved endring fra baseline til endepunkt på Liebowitz Social Anxiety Scale (LSAS) totalskåre. Det var ingen bevis for større effektivitet av 150 til 225 mg per dag-gruppen sammenlignet med 75 mg per dag-gruppen i den 6-måneders studien.
Undersøkelse av undergrupper av populasjonen som ble studert avdekket ingen forskjellig respons på grunnlag av kjønn. Det var utilstrekkelig informasjon til å bestemme effekten av alder eller rase på utfallet i disse studiene.
Panikklidelse
Effekten av Effexor XR som behandling for panikklidelse (PD) ble fastslått i to dobbeltblindede, 12-ukers, multisenter, placebokontrollerte studier hos voksne polikliniske pasienter som oppfyller DSM-IV-kriteriene for PD, med eller uten agorafobi. Pasientene fikk faste doser på 75 eller 150 mg per dag i den ene studien (studie 1) og 75 eller 225 mg per dag i den andre studien (studie 2).
Effekten ble vurdert på grunnlag av utfall i tre variabler: (1) prosentandel av pasienter fri for full-symptom panikkanfall på Panic and Anticipatory Anxiety Scale (PAAS); (2) gjennomsnittlig endring fra baseline til endepunkt på Panic Disorder Severity Scale (PDSS) totalskåre; og (3) prosentandel av pasienter vurdert som respondere (mye forbedret eller veldig mye forbedret) på Clinical Global Impressions (CGI) Improvement-skalaen. I disse to studiene var Effexor XR statistisk signifikant mer effektiv enn placebo (for hver fast dose) på alle tre endepunktene, men et dose-respons-forhold ble ikke klart etablert.
Undersøkelse av undergrupper av populasjonen som ble studert avdekket ingen forskjellig respons på grunnlag av kjønn. Det var utilstrekkelig informasjon til å bestemme effekten av alder eller rase på utfallet i disse studiene.
en langtidsstudie (studie 3) ble voksne polikliniske pasienter som oppfyller DSM-IV-kriteriene for PD som hadde respondert i en 12-ukers åpen fase med Effexor 75 mg XR (75 til 225 mg per dag) tilfeldig tildelt til å fortsette den samme Effexor 75 mg XR-dose (75, 150 eller 225 mg) eller bytt til placebo for observasjon for tilbakefall under dobbeltblinde tilstander. Respons under den åpne fasen ble definert som ≤ 1 fullsymptom panikkanfall per uke i løpet av de siste 2 ukene av den åpne fasen og en CGI Improvement-score på 1 (svært mye forbedret) eller 2 (mye forbedret). Tilbakefall under den dobbeltblindede fasen ble definert som å ha 2 eller flere fullsymptomiske panikkanfall per uke i 2 påfølgende uker eller å ha avbrutt på grunn av tap av effektivitet som bestemt av etterforskerne under studien. Randomiserte pasienter var i responsstatus i gjennomsnittlig 34 dager før de ble randomisert. I den randomiserte fasen etter den 12-ukers åpne perioden, opplevde pasienter som fikk fortsatt Effexor 75 mg XR en statistisk signifikant lengre tid til tilbakefall.
Pediatriske pasienter
To placebokontrollerte studier på 766 pediatriske pasienter med MDD og to placebokontrollerte studier på 793 pediatriske pasienter med GAD er utført med Effexor XR, og dataene var ikke tilstrekkelige til å støtte en påstand om bruk hos pediatriske pasienter.
Hva er Effexor og hvordan brukes det?
Effexor er en reseptbelagt medisin som brukes til å behandle symptomene på depresjon, generalisert angst, sosial angst og panikklidelse. Effexor kan brukes alene eller sammen med andre medisiner.
Effexor tilhører en klasse legemidler som kalles antidepressiva, selektiv serotonin og noradrenalin reopptakshemmere (SNRI).
Hva er de mulige bivirkningene av Effexor 37,5 mg?
Effexor kan forårsake alvorlige bivirkninger inkludert:
- . tåkesyn, . tunnelsyn, . øyesmerter eller hevelse, . ser glorier rundt lys, . lett blåmerker eller blødninger (neseblod, blødende tannkjøtt), . blod i urinen eller avføringen, . hoster opp blod, . hoste, . tetthet i brystet, . problemer med å puste, . kramper (anfall), . hodepine, . forvirring, . utydelig tale, . alvorlig svakhet, . oppkast, . tap av koordinasjon, . føler seg ustø, . veldig stiv (stiv) muskel, . høy feber, . svette, . forvirring, . raske eller ujevne hjerteslag, . skjelvinger, og . svimmelhet . Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor. . De vanligste bivirkningene av Effexor inkluderer: . svimmelhet, . døsighet, . angst, . føler meg nervøs, . søvnproblemer (søvnløshet), . synsforandringer, . kvalme, . oppkast, . diaré, . endringer i vekt eller appetitt, . tørr i munnen, . gjesper, . økt svette, . redusert sexlyst, . maktesløshet, . unormal utløsning, og . problemer med å få orgasme
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Effexor. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
Suicidalitet og antidepressiva
Antidepressiva økte risikoen sammenlignet med placebo for selvmordstenkning og -adferd (suicidalitet) hos barn, ungdom og unge voksne i korttidsstudier av alvorlig depressiv lidelse (MDD) og andre psykiatriske lidelser. Alle som vurderer bruk av venlafaksintabletter, USP eller andre antidepressiva hos et barn, ungdom eller ung voksen må balansere denne risikoen med det kliniske behovet. Korttidsstudier viste ikke en økning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne over 24 år; det var en reduksjon i risiko med antidepressiva sammenlignet med placebo hos voksne i alderen 65 år og eldre. Depresjon og visse andre psykiatriske lidelser er i seg selv assosiert med økt risiko for selvmord. Pasienter i alle aldre som starter på antidepressiv behandling bør overvåkes på passende måte og observeres nøye for klinisk forverring, suicidalitet eller uvanlige endringer i atferd. Familier og omsorgspersoner bør informeres om behovet for tett observasjon og kommunikasjon med forskriveren. Venlafaxin tabletter, USP er ikke godkjent for bruk hos pediatriske pasienter. (Se ADVARSLER : Klinisk forverring og selvmordsrisiko , PASIENTINFORMASJON , og FORHOLDSREGLER : Pediatrisk bruk ).
BESKRIVELSE
Venlafaxin tabletter, USP er et strukturelt nytt antidepressivum for oral administrering. Det er betegnet (R/S)-1-[2-(dimetylamino)-1-(4-metoksyfenyl)etyl]cykloheksanolhydroklorid eller (±)-1-[α-[(dimetylamino)metyl]-p- metoksybenzyl]cykloheksanolhydroklorid og har den empiriske formelen C17H27NO2HCl. Dens molekylvekt er 313,87. Strukturformelen er vist nedenfor.
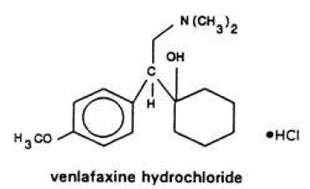
Venlafaksinhydroklorid er et hvitt til off-white krystallinsk fast stoff med en løselighet på 572 mg/ml i vann (justert til ionestyrke på 0,2 M med natriumklorid). Dens oktanol:vann (0,2 M natriumklorid) fordelingskoeffisient er 0,43.
Komprimerte tabletter inneholder venlafaksinhydroklorid, USP tilsvarende 25 mg, 37,5 mg, 50 mg, 75 mg eller 100 mg venlafaksinbase og følgende inaktive ingredienser: mikrokrystallinsk cellulose, laktosemonohydrat, pregelatinisert stivelse, natriumstivelsesglykolat, rødt jernoksid. jernoksid gult, kolloidalt silisiumdioksid og magnesiumstearat.
