Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Cymbalta og hvordan brukes det?
Cymbalta er en reseptbelagt medisin som brukes til å behandle symptomer på alvorlig depressiv lidelse, diabetisk perifer nevropatisk smerte, generalisert angstlidelse, fibromyalgi og kroniske muskelsmerter. Cymbalta kan brukes alene eller sammen med andre medisiner.
- . Cymbalta tilhører en klasse medikamenter kalt antidepressiva, SNRI-er, fibromyalgimidler. . Det er ikke kjent om Cymbalta er trygt og effektivt hos barn yngre enn 7 år.
Hva er de mulige bivirkningene av Cymbalta 20mg?
Cymbalta kan forårsake alvorlige bivirkninger, inkludert:
- . bankende hjerteslag eller flagrende i brystet, . svimmelhet, . lett blåmerker, . uvanlig blødning, . synsforandringer, . smertefull eller vanskelig vannlating, . maktesløshet, . seksuelle problemer, . høyresidig øvre magesmerter, . kløe, . mørk urin, . gulfarging av hud eller øyne (gulsott), . hodepine, . forvirring, . utydelig tale, . alvorlig svakhet, . oppkast, . tap av koordinasjon, . føler seg ustø, . løpende tanker, . økt energi, . hensynsløs oppførsel, . føler meg ekstremt glad eller irritabel, . snakker mer enn vanlig, og . alvorlige søvnproblemer
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Cymbalta inkluderer:
- . døsighet, . kvalme, . forstoppelse, . tap av Appetit, . tørr munn, og . økt svetting
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Cymbalta. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
SELVmordstanker og adferd
Antidepressiva økte risikoen for selvmordstanker og -adferd hos barn, ungdom og unge voksne i korttidsstudier. Disse studiene viste ikke en økning i risikoen for selvmordstanker og -adferd ved bruk av antidepressiva hos pasienter over 24 år; det var en reduksjon i risiko ved bruk av antidepressiva hos pasienter i alderen 65 år og eldre [se ADVARSLER OG FORHOLDSREGLER ].
Hos pasienter i alle aldre som starter på antidepressiv behandling, overvåk nøye for forverring og for fremveksten av selvmordstanker og -adferd. Informer familier og omsorgspersoner om behovet for tett observasjon og kommunikasjon med forskriveren [se ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
CYMBALTA® (duloksetin kapsler med forsinket frigjøring) er en selektiv serotonin- og noradrenalin-reopptakshemmer (SSNRI) for oral administrering. Dens kjemiske betegnelse er (+)-(S)-N-metyl-y-(1-naftyloksy)-2-tiofenpropylaminhydroklorid. Den empiriske formelen er C18H19NOS•HCl, som tilsvarer en molekylvekt på 333,88. Strukturformelen er:
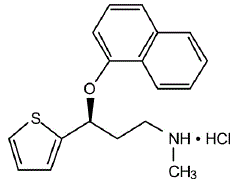
Duloksetinhydroklorid er et hvitt til svakt brunhvitt fast stoff, som er lett løselig i vann.
Hver kapsel inneholder enterisk belagte pellets på henholdsvis 22,4, 33,7 eller 67,3 mg duloksetinhydroklorid tilsvarende 20, 30 eller 60 mg duloksetin. Disse enterisk belagte pellets er designet for å forhindre nedbrytning av stoffet i det sure miljøet i magen. Inaktive ingredienser inkluderer FD&C Blue No. 2, gelatin, hypromellose, hydroksypropylmetylcelluloseacetatsuccinat, natriumlaurylsulfat, sukrose, sukkerkuler, talkum, titandioksid og trietylsitrat. 20 og 60 mg kapslene inneholder også gult jernoksid.
INDIKASJONER
CYMBALTA® er indisert for behandling av:
- . Major depressiv lidelse hos voksne . Generalisert angstlidelse hos voksne og pediatriske pasienter 7 år og eldre . Diabetisk perifer nevropatisk smerte hos voksne . Fibromyalgi hos voksne og pediatriske pasienter 13 år og eldre . kroniske muskel- og skjelettsmerter hos voksne
DOSERING OG ADMINISTRASJON
Viktige administrasjonsinstruksjoner
Administrer CYMBALTA oralt (med eller uten måltider) og svelg hele. Ikke tygg eller knus, og ikke åpne kapselen med forsinket frigjøring og dryss innholdet på mat eller bland med væske fordi disse handlingene kan påvirke det enteriske belegget. Hvis en dose av CYMBALTA 20 mg er glemt, ta den glemte dosen så snart du husker det. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og ta neste dose til vanlig tid. Ikke ta to doser CYMBALTA 60 mg samtidig.
Dosering for behandling av alvorlig depressiv lidelse hos voksne
Anbefalt startdose hos voksne med MDD er 40 mg/dag (gitt som 20 mg to ganger daglig) til 60 mg/dag (gitt enten én gang daglig eller som 30 mg to ganger daglig). For noen pasienter kan det være ønskelig å starte med 30 mg én gang daglig i 1 uke, for å la pasientene tilpasse seg CYMBALTA 30 mg før de økes til 60 mg én gang daglig. Mens en dose på 120 mg/dag ble vist å være effektiv, er det ingen bevis for at doser større enn 60 mg/dag gir noen ekstra fordeler. Vurder med jevne mellomrom for å bestemme behovet for vedlikeholdsbehandling og riktig dosering for slik behandling.
Dosering for behandling av generalisert angstlidelse
Anbefalt dosering hos voksne under 65 år
For de fleste voksne under 65 år med GAD, initier CYMBALTA 60 mg én gang daglig. For noen pasienter kan det være ønskelig å starte med 30 mg én gang daglig i 1 uke, for å la pasientene tilpasse seg CYMBALTA 40 mg før de økes til 60 mg én gang daglig. Mens en dose på 120 mg én gang daglig har vist seg å være effektiv, er det ingen bevis for at doser større enn 60 mg/dag gir ekstra fordel. Likevel, hvis det tas en beslutning om å øke dosen utover 60 mg én gang daglig, økes dosen i trinn på 30 mg én gang daglig. Vurder med jevne mellomrom for å bestemme det fortsatte behovet for vedlikeholdsbehandling og riktig dosering for slik behandling.
Anbefalt dosering hos geriatriske pasienter
Hos geriatriske pasienter med GAD, initier CYMBALTA med en dose på 30 mg én gang daglig i 2 uker før du vurderer en økning til måldosen på 60 mg/dag. Deretter kan pasienter ha nytte av doser over 60 mg én gang daglig. Hvis det besluttes å øke dosen utover 60 mg én gang daglig, øk dosen i trinn på 30 mg én gang daglig. Maksimal dose undersøkt var 120 mg per dag.
Anbefalt dosering hos pediatriske pasienter i alderen 7 til 17 år
Start CYMBALTA 30 mg hos pediatriske pasienter 7 til 17 år med GAD med en dose på 30 mg én gang daglig i 2 uker før man vurderer en økning til 60 mg én gang daglig. Det anbefalte doseringsområdet er 30 til 60 mg én gang daglig. Noen pasienter kan ha nytte av doser over 60 mg én gang daglig. Hvis det besluttes å øke dosen utover 60 mg én gang daglig, øk dosen i trinn på 30 mg én gang daglig. Maksimal dose undersøkt var 120 mg per dag.
Dosering for behandling av diabetisk perifer nevropatisk smerte hos voksne
Administrer 60 mg én gang daglig til voksne med diabetisk perifer nevropatisk smerte. Det er ingen bevis for at doser høyere enn 60 mg én gang daglig gir ytterligere betydelig fordel, og den høyere dosen tolereres klart dårligere. For pasienter der tolerabilitet er et problem, kan en lavere startdose vurderes.
Siden diabetes ofte kompliseres av nyresykdom, bør du vurdere en lavere startdose og gradvis økning i dose for pasienter med nedsatt nyrefunksjon [se Dosering hos pasienter med nedsatt leverfunksjon eller alvorlig nedsatt nyrefunksjon og Bruk i spesifikke populasjoner ].
Dosering for behandling av fibromyalgi
Anbefalt dosering hos voksne
Den anbefalte CYMBALTA-dosen er 60 mg én gang daglig hos voksne med fibromyalgi. Begynn behandlingen med 30 mg én gang daglig i 1 uke, slik at pasientene kan tilpasse seg CYMBALTA 20 mg før de økes til 60 mg én gang daglig. Noen pasienter kan reagere på startdosen. Det er ingen bevis for at doser større enn 60 mg/dag gir ytterligere fordeler, selv hos pasienter som ikke responderer på en 60 mg/dag-dose, og høyere doser var assosiert med en høyere frekvens av bivirkninger.
Anbefalt dosering hos pediatriske pasienter i alderen 13 til 17 år
Den anbefalte startdosen CYMBALTA 60 mg hos pediatriske pasienter 13-17 år med fibromyalgi er 30 mg én gang daglig. Dosen kan økes til 60 mg én gang daglig basert på respons og toleranse.
Dosering for behandling av kronisk muskel-skjelettsmerter hos voksne
Anbefalt CYMBALTA-dose er 60 mg én gang daglig hos voksne med kroniske muskel- og skjelettsmerter. Begynn behandlingen med 30 mg én gang daglig i én uke, for å la pasientene tilpasse seg CYMBALTA før de økes til 60 mg én gang daglig. Det er ingen bevis for at høyere doser gir ytterligere fordeler, selv hos pasienter som ikke responderer på en dose på 60 mg én gang daglig, og høyere doser er assosiert med en høyere forekomst av bivirkninger [se Kliniske studier ].
Dosering hos pasienter med nedsatt leverfunksjon eller alvorlig nedsatt nyrefunksjon
Unngå bruk hos pasienter med kronisk leversykdom eller cirrhose [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Unngå bruk hos pasienter med alvorlig nedsatt nyrefunksjon, GFR ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Avbryter CYMBALTA
Bivirkninger etter seponering av CYMBALTA, etter brå eller nedtrappet seponering, inkluderer: svimmelhet, hodepine, kvalme, diaré, parestesi, irritabilitet, oppkast, søvnløshet, angst, hyperhidrose og tretthet. En gradvis reduksjon i dosen i stedet for brå seponering anbefales når det er mulig [se ADVARSLER OG FORHOLDSREGLER ].
Bytte en pasient til eller fra en monoaminoksidasehemmer (MAOI) beregnet på å behandle psykiatriske lidelser
Det bør gå minst 14 dager mellom seponering av en MAO-hemmer beregnet på å behandle psykiatriske lidelser og oppstart av behandling med CYMBALTA. Omvendt bør det tillates minst 5 dager etter seponering av CYMBALTA 60 mg før man starter en MAO-hemmer beregnet på å behandle psykiatriske lidelser [se KONTRAINDIKASJONER ].
Bruk av CYMBALTA med andre MAO-hemmere som linezolid eller metylenblått
Ikke start CYMBALTA hos en pasient som behandles med linezolid eller intravenøs metylenblått fordi det er økt risiko for serotonergt syndrom. Hos en pasient som trenger mer akutt behandling av en psykiatrisk tilstand, bør andre intervensjoner, inkludert sykehusinnleggelse, vurderes [se KONTRAINDIKASJONER ].
noen tilfeller kan en pasient som allerede får CYMBALTA-behandling trenge akuttbehandling med linezolid eller intravenøs metylenblått. Hvis akseptable alternativer til linezolid eller intravenøs behandling med metylenblått ikke er tilgjengelig og de potensielle fordelene ved behandling med linezolid eller intravenøs metylenblått vurderes å oppveie risikoen for serotonergt syndrom hos en bestemt pasient, bør CYMBALTA stoppes umiddelbart, og linezolid eller intravenøs metylenblått kan administreres. Pasienten bør overvåkes for symptomer på serotonergt syndrom i 5 dager eller inntil 24 timer etter siste dose linezolid eller intravenøs metylenblått, avhengig av hva som kommer først. Behandling med CYMBALTA kan gjenopptas 24 timer etter siste dose linezolid eller intravenøs metylenblått [se ADVARSLER OG FORHOLDSREGLER ].
Risikoen for å administrere metylenblått på ikke-intravenøse veier (som orale tabletter eller ved lokal injeksjon) eller i intravenøse doser mye lavere enn 1 mg/kg med CYMBALTA er uklar. Legen bør likevel være klar over muligheten for nye symptomer på serotonergt syndrom ved slik bruk [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERES
Doseringsformer og styrker
CYMBALTA er tilgjengelig som kapsler med forsinket frigjøring:
- . 20 mg ugjennomsiktige grønne kapsler merket med "Lilly 3235 20mg" . 30 mg ugjennomsiktige hvite og blå kapsler merket med "Lilly 3240 30mg" . 60 mg ugjennomsiktige grønne og blå kapsler merket med "Lilly 3270 60mg"
CYMBALTA (duloksetin kapsler med forsinket frigjøring) er tilgjengelig i følgende styrker, farger, avtrykk og presentasjoner:
Oppbevaring og håndtering
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP-kontrollert romtemperatur].
Markedsført av: Lilly USA, LLC Indianapolis, IN 46285, USA. Revidert: juli 2021
BIVIRKNINGER
Følgende alvorlige bivirkninger er beskrevet nedenfor og andre steder i merkingen:
- . Selvmordstanker og -atferd hos barn, ungdom og unge voksne [se BOKS ADVARSEL og ADVARSLER OG FORHOLDSREGLER ] . Levertoksisitet [se ADVARSLER OG FORHOLDSREGLER ] . Ortostatisk hypotensjon, fall og synkope [se ADVARSLER OG FORHOLDSREGLER ] . Serotoninsyndrom [se ADVARSLER OG FORHOLDSREGLER ] . Økt risiko for blødning [se ADVARSLER OG FORHOLDSREGLER ] . Alvorlige hudreaksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Seponeringssyndrom [se ADVARSLER OG FORHOLDSREGLER ] . Aktivering av mani/hypomani [se ADVARSLER OG FORHOLDSREGLER ] . Vinkel-lukkende glaukom [se ADVARSLER OG FORHOLDSREGLER ] . Anfall [se ADVARSLER OG FORHOLDSREGLER ] . Økning i blodtrykk [se ADVARSLER OG FORHOLDSREGLER ] . Klinisk viktige legemiddelinteraksjoner [se ADVARSLER OG FORHOLDSREGLER ] . Hyponatremi [se ADVARSLER OG FORHOLDSREGLER ] . Urinnøling og retensjon [se ADVARSLER OG FORHOLDSREGLER ] . Seksuell dysfunksjon [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
De oppgitte bivirkningsfrekvensene representerer andelen pasienter som minst én gang opplevde én behandlingsutløst bivirkning av den oppførte typen. En reaksjon ble ansett som behandlingsoppstått hvis den oppstod for første gang eller forverret seg under behandling etter baseline-evaluering.
Bivirkninger hos voksne
Database for kliniske studier for voksne
Dataene beskrevet nedenfor gjenspeiler eksponering for CYMBALTA i placebokontrollerte voksenstudier for MDD (N=3779), GAD (N=1018), OA (N=503), CLBP (N=600), DPNP (N=906), og FM (N=1294). Aldersspennet i denne samlede befolkningen var 17 til 89 år. I denne samlede populasjonen var 66 %, 61 %, 61 %, 43 % og 94 % av voksne pasienter kvinner; og 82 %, 73 %, 85 %, 74 % og 86 % av voksne pasienter var kaukasiske i henholdsvis MDD-, GAD-, OA- og CLBP-, DPNP- og FM-populasjonene. De fleste pasientene fikk CYMBALTA-doser på totalt 60 til 120 mg per dag [se Kliniske studier ]. Dataene nedenfor inkluderer ikke resultatene fra studien som evaluerte effekten av CYMBALTA 30 mg for behandling av GAD hos pasienter ≥65 år (studie GAD-5) [se Kliniske studier ]; bivirkningene observert i denne geriatriske populasjonen var imidlertid generelt lik bivirkningene i den totale voksne populasjonen.
Bivirkninger som fører til seponering av behandling i placebokontrollerte studier for voksne
Major depressiv lidelse
Omtrent 8,4 % (319/3779) av CYMBALTA-behandlede pasienter i placebokontrollerte voksenstudier for MDD avbrøt behandlingen på grunn av en bivirkning, sammenlignet med 4,6 % (117/2536) av placebobehandlede pasienter. Kvalme (CYMBALTA 1,1 %, placebo 0,4 %) var den eneste bivirkningen som ble rapportert som årsak til seponering og ansett for å være medikamentrelatert (dvs. seponering forekommer hos minst 1 % av de CYMBALTA-behandlede pasientene og med en hastighet på kl. minst det dobbelte av placebo-behandlede pasienter).
Generalisert angstlidelse
Omtrent 13,7 % (139/1018) av de CYMBALTA-behandlede pasientene i placebokontrollerte voksenstudier for GAD avbrøt behandlingen på grunn av en bivirkning, sammenlignet med 5 % (38/767) for placebobehandlede pasienter. Vanlige bivirkninger rapportert som en årsak til seponering og ansett for å være legemiddelrelaterte (som definert ovenfor) inkluderte kvalme (CYMBALTA 3,3 %, placebo 0,4 %) og svimmelhet (CYMBALTA 1,3 %, placebo 0,4 %).
Diabetisk perifer nevropatisk smerte
Omtrent 12,9 % (117/906) av de CYMBALTA-behandlede pasientene i placebokontrollerte voksenstudier for DPNP avbrøt behandlingen på grunn av en bivirkning, sammenlignet med 5,1 % (23/448) for placebobehandlede pasienter. Vanlige bivirkninger rapportert som årsak til seponering og ansett for å være medikamentrelaterte (som definert ovenfor) inkluderte kvalme (CYMBALTA 3,5 %, placebo 0,7 %), svimmelhet (CYMBALTA 1,2 %, placebo 0,4 %) og somnolens (CYMBALTA 1,1 % , placebo 0 %).
Fibromyalgi
Omtrent 17,5 % (227/1294) av de CYMBALTA-behandlede pasientene i 3- til 6-måneders placebokontrollerte voksenstudier for FM avbrøt behandlingen på grunn av en bivirkning, sammenlignet med 10,1 % (96/955) for placebo-behandlede pasienter . Bivirkninger rapportert som årsak til seponering og ansett for å være legemiddelrelaterte (som definert ovenfor) inkluderte kvalme (CYMBALTA 2,0 %, placebo 0,5 %), hodepine (CYMBALTA 1,2 %, placebo 0,3 %), søvnighet (CYMBALTA 1,1 %, placebo 0 %) og tretthet (CYMBALTA 1,1 %, placebo 0,1 %).
Kroniske smerter på grunn av slitasjegikt
Omtrent 15,7 % (79/503) av de CYMBALTA-behandlede pasientene i 13-ukers placebokontrollerte voksenstudier for kroniske smerter på grunn av OA avbrøt behandlingen på grunn av en bivirkning, sammenlignet med 7,3 % (37/508) for placebo- behandlede pasienter. Bivirkninger rapportert som årsak til seponering og ansett for å være medikamentrelaterte (som definert ovenfor) inkluderte kvalme (CYMBALTA 2,2 %, placebo 1 %).
Kronisk korsryggsmerter
Omtrent 16,5 % (99/600) av de CYMBALTA-behandlede pasientene i 13-ukers, placebokontrollerte voksenstudier for CLBP avbrøt behandlingen på grunn av en bivirkning, sammenlignet med 6,3 % (28/441) for placebobehandlede pasienter. Bivirkninger rapportert som en årsak til seponering og ansett for å være medikamentrelaterte (som definert ovenfor) inkluderte kvalme (CYMBALTA 3 %, placebo 0,7 %) og somnolens (CYMBALTA 1 %, placebo 0 %).
De vanligste bivirkningene i voksenforsøk
De vanligst observerte bivirkningene hos CYMBALTA-behandlede pasienter (som definert ovenfor) var:
- . Diabetisk perifer nevropatisk smerte: kvalme, somnolens, nedsatt appetitt, forstoppelse, hyperhidrose og munntørrhet. . Fibromyalgi: kvalme, munntørrhet, forstoppelse, somnolens, nedsatt appetitt, hyperhidrose og agitasjon. . Kronisk smerte på grunn av slitasjegikt: kvalme, tretthet, forstoppelse, munntørrhet, søvnløshet, somnolens og svimmelhet. . Kronisk korsryggsmerter: kvalme, munntørrhet, søvnløshet, somnolens, forstoppelse, svimmelhet og tretthet.
De vanligst observerte bivirkningene hos CYMBALTA-behandlede pasienter i alle de sammenslåtte voksne populasjonene (dvs. MDD, GAD, DPNP, FM, OA og CLBP) (insidens på minst 5 % og minst to ganger forekomsten hos placebobehandlede pasienter) var kvalme, munntørrhet, somnolens, forstoppelse, nedsatt appetitt og hyperhidrose.
Tabell 2 viser forekomsten av bivirkninger i placebokontrollerte studier for godkjente voksne populasjoner (dvs. MDD, GAD, DPNP, FM, OA og CLBP) som oppstod hos 5 % eller flere av CYMBALTA-behandlede pasienter og med en høyere forekomst enn placebobehandlede pasienter.
Bivirkninger i sammenslåtte MDD- og GAD-forsøk hos voksne
Tabell 3 viser forekomsten av bivirkninger i MDD og GAD placebokontrollerte voksenstudier som forekom hos 2 % eller flere av CYMBALTA-behandlede pasienter og med en høyere forekomst enn placebobehandlede pasienter.
Bivirkninger i DPNP, FM, OA og CLBP voksenforsøk
Tabell 4 viser forekomsten av bivirkninger som oppsto hos 2 % eller flere av CYMBALTA-behandlede pasienter (bestemt før avrunding) i den akutte fasen før markedsføring av DPNP, FM, OA og CLBP placebokontrollerte voksne studier og med en høyere forekomst enn placebobehandlede pasienter.
Effekter på mannlig og kvinnelig seksuell funksjon hos voksne med MDD
Endringer i seksuell lyst, seksuell ytelse og seksuell tilfredsstillelse forekommer ofte som manifestasjoner av psykiatriske lidelser eller diabetes, men de kan også være en konsekvens av farmakologisk behandling. Fordi uønskede seksuelle reaksjoner antas å være frivillig underrapportert, ble Arizona Sexual Experience Scale (ASEX), et validert mål utviklet for å identifisere seksuelle bivirkninger, brukt prospektivt i 4 MDD placebokontrollerte voksenstudier (studier MDD-1, MDD-2 , MDD-3 og MDD-4) [se Kliniske studier ]. ASEX-skalaen inkluderer fem spørsmål som gjelder følgende aspekter av seksuell funksjon: 1) sexlyst, 2) lett opphisselse, 3) evne til å oppnå ereksjon (menn) eller smøring (kvinner), 4) letthet for å oppnå orgasme, og 5) tilfredshet med orgasme. Positive tall indikerer en forverring av seksuell funksjon fra baseline. Negative tall indikerer en forbedring fra et grunnleggende nivå av dysfunksjon, som ofte sees hos deprimerte pasienter.
disse studiene opplevde CYMBALTA-behandlede mannlige pasienter signifikant mer seksuell dysfunksjon, målt ved totalskåren på ASEX og evnen til å oppnå orgasme, enn placebobehandlede mannlige pasienter (se ). CYMBALTA-behandlede kvinnelige pasienter opplevde ikke mer seksuell dysfunksjon enn placebo-behandlede kvinnelige pasienter målt ved ASEX totalscore. Helsepersonell bør rutinemessig spørre om mulige seksuelle bivirkninger hos CYMBALTA-behandlede pasienter.
Vitale tegnendringer hos voksne
I placebokontrollerte kliniske studier på tvers av godkjente voksne populasjoner for endring fra baseline til endepunkt, hadde CYMBALTA-behandlede pasienter gjennomsnittlig økning på 0,23 mm Hg i systolisk blodtrykk (SBP) og 0,73 mm Hg i diastolisk blodtrykk (DBP) sammenlignet med gjennomsnittlige reduksjoner på 1,09 mm Hg i SBP og 0,55 mm Hg i DBP hos placebobehandlede pasienter. Det var ingen signifikant forskjell i frekvensen av vedvarende (3 påfølgende besøk) forhøyet blodtrykk [se ADVARSLER OG FORHOLDSREGLER ].
CYMBALTA 20 mg-behandling, i opptil 26 uker i placebokontrollerte studier på tvers av godkjente voksne populasjoner, forårsaket typisk en liten økning i hjertefrekvensen for endring fra baseline til endepunkt sammenlignet med placebo på opptil 1,37 slag per minutt (økning på 1,20 slag per minutt) hos CYMBALTA-behandlede pasienter, reduksjon på 0,17 slag per minutt hos placebobehandlede pasienter).
Laboratorieendringer hos voksne
CYMBALTA-behandling i placebokontrollerte kliniske studier på tvers av godkjente voksne populasjoner, var assosiert med små gjennomsnittlige økninger fra baseline til endepunkt i ALAT, ASAT, CPK og alkalisk fosfatase; sjeldne, beskjedne, forbigående, unormale verdier ble observert for disse analyttene hos CYMBALTA-behandlede pasienter sammenlignet med placebo-behandlede pasienter [se ADVARSLER OG FORHOLDSREGLER ]. Høyt bikarbonat, kolesterol og unormalt (høyt eller lavt) kalium ble observert hyppigere hos CYMBALTA-behandlede pasienter sammenlignet med placebo-behandlede pasienter.
Andre bivirkninger observert under den kliniske studieevalueringen av CYMBALTA hos voksne
Følgende er en liste over bivirkninger rapportert av pasienter behandlet med CYMBALTA 40 mg i kliniske studier for voksne. I kliniske studier av alle godkjente voksne populasjoner ble 34 756 pasienter behandlet med CYMBALTA. Av disse tok 27 % (9337) CYMBALTA 60 mg i minst 6 måneder, og 12 % (4317) tok CYMBALTA i minst ett år. Følgende liste er ikke ment å inkludere reaksjoner (1) som allerede er oppført i tidligere tabeller eller andre steder i merking, (2) som en medikamentårsak var fjern, (3) som var så generelle at de var uinformative, (4) som var ikke anses å ha signifikante kliniske implikasjoner, eller (5) som skjedde med en hastighet lik eller mindre enn placebo.
Reaksjoner er kategorisert etter kroppssystem i henhold til følgende definisjoner: hyppige bivirkninger er de som forekommer hos minst 1/100 pasienter; sjeldne bivirkninger er de som forekommer hos 1/100 til 1/1000 pasienter; sjeldne reaksjoner er de som forekommer hos færre enn 1/1000 pasienter.
- . Hjertelidelser - Hyppig: hjertebank; Sjeldne: hjerteinfarkt, takykardi og Takotsubo kardiomyopati. . Øre- og labyrintlidelser - Hyppig: svimmelhet; Sjelden: øresmerter og tinnitus. . Endokrine lidelser - Sjelden: hypotyreose. . Øyelidelser - Hyppig: uklart syn; Sjelden: diplopi, tørre øyne og synshemming. . Gastrointestinale lidelser - Hyppig: flatulens; Sjeldne: dysfagi, eruktasjon, gastritt, gastrointestinal blødning, halitose og stomatitt; Sjelden: magesår. . Generelle lidelser og administrasjonsbetingelser - Hyppig: frysninger/påkjenninger; Sjeldne: fall, unormal følelse, varm og/eller kald følelse, ubehag og tørst; Sjelden: gangforstyrrelse. . Infeksjoner og angrep - Sjelden: gastroenteritt og laryngitt. . Undersøkelser Hyppig: vekt økt, vekt redusert; Sjelden: økt kolesterol i blodet. . Metabolisme og ernæringsforstyrrelser - Sjeldne: dehydrering og hyperlipidemi; Sjeldne: dyslipidemi. . Muskuloskeletale og bindevevslidelser - Hyppig: muskel-skjelettsmerter; Sjelden: muskelstramhet og muskelrykninger. . Forstyrrelser i nervesystemet - Hyppig: dysgeusi, sløvhet og parestesi/hypoestesi; Sjeldne: oppmerksomhetsforstyrrelser, dyskinesi, myoklonus og dårlig søvnkvalitet; Sjelden: dysartri. . Psykiatriske lidelser - Hyppig: unormale drømmer og søvnforstyrrelser; Sjeldne: apati, bruksisme, desorientering/forvirringstilstand, irritabilitet, humørsvingninger og selvmordsforsøk; Sjelden: fullført selvmord. . Nyre- og urinveislidelser - Hyppig: urinfrekvens; Sjelden: dysuri, vannlating haster, nokturi, polyuri og unormal urinlukt. . Reproduktive system og brystsykdommer - Hyppig: anorgasmi/orgasme unormal; Sjeldne: menopausale symptomer, seksuell dysfunksjon og testikkelsmerter; Sjelden: menstruasjonsforstyrrelser. . Respiratoriske, thorax- og mediastinumsykdommer Hyppig: gjesping, orofaryngeal smerte; Sjelden: tetthet i halsen. . Hud- og subkutane vevslidelser - Hyppig: kløe; Sjelden: kaldsvette, dermatittkontakt, erytem, økt tendens til blåmerker, nattesvette og lysfølsomhetsreaksjon; Sjelden: ekkymose. . Vaskulære lidelser - Hyppig: hetetokter; Sjeldne: rødme, ortostatisk hypotensjon og perifer kulde.
Bivirkninger observert i placebokontrollerte kliniske studier hos pediatriske pasienter
Pediatrisk klinisk prøvedatabase
Dataene beskrevet nedenfor gjenspeiler eksponering for CYMBALTA (N=567) hos pediatriske pasienter i alderen 7 til 18 år fra to 10-ukers, placebokontrollerte studier med pasienter med MDD (N=341) (studier MDD-6 og MDD- 7), en 10-ukers placebokontrollert studie i GAD (N=135) (Studie GAD-6), og en 13-ukers studie i fibromyalgi (N=91). CYMBALTA 60mg er ikke godkjent for behandling av MDD hos pediatriske pasienter [se Bruk i spesifikke populasjoner ]. Av de CYMBALTA-behandlede pasientene i disse studiene var 36 % i alderen 7 til 11 år (64 % var mellom 12 og 18 år), 55 % var kvinner og 69 % var kaukasiske. Pasientene fikk 30 til 120 mg CYMBALTA per dag under placebokontrollerte akutte behandlingsstudier. I de pediatriske MDD-, GAD- og fibromyalgistudiene på opptil 40 uker var det 988 CYMBALTA-behandlede pediatriske pasienter i alderen 7 til 17 år (de fleste pasientene fikk 30-120 mg per dag) – 35 % var 7 til 11 år. alder (65 % var 12 til 17 år) og 56 % var kvinner.
De vanligste bivirkningene i pediatriske studier
De vanligste bivirkningene (≥5 % hos CYMBALTA-behandlede pasienter og minst dobbelt så høy forekomst av placebobehandlede pasienter) i alle sammenslåtte pediatriske populasjoner (MDD, GAD og fibromyalgi) var redusert vekt, nedsatt appetitt, kvalme, oppkast, tretthet og diaré.
Bivirkninger hos pediatriske pasienter i alderen 7 til 17 år med MDD og GAD
Bivirkningsprofilen observert i kliniske studier hos pediatriske pasienter i alderen 7 til 18 år med MDD og GAD var i samsvar med bivirkningsprofilen observert i kliniske studier for voksne. De vanligste (≥5 % og to ganger placebo) bivirkningene observert i disse pediatriske kliniske studiene inkluderte: kvalme, diaré, vektnedgang og svimmelhet.
Tabell 6 viser forekomsten av bivirkninger i MDD og GAD pediatriske placebokontrollerte studier som forekom hos mer enn 2 % av pasientene behandlet med CYMBALTA og med en høyere forekomst enn pasienter behandlet med placebo. CYMBALTA er ikke godkjent i behandling av MDD hos pediatriske pasienter [se Bruk i spesifikke populasjoner ].
Andre bivirkninger som forekom med en forekomst på mindre enn 2 % og ble rapportert av flere CYMBALTA-behandlede pasienter enn placebo-behandlede pasienter i pediatriske MDD og GAD kliniske studier inkluderte: unormale drømmer (inkludert mareritt), angst, rødme (inkludert hetetokter ), hyperhidrose, hjertebank, økt puls og skjelving (CYMBALTA 20mg er ikke godkjent for behandling av pediatriske pasienter med MDD).
De hyppigst rapporterte symptomene etter seponering av CYMBALTA 30 mg i kliniske studier med MDD og GAD for barn inkluderte hodepine, svimmelhet, søvnløshet og magesmerter [se ADVARSLER OG FORHOLDSREGLER ].
Vekst (høyde og vekt) hos pediatriske pasienter 7 til 17 år gamle med GAD og MDD
Redusert appetitt og vekttap har blitt observert i forbindelse med bruk av SSRI og SNRI. CYMBALTA-behandlede pediatriske pasienter i kliniske studier opplevde en gjennomsnittlig vektreduksjon på 0,1 kg etter 10 uker, sammenlignet med en gjennomsnittlig vektøkning på ca. 0,9 kg hos placebobehandlede pediatriske pasienter. Andelen pasienter som opplevde en klinisk signifikant reduksjon i vekt (≥3,5 %) var større i CYMBALTA-gruppen enn i placebogruppen (henholdsvis 16 % og 6 %). Deretter, i løpet av de 4 til 6-måneders ukontrollerte forlengelsesperiodene, hadde CYMBALTA-behandlede pasienter i gjennomsnitt en trend mot restitusjon til forventet baseline vektpersentil basert på populasjonsdata fra jevnaldrende med alder og kjønn.
studier på opptil 9 måneder opplevde CYMBALTA-behandlede pediatriske pasienter en økning i høyden på 1,7 cm i gjennomsnitt (2,2 cm økning hos pasienter i alderen 7 til 11 år og 1,3 cm økning hos pasienter i alderen 12 til 17 år). Mens høydeøkning ble observert under disse studiene, ble det observert en gjennomsnittlig reduksjon på 1 % i høydepersentil (reduksjon på 2 % hos pasienter i alderen 7 til 11 år og økning på 0,3 % hos pasienter i alderen 12 til 17 år). Vekt og høyde bør overvåkes regelmessig hos pediatriske pasienter behandlet med CYMBALTA [se Bruk i spesifikke populasjoner ].
Bivirkninger hos pediatriske pasienter i alderen 13 til 17 år med fibromyalgi
Tabell 7 viser forekomsten av bivirkninger i en fibromyalgi pediatrisk placebokontrollert studie (Studie FM-4) som forekom hos mer enn 5 % av pasientene behandlet med CYMBALTA 30 mg og med en forekomst større enn pasienter behandlet med placebo [se Kliniske studier ].
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av CYMBALTA etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Bivirkninger rapportert siden markedsintroduksjonen som var tidsmessig relatert til behandling med CYMBALTA 40 mg og som ikke er nevnt andre steder i merkingen inkluderer: akutt pankreatitt, anafylaktisk reaksjon, aggresjon og sinne (spesielt tidlig i behandlingen eller etter behandlingsavbrudd), angioneurotisk ødem, lukket vinkelglaukom, kolitt (mikroskopisk eller uspesifisert), kutan vaskulitt (noen ganger assosiert med systemisk involvering), ekstrapyramidal lidelse, galaktoré, gynekologisk blødning, hallusinasjoner, hyperglykemi, hyperprolaktinemi, overfølsomhet, hypertensiv krise, muskelspasmer, utslett, rastløse benssyndrom ved behandling, senksjon, supraventrikulær arytmi, tinnitus (ved seponering av behandlingen), trismus og urticaria.
NARKOTIKAHANDEL
Både CYP1A2 og CYP2D6 er ansvarlige for duloksetinmetabolismen.
Hemmere av CYP1A2
Når CYMBALTA 60 mg ble administrert samtidig med fluvoksamin 100 mg, en potent CYP1A2-hemmer, til mannlige forsøkspersoner (n=14) ble AUC for duloksetin økt ca. 6 ganger, Cmax ble økt ca. 2,5 ganger, og duloksetin t1/2 ble økt. økte ca. 3 ganger. Andre legemidler som hemmer CYP1A2-metabolismen inkluderer cimetidin og kinolonantimikrobielle midler som ciprofloksacin og enoksacin [se ADVARSLER OG FORHOLDSREGLER ].
Hemmere av CYP2D6
Samtidig bruk av CYMBALTA (40 mg én gang daglig) og paroksetin (20 mg én gang daglig) økte konsentrasjonen av duloksetin AUC med ca. 60 %, og høyere grader av hemming forventes med høyere doser paroksetin. Lignende effekter kan forventes med andre potente CYP2D6-hemmere (f.eks. fluoksetin, kinidin) [se ADVARSLER OG FORHOLDSREGLER ].
Dobbel hemming av CYP1A2 og CYP2D6
Samtidig administrering av CYMBALTA 40 mg to ganger daglig med fluvoksamin 100 mg, en potent CYP1A2-hemmer, til forsøkspersoner med lavt CYP2D6-metabolisme (n=14) resulterte i en 6 ganger økning i duloksetin AUC og Cmax.
Legemidler som forstyrrer hemostase (f.eks. NSAIDs, aspirin og warfarin)
Serotoninfrigjøring av blodplater spiller en viktig rolle i hemostase. Epidemiologiske studier av case-control og kohortdesign som har vist en sammenheng mellom bruk av psykotrope legemidler som forstyrrer serotoningjenopptak og forekomsten av øvre gastrointestinal blødning har også vist at samtidig bruk av et NSAID eller aspirin kan potensere denne blødningsrisikoen. Endrede antikoagulerende effekter, inkludert økt blødning, er rapportert når SSRI eller SNRI administreres samtidig med warfarin. Samtidig administrering av warfarin (2-9 mg én gang daglig) under steady state-betingelser med CYMBALTA 60 eller 120 mg én gang daglig i opptil 14 dager hos friske personer (n=15) endret ikke signifikant INR fra baseline (gjennomsnittlige INR-endringer varierte fra 0,05 til +0,07). Den totale farmakokinetikken for warfarin (proteinbundet pluss fritt medikament) (AUCτ,ss, Cmax,ss eller tmax,ss) for både R- og S-warfarin ble ikke endret av duloksetin. På grunn av den potensielle effekten av duloksetin på blodplater, bør pasienter som får warfarinbehandling overvåkes nøye når CYMBALTA startes eller seponeres [se ADVARSLER OG FORHOLDSREGLER ].
Lorazepam
Under steady-state forhold for CYMBALTA (60 mg Q 12 timer) og lorazepam (2 mg Q 12 timer), ble farmakokinetikken til duloksetin ikke påvirket av samtidig administrering.
Temazepam
Under steady-state forhold for CYMBALTA (20 mg qhs) og temazepam (30 mg qhs), ble ikke farmakokinetikken til duloksetin påvirket av samtidig administrasjon.
Legemidler som påvirker magesyren
CYMBALTA har et enterisk belegg som motstår oppløsning til det når et segment av mage-tarmkanalen hvor pH overstiger 5,5. Under ekstremt sure forhold kan CYMBALTA 20mg, ubeskyttet av det enteriske belegget, gjennomgå hydrolyse for å danne naftol. Forsiktighet anbefales ved bruk av CYMBALTA 30 mg hos pasienter med tilstander som kan redusere magetømmingen (f.eks. noen diabetikere). Legemidler som øker den gastrointestinale pH kan føre til en tidligere frigjøring av duloksetin. Samtidig administrering av CYMBALTA 60 mg med antacida som inneholder aluminium og magnesium (51 mEq) eller CYMBALTA med famotidin, hadde imidlertid ingen signifikant effekt på hastigheten eller omfanget av duloksetinabsorpsjon etter administrering av en 40 mg oral
Legemidler metabolisert av CYP1A2
In vitro legemiddelinteraksjonsstudier viser at duloksetin ikke induserer CYP1A2-aktivitet. En økning i metabolismen av CYP1A2-substrater (f.eks. teofyllin, koffein) som følge av induksjon er derfor ikke forventet, selv om kliniske studier av induksjon ikke er utført. Duloksetin er en hemmer av CYP1A2-isoformen i in vitro-studier, og i to kliniske studier var gjennomsnittlig (90 % konfidensintervall) økning i AUC for teofyllin 7 % (1 %-15 %) og 20 % (13 %-27 %) når det administreres sammen med CYMBALTA (60 mg to ganger daglig).
Legemidler metabolisert av CYP2D6
Duloksetin er en moderat hemmer av CYP2D6. Når CYMBALTA ble administrert (i en dose på 60 mg to ganger daglig) sammen med en enkeltdose på 50 mg desipramin, et CYP2D6-substrat, økte AUC for desipramin 3 ganger [se ADVARSLER OG FORHOLDSREGLER ].
Legemidler metabolisert av CYP2C9
Resultater fra in vitro-studier viser at duloksetin ikke hemmer aktiviteten. I en klinisk studie ble farmakokinetikken til S-warfarin, et CYP2C9-substrat, ikke signifikant påvirket av duloksetin [se Legemidler som forstyrrer hemostase (f.eks. NSAIDs, aspirin og warfarin) ].
Legemidler metabolisert av CYP3A
Resultater fra in vitro-studier viser at duloksetin ikke hemmer eller induserer CYP3A-aktivitet. En økning eller reduksjon i metabolismen av CYP3A-substrater (f.eks. orale prevensjonsmidler og andre steroide midler) som følge av induksjon eller hemming er derfor ikke forventet, selv om kliniske studier ikke er utført.
Legemidler metabolisert av CYP2C19
Resultater fra in vitro-studier viser at duloksetin ikke hemmer CYP2C19-aktivitet ved terapeutiske konsentrasjoner. Hemming av metabolismen av CYP2C19-substrater er derfor ikke forventet, selv om kliniske studier ikke er utført.
Monoaminoksidasehemmere (MAO-hemmere)
[Se DOSERING OG ADMINISTRASJON , KONTRAINDIKASJONER , og ADVARSLER OG FORHOLDSREGLER ].
Serotonerge legemidler
[Se DOSERING OG ADMINISTRASJON , KONTRAINDIKASJONER , og ADVARSLER OG FORHOLDSREGLER ].
Alkohol
Når CYMBALTA 40 mg og etanol ble administrert med flere timers mellomrom, slik at toppkonsentrasjoner av hver av dem skulle falle sammen, økte ikke CYMBALTA svekkelsen av mentale og motoriske ferdigheter forårsaket av alkohol.
I CYMBALTA-databasen for kliniske studier hadde tre CYMBALTA-behandlede pasienter leverskade som manifestert av ALAT og total bilirubinøkninger, med tegn på obstruksjon. Betydelig interkurrent etanolbruk var tilstede i hvert av disse tilfellene, og dette kan ha bidratt til abnormitetene som ble sett [se ADVARSLER OG FORHOLDSREGLER ].
CNS-medisiner
[Se ADVARSLER OG FORHOLDSREGLER ].
Legemidler som er sterkt bundet til plasmaprotein
Fordi duloksetin er sterkt bundet til plasmaprotein, kan administrering av CYMBALTA 30 mg til en pasient som tar et annet medikament som er sterkt proteinbundet, forårsake økte frie konsentrasjoner av det andre legemidlet, som potensielt kan resultere i bivirkninger. Samtidig administrering av CYMBALTA (60 eller 120 mg) med warfarin (2-9 mg), et sterkt proteinbundet legemiddel, resulterte imidlertid ikke i signifikante endringer i INR og i farmakokinetikken til verken total S- eller total R- warfarin (proteinbundet pluss fritt medikament) [se Legemidler som forstyrrer hemostase (f.eks. NSAIDs, aspirin og warfarin) ].
Narkotikamisbruk og avhengighet
Misbruke
I dyrestudier viste ikke duloksetin barbituratlignende (depressiv) misbrukspotensial.
Selv om CYMBALTA ikke har blitt systematisk studert hos mennesker med hensyn til potensialet for misbruk, var det ingen indikasjon på legemiddelsøkende atferd i de kliniske studiene. Det er imidlertid ikke mulig å forutsi på grunnlag av erfaring før markedsføring i hvilken grad et CNS-aktivt legemiddel vil bli misbrukt, avledet og/eller misbrukt når det først er markedsført. Følgelig bør leger nøye vurdere pasienter for en historie med narkotikamisbruk og følge slike pasienter nøye, og observere dem for tegn på misbruk eller misbruk av CYMBALTA (f.eks. utvikling av toleranse, økning av dose, legemiddelsøkende atferd).
Avhengighet
I legemiddelavhengighetsstudier viste ikke duloksetin avhengighetsproduserende potensial hos rotter.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Selvmordstanker og -adferd hos barn, ungdom og unge voksne
Pasienter med alvorlig depressiv lidelse (MDD), både voksne og barn, kan oppleve forverring av depresjonen og/eller fremveksten av selvmordstanker og -adferd (suicidalitet) eller uvanlige endringer i atferd, enten de tar antidepressive medisiner eller ikke, og dette risikoen kan vedvare inntil betydelig remisjon oppstår. Selvmord er en kjent risiko for depresjon og visse andre psykiatriske lidelser, og disse lidelsene er i seg selv de sterkeste prediktorene for selvmord. Det har imidlertid vært en langvarig bekymring for at antidepressiva kan ha en rolle i å indusere forverring av depresjon og fremveksten av suicidalitet hos visse pasienter i de tidlige faser av behandlingen.
Samlede analyser av kortsiktige placebokontrollerte studier av antidepressiva (SSRI og andre) viste at disse medikamentene øker risikoen for selvmordstanking og selvmordsatferd (suicidalitet) hos barn, ungdom og unge voksne (alder 1824) med alvorlig depressiv lidelse ( MDD) og andre psykiatriske lidelser. Korttidsstudier viste ikke en økning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne over 24 år; det var en reduksjon med antidepressiva sammenlignet med placebo hos voksne i alderen 65 år og eldre.
De samlede analysene av placebokontrollerte studier hos barn og ungdom med MDD, tvangslidelse (OCD) eller andre psykiatriske lidelser inkluderte totalt 24 korttidsstudier av 9 antidepressiva med over 4400 pasienter. De samlede analysene av placebokontrollerte studier hos voksne med MDD eller andre psykiatriske lidelser inkluderte totalt 295 korttidsstudier (median varighet på 2 måneder) med 11 antidepressiva med over 77 000 pasienter. Det var betydelig variasjon i risiko for suicidalitet blant legemidler, men en tendens til en økning i yngre pasienter for nesten alle legemidler som ble studert. Det var forskjeller i absolutt risiko for suicidalitet på tvers av de forskjellige indikasjonene, med høyest forekomst av MDD. Risikoen for forskjeller (legemiddel vs placebo) var imidlertid relativt stabil innenfor aldersstrata og på tvers av indikasjoner. Disse risikoforskjellene (medikament-placebo-forskjell i antall tilfeller av suicidalitet per 1000 behandlede pasienter) er gitt i tabell 1.
Ingen selvmord forekom i noen av de pediatriske CYMBALTA-studiene. Det var selvmord i CYMBALTA 20 mg-studiene for voksne, men antallet var ikke tilstrekkelig til å komme til noen konklusjon om CYMBALTA-effekten på selvmord.
Det er ukjent om suicidalitetsrisikoen strekker seg til langvarig bruk, dvs. utover flere måneder. Det er imidlertid betydelig bevis fra placebokontrollerte vedlikeholdsforsøk hos voksne med depresjon på at bruk av antidepressiva kan forsinke tilbakefall av depresjon.
Alle pasienter som behandles med antidepressiva for enhver indikasjon bør overvåkes hensiktsmessig og observeres nøye for klinisk forverring, suicidalitet og uvanlige endringer i atferd, spesielt i løpet av de første månedene av en medikamentell behandlingskur, eller ved doseendringer, enten økninger eller synker.
Følgende symptomer, angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshet), hypomani og mani, er rapportert hos voksne og pediatriske pasienter som også behandles med antidepressiva for alvorlig depressiv lidelse som for andre indikasjoner, både psykiatriske og ikke-psykiatriske. Selv om det ikke er etablert en årsakssammenheng mellom fremveksten av slike symptomer og enten forverring av depresjon og/eller fremveksten av selvmordsimpulser, er det bekymring for at slike symptomer kan representere forløpere til fremvoksende suicidalitet.
Det bør vurderes å endre det terapeutiske regimet, inkludert eventuelt seponering av medisinen, hos pasienter hvis depresjon er vedvarende verre, eller som opplever ny suicidalitet eller symptomer som kan være forløpere til forverring av depresjon eller suicidalitet, spesielt hvis disse symptomene er alvorlige, brå i debut, eller var ikke en del av pasientens tilstedeværende symptomer.
Hvis beslutningen er tatt om å avbryte behandlingen, bør medisinen trappes ned så raskt som mulig, men med erkjennelse av at seponering kan være forbundet med visse symptomer [se DOSERING OG ADMINISTRASJON og Seponeringssyndrom ] for beskrivelser av risikoen ved seponering av CYMBALTA.
Familier og omsorgspersoner til pasienter som behandles med antidepressiva for alvorlig depressiv lidelse eller andre indikasjoner, både psykiatriske og ikke-psykiatriske, bør varsles om behovet for å overvåke pasienter for fremveksten av agitasjon, irritabilitet, uvanlige endringer i atferd og de andre symptomene beskrevet ovenfor , samt fremveksten av suicidalitet, og å rapportere slike symptomer umiddelbart til helsepersonell. Slik overvåking bør inkludere daglig observasjon av familier og omsorgspersoner. Resepter for CYMBALTA bør skrives ut for den minste mengde kapsler i samsvar med god pasientbehandling, for å redusere risikoen for overdosering.
Screening av pasienter for bipolar lidelse
En alvorlig depressiv episode kan være den første presentasjonen av bipolar lidelse. Det er generelt antatt (men ikke etablert i kontrollerte studier) at behandling av en slik episode med et antidepressivum alene kan øke sannsynligheten for utfelling av en blandet/manisk episode hos pasienter med risiko for bipolar lidelse. Hvorvidt noen av symptomene beskrevet ovenfor representerer en slik konvertering er ukjent. Før behandling med et antidepressivum startes, bør imidlertid pasienter med depressive symptomer undersøkes tilstrekkelig for å avgjøre om de har risiko for bipolar lidelse; slik screening bør inkludere en detaljert psykiatrisk historie, inkludert en familiehistorie med selvmord, bipolar lidelse og depresjon. Det skal bemerkes at CYMBALTA ikke er godkjent for bruk ved behandling av bipolar depresjon.
Hepatotoksisitet
Det har vært rapporter om leversvikt, noen ganger dødelig, hos pasienter behandlet med CYMBALTA. Disse tilfellene har presentert seg som hepatitt med magesmerter, hepatomegali og forhøyede transaminasenivåer til mer enn tjue ganger øvre normalgrense (ULN) med eller uten gulsott, noe som gjenspeiler et blandet eller hepatocellulært mønster av leverskade. CYMBALTA 30 mg bør seponeres hos pasienter som utvikler gulsott eller andre tegn på klinisk signifikant leverdysfunksjon og bør ikke gjenopptas med mindre en annen årsak kan fastslås.
Tilfeller av kolestatisk gulsott med minimal økning av transaminasenivåer er også rapportert. Andre rapporter etter markedsføring indikerer at forhøyede transaminaser, bilirubin og alkalisk fosfatase har forekommet hos pasienter med kronisk leversykdom eller cirrhose.
CYMBALTA økte risikoen for forhøyede serumtransaminasenivåer i kliniske studier i utviklingsprogram. Forhøyede levertransaminaser resulterte i seponering av 0,3 % (92/34 756) av CYMBALTA-behandlede pasienter. Hos de fleste pasienter var mediantiden til påvisning av transaminaseøkningen omtrent to måneder. I placebokontrollerte studier for voksne, for pasienter med normale og unormale baseline ALAT-verdier, forekom økning av ALAT >3 ganger ULN hos 1,25 % (144/11 496) av CYMBALTA-behandlede pasienter sammenlignet med 0,45 % (39/8716) av placebo -behandlede pasienter. I placebokontrollerte voksne studier med fast dosedesign, var det bevis på en CYMBALTA-doseresponsrelasjon for ALAT- og ASAT-økning på henholdsvis >3 ganger ULN og >5 ganger ULN.
Fordi det er mulig at CYMBALTA og alkohol kan interagere og forårsake leverskade eller at CYMBALTA 20 mg kan forverre eksisterende leversykdom, bør CYMBALTA ikke forskrives til pasienter med betydelig alkoholbruk eller tegn på kronisk leversykdom.
Ortostatisk hypotensjon, fall og synkope
Ortostatisk hypotensjon, fall og synkope er rapportert hos pasienter behandlet med anbefalte CYMBALTA-doser. Synkope og ortostatisk hypotensjon har en tendens til å oppstå innen den første uken av behandlingen, men kan oppstå når som helst under CYMBALTA-behandling, spesielt etter doseøkninger. Risikoen for å falle ser ut til å være relatert til graden av ortostatisk reduksjon i blodtrykket (BP) samt andre faktorer som kan øke den underliggende risikoen for fall.
en analyse av pasienter fra alle placebokontrollerte studier rapporterte pasienter behandlet med CYMBALTA 20 mg en høyere fallrate sammenlignet med pasienter behandlet med placebo. Risiko ser ut til å være relatert til tilstedeværelsen av ortostatisk reduksjon i BP. Risikoen for BP-reduksjon kan være større hos pasienter som samtidig tar medisiner som induserer ortostatisk hypotensjon (som antihypertensiva) eller er potente CYP1A2-hemmere [se ADVARSLER OG FORHOLDSREGLER og Klinisk viktige legemiddelinteraksjoner ] og hos pasienter som tar CYMBALTA 20 mg i doser over 60 mg daglig. Dosereduksjon eller seponering av CYMBALTA bør vurderes hos pasienter som opplever symptomatisk ortostatisk hypotensjon, fall og/eller synkope under behandling med CYMBALTA 40 mg.
Risikoen for å falle så også ut til å være proporsjonal med en pasients underliggende risiko for fall og så ut til å øke jevnt med alderen. Siden geriatriske pasienter har en tendens til å ha en høyere underliggende risiko for fall på grunn av høyere forekomst av risikofaktorer som bruk av flere medisiner, medisinske komorbiditeter og gangforstyrrelser, er virkningen av økende alder i seg selv uklar. Fall med alvorlige konsekvenser inkludert brudd og sykehusinnleggelser er rapportert ved bruk av CYMBALTA 30 mg [se BIVIRKNINGER ].
Serotonin syndrom
Utvikling av et potensielt livstruende serotonergt syndrom er rapportert med SNRI og SSRI, inkludert CYMBALTA 60 mg, alene, men spesielt ved samtidig bruk av andre serotonerge legemidler (inkludert triptaner, trisykliske antidepressiva, fentanyl, litium, tramadolamin, tryptofan, , og johannesurt) og med legemidler som hemmer metabolismen av serotonin (spesielt MAO-hemmere, både de som er beregnet på å behandle psykiatriske lidelser og også andre, som linezolid og intravenøs metylenblått).
Symptomer på serotonergt syndrom kan omfatte endringer i mental status (f.eks. agitasjon, hallusinasjoner, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtrykk, svimmelhet, diaforese, rødme, hypertermi), nevromuskulære symptomer (f.eks. tremor, rigiditet, myoklonus, hyperrefleksi, inkoordinering), anfall og/eller gastrointestinale symptomer (f.eks. kvalme, oppkast, diaré). Pasienter bør overvåkes for fremveksten av serotonergt syndrom.
Samtidig bruk av CYMBALTA 30 mg og MAO-antidepressiva er kontraindisert. CYMBALTA 60 mg bør heller ikke startes hos en pasient som behandles med MAO-hemmere som linezolid eller intravenøs metylenblått. Alle rapporter med metylenblått som ga informasjon om administreringsveien involverte intravenøs administrering i doseområdet 1 mg/kg til 8 mg/kg. Ingen rapporter involverte administrering av metylenblått på andre måter (som orale tabletter eller lokal vevsinjeksjon) eller ved lavere doser. Det kan være omstendigheter når det er nødvendig å starte behandling med en MAO-hemmer som linezolid eller intravenøs metylenblått hos en pasient som tar CYMBALTA. CYMBALTA bør seponeres før behandling med MAO-hemmeren startes [se DOSERING OG ADMINISTRASJON og KONTRAINDIKASJONER ].
Hvis samtidig bruk av CYMBALTA 20mg med andre serotonerge legemidler inkludert triptaner, trisykliske antidepressiva, fentanyl, litium, tramadol, buspiron, tryptofan, amfetamin og johannesurt er klinisk berettiget, bør pasienter gjøres oppmerksomme på en potensiell økt risiko for serotoninsyndrom. , spesielt under behandlingsstart og doseøkninger. Behandling med CYMBALTA 60 mg og eventuelle samtidige serotonerge midler bør seponeres umiddelbart hvis ovennevnte hendelser oppstår og støttende symptomatisk behandling bør startes.
Økt risiko for blødning
Legemidler som forstyrrer serotonin-reopptakshemming, inkludert CYMBALTA, kan øke risikoen for blødningshendelser. Kasusrapporter og epidemiologiske studier (kasuskontroll og kohortdesign) har vist en sammenheng mellom bruk av medikamenter som forstyrrer serotoningjenopptak og forekomst av gastrointestinal blødning. En post-marketing studie viste en høyere forekomst av postpartum blødning hos mødre som tok CYMBALTA. Andre blødningshendelser relatert til SSRI- og SNRI-bruk har variert fra ekkymoser, hematomer, neseblødninger og petekkier til livstruende blødninger. Samtidig bruk av aspirin, ikke-steroide antiinflammatoriske legemidler (NSAIDs), warfarin og andre antikoagulantia kan øke denne risikoen.
Informer pasienter om risikoen for blødning forbundet med samtidig bruk av CYMBALTA og NSAIDs, aspirin eller andre legemidler som påvirker koagulasjonen [se NARKOTIKAHANDEL ].
Alvorlige hudreaksjoner
Alvorlige hudreaksjoner, inkludert erythema multiforme og Stevens-Johnsons syndrom (SJS), kan oppstå med CYMBALTA. Rapporteringsraten for SJS assosiert med CYMBALTA-bruk overstiger den generelle bakgrunnsforekomsten for denne alvorlige hudreaksjonen (1 til 2 tilfeller per million personår). Rapporteringsraten er generelt akseptert å være et underestimat på grunn av underrapportering.
CYMBALTA bør seponeres ved første opptreden av blemmer, peeling-utslett, slimhinneerosjoner eller andre tegn på overfølsomhet dersom ingen annen etiologi kan identifiseres.
Seponeringssyndrom
Seponeringssymptomer har blitt systematisk evaluert hos pasienter som tar CYMBALTA. Etter brå eller nedtrappet seponering i placebokontrollerte kliniske studier for voksne, oppsto følgende symptomer ved 1 % eller mer og med en signifikant høyere frekvens hos CYMBALTA-behandlede pasienter sammenlignet med de som sluttet med placebo: svimmelhet, hodepine, kvalme, diaré, parestesi, irritabilitet, oppkast, søvnløshet, angst, hyperhidrose og tretthet.
Under markedsføring av andre SSRI-er og SNRI-er (serotonin- og noradrenalin-reopptakshemmere), har det vært spontane rapporter om uønskede hendelser ved seponering av disse legemidlene, spesielt ved brå behandling, inkludert følgende: dysforisk stemning, irritabilitet, agitasjon, svimmelhet, sensoriske forstyrrelser ( parestesier som elektrisk sjokkfølelse), angst, forvirring, hodepine, sløvhet, emosjonell labilitet, søvnløshet, hypomani, tinnitus og anfall. Selv om disse hendelsene generelt er selvbegrensende, har noen blitt rapportert å være alvorlige.
Pasienter bør overvåkes for disse symptomene når behandlingen med CYMBALTA avsluttes. En gradvis reduksjon i dosen i stedet for brå seponering anbefales når det er mulig. Hvis det oppstår utålelige symptomer etter en dosereduksjon eller ved seponering av behandlingen, kan det vurderes å gjenoppta den tidligere foreskrevne dosen. Deretter kan helsepersonell fortsette å redusere dosen, men med en mer gradvis hastighet [se DOSERING OG ADMINISTRASJON ].
Aktivering av mani/hypomani
placebokontrollerte studier hos voksne med pasienter med MDD ble aktivering av mani eller hypomani rapportert hos 0,1 % (4/3779) av CYMBALTA-behandlede pasienter og 0,04 % (1/2536) av placebobehandlede pasienter. Ingen aktivering av mani eller hypomani ble rapportert i placebokontrollerte studier med DPNP, GAD, fibromyalgi eller kroniske muskel- og skjelettsmerter. Aktivering av mani eller hypomani er rapportert hos en liten andel av pasienter med stemningslidelser som ble behandlet med andre markedsførte legemidler som er effektive i behandlingen av alvorlig depressiv lidelse. Som med disse andre midlene, bør CYMBALTA 60 mg brukes med forsiktighet hos pasienter med en historie med mani.
Vinkel-lukkende glaukom
Pupilleutvidelsen som oppstår etter bruk av mange antidepressiva, inkludert CYMBALTA, kan utløse et vinkellukkingsangrep hos en pasient med anatomisk smale vinkler som ikke har patentert iridektomi.
Anfall
CYMBALTA har ikke blitt systematisk evaluert hos pasienter med anfallsforstyrrelse, og slike pasienter ble ekskludert fra kliniske studier. I placebokontrollerte kliniske studier hos voksne forekom anfall/kramper hos 0,02 % (3/12 722) av pasientene behandlet med CYMBALTA 60 mg og 0,01 % (1/9513) av pasientene behandlet med placebo. CYMBALTA bør forskrives med forsiktighet til pasienter med anfallslidelse.
Økning i blodtrykk
placebokontrollerte kliniske studier for voksne på tvers av de godkjente voksne populasjonene fra baseline til endepunkt, var CYMBALTA-behandling assosiert med gjennomsnittlig økning på 0,5 mm Hg i systolisk blodtrykk og 0,8 mm Hg i diastolisk blodtrykk sammenlignet med gjennomsnittlig reduksjon på 0,6 mm Hg systolisk og 0,3 mm Hg diastolisk hos placebobehandlede pasienter. Det var ingen signifikant forskjell i frekvensen av vedvarende (3 påfølgende besøk) forhøyet blodtrykk. I en klinisk farmakologisk studie designet for å evaluere effekten av CYMBALTA 60 mg på ulike parametere, inkludert blodtrykk ved supraterapeutiske doser med en akselerert dosetitrering, var det tegn på økning i liggende blodtrykk ved doser opp til 200 mg to ganger daglig (omtrent 3,3 ganger daglig) maksimal anbefalt dose). Ved den høyeste dosen på 200 mg to ganger daglig var økningen i gjennomsnittlig puls 5,0 til 6,8 slag og økningen i gjennomsnittlig blodtrykk var 4,7 til 6,8 mm Hg (systolisk) og 4,5 til 7 mm Hg (diastolisk) opptil 12 timer etter dosering. .
Blodtrykket bør måles før behandlingsstart og periodisk måles gjennom hele behandlingen [se BIVIRKNINGER ].
Klinisk viktige legemiddelinteraksjoner
Både CYP1A2 og CYP2D6 er ansvarlige for CYMBALTA-metabolismen.
Potensial for andre legemidler å påvirke CYMBALTA
CYP1A2-hemmere
Samtidig administrering av CYMBALTA 40 mg og potente CYP1A2-hemmere bør unngås [se NARKOTIKAHANDEL ].
CYP2D6-hemmere
Fordi CYP2D6 er involvert i CYMBALTA-metabolismen, vil samtidig bruk av CYMBALTA og potente hemmere av CYP2D6 forventes å, og vil, resultere i høyere konsentrasjoner (i gjennomsnitt på 60%) av CYMBALTA [se NARKOTIKAHANDEL ].
Potensial for CYMBALTA 30mg til å påvirke andre legemidler
Legemidler metabolisert av CYP2D6
Samtidig administrering av CYMBALTA 20 mg med legemidler som metaboliseres i stor utstrekning av CYP2D6 og som har en smal terapeutisk indeks, inkludert visse antidepressiva (trisykliske antidepressiva [TCA], som nortriptylin, amitriptylin og imipramin), fentiaziner og type 1C antiarrhymi (f.eks. propafenon, flekainid), bør behandles med forsiktighet. Plasma-TCA-konsentrasjoner må kanskje overvåkes og dosen av TCA må kanskje reduseres hvis en TCA administreres samtidig med CYMBALTA. På grunn av risikoen for alvorlige ventrikulære arytmier og plutselig død potensielt assosiert med forhøyede plasmanivåer av tioridazin, bør CYMBALTA 30 mg og tioridazin ikke administreres samtidig [se NARKOTIKAHANDEL ].
Andre klinisk viktige legemiddelinteraksjoner
Alkohol
Bruk av CYMBALTA 40 mg samtidig med tungt alkoholinntak kan være assosiert med alvorlig leverskade. Av denne grunn bør CYMBALTA 60 mg ikke forskrives til pasienter med betydelig alkoholbruk [se Hepatotoksisitet og GENERELT INTERAKSJONER ].
CNS-virkende legemidler
Gitt de primære CNS-effektene av CYMBALTA, bør det brukes med forsiktighet når det tas i kombinasjon med eller erstatter andre sentralt virkende legemidler, inkludert de med lignende virkningsmekanisme [se Klinisk viktige legemiddelinteraksjoner og NARKOTIKAHANDEL ].
Hyponatremi
Hyponatremi kan oppstå som følge av behandling med SSRI og SNRI, inkludert CYMBALTA. I mange tilfeller ser denne hyponatremien ut til å være et resultat av syndromet med upassende antidiuretisk hormonsekresjon (SIADH). Tilfeller med serumnatrium lavere enn 110 mmol/L er rapportert ved bruk av CYMBALTA 40 mg og så ut til å være reversible når CYMBALTA ble seponert. Geriatriske pasienter kan ha større risiko for å utvikle hyponatremi med SSRI og SNRI. Pasienter som tar diuretika eller på annen måte er volummangel kan også ha større risiko [se Bruk i spesifikke populasjoner ]. Seponering av CYMBALTA bør vurderes hos pasienter med symptomatisk hyponatremi og passende medisinsk intervensjon bør iverksettes.
Tegn og symptomer på hyponatremi inkluderer hodepine, konsentrasjonsvansker, hukommelsessvikt, forvirring, svakhet og ustabilitet, som kan føre til fall. Mer alvorlige og/eller akutte tilfeller har vært assosiert med hallusinasjoner, synkope, anfall, koma, respirasjonsstans og død.
Bruk hos pasienter med samtidig sykdom
Klinisk erfaring med CYMBALTA hos pasienter med samtidige systemiske sykdommer er begrenset. Det er ingen informasjon om hvilken effekt endringer i gastrisk motilitet kan ha på stabiliteten til CYMBALTAs enteriske belegg. Under ekstremt sure forhold kan CYMBALTA, ubeskyttet av det enteriske belegget, gjennomgå hydrolyse for å danne naftol. Forsiktighet anbefales ved bruk av CYMBALTA hos pasienter med tilstander som kan redusere magetømmingen (f.eks. noen diabetikere).
CYMBALTA 30 mg har ikke blitt systematisk evaluert hos pasienter med en nylig historie med hjerteinfarkt eller ustabil koronararteriesykdom. Pasienter med disse diagnosene ble generelt ekskludert fra kliniske studier under produktets premarketingtesting.
Nedsatt leverfunksjon
Unngå bruk hos pasienter med kronisk leversykdom eller cirrhose [se DOSERING OG ADMINISTRASJON , Hepatotoksisitet , og Bruk i spesifikke populasjoner ].
Alvorlig nedsatt nyrefunksjon
Unngå bruk hos pasienter med alvorlig nedsatt nyrefunksjon, GFR DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Glykemisk kontroll hos pasienter med diabetes
Som observert i DPNP-studier, forverret behandling med CYMBALTA 30 mg den glykemiske kontrollen hos noen pasienter med diabetes. I tre kliniske studier av CYMBALTA for behandling av nevropatisk smerte assosiert med diabetisk perifer nevropati [se Kliniske studier ], gjennomsnittlig varighet av diabetes var omtrent 12 år, gjennomsnittlig baseline fastende blodsukker var 176 mg/dL, og gjennomsnittlig baseline hemoglobin A1c (HbA1c) var 7,8 %. I den 12-ukers akutte behandlingsfasen av disse studiene var CYMBALTA assosiert med en liten økning i gjennomsnittlig fastende blodsukker sammenlignet med placebo. I forlengelsesfasen av disse studiene, som varte i opptil 52 uker, økte gjennomsnittlig fastende blodsukker med 12 mg/dL i CYMBALTA 40 mg-gruppen og reduserte med 11,5 mg/dL i rutinebehandlingsgruppen. HbA1c økte med 0,5 % i CYMBALTA 40 mg-gruppen og med 0,2 % i rutinebehandlingsgruppen.
Urinnøling og retensjon
CYMBALTA 60mg er i en klasse med legemidler som er kjent for å påvirke urethral motstand. Hvis symptomer på urinnøling utvikles under behandling med CYMBALTA 20 mg, bør det vurderes om de kan være medikamentrelaterte.
Etter markedsføring har tilfeller av urinretensjon blitt observert. I noen tilfeller av urinretensjon forbundet med bruk av CYMBALTA 60 mg, har sykehusinnleggelse og/eller kateterisering vært nødvendig.
Seksuell dysfunksjon
Bruk av SNRI, inkludert CYMBALTA 60 mg, kan forårsake symptomer på seksuell dysfunksjon [se BIVIRKNINGER ]. Hos mannlige pasienter kan bruk av SNRI resultere i ejakulatorisk forsinkelse eller svikt, redusert libido og erektil dysfunksjon. Hos kvinnelige pasienter kan bruk av SNRI resultere i redusert libido og forsinket eller manglende orgasme.
Det er viktig for forskrivere å spørre om seksuell funksjon før oppstart av CYMBALTA 40 mg og å spørre spesifikt om endringer i seksuell funksjon under behandlingen, fordi seksuell funksjon kanskje ikke er spontant rapportert. Ved evaluering av endringer i seksuell funksjon er det viktig å få en detaljert anamnese (inkludert tidspunkt for symptomdebut) fordi seksuelle symptomer kan ha andre årsaker, inkludert den underliggende psykiatriske lidelsen. Diskuter potensielle ledelsesstrategier for å støtte pasienter i å ta informerte beslutninger om behandling.
Pasientrådgivningsinformasjon
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning ).
Selvmordstanker og -adferd
Råd pasienter, deres familier og deres omsorgspersoner til å se etter fremveksten av selvmordstanker og -adferd, spesielt under behandling og når dosen justeres opp eller ned, og instruer dem om å rapportere slike symptomer til helsepersonell [se BOKS ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Administrasjon
Råd pasientene til å svelge CYMBALTA 20 mg hel og ikke tygge, knuse eller åpne kapselen (ikke dryss innhold på mat eller blandet med væske) fordi disse handlingene kan påvirke det enteriske belegget.
Hepatotoksisitet
Informer pasienter om at alvorlige leverproblemer, noen ganger dødelige, er rapportert hos pasienter behandlet med CYMBALTA. Instruer pasienter om å snakke med helsepersonell dersom de utvikler kløe, smerter i øvre høyre del av magen, mørk urin eller gul hud/øyne mens de tar CYMBALTA, som kan være tegn på leverproblemer. Be pasienter om å snakke med helsepersonell om alkoholforbruket. Bruk av CYMBALTA med høyt alkoholinntak kan være assosiert med alvorlig leverskade [se ADVARSLER OG FORHOLDSREGLER ].
Alkohol
Selv om CYMBALTA ikke øker svekkelsen av mentale og motoriske ferdigheter forårsaket av alkohol, kan bruk av CYMBALTA samtidig med tungt alkoholinntak være assosiert med alvorlig leverskade [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ].
Ortostatisk hypotensjon, fall og synkope
Informer pasienter om risikoen for ortostatisk hypotensjon, fall og synkope, spesielt i perioden med førstegangsbruk og påfølgende doseøkning, og i forbindelse med bruk av samtidig legemidler som kan potensere den ortostatiske effekten av CYMBALTA [se ADVARSLER OG FORHOLDSREGLER ].
Serotonin syndrom
Forsiktig pasienter om risikoen for serotonergt syndrom ved samtidig bruk av CYMBALTA 30 mg og andre serotonerge midler, inkludert triptaner, trisykliske antidepressiva, fentanyl, litium, tramadol, buspiron, tryptofan, amfetamin og johannesurt [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER , og NARKOTIKAHANDEL ]. Informer pasienter om tegn og symptomer assosiert med serotonergt syndrom som kan omfatte endringer i mental status (f.eks. agitasjon, hallusinasjoner, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtrykk, svimmelhet, diaforese, rødme, hypertermi), nevromuskulære endringer (f.eks. skjelving, rigiditet, myoklonus, hyperrefleksi, inkoordinasjon), anfall og/eller gastrointestinale symptomer (f.eks. kvalme, oppkast, diaré). Forsiktig pasienter om å søke medisinsk hjelp umiddelbart hvis de opplever disse symptomene.
Økt risiko for blødning
Vær forsiktig med pasienter med samtidig bruk av CYMBALTA 30mg og NSAIDs, aspirin, warfarin eller andre legemidler som påvirker koagulasjonen siden kombinert bruk av psykotrope legemidler som forstyrrer serotoningjenopptak og disse midlene har vært assosiert med økt risiko for blødning [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Alvorlige hudreaksjoner
Vær oppmerksom på at CYMBALTA kan forårsake alvorlige hudreaksjoner. Dette må kanskje behandles på sykehus og kan være livstruende. Råd pasienter til å ringe legen sin med en gang eller få akutt hjelp hvis de har blemmer på huden, flassende utslett, sår i munnen, elveblest eller andre allergiske reaksjoner [se ADVARSLER OG FORHOLDSREGLER ].
Seponering av behandling
Instruer pasienter om at seponering av CYMBALTA 30 mg kan være assosiert med symptomer som svimmelhet, hodepine, kvalme, diaré, parestesi, irritabilitet, oppkast, søvnløshet, angst, hyperhidrose og tretthet, og bør rådes til å ikke endre doseringsregimet eller slutte. tar CYMBALTA uten å konsultere helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Aktivering av mani eller hypomani
Undersøk pasienter med depressive symptomer for risiko for bipolar lidelse (f.eks. familiehistorie med selvmord, bipolar lidelse og depresjon) før oppstart av behandling med CYMBALTA. Råd pasientene til å rapportere tegn eller symptomer på en manisk reaksjon som kraftig økt energi, alvorlige søvnvansker, løpende tanker, hensynsløs oppførsel, snakke mer eller raskere enn vanlig, uvanlig store ideer og overdreven lykke eller irritabilitet [se ADVARSLER OG FORHOLDSREGLER ].
Vinkel-lukkende glaukom
Informer pasienter om at inntak av CYMBALTA 40 mg kan forårsake mild pupilleutvidelse, som hos følsomme individer kan føre til en episode med lukket vinkelglaukom. Eksisterende glaukom er nesten alltid åpenvinklet glaukom fordi vinkel-lukkende glaukom, når diagnostisert, kan behandles definitivt med iridektomi. Åpenvinklet glaukom er ikke en risikofaktor for lukkevinkelglaukom. Pasienter kan ønske å bli undersøkt for å avgjøre om de er mottakelige for vinkellukking, og ha en profylaktisk prosedyre (f.eks. iridektomi), hvis de er mottakelige [se ADVARSLER OG FORHOLDSREGLER ].
Anfall
Råd pasientene til å informere helsepersonell dersom de har en historie med anfallsforstyrrelse [se ADVARSLER OG FORHOLDSREGLER ].
Effekter på blodtrykk
Pasienter må advare om at CYMBALTA 60 mg kan føre til økt blodtrykk [se ADVARSLER OG FORHOLDSREGLER ].
Samtidige medisiner
Råd pasientene til å informere helsepersonell dersom de tar, eller planlegger å ta, reseptbelagte eller reseptfrie medisiner, siden det er et potensial for interaksjoner [se DOSERING OG ADMINISTRASJON , KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER , og NARKOTIKAHANDEL ].
Hyponatremi
Informer pasienter om at hyponatremi er rapportert som følge av behandling med SNRI og SSRI, inkludert CYMBALTA. Informer pasienter om tegn og symptomer på hyponatremi [se ADVARSLER OG FORHOLDSREGLER ].

Samtidige sykdommer
Råd pasientene til å informere helsepersonell om alle deres medisinske tilstander [se ADVARSLER OG FORHOLDSREGLER ].
Urinnøling og retensjon
CYMBALTA er i en klasse legemidler som kan påvirke vannlating. Instruer pasienter om å rådføre seg med helsepersonell dersom de utvikler problemer med urinstrømmen [se ADVARSLER OG FORHOLDSREGLER ].
Seksuell dysfunksjon
Informer pasienter om at bruk av CYMBALTA 40 mg kan forårsake symptomer på seksuell dysfunksjon hos både mannlige og kvinnelige pasienter. Informer pasienter om at de bør diskutere eventuelle endringer i seksuell funksjon og potensielle behandlingsstrategier med helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Svangerskap
- . Råde kvinner til å varsle helsepersonell dersom de blir gravide eller har tenkt å bli gravide under behandling med CYMBALTA. . Informer gravide kvinner eller pasienter som har tenkt å bli gravide at bruk av CYMBALTA 40 mg i løpet av måneden før fødselen kan føre til økt risiko for postpartum blødning og kan øke risikoen for neonatale komplikasjoner som krever langvarig sykehusinnleggelse, pustestøtte og sondeernæring. . Informer gravide om at det er fare for tilbakefall ved seponering av antidepressiva. . Gi pasienter beskjed om at det finnes et eksponeringsregister for graviditet som overvåker graviditetsutfall hos kvinner som er eksponert for duloksetin under graviditet [se Bruk i spesifikke populasjoner ].
Amming
Råd ammende kvinner som bruker CYMBALTA 30 mg for å overvåke spedbarn for sedasjon, dårlig fôring og dårlig vektøkning og å søke medisinsk hjelp hvis de merker disse tegnene [se Bruk i spesifikke populasjoner ].
Interferens med psykomotorisk ytelse
CYMBALTA 30 mg kan være assosiert med sedasjon og svimmelhet. Vær derfor oppmerksom på pasienter med å bruke farlige maskiner, inkludert biler, inntil de er rimelig sikre på at CYMBALTA-behandling ikke påvirker deres evne til å delta i slike aktiviteter.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Duloksetin ble administrert i dietten til mus og rotter i 2 år.
Hos hunnmus som fikk duloksetin med 140 mg/kg/dag (3 ganger maksimal anbefalt human dose (MRHD) på 120 mg/dag gitt til barn på mg/m2 basis), var det en økt forekomst av hepatocellulære adenomer og karsinomer. Ingen-effektdosen var 50 mg/kg/dag (1 gang MRHD gitt til barn). Tumorforekomsten var ikke økt hos hannmus som fikk duloksetin i doser opp til 100 mg/kg/dag (2 ganger MRHD gitt til barn).
Hos rotter økte ikke diettdoser av duloksetin opptil 27 mg/kg/dag hos hunner (1 gang MRHD gitt til barn) og opptil 36 mg/kg/dag hos hanner (1,4 ganger MRHD gitt til barn) forekomst av svulster.
Mutagenese
Duloksetin var ikke mutagent i in vitro bakteriell revers mutasjonsanalyse (Ames test) og var ikke klastogent i en in vivo kromosomavvikstest i benmargsceller fra mus. I tillegg var duloksetin ikke genotoksisk i en in vitro pattedyrforover-genmutasjonsanalyse i muselymfomceller eller i en in vitro ikke-planlagt DNA-syntese (UDS)-analyse i primære rottehepatocytter, og induserte ikke søsterkromatidutveksling i benmarg fra kinesisk hamster in vivo .
Nedsatt fruktbarhet
Duloksetin administrert oralt til enten hann- eller hunnrotter før og gjennom parring i doser på opptil 45 mg/kg/dag (3 ganger MRHD gitt til ungdom på mg/m2-basis) endret ikke paring eller fertilitet.
Bruk i spesifikke populasjoner
Svangerskap
Eksponeringsregister for graviditet
Det finnes et graviditetseksponeringsregister som overvåker graviditetsutfallene hos kvinner eksponert for CYMBALTA under graviditet. For å registrere deg, kontakt CYMBALTA Pregnancy Registry på 1-866-814-6975 eller www.cymbalta 20mgpregnancyregistry.com.
Risikosammendrag
Data fra en postmarketing retrospektiv kohortstudie indikerer at bruk av duloksetin i måneden før fødsel kan være assosiert med økt risiko for postpartum blødning. Data fra publisert litteratur og fra en retrospektiv kohortstudie etter markedsføring har ikke identifisert en klar medikamentassosiert risiko for alvorlige fødselsskader eller andre uønskede utviklingsresultater (se Data ). Det er risiko forbundet med ubehandlet depresjon og fibromyalgi under graviditet, og med eksponering for SNRI og SSRI, inkludert CYMBALTA, under graviditet (se Kliniske betraktninger ).
Hos rotter og kaniner behandlet med duloksetin i løpet av organogeneseperioden ble fostervekten redusert, men det var ingen tegn på utviklingseffekter ved doser opp til henholdsvis 3 og 6 ganger den maksimale anbefalte humane dosen (MRHD) på 120 mg/dag gitt til ungdom på mg/m2 basis. Når duloksetin ble administrert oralt til drektige rotter gjennom svangerskapet og diegivningen, ble valpevekten ved fødselen og valpenes overlevelse til 1 dag postpartum redusert med en dose 2 ganger MRHD gitt til ungdom på mg/m2-basis. Ved denne dosen ble det observert atferd for valpen i samsvar med økt reaktivitet, slik som økt skremmerespons på støy og redusert tilvenning av bevegelsesaktivitet. Veksten etter avvenning ble ikke negativt påvirket.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 til 4 % og 15 til 20 %.
Kliniske betraktninger
Sykdomsrelatert mors- og/eller embryo-/fosterrisiko
Kvinner som slutter med antidepressiva under svangerskapet har større sannsynlighet for å få tilbakefall av alvorlig depresjon enn kvinner som fortsetter med antidepressiva. Dette funnet er fra en prospektiv, longitudinell studie som fulgte 201 gravide kvinner med en historie med alvorlig depressiv lidelse som var euthymic og tok antidepressiva i begynnelsen av svangerskapet. Vurder risikoen for ubehandlet depresjon når du avbryter eller endrer behandling med antidepressiva under graviditet og etter fødsel.
Gravide kvinner med fibromyalgi har økt risiko for uønskede utfall hos mor og spedbarn, inkludert prematur prematur ruptur av membraner, prematur fødsel, liten for svangerskapsalderen, intrauterin vekstbegrensning, placentaforstyrrelser og venøs trombose. Det er ikke kjent om disse uheldige mors- og fosterutfallene er et direkte resultat av fibromyalgi eller andre komorbide faktorer.
Bivirkninger hos mor
Bruk av duloksetin i måneden før fødsel kan være assosiert med økt risiko for blødning etter fødselen [se ADVARSLER OG FORHOLDSREGLER ].
Fetal/neonatal bivirkning
Nyfødte eksponert for CYMBALTA og andre SNRI eller SSRI sent i tredje trimester har utviklet komplikasjoner som krever langvarig sykehusinnleggelse, pustestøtte og sondeernæring. Slike komplikasjoner kan oppstå umiddelbart etter levering. Rapporterte kliniske funn har inkludert pustebesvær, cyanose, apné, anfall, temperaturustabilitet, matvansker, oppkast, hypoglykemi, hypotoni, hypertoni, hyperrefleksi, skjelving, urolighet, irritabilitet og konstant gråt. Disse funnene stemmer overens med enten en direkte toksisk effekt av SNRI eller SSRI, eller muligens et medikamentavbruddssyndrom. Det skal bemerkes at i noen tilfeller er det kliniske bildet i samsvar med serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ].
Data
Menneskelige data
Data fra en postmarketing retrospektiv påstandsbasert kohortstudie fant en økt risiko for postpartum blødning blant 955 gravide kvinner eksponert for duloksetin i den siste måneden av svangerskapet sammenlignet med 4 128 460 ueksponerte gravide kvinner (justert relativ risiko: 1,53; 1808-2: 18% CI. ). Den samme studien fant ikke en klinisk meningsfull økning i risikoen for alvorlige fødselsskader i sammenligningen av 2532 kvinner eksponert for duloksetin i første trimester av svangerskapet med 1 284 827 ueksponerte kvinner etter justering for flere konfoundere. Metodiske begrensninger inkluderer mulig gjenværende forvirring, feilklassifisering av eksponering og utfall, mangel på direkte mål på sykdommens alvorlighetsgrad og mangel på informasjon om alkoholbruk, ernæring og reseptfrie medisiner.
Dyredata
I reproduksjonsstudier på dyr har duloksetin vist seg å ha uønskede effekter på embryo/føtal og postnatal utvikling.
Når duloksetin ble administrert oralt til drektige rotter og kaniner i løpet av organogeneseperioden, var det ingen tegn på misdannelser eller utviklingsvariasjoner ved doser opp til 45 mg/kg/dag [henholdsvis 3 og 6 ganger MRHD på 120 mg/dag gitt til ungdom på mg/m2 basis]. Imidlertid ble fostervekten redusert ved denne dosen, med en dose uten effekt på 10 mg/kg/dag (omtrent lik MRHD hos rotter og 2 ganger MRHD hos kaniner).
Når duloksetin ble administrert oralt til drektige rotter gjennom drektighet og diegivning, ble overlevelsen av unger til 1 dag postpartum og kroppsvekten av unger ved fødselen og under diegivningsperioden redusert med en dose på 30 mg/kg/dag (2 ganger MRHD gitt til ungdom på mg/m2 basis); dosen uten effekt var 10 mg/kg/dag. Videre ble atferd i samsvar med økt reaktivitet, slik som økt skremmerespons på støy og redusert tilvenning av bevegelsesaktivitet, observert hos unger etter mors eksponering for 30 mg/kg/dag. Vekst etter avvenning og reproduksjonsevne til avkommet ble ikke påvirket negativt av maternal duloksetinbehandling.
Amming
Risikosammendrag
Data fra publisert litteratur rapporterer tilstedeværelsen av duloksetin i morsmelk (se Data ). Det er rapporter om sedasjon, dårlig mating og dårlig vektøkning hos spedbarn som er eksponert for duloksetin gjennom morsmelk (se Kliniske betraktninger ). Det finnes ingen data på effekten av duloksetin på melkeproduksjonen.
De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for CYMBALTA og eventuelle skadelige effekter på det ammede barnet fra CYMBALTA eller fra den underliggende mors tilstand.
Kliniske betraktninger
Spedbarn som eksponeres for CYMBALTA bør overvåkes for sedasjon, dårlig fôring og dårlig vektøkning.
Data
Disponering av CYMBALTA 60 mg ble studert hos 6 ammende kvinner som var minst 12 uker etter fødselen og som hadde valgt å avvenne sine spedbarn. Kvinnene fikk 40 mg CYMBALTA 60 mg to ganger daglig i 3,5 dager. Maksimal konsentrasjon målt i morsmelk skjedde med en median på 3 timer etter dosen. Mengden av CYMBALTA i morsmelk var ca. 7 mikrogram/dag under den dosen; den estimerte daglige spedbarnsdosen var ca. 2 mikrogram/kg/dag, som er mindre enn 1 % av mors dose. Tilstedeværelsen av CYMBALTA 40 mg metabolitter i morsmelk ble ikke undersøkt.
Pediatrisk bruk
Sikkerheten og effektiviteten til CYMBALTA 60 mg er etablert for behandling av generalisert angstlidelse (GAD) hos pasienter i alderen 7 til 17 år og for behandling av juvenilt fibromyalgisyndrom hos pasienter i alderen 13 til 17 år. Sikkerheten og effekten av CYMBALTA 20 mg er ikke fastslått hos pediatriske pasienter med alvorlig depressiv lidelse (MDD), diabetisk perifer nevropatisk smerte eller kronisk muskel- og skjelettsmerter.
Antidepressiva økte risikoen for selvmordstanker og selvmordsatferd hos pediatriske pasienter. Overvåk alle pediatriske pasienter som behandles med antidepressiva for klinisk forverring og fremvekst av selvmordstanker og -adferd, spesielt i løpet av de første månedene av behandlingen, eller ved doseendringer [se ADVARSLER OG FORHOLDSREGLER ]. Utfør regelmessig overvåking av vekt og vekst hos pediatriske pasienter behandlet med CYMBALTA [se BIVIRKNINGER ].
Generalisert angstlidelse
Bruk av CYMBALTA til behandling av GAD hos pasienter i alderen 7 til 17 år støttes av en 10-ukers, placebokontrollert studie (GAD-6). Studien inkluderte 272 pediatriske pasienter med GAD, hvorav 47 % var 7 til 11 år (53 % var 12 til 17 år). CYMBALTA viste overlegenhet over placebo målt ved større forbedring i Pediatric Anxiety Rating Scale (PARS) for GAD-score [se Kliniske studier ].
Sikkerheten og effektiviteten til CYMBALTA 20 mg for behandling av GAD hos pediatriske pasienter under 7 år er ikke fastslått.
Fibromyalgi
Bruk av CYMBALTA til behandling av fibromyalgi hos pasienter i alderen 13 til 17 år støttes av en 13-ukers placebokontrollert studie med 184 pasienter med juvenilt fibromyalgisyndrom (Studie FM-4). CYMBALTA viste forbedring i forhold til placebo på det primære endepunktet, endring fra baseline til behandlingsslutt på Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24-timers gjennomsnittlig smerte alvorlighetsgrad [se Kliniske studier ].
Sikkerheten og effektiviteten til CYMBALTA for behandling av fibromyalgi hos pasienter under 13 år er ikke fastslått.
Major depressiv lidelse
Sikkerheten og effektiviteten til CYMBALTA er ikke fastslått hos pediatriske pasienter for behandling av MDD.
Effekten av CYMBALTA ble ikke vist i to 10-ukers, placebokontrollerte studier med 800 pediatriske pasienter i alderen 7 til 17 år med MDD (MDD-6 og MDD-7). Verken CYMBALTA eller en aktiv kontroll (godkjent for behandling av pediatrisk MDD) var overlegen placebo.
De hyppigst observerte bivirkningene i MDD pediatriske kliniske studier inkluderte kvalme, hodepine, redusert vekt og magesmerter. Redusert appetitt og vekttap har blitt observert i forbindelse med bruk av SSRI og SNRI.
Toksikologiske data for ungdomsdyr
Administrering av duloksetin til unge rotter fra post-natal dag 21 (avvenning) til post-natal dag 90 (voksen) resulterte i reduserte kroppsvekter som vedvarte inn i voksen alder, men kom seg når medikamentell behandling ble avbrutt; litt forsinket (~1,5 dager) kjønnsmodning hos kvinner, uten noen effekt på fruktbarheten; og en forsinkelse i å lære en kompleks oppgave i voksen alder, som ikke ble observert etter at medikamentell behandling ble avsluttet. Disse effektene ble observert ved høy dose på 45 mg/kg/dag (2 ganger MRHD, for et barn); nivået uten effekt var 20 mg/kg/dag (≈1 ganger MRHD, for et barn).
Geriatrisk bruk
Geriatrisk eksponering i kliniske studier før markedsføring av CYMBALTA
- . Av de 2 418 pasientene i MDD-studier var 6 % (143) 65 år eller eldre. . Av de 1041 pasientene i CLBP-studier var 21 % (221) 65 år eller eldre. . Av de 487 pasientene i OA-studier var 41 % (197) 65 år eller eldre. . Av de 1 074 pasientene i DPNP-studiene var 33 % (357) 65 år eller eldre. . Av de 1 761 pasientene i FM-studier var 8 % (140) 65 år eller eldre.
I MDD-, GAD-, DPNP-, FM-, OA- og CLBP-studiene ble ingen generelle forskjeller i sikkerhet eller effektivitet observert mellom disse pasientene og yngre voksne pasienter, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom disse geriatriske og yngre pasientene. voksne pasienter, men større sensitivitet hos enkelte eldre pasienter kan ikke utelukkes.
SSRI og SNRI, inkludert CYMBALTA har vært assosiert med klinisk signifikant hyponatremi hos geriatriske pasienter, som kan ha større risiko for denne bivirkningen [se ADVARSLER OG FORHOLDSREGLER ].
en analyse av data fra alle placebokontrollerte studier rapporterte CYMBALTA-behandlede pasienter en høyere fallrate sammenlignet med placebo-behandlede pasienter. Den økte risikoen ser ut til å være proporsjonal med en pasients underliggende risiko for fall. Underliggende risiko ser ut til å øke jevnt med alderen. Siden geriatriske pasienter har en tendens til å ha en høyere forekomst av risikofaktorer for fall som medisiner, medisinske komorbiditeter og gangforstyrrelser, er virkningen av økende alder i seg selv på fall under behandling med CYMBALTA 30 mg uklar. Fall med alvorlige konsekvenser inkludert beinbrudd og sykehusinnleggelser er rapportert ved bruk av CYMBALTA [se ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGER ].
Farmakokinetikken til duloksetin etter en enkeltdose på 40 mg ble sammenlignet hos friske eldre kvinner (65 til 77 år) og friske middelaldrende kvinner (32 til 50 år). Det var ingen forskjell i Cmax, men AUC for duloksetin var noe (ca. 25 %) høyere og halveringstiden ca. 4 timer lengre hos eldre kvinner. Populasjonsfarmakokinetiske analyser tyder på at de typiske verdiene for clearance reduseres med omtrent 1 % for hvert aldersår mellom 25 og 75 år; men alder som en prediktiv faktor står bare for en liten prosentandel av variasjonen mellom pasienter. Dosejustering basert på den voksne pasientens alder er ikke nødvendig.
Kjønn
Duloksetins halveringstid er lik hos menn og kvinner. Dosejustering basert på kjønn er ikke nødvendig.
Røykestatus
Duloksetin biotilgjengelighet (AUC) ser ut til å være redusert med omtrent en tredjedel hos røykere. Doseendringer anbefales ikke for røykere.
Løp
Ingen spesifikk farmakokinetisk studie ble utført for å undersøke effekten av rase.
Nedsatt leverfunksjon
Pasienter med klinisk tydelig nedsatt leverfunksjon har redusert duloksetinmetabolisme og eliminering. Etter en enkeltdose på 20 mg CYMBALTA 20 mg hadde 6 cirrhotiske pasienter med moderat nedsatt leverfunksjon (Child-Pugh klasse B) en gjennomsnittlig plasma-duloksetinclearance på omtrent 15 % av den for alders- og kjønnstilpassede friske forsøkspersoner, med en 5-dobling i gjennomsnittlig eksponering (AUC). Selv om Cmax var lik normalen hos cirrhotiske pasienter, var halveringstiden omtrent 3 ganger lengre [se DOSERING OG ADMINISTRASJON og ADVARSLER OG FORHOLDSREGLER ].
Alvorlig nedsatt nyrefunksjon
Begrensede data er tilgjengelige om effekten av CYMBALTA 40 mg hos pasienter med nyresykdom i sluttstadiet (ESRD). Etter en enkeltdose på 60 mg CYMBALTA 20 mg, var Cmax- og AUC-verdiene omtrent 100 % høyere hos pasienter med ESRD som fikk kronisk intermitterende hemodialyse enn hos personer med normal nyrefunksjon. Eliminasjonshalveringstiden var imidlertid lik i begge gruppene. AUC-ene for de viktigste sirkulerende metabolittene, 4-hydroksyduloksetinglukuronid og 5-hydroksy,6metoksyduloksetinsulfat, hovedsakelig utskilt i urin, var omtrent 7 til 9 ganger høyere og forventes å øke ytterligere ved gjentatt dosering. Populasjons-PK-analyser tyder på at milde til moderate grader av nedsatt nyrefunksjon (estimert CrCl 30-80 ml/min) ikke har noen signifikant effekt på duloksetins tilsynelatende clearance [se DOSERING OG ADMINISTRASJON og ADVARSLER OG FORHOLDSREGLER ].
OVERDOSE
Tegn og symptomer
Etter markedsføring er det rapportert dødelige utfall for akutte CYMBALTA 60 mg overdoser, primært med blandede overdoser, men også med CYMBALTA 20 mg kun, inkludert 1000 mg CYMBALTA (omtrent 8,3 ganger den maksimale anbefalte dosen). Tegn og symptomer på overdose (CYMBALTA alene eller med blandede legemidler) inkluderte søvnighet, koma, serotonergt syndrom, anfall, synkope, takykardi, hypotensjon, hypertensjon og oppkast.
Håndtering av overdose
Det finnes ingen spesifikk motgift mot en CYMBALTA 60 mg overdosering, men hvis serotonergt syndrom oppstår, kan spesifikk behandling (som med cyproheptadin og/eller temperaturkontroll) vurderes.
Ved akutt overdose med CYMBALTA 30 mg, bør behandlingen bestå av de generelle tiltakene som brukes i håndteringen av overdosering med et hvilket som helst medikament, slik som å sikre tilstrekkelige luftveier, oksygenering og ventilasjon og overvåking av hjerterytme og vitale tegn. Mageskylling med en orogastrisk sonde med stor boring med passende luftveisbeskyttelse, om nødvendig, kan være indisert dersom det utføres kort tid etter inntak eller hos symptomatiske pasienter. Induksjon av brekninger anbefales ikke.
Aktivt kull kan være nyttig for å begrense absorpsjonen av duloksetin fra mage-tarmkanalen. Administrering av aktivt kull har vist seg å redusere AUC og Cmax for duloksetin med gjennomsnittlig en tredjedel, selv om noen pasienter hadde begrenset effekt av aktivt kull. På grunn av det store distribusjonsvolumet av duloksetin er det usannsynlig at tvungen diurese, dialyse, hemoperfusjon og utvekslingstransfusjon vil være fordelaktig.
Ved håndtering av overdose bør muligheten for flere legemiddelinvolvering vurderes. En spesiell forsiktighet involverer pasienter som overdoserer med CYMBALTA 60 mg og trisykliske antidepressiva. I et slikt tilfelle kan redusert clearance av den opprinnelige trisykliske og/eller dens aktive metabolitt øke muligheten for klinisk signifikante følgetilstander og forlenge tiden som trengs for nøye medisinsk observasjon [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ].
Vurder å kontakte et giftkontrollsenter (1-800-222-1222 eller www.poison.org) for ytterligere informasjon om behandling av overdosering.
KONTRAINDIKASJONER
Bruk av MAO-hemmere beregnet på å behandle psykiatriske lidelser med CYMBALTA 40 mg eller innen 5 dager etter avsluttet behandling med CYMBALTA er kontraindisert på grunn av økt risiko for serotonergt syndrom. Bruk av CYMBALTA innen 14 dager etter seponering av en MAO-hemmer beregnet på å behandle psykiatriske lidelser er kontraindisert [se DOSERING OG ADMINISTRASJON og ADVARSLER OG FORHOLDSREGLER ].
Å starte CYMBALTA 30 mg hos en pasient som behandles med MAO-hemmere som linezolid eller intravenøs metylenblått er også kontraindisert på grunn av økt risiko for serotonergt syndrom [se DOSERING OG ADMINISTRASJON og ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Selv om de eksakte mekanismene til antidepressiva, sentrale smertehemmende og anxiolytiske virkninger av duloksetin hos mennesker er ukjente, antas disse virkningene å være relatert til dets potensering av serotonerg og noradrenerg aktivitet i CNS.
Farmakodynamikk
Prekliniske studier har vist at duloksetin er en potent hemmer av nevronalt serotonin- og noradrenalin-reopptak og en mindre potent hemmer av dopamin-reopptak. Duloksetin har ingen signifikant affinitet for dopaminerge, adrenerge, kolinerge, histaminerge, opioid-, glutamat- og GABA-reseptorer in vitro. Duloksetin hemmer ikke monoaminoksidase (MAO).
CYMBALTA er i en klasse legemidler som er kjent for å påvirke urethral motstand [se ADVARSLER OG FORHOLDSREGLER ].
Hjerteelektrofysiologi
Effekten av CYMBALTA 160 mg og 200 mg administrert to ganger daglig (henholdsvis 2,7 og 3,3 ganger maksimal anbefalt dose) til steady state ble evaluert i en randomisert, dobbeltblindet, toveis crossover-studie med 117 friske kvinnelige voksne personer. Ingen QT-intervallforlengelse ble oppdaget. CYMBALTA 40 mg ser ut til å være assosiert med konsentrasjonsavhengig, men ikke klinisk meningsfull QT-forkorting.
Farmakokinetikk
Duloksetin har en eliminasjonshalveringstid på ca. 12 timer (fra 8 til 17 timer) og dets farmakokinetikk er doseproporsjonal over det terapeutiske området. Steady-state plasmakonsentrasjoner oppnås vanligvis etter 3 dagers dosering. Eliminering av duloksetin skjer hovedsakelig gjennom levermetabolisme som involverer to P450-isozymer, CYP1A2 og CYP2D6.
Absorpsjon
Etter oral administrering av CYMBALTA 30 mg absorberes duloksetinhydroklorid godt. Det er en median forsinkelse på 2 timer til absorpsjon starter (Tlag), med maksimal plasmakonsentrasjon (Cmax) av duloksetin inntil 6 timer etter dose. Det er en 3 timers forsinkelse i absorpsjonen og en tredjedel økning i tilsynelatende clearance av duloksetin etter en kveldsdose sammenlignet med en morgendose.
Effekt av mat
Mat påvirker ikke Cmax for duloksetin, men forsinker tiden for å nå toppkonsentrasjon fra 6 til 10 timer og reduserer absorpsjonsgraden (AUC) marginalt med ca. 10 %.
Fordeling
Det tilsynelatende distribusjonsvolumet er i gjennomsnitt ca. 1640 l. Duloksetin er sterkt bundet (>90 %) til proteiner i humant plasma, og binder seg primært til albumin og α1-syreglykoprotein. Interaksjonen mellom duloksetin og andre sterkt proteinbundne legemidler har ikke blitt fullstendig evaluert. Plasmaproteinbinding av duloksetin påvirkes ikke av nedsatt nyre- eller leverfunksjon.
Eliminering
Metabolisme
Biotransformasjon og disponering av duloksetin hos mennesker er bestemt etter oral administrering av 14C-merket duloksetin. Duloksetin utgjør omtrent 3 % av det totale radiomerket materiale i plasma, noe som indikerer at det gjennomgår omfattende metabolisme til en rekke metabolitter. De viktigste biotransformasjonsveiene for duloksetin involverer oksidasjon av naftylringen etterfulgt av konjugering og ytterligere oksidasjon. Både CYP1A2 og CYP2D6 katalyserer oksidasjonen av naftylringen in vitro. Metabolitter funnet i plasma inkluderer 4-hydroksyduloksetinglukuronid og 5hydroksy,6-metoksyduloksetinsulfat.
Utskillelse
Mange ekstra metabolitter er identifisert i urin, noen representerer bare mindre eliminasjonsveier. Kun spor (
Spesifikke populasjoner
Pediatriske pasienter
Duloksetin steady-state plasmakonsentrasjon var sammenlignbar hos pediatriske pasienter i alderen 7 til 17 år og voksne pasienter. Gjennomsnittlig steady-state duloksetinkonsentrasjon var omtrent 30 % lavere i denne pediatriske populasjonen sammenlignet med voksne pasienter. De modellforutsagte steady state-plasmakonsentrasjonene av duloksetin hos pediatriske pasienter i alderen 7 til 17 år var for det meste innenfor konsentrasjonsområdet som ble observert hos voksne pasienter og overskred ikke konsentrasjonsområdet hos voksne.
Kliniske studier
Oversikt over de kliniske forsøkene
Effekten av CYMBALTA 60 mg er fastslått i følgende populasjoner i tilstrekkelige og godt kontrollerte studier:
Major depressiv lidelse (MDD)
4 korttidsstudier (studier MDD-1, MDD-2, MDD-3 og MDD-4) og 1 vedlikeholdsstudie (studie MDD-5) hos voksne [se Major depressiv lidelse hos voksne ].
Generalisert angstlidelse (GAD)
3 korttidsstudier på voksne (studier GAD-1, GAD-2 og GAD-3), 1 vedlikeholdsstudie på voksne (studie GAD-4), 1 korttidsstudie på geriatriske pasienter (studie GAD-5), og 1 korttidsstudie med pediatriske pasienter i alderen 7 til 17 år (Studie GAD-6) [se Generalisert angstlidelse ].
Diabetisk perifer nevropatisk smerte (DPNP)
To 12-ukers forsøk på voksne (studier DPNP-1 og DPNP-2) [se Diabetisk perifer nevropatisk smerte hos voksne ].
Fibromyalgi (FM)
To studier med voksne (en av 3 måneders varighet og en av 6 måneders varighet) (studiene FM-1 og FM-2) og en 13-ukers studie på pediatriske pasienter i alderen 13 til 17 år (studie FM-4) [se Fibromyalgi ].
Kroniske muskel- og skjelettsmerter
To 12- til 13-ukers studier på voksne pasienter med kroniske korsryggsmerter (CLBP) (studier CLBP-1 og CLBP-3) og en 13-ukers studie på voksne pasienter med kroniske smerter på grunn av slitasjegikt (OA) (studie OA) -1) [se Kroniske muskel- og skjelettsmerter hos voksne ].
I tillegg er et sammendrag av følgende studier som ikke viste effekt presentert nedenfor: Studie FM-3 (en 16 ukers studie på voksne pasienter med fibromyalgi), studie CLBP-2 (en 13-ukers studie med voksne pasienter med CLBP), og Studie OA-2 (en 13-ukers studie hos voksne pasienter med kroniske smerter på grunn av OA).
Major depressiv lidelse hos voksne
Effekten av CYMBALTA som behandling for MDD hos voksne ble fastslått i 4 randomiserte, dobbeltblindede, placebokontrollerte studier med faste doser hos voksne polikliniske pasienter (18 til 83 år) som oppfyller DSM-IV-kriteriene for MDD:
- . studiene MDD-1 og MDD-2 ble pasientene randomisert til CYMBALTA 60 mg én gang daglig (henholdsvis N=123 og N=128) eller placebo (henholdsvis N=122 og N=139) i 9 uker . I studie MDD-3 ble pasienter randomisert til CYMBALTA 20 eller 40 mg to ganger daglig (henholdsvis N=86 og N=91) eller placebo (N=89) i 8 uker . I studie MDD-4 ble pasientene randomisert til CYMBALTA 40 eller 60 mg to ganger daglig (henholdsvis N=95 og N=93) eller placebo (N=93) i 8 uker.
I alle fire studiene viste CYMBALTA 40 mg overlegenhet over placebo målt ved forbedring i Hamilton Depression Rating Scale (HAMD-17) med 17 elementer (se ). Det er ingen bevis for at doser større enn 60 mg/dag gir ytterligere fordeler.
I alle disse kliniske studiene antydet ikke analyser av sammenhengen mellom behandlingsresultat og alder, kjønn og rase noen forskjellig respons på grunnlag av disse pasientkarakteristikkene.
Studie MDD-1 CYMBALTA (60 mg/dag)b Placebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
I studie MDD-5 fikk 533 voksne pasienter som oppfyller DSM-IV-kriteriene for MDD CYMBALTA 60 mg én gang daglig i løpet av en innledende 12-ukers åpen behandlingsfase. To hundre og syttiåtte pasienter som responderte på åpen behandling [definert som å oppfylle følgende kriterier ved uke 10 og 12: en HAMD-17 totalscore ≤9, Clinical Global Impressions of Severity (CGI-S) ≤2, og ikke som oppfyller DSM-IV-kriteriene for MDD] ble tilfeldig tildelt fortsettelse av CYMBALTA ved samme dosering (N=136) eller til placebo (N=142) i 6 måneder.
I studie MDD-5 opplevde pasienter på CYMBALTA en statistisk signifikant lengre tid til tilbakefall av depresjon enn pasienter på placebo (se Figur 1 ). Tilbakefall ble definert som en økning i CGI-S-skåren på ≥2 poeng sammenlignet med den oppnådd ved uke 12, samt oppfyllelse av DSM-IV-kriteriene for MDD ved 2 påfølgende besøk med minst 2 ukers mellomrom, der 2-ukers det tidsmessige kriteriet måtte være oppfylt ved bare det andre besøket.
Figur 1: Kumulativ proporsjon av voksne pasienter med MDD-tilbakefall (studie MDD-5)
Generalisert angstlidelse
GAD-forsøk hos voksne (inkludert geriatriske pasienter)
Effekten av CYMBALTA 20 mg i behandlingen av generalisert angstlidelse (GAD) ble fastslått i 1 fastdose randomisert, dobbeltblindet, placebokontrollert studie og 2 fleksible dose randomiserte, dobbeltblinde, placebokontrollerte studier hos voksne polikliniske pasienter mellom 18 og 83 år som oppfyller DSM-IV-kriteriene for GAD (studier henholdsvis GAD-1, GAD-2 og GAD-3).
studiene GAD-1 og GAD-2 var startdosen 60 mg én gang daglig (nedtitrering til 30 mg én gang daglig var tillatt av toleransegrunner; dosen kunne økes til 60 mg én gang daglig). Femten prosent av pasientene ble nedtitrert. Studie GAD-3 hadde en startdose på 30 mg én gang daglig i 1 uke før den økte til 60 mg én gang daglig.
Studiene GAD-2 og GAD-3 involverte dosetitrering med CYMBALTA-doser fra 60 mg én gang daglig til 120 mg én gang daglig (N=168 og N=162) sammenlignet med placebo (N=159 og N=161) over en 10- ukes behandlingsperiode. Gjennomsnittlig dose for fullfører ved endepunktet i disse studiene var 104,8 mg/dag. Studie GAD-1 evaluerte CYMBALTA 60 mg doser på 60 mg én gang daglig (N=168) og 120 mg én gang daglig (N=170) sammenlignet med placebo (N=175) over en 9-ukers behandlingsperiode. Mens en dose på 120 mg/dag ble vist å være effektiv, er det ingen bevis for at doser større enn 60 mg/dag gir ekstra fordel.
alle 3 studiene viste CYMBALTA overlegenhet over placebo målt ved større forbedring i Hamilton Anxiety Scale (HAM-A) totalskåre (se ) og ved Sheehan Disability Scale (SDS) globale funksjonshemmingsscore. SDS er en sammensatt måling av i hvilken grad emosjonelle symptomer forstyrrer pasientens funksjon i 3 livsdomener: arbeid/skole, sosialt liv/fritidsaktiviteter og familieliv/hjemansvar.
studie GAD-4 fikk 887 pasienter som oppfyller DSM-IV-TR-kriteriene for GAD CYMBALTA 60 mg til 120 mg én gang daglig i løpet av en innledende 26-ukers åpen behandlingsfase. Fire hundre og tjueni pasienter som responderte på åpen behandling [definert som å oppfylle følgende kriterier i uke 24 og 26: en reduksjon fra baseline HAM-A totalskåre med minst 50 % til en skåre ikke høyere enn 11, og en Clinical Global Impressions of Improvement (CGI-Improvement)-score på 1 eller 2] ble tilfeldig tildelt fortsettelse av CYMBALTA 30 mg ved samme dosering (N=216) eller til placebo (N=213) og ble observert for tilbakefall. Av de randomiserte pasientene hadde 73 % vært i responderstatus i minst 10 uker. Tilbakefall ble definert som en økning i CGI-alvorlighetsscore på minst 2 poeng til en skåre ≥4 og en MINI (Mini-International Neuropsychiatric Interview) diagnose av GAD (ekskludert varighet), eller seponering på grunn av manglende effekt. Pasienter som tok CYMBALTA opplevde en statistisk signifikant lengre tid til tilbakefall av GAD enn pasienter som tok placebo (se Figur 2 ).
Undergruppeanalyser indikerte ikke at det var noen forskjeller i behandlingsresultater som funksjon av alder eller kjønn.
GAD-forsøk hos geriatriske pasienter
Effekten av CYMBALTA ved behandling av pasienter ≥65 år med GAD ble fastslått i en 10-ukers fleksibel dose, randomisert, dobbeltblind, placebokontrollert studie hos voksne ≥65 år som oppfyller DSM-IV-kriteriene for GAD (Studie GAD-5). I studie GAD-5 var startdosen 30 mg én gang daglig i 2 uker før ytterligere doseøkninger i trinn på 30 mg ved behandlingsuke 2, 4 og 7 opp til 120 mg én gang daglig ble tillatt basert på utforskerens vurdering av klinisk respons og toleranse. Gjennomsnittlig dosering for pasienter som fullførte den 10-ukers akutte behandlingsfasen var 51 mg. Pasienter behandlet med CYMBALTA (N=151) viste signifikant større forbedring sammenlignet med placebo (N=140) på gjennomsnittlig endring fra baseline til endepunkt målt ved HAM-A totalskåre (se ).
GAD-forsøk hos pediatriske pasienter 7 til 17 år gamle
Effekten av CYMBALTA ved behandling av pediatriske pasienter i alderen 7 til 17 år med GAD ble fastslått i 1 fleksible dose randomisert, dobbeltblind, placebokontrollert studie hos pediatriske polikliniske pasienter med GAD (basert på DSM-IV kriterier) (Studie) GAD-6).
I studie GAD-6 var startdosen 30 mg én gang daglig i 2 uker. Ytterligere doseøkninger i trinn på 30 mg opp til 120 mg én gang daglig ble tillatt basert på utforskerens vurdering av klinisk respons og tolerabilitet. Gjennomsnittlig dosering for pasienter som fullførte den 10-ukers behandlingsfasen var 57,6 mg/dag. I denne studien viste CYMBALTA (N=135) overlegenhet over placebo (N=137) fra baseline til endepunkt målt ved større forbedring i Pediatric Anxiety Rating Scale (PARS) for GAD-alvorlighetsscore (se ).
Figur 2: Kumulativ proporsjon av voksne pasienter med GAD-tilbakefall (studie GAD-4)
Diabetisk perifer nevropatisk smerte hos voksne
Effekten av CYMBALTA 30 mg for behandling av nevropatisk smerte assosiert med diabetisk perifer nevropati hos voksne ble fastslått i 2 randomiserte, 12 ukers, dobbeltblinde, placebokontrollerte, fastdosestudier hos voksne pasienter med diabetisk perifer nevropatisk smerte (DPNP) ) i minst 6 måneder (studie DPNP-1 og studie DPNP-2). Disse studiene inkluderte totalt 791 pasienter, hvorav 592 (75 %) fullførte studiene. Pasienter som ble registrert hadde type I eller II diabetes mellitus med diagnosen smertefull distal symmetrisk sensorimotorisk polynevropati i minst 6 måneder. Pasientene hadde en baseline smertescore på ≥4 på en 11-punkts skala fra 0 (ingen smerte) til 10 (verst mulig smerte). Pasientene ble tillatt opptil 4 gram paracetamol per dag etter behov for smerte, i tillegg til CYMBALTA. Pasientene registrerte smertene sine daglig i en dagbok.
Begge studiene sammenlignet CYMBALTA 60 mg én gang daglig eller 60 mg to ganger daglig med placebo. Studien DPNP-1 sammenlignet i tillegg CYMBALTA 20 mg med placebo. Totalt 457 pasienter (342 CYMBALTA, 115 placebo) ble inkludert i studie DPNP-1 og totalt 334 pasienter (226 CYMBALTA, 108 placebo) ble inkludert i studie DPNP-2.
Behandling med CYMBALTA 60 mg en eller to ganger daglig forbedret statistisk signifikant endepunkts gjennomsnittlige smerteskåre fra baseline og økte andelen pasienter med minst 50 % reduksjon i smertescore fra baseline. For ulike grader av bedring i smerte fra baseline til studieendepunkt, viser figur 3 og 4 andelen pasienter som oppnår den grad av forbedring i henholdsvis studiene DPNP-1 og DPNP-2. Tallene er kumulative, slik at pasienter hvis endring fra baseline er for eksempel 50 %, også inkluderes ved hvert forbedringsnivå under 50 %. Pasienter som ikke fullførte studien ble tildelt 0 % forbedring. Noen pasienter opplevde en reduksjon i smerte allerede i uke 1, som vedvarte gjennom hele forsøket.
Figur 3: Prosentandel av DPNP voksne pasienter som oppnår ulike nivåer av smertelindring målt etter 24-timers gjennomsnittlig smertealvorlighet (studie DPNP-1)
Figur 4: Prosentandel av DPNP voksne pasienter som oppnår ulike nivåer av smertelindring målt etter 24-timers gjennomsnittlig smertealvorlighet (studie DPNP-2)
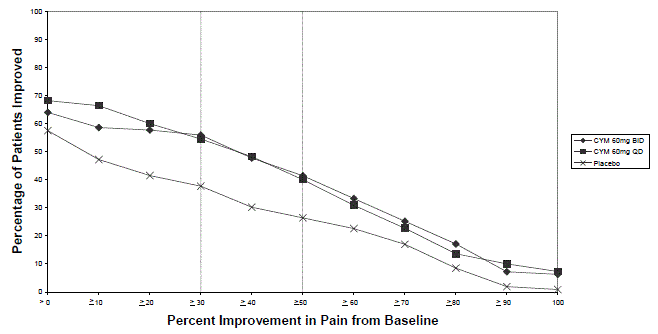
Fibromyalgi
Voksenforsøk i fibromyalgi
Effekten av CYMBALTA for behandling av fibromyalgi hos voksne ble fastslått i to randomiserte, dobbeltblindede, placebokontrollerte studier med faste doser hos voksne pasienter som oppfyller American College of Rheumatology-kriteriene for fibromyalgi (en historie med utbredt smerte i 3 måneder) , og smerte tilstede på 11 eller flere av de 18 spesifikke ømme punktstedene). Studie FM-1 varte i tre måneder og inkluderte kun kvinnelige pasienter. Studie FM-2 varte i seks måneder og inkluderte mannlige og kvinnelige pasienter. Omtrent 25 % av deltakerne hadde en komorbid diagnose MDD. Studiene FM1 og FM-2 inkluderte totalt 874 pasienter, hvorav 541 (62%) fullførte studiene. Totalt 354 pasienter (234 CYMBALTA 40 mg, 120 placebo) ble inkludert i studie FM-1 og totalt 520 pasienter (376 CYMBALTA, 144 placebo) ble inkludert i studie FM-2 (5 % menn, 95 % kvinner). Pasientene hadde en baseline smertescore på 6,5 på en 11-punkts skala fra 0 (ingen smerte) til 10 (verre mulig smerte).
Studiene FM-1 og FM-2 sammenlignet CYMBALTA 60 mg én gang daglig eller 120 mg daglig (gitt i delte doser i studie FM-1 og som en enkelt daglig dose i studie FM-2) med placebo. Studie FM-2 sammenlignet i tillegg CYMBALTA 20 mg med placebo i løpet av de første tre månedene av en seks måneder lang studie.
Behandling med CYMBALTA 60 mg eller 120 mg daglig forbedret statistisk signifikant endepunkts gjennomsnittlige smerteskåre fra baseline og økte andelen pasienter med minst 50 % reduksjon i smertescore fra baseline. Smertereduksjon ble observert hos pasienter både med og uten komorbid MDD. Graden av smertereduksjon kan imidlertid være større hos pasienter med komorbid MDD. For ulike grader av bedring i smerte fra baseline til studieendepunkt, viser figur 5 og 6 andelen pasienter som oppnår den grad av forbedring i henholdsvis studiene FM-1 og FM-2. Tallene er kumulative slik at pasienter hvis endring fra baseline er for eksempel 50 %, også inkluderes ved hvert forbedringsnivå under 50 %. Pasienter som ikke fullførte studien ble tildelt 0 % forbedring. Noen pasienter opplevde en reduksjon i smerte allerede i uke 1, som vedvarte gjennom hele forsøket. Forbedring ble også demonstrert på mål på funksjon (Fibromyalgia Impact Questionnaires) og pasientens globale inntrykk av endring (PGI). Ingen av studiene viste en fordel på 120 mg sammenlignet med 60 mg, og en høyere dose var assosiert med flere bivirkninger og for tidlig seponering av behandlingen.
Figur 5: Prosentandel av voksne fibromyalgipasienter som oppnår ulike nivåer av smertelindring ved studiens endepunkt målt etter 24-timers gjennomsnittlig smertealvorlighet (studie FM-1)

Figur 6: Prosentandel av voksne fibromyalgipasienter som oppnår ulike nivåer av smertelindring ved studiens endepunkt målt etter 24-timers gjennomsnittlig smertealvorlighet (studie FM-2)
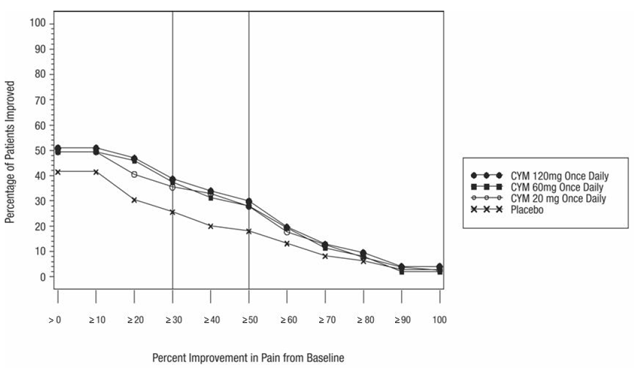
tillegg ble fordelen med opptitrering hos ikke-respondere på CYMBALTA ved 60 mg/dag evaluert i en separat studie (Studie FM-3). Voksne pasienter ble opprinnelig behandlet med CYMBALTA 60 mg én gang daglig i åtte uker på åpen måte. Deretter ble personer som fullførte denne fasen randomisert til dobbeltblind behandling med CYMBALTA med enten 60 mg én gang daglig eller 120 mg én gang daglig. Responders ble definert som pasienter som hadde minst 30 % reduksjon i smertescore fra baseline ved slutten av 8-ukers behandling. Pasienter som ikke responderte etter 8 uker var ikke mer sannsynlig å oppfylle responskriteriene ved slutten av 60 ukers behandling hvis de ble titrert til CYMBALTA 120 mg sammenlignet med de som ble blindt fortsatt på CYMBALTA 60 mg.
Pediatrisk prøve i fibromyalgi
CYMBALTA ble studert hos 184 pediatriske pasienter i alderen 13 til 17 år med juvenil fibromyalgisyndrom i en 13-ukers, placebokontrollert studie (Studie FM-4). I studie FM-4 fullførte 149 (81 %) pasienter studien. CYMBALTA (N=91) ble initiert med en dose på 30 mg én gang daglig i én uke og titrert til 60 mg én gang daglig i 12 uker, etter toleranse. Gjennomsnittlig dosering for pasienter som fullførte den 12-ukers behandlingsfasen var 49 mg/dag. CYMBALTA viste forbedring i forhold til placebo på det primære endepunktet [endring fra baseline til end-of-treatment på Brief Pain Inventory (BPI) – Modified Short Form: Adolescent Version 24-timers gjennomsnittlig smerte alvorlighetsgrad] med en p-verdi på 0,052 fra den forhåndsspesifiserte primæranalysen, og p-verdier som varierer fra 0,011-0,020 fra sensitivitetsanalyser som tilordnet baseline-verdier til manglende vurderinger av noen pasienter som ikke fullførte studien av ulike årsaker. Pasientene hadde en baseline BPI på 5,7. For ulike grader av bedring i smerte fra baseline til studieendepunkt, viser figur 7 andelen pasienter som oppnår den grad av forbedring i studie FM-4.
Figur 7: Andel av pediatriske pasienter i alderen 13 til 17 år med juvenilt fibromyalgisyndrom som oppnår ulike nivåer av smertelindring ved uke 12 (Studie FM-4)a
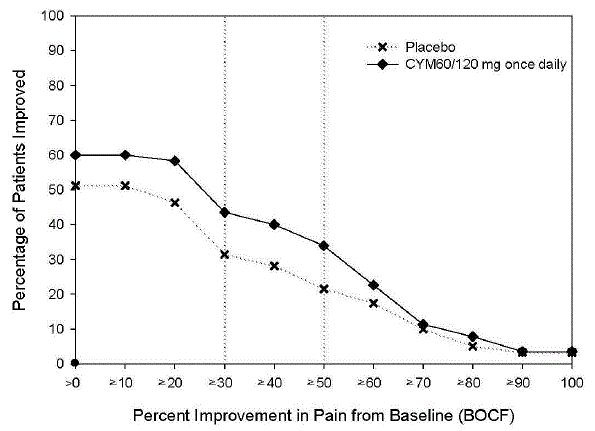
Kroniske muskel- og skjelettsmerter hos voksne
CYMBALTA er indisert for behandling av kroniske muskel- og skjelettsmerter hos voksne. Dette er etablert i studier hos voksne pasienter med kroniske korsryggsmerter og kroniske smerter på grunn av slitasjegikt.
Forsøk med kroniske korsryggsmerter hos voksne
Effekten av CYMBALTA 60 mg ved kroniske korsryggsmerter (CLBP) hos voksne ble vurdert i to dobbeltblindede, placebokontrollerte, randomiserte kliniske studier av 13 ukers varighet (studier CLBP-1 og CLBP-2), og en av 12 -ukers varighet (CLBP-3). Studiene CLBP-1 og CLBP-3 viste effekt av CYMBALTA i behandlingen av CLBP. Pasienter i alle studier hadde ingen tegn på radikulopati eller spinal stenose.
Studer CLBP-1
To hundre og trettiseks voksne pasienter (N=115 på CYMBALTA 40 mg, N=121 på placebo) ble registrert og 182 (77 %) fullførte en 13-ukers behandlingsfase. Etter 7 ukers behandling fikk CYMBALTA-behandlede pasienter med mindre enn 30 % reduksjon i gjennomsnittlig daglig smerte og som var i stand til å tolerere 60 mg én gang daglig, dobbel-blindet CYMBALTA-dosen økt til 120 mg én gang daglig. resten av rettssaken. Pasientene hadde en gjennomsnittlig baseline smertevurdering på 6 på en numerisk vurderingsskala fra 0 (ingen smerte) til 10 (verst mulig smerte). Etter 13 ukers behandling hadde pasienter som tok CYMBALTA 60-120 mg daglig en signifikant større smertereduksjon sammenlignet med pasienter som tok placebo. Randomisering ble stratifisert etter pasientenes baseline NSAID-bruksstatus. Undergruppeanalyser indikerte ikke at det var forskjeller i behandlingsresultater som en funksjon av bruk av NSAIDs.
Studer CLBP-2
Fire hundre og fire pasienter ble randomisert til å motta faste doser av CYMBALTA 60 mg daglig eller en matchende placebo (N=59 på CYMBALTA 20 mg, N=116 på CYMBALTA 60 mg, N=112 på CYMBALTA 120 mg, N=117 på placebo) og 267 (66 %) fullførte hele den 13 uker lange prøveperioden. Etter 13 ukers behandling viste ingen av de tre CYMBALTA 30 mg-dosene en statistisk signifikant forskjell i smertereduksjon sammenlignet med placebo.
Studer CLBP-3
Fire hundre og én pasienter ble randomisert til å motta faste doser av CYMBALTA 60 mg daglig eller placebo (N=198 på CYMBALTA 20 mg, N=203 på placebo), og 303 (76 %) fullførte studien. Pasientene hadde en gjennomsnittlig baseline smertevurdering på 6 på en numerisk vurderingsskala fra 0 (ingen smerte) til 10 (verst mulig smerte). Etter 12 ukers behandling hadde pasienter som tok CYMBALTA 60 mg daglig signifikant større smertereduksjon sammenlignet med pasienter som tok placebo.
For ulike grader av bedring i smerte fra baseline til studieendepunkt, viser figur 8 og 9 andelen pasienter i studiene CLBP-1 og CLBP-3 som oppnår den grad av bedring, henholdsvis. Tallene er kumulative, slik at pasienter hvis endring fra baseline er for eksempel 50 %, også inkluderes ved hvert forbedringsnivå under 50 %. Pasienter som ikke fullførte studien ble tildelt verdien på 0 % forbedring.
Figur 8: Prosentandel av voksne pasienter med CLBP som oppnår ulike nivåer av smertelindring målt etter 24-timers gjennomsnittlig smertealvorlighet (studie CLBP-1)
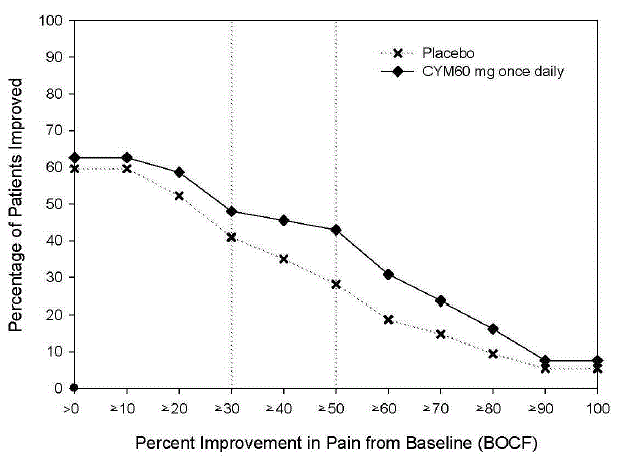
Figur 9: Prosentandel av voksne pasienter med CLBP som oppnår ulike nivåer av smertelindring målt etter 24-timers gjennomsnittlig smertealvorlighet (studie CLBP-3)
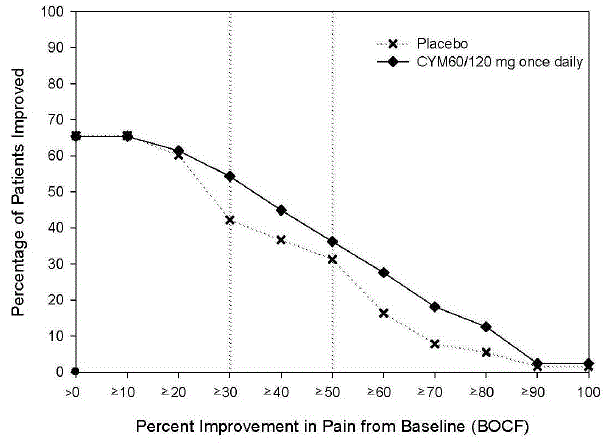
Forsøk med kroniske smerter på grunn av slitasjegikt hos voksne
Effekten av CYMBALTA ved kronisk smerte på grunn av slitasjegikt (OA) hos voksne ble vurdert i 2 dobbeltblindede, placebokontrollerte, randomiserte kliniske studier av 13 ukers varighet (studie OA-1 og studie OA-2). Alle pasientene i begge studiene oppfylte ACR kliniske og radiografiske kriteriene for klassifisering av idiopatisk OA i kneet. Randomisering ble stratifisert etter pasientenes baseline NSAID-bruksstatus.
Pasienter som ble tildelt CYMBALTA startet behandlingen i begge studiene med en dose på 30 mg én gang daglig i én uke. Etter den første uken ble dosen av CYMBALTA økt til 60 mg én gang daglig. Etter 7 ukers behandling med CYMBALTA 60 mg én gang daglig, i studie OA-1 fikk pasienter med suboptimal respons på behandling (
Studie OA-1
To hundre og femtiseks pasienter (N=128 på CYMBALTA 30 mg, N=128 på placebo) ble registrert og 204 (80 %) fullførte studien. Pasientene hadde en gjennomsnittlig baseline smertevurdering på 6 på en numerisk vurderingsskala fra 0 (ingen smerte) til 10 (verst mulig smerte). Etter 13 ukers behandling hadde pasienter som tok CYMBALTA 20 mg signifikant større smertereduksjon enn pasienter som tok placebo. Undergruppeanalyser indikerte ikke at det var forskjeller i behandlingsresultater som en funksjon av bruk av NSAIDs.
Studie OA-2
To hundre og trettien pasienter (N=111 på CYMBALTA 30 mg, N=120 på placebo) ble registrert og 173 (75 %) fullførte studien. Pasientene hadde en gjennomsnittlig baseline smerte på 6 på en numerisk vurderingsskala fra 0 (ingen smerte) til 10 (verst mulig smerte). Etter 13 ukers behandling viste ikke pasienter som tok CYMBALTA 20 mg en signifikant større smertereduksjon enn pasienter som tok placebo.
studie OA-1, for ulike grader av bedring i smerte fra baseline til studieendepunkt, viser figur 10 andelen av pasienter som oppnår den graden av bedring. Tallet er kumulativt, slik at pasienter hvis endring fra baseline er for eksempel 50 %, også inkluderes ved hvert forbedringsnivå under 50 %. Pasienter som ikke fullførte studien ble tildelt verdien på 0 % forbedring.
Figur 10: Prosentandel av voksne pasienter med OA som oppnår ulike nivåer av smertelindring målt etter 24-timers gjennomsnittlig smertealvorlighet (studie OA-1)
PASIENTINFORMASJON
Cymbalta® [sim-BALL-tah] (duloksetin kapsler med forsinket frigjøring)
Les denne medisinveiledningen før du begynner å ta Cymbalta® og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med helsepersonell om din medisinske tilstand eller behandling.
Snakk med helsepersonell om:
- . alle risikoer og fordeler ved behandling med antidepressiva . alle behandlingsvalg for depresjon eller annen alvorlig psykisk lidelse
Hva er den viktigste informasjonen jeg bør vite om antidepressiva, depresjon, andre alvorlige psykiske lidelser og selvmordstanker eller -handlinger?
. Cymbalta 40mg og andre antidepressiva kan øke selvmordstanker eller handlinger hos noen barn, tenåringer eller unge voksne i løpet av de første månedene av behandlingen eller når dosen endres. . Depresjon og andre alvorlige psykiske lidelser er de viktigste årsakene til selvmordstanker eller -handlinger. Noen mennesker kan ha en spesielt høy risiko for å ha selvmordstanker eller -handlinger. Disse inkluderer personer som har (eller har en familiehistorie av) bipolar sykdom (også kalt manisk-depressiv sykdom). . Hvordan kan jeg se etter og prøve å forhindre selvmordstanker og -handlinger?- . Vær nøye med endringer i humør, oppførsel, handlinger, tanker eller følelser, spesielt plutselige endringer. Dette er svært viktig når en antidepressiv medisin startes eller når dosen endres. . Ring helsepersonell med en gang for å rapportere nye eller plutselige endringer i humør, oppførsel, tanker eller følelser.
- . Hold alle oppfølgingsbesøk hos helsepersonell som planlagt. Ring helsepersonell mellom besøkene etter behov, spesielt hvis du er bekymret for symptomer.
Ring helsepersonell med en gang hvis du har noen av følgende symptomer eller følelser, spesielt hvis de er nye, verre eller bekymrer deg. I en nødssituasjon, ring 911.
- . forsøk på å begå selvmord . handler på farlige impulser . opptrer aggressivt, er sint eller voldelig . tanker om selvmord eller å dø . ny eller verre depresjon . ny eller verre angst . panikk anfall . føler meg veldig urolig eller rastløs . ny eller verre irritabilitet . problemer med å sove . en ekstrem økning i aktivitet eller prat (mani) . andre uvanlige endringer i atferd eller humør
Hva annet trenger jeg å vite om antidepressiva?
- . Slutt aldri en antidepressiv medisin uten først å snakke med en helsepersonell. Å stoppe en antidepressiv medisin plutselig kan forårsake andre symptomer. . Antidepressiva er medisiner som brukes til å behandle depresjon og andre sykdommer. Det er viktig å diskutere alle risikoene ved å behandle depresjon og også risikoen ved å ikke behandle den. Pasienter bør diskutere alle behandlingsvalg med helsepersonell, ikke bare bruken av antidepressiva. . Antidepressiva har andre bivirkninger. Snakk med helsepersonell om bivirkningene av medisinen som er foreskrevet for deg eller ditt familiemedlem. . Antidepressiva kan samhandle med andre medisiner. Kjenn til alle medisinene du eller ditt familiemedlem tar. Hold en liste over alle medisiner for å vise helsepersonell. Ikke start nye medisiner uten først å sjekke med helsepersonell.
Hva er Cymbalta 60mg?
Cymbalta er en reseptbelagt medisin som brukes til å behandle en bestemt type depresjon kalt Major Depressive Disorder (MDD). Cymbalta 20mg tilhører en klasse legemidler kjent som SNRI (orserotonin-noradrenalin reopptakshemmere).
Cymbalta 60mg brukes også til å behandle eller behandle:
- . Generalisert angstlidelse (GAD) . Diabetisk perifer nevropatisk smerte (DPNP) . Fibromyalgi (FM) . Kroniske muskel- og skjelettsmerter
Hvem bør ikke ta Cymbalta?
Ikke ta Cymbalta 20 mg hvis du:
- . ta en monoaminoksidasehemmer (MAOI). Spør helsepersonell eller apotek hvis du ikke er sikker på om du tar en MAO-hemmer, inkludert antibiotikum linezolid eller intravenøs metylenblått.
- . Ikke ta en MAO-hemmer innen 5 dager etter at du har stoppet Cymbalta med mindre du blir bedt om å gjøre det av helsepersonell. . Ikke start Cymbalta hvis du sluttet å ta en MAO-hemmer i løpet av de siste 14 dagene med mindre du har fått beskjed om det fra helsepersonell.
Personer som tar Cymbalta 60mg nær en MAO-hemmer kan ha et alvorlig problem som kalles serotoninsyndrom (se "Hva er de mulige bivirkningene av Cymbalta 60mg?").
Hva bør jeg fortelle helsepersonell før jeg tar Cymbalta?
Før du starter Cymbalta, fortell helsepersonell dersom du:
- . har hjerteproblemer eller høyt blodtrykk . har diabetes (Cymbalta 40 mg-behandling gjør det vanskeligere for noen personer med diabetes å kontrollere blodsukkeret) . har leverproblemer . har nyreproblemer . har glaukom . har eller hatt anfall eller kramper . har bipolar lidelse eller mani . har lave natriumnivåer i blodet . har forsinket magetømming . har eller hatt blødningsproblemer . er gravid eller planlegger å bli gravid. Cymbalta kan skade det ufødte barnet ditt. Snakk med helsepersonell om risikoen for det ufødte barnet ditt hvis du tar Cymbalta under graviditet.
- . Fortell helsepersonell med en gang hvis du blir gravid eller tror du er gravid under behandling med Cymbalta. . Hvis du blir gravid mens du tar Cymbalta 30mg, snakk med helsepersonell om registrering hos Cymbalta Pregnancy Registry. Du kan registrere deg ved å ringe 1-866-8146975 eller ved å besøke www.cymbalta 40mgpregnancyregistry.com. Formålet med dette registeret er å overvåke graviditetsutfall hos kvinner som har blitt behandlet med Cymbalta når som helst under graviditeten.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. Cymbalta og noen medisiner kan interagere med hverandre, fungerer kanskje ikke like bra eller kan forårsake alvorlige bivirkninger.
Fortell spesielt helsepersonell hvis du tar:
- . triptaner som brukes til å behandle migrenehodepine . legemidler som brukes til å behandle humør, angst, psykotiske eller tankeforstyrrelser, inkludert trisykliske, litium, buspiron, SSRI, SNRI eller MAO-hemmer . tramadol og fentanyl . amfetamin . cimetidin . antibiotika ciprofloksacin, enoksacin . medisin for å behandle uregelmessig hjertefrekvens (som propafenon, flekainid, kinidin) . teofyllin . det blodfortynnende warfarinet (Coumadin, Jantoven) . ikke-steroide antiinflammatoriske legemidler (NSAID) (som ibuprofen, naproxen eller aspirin). . reseptfrie kosttilskudd som tryptofan eller johannesurt . tioridazin (Mellaril). Mellaril sammen med Cymbalta kan forårsake alvorlige hjerterytmeproblemer eller plutselig død.
Spør helsepersonell om en liste over disse medisinene hvis du er usikker.
Ikke ta Cymbalta sammen med andre legemidler som inneholder duloksetin.
Hvordan skal jeg ta Cymbalta 60mg?
- . Ta Cymbalta nøyaktig slik helsepersonell ber deg ta det. Det kan hende at helsepersonell må endre dosen av Cymbalta 20 mg til den er riktig dose for deg. . Svelg Cymbalta hel. Ikke tygg eller knus Cymbalta. . Ikke åpne kapselen og dryss på mat eller bland med væske. Åpning av kapselen kan påvirke hvor godt Cymbalta virker. . Cymbalta kan tas med eller uten mat. . Hvis du glemmer en dose Cymbalta 30 mg, ta den glemte dosen så snart du husker det. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og ta neste dose til vanlig tid. Ikke ta to doser Cymbalta 30mg samtidig. . Hvis du tar for mye Cymbalta, ring helsepersonell eller giftkontrollsenter på 1800-222-1222 med en gang, eller få akuttbehandling. . Når du bytter fra et annet antidepressivum til Cymbalta, kan det hende at helsepersonell vil senke dosen av det initiale antidepressiva først for å potensielt unngå bivirkninger.
Hva bør jeg unngå mens jeg tar Cymbalta?
- . Cymbalta kan forårsake søvnighet eller kan påvirke din evne til å ta avgjørelser, tenke klart eller reagere raskt. Du bør ikke kjøre bil, bruke tunge maskiner eller gjøre andre farlige aktiviteter før du vet hvordan Cymbalta påvirker deg. . Bruk av Cymbalta samtidig med tungt alkoholinntak kan være assosiert med alvorlig leverskade. Unngå tung alkoholbruk mens du tar Cymbalta.
Hva er de mulige bivirkningene av Cymbalta?
Cymbalta 30mg kan forårsake alvorlige bivirkninger, inkludert: Se "Hva er den viktigste informasjonen jeg bør vite om Cymbalta?"
Vanlige mulige bivirkninger hos personer som tar Cymbalta 20mg inkluderer:
Symptomer hos menn kan omfatte:
Symptomer hos kvinner kan omfatte:
Snakk med helsepersonell hvis du utvikler endringer i din seksuelle funksjon eller hvis du har spørsmål eller bekymringer angående seksuelle problemer under behandling med CYMBALTA. Det kan være behandlinger som helsepersonell kan foreslå.
. leverskade. Symptomer kan omfatte:- . kløe . smerter i høyre øvre del av magen . mørk urin . gul hud eller øyne . forstørret lever . økte leverenzymer
- . øke blodtrykket. . redusere blodtrykket når du står og forårsake svimmelhet eller besvimelse, mest når du starter med Cymbalta eller når du øker dosen. . øke risikoen for fall, spesielt hos eldre.
- . agitasjon, hallusinasjoner, koma eller andre endringer i mental status . koordinasjonsproblemer eller muskelrykninger (overaktive reflekser) . løpende hjerterytme, høyt eller lavt blodtrykk . svette eller feber . kvalme, oppkast eller diaré . muskelstivhet . svimmelhet . rødming . skjelving . anfall
- . angst . irritabilitet . trøtthet eller problemer med å sove . hodepine . svette . svimmelhet . elektrisk støt-lignende opplevelser . oppkast eller kvalme . diaré
- . kraftig økt energi . alvorlige søvnproblemer . racing tanker . hensynsløs oppførsel . uvanlig store ideer . overdreven lykke eller irritabilitet . snakker mer eller raskere enn vanlig
Bare noen mennesker er i faresonen for disse problemene. Det kan være lurt å gjennomgå en øyeundersøkelse for å se om du er i faresonen og motta forebyggende behandling hvis du er det.
- . øyesmerter . endringer i synet . hevelse eller rødhet i eller rundt øyet
- . hodepine . svakhet eller ustabilitet . forvirring, problemer med å konsentrere seg eller tenke eller hukommelsesproblemer
- . økt urinstrøm . ikke klarer å tisse
- . forsinket utløsning eller manglende evne til å få utløsning . redusert sexlyst . problemer med å få eller beholde ereksjon
- . redusert sexlyst . forsinket orgasme eller manglende evne til å få orgasme
De vanligste bivirkningene av Cymbalta 20mg inkluderer:
- . kvalme . tørr i munnen . søvnighet . utmattelse . forstoppelse . tap av Appetit . økt svetting . svimmelhet
Vanlige mulige bivirkninger hos barn og ungdom som tar Cymbalta 20mg inkluderer:
- . kvalme . redusert vekt . svimmelhet
Bivirkninger hos voksne kan også forekomme hos barn og ungdom som tar Cymbalta. Barn og ungdom bør ha høyde og vekt overvåket under behandlingen.
Fortell helsepersonell dersom du har noen bivirkninger som plager deg eller som ikke forsvinner.
Dette er ikke alle mulige bivirkninger av Cymbalta. For mer informasjon, spør helsepersonell eller apotek.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til 1800-FDA-1088.
Hvordan bør jeg oppbevare Cymbalta 40mg?
Oppbevar Cymbalta ved romtemperatur mellom 68 °F til 77 °F (20 °C til 25 °C).
Oppbevar Cymbalta og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av Cymbalta.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk Cymbalta for en tilstand som den ikke er foreskrevet for. Ikke gi Cymbalta 20 mg til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Denne medisinguiden oppsummerer den viktigste informasjonen om Cymbalta. Hvis du vil ha mer informasjon, snakk med helsepersonell. Du kan spørre apoteket hos helsepersonell om informasjon om Cymbalta som er skrevet for helsepersonell.
For mer informasjon, ring 1-800-545-5979.
Hva er ingrediensene i Cymbalta 30mg?
Aktiv ingrediens: duloksetinhydroklorid
Inaktive ingredienser:
FD&C Blue No. 2, gelatin, hypromellose, hydroksypropylmetylcelluloseacetatsuccinat, natriumlaurylsulfat, sukrose, sukkerkuler, talkum, titandioksid og trietylsitrat. 20 og 60 mg kapslene inneholder også gult jernoksid.
Denne medisinveiledningen er godkjent av US Food and Drug Administration.
