Geodon 40mg, 80mg, 20mg Ziprasidone Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Geodon og hvordan brukes det?
Geodon er et reseptbelagt legemiddel som brukes til å behandle symptomene på schizofreni, akutt agitasjon med schizofreni og bipolar I-lidelse. Geodon kan brukes alene eller sammen med andre medisiner.
Geodon 20mg tilhører en klasse med medisiner som kalles antipsykotika.
Det er ikke kjent om Geodon er trygt og effektivt hos barn.
Hva er mulige bivirkninger av Geodon?
Geodon 20mg kan forårsake alvorlige bivirkninger, inkludert:
- . raske eller bankende hjerteslag, . flagrende i brystet, . kortpustethet, . plutselig svimmelhet, . ukontrollerte muskelbevegelser i ansiktet (tygging, leppesmekking, rynking, tungebevegelse, blunking eller øyebevegelser), . ethvert hudutslett, . feber, . munnsår, . hudsår, . sår hals, . hoste, . problemer med å puste, . økt tørst, . økt vannlating . tørr i munnen, . lukt av fruktig pust, . veldig stive muskler, . høy feber, . svette, . agitasjon, og . forvirring
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Geodon 40mg inkluderer:
- . svimmelhet, . døsighet, . svakhet, . kvalme, . oppkast, . problemer med å svelge, . føler seg rastløs, . skjelvinger, . synsproblemer, . rennende nese, og . ny eller forverret hoste
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Prometrium. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
ØKT DØDELIGHET HOS ELDRE PASIENTER MED DEMENSRELATTER PSYKOSE
Eldre pasienter med demensrelatert psykose behandlet med antipsykotiske legemidler har økt risiko for død. GEODON er ikke godkjent for behandling av demensrelatert psykose [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
GEODON 40mg er tilgjengelig som kapsler (ziprasidonhydroklorid) for oral administrering og som en injeksjon (ziprasidonmesylat) kun for intramuskulær bruk. Ziprasidon er et psykotropisk middel som ikke er kjemisk relatert til fenotiazin eller butyrofenon antipsykotiske midler. Den har en molekylvekt på 412,94 (fri base), med følgende kjemiske navn: 5-[2-[4-(1,2-benzisotiazol-3-yl)-1-piperazinyl]etyl]-6-klor-1 ,3-dihydro-2H-indol-2-on. Den empiriske formelen til C21H21ClN4OS (fri base av ziprasidon) representerer følgende strukturformel:
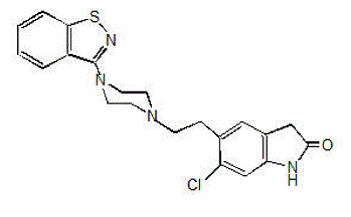
GEODON kapsler inneholder et monohydroklorid, monohydratsalt av ziprasidon. Kjemisk sett er ziprasidonhydrokloridmonohydrat 5-[2-[4-(1,2-benzisotiazol-3-yl)-1-piperazinyl]etyl]-6-klor-1,3-dihydro-2H-indol-2-on monohydroklorid, monohydrat. Den empiriske formelen er C21H21ClN4OS• HCl• H2O og dens molekylvekt er 467,42. Ziprasidonhydrokloridmonohydrat er et hvitt til svakt rosa pulver.
GEODON 20 mg kapsler leveres for oral administrering i 20 mg (blå/hvit), 40 mg (blå/blå), 60 mg (hvit/hvit) og 80 mg (blå/hvit) kapsler. GEODON 40mg kapsler inneholder ziprasidonhydrokloridmonohydrat, laktose, pregelatinisert stivelse og magnesiumstearat.
GEODON til injeksjon inneholder en lyofilisert form av ziprasidonmesylattrihydrat. Kjemisk sett er ziprasidonmesylattrihydrat 5-[2-[4-(1,2-benzisotiazol-3-yl)-1-piperazinyl]etyl]-6-klor-1,3-dihydro-2H-indol-2-on metansulfonat, trihydrat. Den empiriske formelen er C21H21ClN4OS • CH3SO3H • 3H2O og dens molekylvekt er 563,09.
GEODON 40 mg til injeksjon er tilgjengelig i et enkeltdose hetteglass som ziprasidonmesylat (20 mg ziprasidon/ml når rekonstituert i henhold til instruksjonene på etiketten) [se DOSERING OG ADMINISTRASJON ]. Hver ml ziprasidonmesylat til injeksjon (når rekonstituert) inneholder 20 mg ziprasidon og 4,7 mg metansulfonsyre oppløst med 294 mg sulfobutyleter β-cyklodekstrinnatrium (SBECD).
INDIKASJONER
GEODON er indisert for behandling av schizofreni, som monoterapi for akutt behandling av bipolare maniske eller blandede episoder, og som et tillegg til litium eller valproat for vedlikeholdsbehandling av bipolar lidelse. GEODON intramuskulær er indisert for akutt agitasjon hos schizofrene pasienter. Når forskriveren skal velge blant de alternative behandlingene som er tilgjengelige for tilstanden som trenger behandling, bør forskriveren vurdere funnet av ziprasidons større kapasitet til å forlenge QT/QTc-intervallet sammenlignet med flere andre antipsykotiske legemidler [se ADVARSLER OG FORHOLDSREGLER ]. Forlengelse av QTc-intervallet er assosiert med noen andre legemidler med evnen til å forårsake torsade de pointes-type arytmi, en potensielt dødelig polymorf ventrikkeltakykardi og plutselig død. I mange tilfeller vil dette føre til at andre rusmidler bør prøves først. Hvorvidt ziprasidon vil forårsake torsade de pointes eller øke hyppigheten av plutselig død er ennå ikke kjent [se ADVARSLER OG FORHOLDSREGLER ]
Schizofreni
- . GEODON er indisert for behandling av schizofreni hos voksne [se Kliniske studier ].
Bipolar I-lidelse (akutt blandede eller maniske episoder og vedlikeholdsbehandling som tillegg til litium eller valproat)
- . GEODON er indisert som monoterapi for akutt behandling av voksne med maniske eller blandede episoder assosiert med bipolar I lidelse [se Kliniske studier ]. . GEODON 40 mg er indisert som et tillegg til litium eller valproat for vedlikeholdsbehandling av bipolar lidelse I hos voksne [se Kliniske studier ].
Akutt behandling av agitasjon ved schizofreni
- . GEODON 40 mg intramuskulært er indisert for behandling av akutt agitasjon hos schizofrene voksne pasienter for hvem behandling med ziprasidon er egnet og som trenger intramuskulær antipsykotisk medisin for rask kontroll av agitasjon [se Kliniske studier ].
Siden det ikke er erfaring med sikkerheten ved intramuskulær administrering av ziprasidon til schizofrene pasienter som allerede tar oral ziprasidon, anbefales ikke samtidig administrering.
DOSERING OG ADMINISTRASJON
Schizofreni
Dosevalg
GEODON 40mg kapsler skal administreres med en startdosis på 20 mg to ganger daglig sammen med mat. Hos noen pasienter kan den daglige dosen deretter justeres på grunnlag av individuell klinisk status opp til 80 mg to ganger daglig. Dosejusteringer, hvis indisert, bør vanligvis skje med intervaller på ikke mindre enn 2 dager, da steady-state oppnås innen 1 til 3 dager. For å sikre bruk av lavest effektive dose, bør pasienter vanligvis observeres for bedring i flere uker før oppjustering av dosen.
Effekt ved schizofreni ble vist i et doseområde på 20 mg til 100 mg to ganger daglig i kortsiktige, placebokontrollerte kliniske studier. Det var trender mot doserespons innenfor området 20 mg til 80 mg to ganger daglig, men resultatene var ikke konsistente. En økning til en dose større enn 80 mg to ganger daglig anbefales generelt ikke. Sikkerheten ved doser over 100 mg to ganger daglig har ikke blitt systematisk evaluert i kliniske studier [se Kliniske studier ].
Vedlikeholdsbehandling
Selv om det ikke er noen bevis tilgjengelig for å svare på spørsmålet om hvor lenge en pasient behandlet med ziprasidon bør forbli på det, viste en vedlikeholdsstudie med pasienter som hadde vært symptomatisk stabile og deretter randomisert til å fortsette ziprasidon eller bytte til placebo en forsinkelse i tid tilbakefall for pasienter som får GEODON [se Kliniske studier ]. Ingen ytterligere fordel ble vist for doser over 20 mg to ganger daglig. Pasienter bør med jevne mellomrom revurderes for å fastslå behovet for vedlikeholdsbehandling.
Bipolar I-lidelse (akutt blandede eller maniske episoder og vedlikeholdsbehandling som tillegg til litium eller valproat)
Akutt behandling av maniske eller blandede episoder
Doseseleksjon-Oral ziprasidon bør administreres med en initial daglig dose på 40 mg to ganger daglig sammen med mat. Dosen kan deretter økes til 60 mg eller 80 mg to ganger daglig på den andre behandlingsdagen og deretter justeres på grunnlag av toleranse og effekt innenfor området 40 mg – 80 mg to ganger daglig. I de kliniske studiene med fleksibel dose var gjennomsnittlig daglig administrert dose ca. 120 mg [se Kliniske studier ].
Vedlikeholdsbehandling (som et tillegg til litium eller valproat)
Fortsett behandlingen med samme dose som pasienten først ble stabilisert på, innenfor området 40 mg–80 mg to ganger daglig med mat. Pasienter bør med jevne mellomrom revurderes for å fastslå behovet for vedlikeholdsbehandling [se Kliniske studier ].
Akutt behandling av agitasjon ved schizofreni
Intramuskulær dosering
Den anbefalte dosen er 10 mg til 20 mg administrert etter behov opp til en maksimal dose på 40 mg per dag. Doser på 10 mg kan administreres annenhver time; doser på 20 mg kan administreres hver fjerde time opp til maksimalt 40 mg/dag. Intramuskulær administrering av ziprasidon i mer enn tre påfølgende dager er ikke studert.
Hvis langtidsbehandling er indisert, bør orale ziprasidonhydrokloridkapsler erstatte intramuskulær administrering så snart som mulig.
Siden det ikke er erfaring med sikkerheten ved intramuskulær administrering av ziprasidon til schizofrene pasienter som allerede tar oral ziprasidon, anbefales ikke samtidig administrering.
Ziprasidon intramuskulært er kun beregnet for intramuskulær bruk og bør ikke administreres intravenøst.
Intramuskulær forberedelse til administrering
GEODON for injeksjon (ziprasidonmesylat) skal kun administreres ved intramuskulær injeksjon og skal ikke administreres intravenøst. Enkeltdose hetteglass krever rekonstituering før administrering.
Tilsett 1,2 mL sterilt vann til injeksjon i hetteglasset og rist kraftig til alt medikamentet er oppløst. Hver ml rekonstituert oppløsning inneholder 20 mg ziprasidon. For å administrere en 10 mg dose trekkes opp 0,5 ml av den rekonstituerte oppløsningen. For å administrere en 20 mg dose trekkes opp 1,0 ml av den rekonstituerte oppløsningen. Eventuell ubrukt del skal kastes. Siden det ikke er noe konserveringsmiddel eller bakteriostatisk middel til stede i dette produktet, må aseptisk teknikk brukes ved tilberedning av den endelige løsningen. Dette legemidlet må ikke blandes med andre legemidler eller løsemidler enn sterilt vann til injeksjonsvæsker. Parenterale legemidler bør inspiseres visuelt for partikler og misfarging før administrering, når oppløsning og beholder tillater det.
HVORDAN LEVERES
Doseringsformer og styrker
GEODON kapsler er differensiert etter kapselfarge/størrelse og er merket med svart blekk med "Pfizer og ZDX [doseringsstyrke]" eller "Pfizer" og et unikt nummer. GEODON 40 mg kapsler leveres for oral administrering i 20 mg (blå/hvit), 40 mg (blå/blå), 60 mg (hvit/hvit) og 80 mg (blå/hvit) kapsler. De leveres i følgende styrker og pakkekonfigurasjoner:
GEODON til injeksjon er tilgjengelig i et enkeltdose hetteglass som ziprasidonmesylat (20 mg ziprasidon/ml når rekonstituert i henhold til instruksjonene på etiketten) [se DOSERING OG ADMINISTRASJON ]. Hver ml ziprasidonmesylat til injeksjon (når rekonstituert) gir en fargeløs til blekrosa oppløsning som inneholder 20 mg ziprasidon og 4,7 mg metansulfonsyre solubilisert med 294 mg sulfobutyleter β-cyklodekstrinnatrium (SBECD).
Oppbevaring og håndtering
GEODON kapsler er differensiert etter kapselfarge/størrelse og er merket med svart blekk med "Pfizer og ZDX [doseringsstyrke]" eller med "Pfizer" og et unikt nummer. GEODON 20 mg kapsler leveres for oral administrering i 20 mg (blå/hvit), 40 mg (blå/blå), 60 mg (hvit/hvit) og 80 mg (blå/hvit) kapsler. De leveres i følgende styrker og pakkekonfigurasjoner:
Eller
GEODON kapsler skal oppbevares ved 25°C (77°F); utflukter tillatt til 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ].
GEODON 80 mg til injeksjon er tilgjengelig i et enkeltdose hetteglass som ziprasidonmesylat (20 mg ziprasidon/ml når rekonstituert i henhold til instruksjonene på etiketten) [se DOSERING OG ADMINISTRASJON ]. Hver ml ziprasidonmesylat til injeksjon (når rekonstituert) gir en fargeløs til blekrosa oppløsning som inneholder 20 mg ziprasidon og 4,7 mg metansulfonsyre solubilisert med 294 mg sulfobutyleter β-cyklodekstrinnatrium (SBECD).
GEODON 40mg til injeksjon skal oppbevares ved 25°C (77°F); utflukter tillatt til 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur i tørr form. Beskytt mot lys. Etter rekonstituering kan GEODON 40 mg til injeksjon lagres, beskyttet mot lys, i opptil 24 timer ved 15 °C til 30 °C (59 °F til 86 °F) eller opptil 7 dager i kjøleskap, 2 °C til 8 °C (36 °F til 46 °F).
Distribuert av: Roerig Division of Pfizer Inc, NY, NY 10017. Revidert: okt 2020
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Kliniske studier for oral ziprasidon inkluderte ca. 5700 pasienter og/eller normale forsøkspersoner eksponert for én eller flere doser ziprasidon. Av disse 5700 var over 4800 pasienter som deltok i effektivitetsstudier med flere doser, og deres erfaring tilsvarte omtrent 1831 pasientår. Disse pasientene inkluderer: (1) 4331 pasienter som deltok i flerdosestudier, hovedsakelig i schizofreni, som representerer omtrent 1698 pasientår med eksponering per 5. februar 2000; og (2) 472 pasienter som deltok i bipolar manistudier som representerte omtrent 133 pasientår med eksponering. Ytterligere 127 pasienter med bipolar lidelse deltok i en langsiktig vedlikeholdsbehandlingsstudie som representerte omtrent 74,7 pasientår med eksponering for ziprasidon. Betingelsene og varigheten av behandlingen med ziprasidon inkluderte åpne og dobbeltblinde studier, polikliniske og polikliniske studier og korttids- og langtidseksponering.
Kliniske studier for intramuskulært ziprasidon inkluderte 570 pasienter og/eller normale forsøkspersoner som fikk en eller flere injeksjoner med ziprasidon. Over 325 av disse personene deltok i studier som involverte administrering av flere doser.
Bivirkninger under eksponering ble oppnådd ved å samle frivillig rapporterte uønskede erfaringer, samt resultater av fysiske undersøkelser, vitale tegn, vekter, laboratorieanalyser, EKG og resultater fra oftalmologiske undersøkelser.
De oppgitte bivirkningsfrekvensene representerer andelen individer som minst én gang opplevde en behandlingsutløst bivirkning av den oppførte typen. En reaksjon ble ansett som behandlingsoppstått hvis den oppstod for første gang eller forverret seg under behandling etter baseline-evaluering.
Uønskede funn observert i kortsiktige, placebokontrollerte forsøk med oral Ziprasidon
Følgende funn er basert på de kortsiktige placebokontrollerte premarketing-studiene for schizofreni (en samling av to 6-ukers og to 4-ukers fastdose-studier) og bipolar mani (en pool med to 3-ukers fleksible doser) forsøk) der ziprasidon ble administrert i doser fra 10 til 200 mg/dag.
Vanlige observerte bivirkninger i kortsiktige placebokontrollerte forsøk
Følgende bivirkninger var de vanligst observerte bivirkningene assosiert med bruk av ziprasidon (forekomst på 5 % eller mer) og ikke observert ved en tilsvarende forekomst blant placebobehandlede pasienter (ziprasidonforekomst minst dobbelt så stor som for placebo):
Schizofreniforsøk (se tabell 11)
- . Søvnighet . Luftveisinfeksjon
Bipolare forsøk (se tabell 12)
- . Søvnighet . Ekstrapyramidale symptomer som inkluderer følgende bivirkningsbetegnelser: ekstrapyramidalt syndrom, hypertoni, dystoni, dyskinesi, hypokinesi, tremor, lammelser og rykninger. Ingen av disse bivirkningene forekom individuelt med en forekomst på over 10 % i bipolar manistudier. . Svimmelhet som inkluderer bivirkningsbetegnelsene svimmelhet og svimmelhet. . Akatisia . Unormalt syn . Asteni . Oppkast
Schizofreni
Bivirkninger assosiert med seponering av behandling i kortsiktige, placebokontrollerte forsøk med oral Ziprasidon
Omtrent 4,1 % (29/702) av ziprasidon-behandlede pasienter i korttids, placebokontrollerte studier avbrøt behandlingen på grunn av en bivirkning, sammenlignet med ca. 2,2 % (6/273) på placebo. Den vanligste reaksjonen assosiert med frafall var utslett, inkludert 7 frafall for utslett blant ziprasidonpasienter (1 %) sammenlignet med ingen placebopasienter [se ADVARSLER OG FORHOLDSREGLER ].
Bivirkninger som oppstår med en forekomst på 2 % eller mer blant Ziprasidon-behandlede pasienter i kortsiktige, orale, placebokontrollerte studier
Tabell 11 oppregner forekomsten, avrundet til nærmeste prosent, av behandlingsfremkomne bivirkninger som oppstod under akutt behandling (opptil 6 uker) hos hovedsakelig pasienter med schizofreni, inkludert bare de reaksjonene som oppstod hos 2 % eller flere av pasientene behandlet med ziprasidon og hvor forekomsten hos pasienter behandlet med ziprasidon var høyere enn forekomsten hos placebobehandlede pasienter.
Doseavhengighet av bivirkninger i kortsiktige, faste doser, placebokontrollerte forsøk
En analyse for doserespons i schizofreni 4-studiegruppen avslørte en tilsynelatende sammenheng mellom bivirkning og dose for følgende reaksjoner: asteni, postural hypotensjon, anoreksi, munntørrhet, økt salivasjon, artralgi, angst, svimmelhet, dystoni, hypertoni, somnolens , skjelving, rhinitt, utslett og unormalt syn.
Ekstrapyramidale symptomer (EPS)
Forekomsten av rapportert EPS (som inkluderte bivirkningsbetegnelsene ekstrapyramidalt syndrom, hypertoni, dystoni, dyskinesi, hypokinesi, tremor, lammelser og rykninger) for ziprasidon-behandlede pasienter i de kortsiktige, placebokontrollerte schizofrenistudiene var 14 % vs. 8 % for placebo. Objektivt innsamlede data fra disse forsøkene på Simpson-Angus Rating Scale (for EPS) og Barnes Akathisia Scale (for akathisia) viste generelt ikke en forskjell mellom ziprasidon og placebo.
Dystoni
Klasseeffekt: Symptomer på dystoni, langvarige unormale sammentrekninger av muskelgrupper, kan forekomme hos følsomme individer i løpet av de første dagene av behandlingen. Dystoniske symptomer inkluderer: spasmer i nakkemusklene, noen ganger utvikler seg til tetthet i halsen, svelgevansker, pustevansker og/eller tungefremspring. Selv om disse symptomene kan oppstå ved lave doser, forekommer de hyppigere og med større alvorlighetsgrad med høy styrke og ved høyere doser av førstegenerasjons antipsykotiske legemidler. En forhøyet risiko for akutt dystoni er observert hos menn og yngre aldersgrupper.
Endringer av vitale tegn
Ziprasidon er assosiert med ortostatisk hypotensjon [se ADVARSLER OG FORHOLDSREGLER ]
EKG-endringer
Ziprasidon er assosiert med en økning i QTc-intervallet [se ADVARSLER OG FORHOLDSREGLER ]. I schizofrenistudiene var ziprasidon assosiert med en gjennomsnittlig økning i hjertefrekvens på 1,4 slag per minutt sammenlignet med en reduksjon på 0,2 slag per minutt blant placebopasienter.
Andre bivirkninger observert under premarketing-evalueringen av oral Ziprasidon
Følgende er en liste over COSTART-termer som gjenspeiler behandlingsfremkomne bivirkninger som definert i introduksjonen til BIVIRKNINGER-delen rapportert av pasienter behandlet med ziprasidon i schizofrenistudier med flere doser >4 mg/dag i databasen med 3834 pasienter. Alle rapporterte reaksjoner er inkludert bortsett fra de som allerede er oppført i tabell 11 eller andre steder i merkingen, de reaksjonsbegrepene som var så generelle at de var uinformative, reaksjoner rapportert bare én gang og som ikke hadde en vesentlig sannsynlighet for å være akutt livstruende, reaksjoner som er en del av sykdommen som behandles eller er på annen måte vanlig som bakgrunnsreaksjoner, og reaksjoner som anses som usannsynlig å være rusrelaterte. Det er viktig å understreke at selv om de rapporterte reaksjonene oppstod under behandling med ziprasidon, var de ikke nødvendigvis forårsaket av det.
Bivirkninger er videre kategorisert etter kroppssystem og oppført i rekkefølge etter avtagende frekvens i henhold til følgende definisjoner:
Hyppige - bivirkninger som forekommer hos minst 1/100 pasienter (≥1,0 % av pasientene) (bare de som ikke allerede er oppført i tabellresultatene fra placebokontrollerte studier vises i denne listen);
Sjeldne - bivirkninger forekommer hos 1/100 til 1/1000 pasienter (hos 0,1-1,0 % av pasientene)
Sjeldne - bivirkninger forekommer hos færre enn 1/1000 pasienter (
Kroppen som en helhet
Hyppige magesmerter, influensasyndrom, feber, utilsiktet fall, ansiktsødem, frysninger, lysfølsomhetsreaksjon, flankesmerter, hypotermi, bilulykke
Sirkulasjonssystem
Hyppig takykardi, hypertensjon, postural hypotensjon
Sjelden bradykardi, angina pectoris, atrieflimmer
Sjelden førstegrads AV-blokk, grenblokk, flebitt, lungeemboli, kardiomegali, hjerneinfarkt, cerebrovaskulær ulykke, dyp tromboflebitt, myokarditt, tromboflebitt
Fordøyelsessystemet
Hyppig anoreksi, oppkast
Sjeldne rektalblødninger, dysfagi, tungeødem
Sjeldne tannkjøttblødninger, gulsott, fekal påvirkning, økt gamma-glutamyltranspeptidase, hematemese, kolestatisk gulsott, hepatitt, hepatomegali, leukoplaki i munnen, fettleveravleiring, melena
Endokrine
Sjelden hypotyreose, hypertyreose, tyreoiditt
Hemisk og lymfatisk system
Sjelden anemi, ekkymose, leukocytose, leukopeni, eosinofili, lymfadenopati
Sjelden trombocytopeni, hypokrom anemi, lymfocytose, monocytose, basofili, lymfødem, polycytemi, trombocytemi
Metabolske og ernæringsforstyrrelser
Sjelden tørste, økt transaminase, perifert ødem, hyperglykemi, økt kreatinfosfokinase, økt alkalisk fosfatase, hyperkolesteremi, dehydrering, økt melkesyredehydrogenase, albuminuri, hypokalemi
Sjelden BUN økt, kreatinin økt, hyperlipemi, hypokolesteremi, hyperkalemi, hypokloremi, hypoglykemi, hyponatremi, hypoproteinemi, redusert glukosetoleranse, gikt, hyperkloremi, hyperurikemi, hypokalsemi, hypoglykemisk reaksjon, hypomagnesemi, respiratorisk alkalose,
Muskel- og skjelettsystemet
Hyppig myalgi
Sjelden tenosynovitt
Sjelden myopati
Nervesystemet
Frekvenstagitasjon, ekstrapyramidalt syndrom, skjelving, dystoni, hypertoni, dyskinesi, fiendtlighet, rykninger, parestesi, forvirring, svimmelhet, hypokinesi, hyperkinesi, unormal gang, okulogyrisk krise, hypestesi, ataksi, hukommelsestap, stivhet i tannhjulet, dysstivhet, delironi, abstinenssyndrom, buccoglossalt syndrom, koreoatetose, diplopi, inkoordinasjon, nevropati
Sjeldne lammelser
Sjeldne myoklonus, nystagmus, torticollis, sirkumoral parestesi, opisthotonos, økte reflekser, trismus
Luftveiene
Hyppig dyspné
Sjelden lungebetennelse, neseblødning
Sjelden hemoptyse, laryngisme
Hud og vedheng
Sjeldne makulopapulære utslett, urticaria, alopecia, eksem, eksfoliativ dermatitt, kontakteksem, vesikulobulløst utslett
Spesielle sanser
Hyppig soppeksem
Sjelden konjunktivitt, tørre øyne, tinnitus, blefaritt, grå stær, fotofobi
Sjelden øyeblødning, synsfeltdefekt, keratitt, keratokonjunktivitt
Urogenital system
Sjelden impotens, unormal utløsning, amenoré, hematuri, menorrhagia, kvinnelig amming, polyuri, urinretensjonsmetrorragi, mannlig seksuell dysfunksjon, anorgasmi, glykosuri
Sjelden gynekomasti, vaginal blødning, nokturi, oliguri, seksuell dysfunksjon hos kvinner, livmorblødning
Bipolar lidelse
Akutt behandling av maniske eller blandede episoder
Bivirkninger forbundet med seponering av behandling på kort sikt, placebokontrollerte studier
Omtrent 6,5 % (18/279) av ziprasidon-behandlede pasienter i korttids, placebokontrollerte studier avbrøt behandlingen på grunn av en bivirkning, sammenlignet med ca. 3,7 % (5/136) på placebo. De vanligste reaksjonene assosiert med frafall hos ziprasidon-behandlede pasienter var akatisi, angst, depresjon, svimmelhet, dystoni, utslett og oppkast, med 2 frafall for hver av disse reaksjonene blant ziprasidonpasienter (1 %) sammenlignet med én placebopasient hver for dystoni og utslett (1 %) og ingen placebopasienter for de resterende bivirkningene.
Bivirkninger som oppstår med en forekomst på 2 % eller mer blant Ziprasidon-behandlede pasienter i kortsiktige, orale, placebokontrollerte studier
Tabell 12 oppregner forekomsten, avrundet til nærmeste prosent, av behandlingsutløste bivirkninger som oppsto under akutt behandling (opptil 3 uker) hos pasienter med bipolar mani, inkludert bare de reaksjonene som oppstod hos 2 % eller flere av pasientene behandlet med ziprasidon og hvor forekomsten hos pasienter behandlet med ziprasidon var høyere enn forekomsten hos placebobehandlede pasienter.
Undersøkelser etter interaksjoner på grunnlag av kjønn avdekket ingen klinisk betydningsfulle forskjeller i bivirkningsforekomsten på grunnlag av denne demografiske faktoren.
Intramuskulær Ziprasidon
Bivirkninger som oppstår med en forekomst på 1 % eller mer blant Ziprasidon-behandlede pasienter i korttidsforsøk med intramuskulært Ziprasidon
Tabell 13 oppregner forekomsten, avrundet til nærmeste prosent, av behandlingsutløste bivirkninger som oppsto under akuttbehandling med intramuskulær ziprasidon hos 1 % eller flere av pasientene.
disse studiene ble de vanligst observerte bivirkningene assosiert med bruk av intramuskulært ziprasidon (forekomst på 5 % eller mer) og observert med en hastighet på intramuskulær ziprasidon (i de høyere dosegruppene) minst to ganger den for den laveste intramuskulære ziprasidongruppen. var hodepine (13 %), kvalme (12 %) og somnolens (20 %).
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av GEODON etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Bivirkningsrapporter som ikke er oppført ovenfor som har blitt mottatt siden markedsintroduksjonen inkluderer sjeldne forekomster av følgende: Hjertelidelser: Takykardi, torsade de pointes (i nærvær av flere forstyrrende faktorer), [se ADVARSLER OG FORHOLDSREGLER ]; Fordøyelsessystemet lidelser: Hovent tunge; Reproduktive system og brystsykdommer: Galactorrhea, priapisme; Forstyrrelser i nervesystemet: Ansiktsheng, malignt neuroleptisk syndrom, serotonergt syndrom (alene eller i kombinasjon med serotonerge legemidler), tardiv dyskinesi; Psykiatriske lidelser: Søvnløshet, mani/hypomani; Hud- og subkutane vevssykdommer: Allergisk reaksjon (som allergisk dermatitt, angioødem, orofacialt ødem, urticaria), utslett, legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS); Urogenitale systemsykdommer: Enurese, urininkontinens; Vaskulære lidelser: Postural hypotensjon, synkope.
NARKOTIKAHANDEL
Legemiddelinteraksjoner kan være farmakodynamiske (kombinerte farmakologiske effekter) eller farmakokinetiske (endring av plasmanivåer). Risikoen ved bruk av ziprasidon i kombinasjon med andre legemidler har blitt evaluert som beskrevet nedenfor. Alle interaksjonsstudier er utført med oral ziprasidon. Basert på den farmakodynamiske og farmakokinetiske profilen til ziprasidon, kan mulige interaksjoner forventes:
Metabolsk vei
Omtrent to tredjedeler av ziprasidon metaboliseres via en kombinasjon av kjemisk reduksjon med glutation og enzymatisk reduksjon med aldehydoksidase. Det er ingen kjente klinisk relevante hemmere eller induktorer av aldehydoksidase. Mindre enn en tredjedel av ziprasidon metabolsk clearance medieres av cytokrom P450-katalysert oksidasjon.
In vitro studier
En in vitro enzymhemmingsstudie med bruk av humane levermikrosomer viste at ziprasidon hadde liten hemmende effekt på CYP1A2, CYP2C9, CYP2C19, CYP2D6 og CYP3A4, og derfor sannsynligvis ikke ville forstyrre metabolismen til legemidler som primært metaboliseres av disse enzymene. Det er lite potensiale for legemiddelinteraksjoner med ziprasidon på grunn av forskyvning [se KLINISK FARMAKOLOGI ].
Farmakodynamiske interaksjoner
Ziprasidon skal ikke brukes sammen med legemidler som forlenger QT-intervallet [se KONTRAINDIKASJONER ].
Gitt de primære CNS-effektene av ziprasidon, bør det utvises forsiktighet når det tas i kombinasjon med andre sentralt virkende legemidler.
På grunn av potensialet for å indusere hypotensjon, kan ziprasidon forsterke effekten av visse antihypertensiva.
Ziprasidon kan motvirke effekten av levodopa og dopaminagonister.
Farmakokinetiske interaksjoner
Karbamazepin
Karbamazepin er en induktor av CYP3A4; administrasjon av 200 mg to ganger daglig i 21 dager resulterte i en reduksjon på ca. 35 % i AUC for ziprasidon. Denne effekten kan være større når høyere doser karbamazepin administreres.
Ketokonazol
Ketokonazol, en potent hemmer av CYP3A4, i en dose på 400 mg daglig i 5 dager, økte AUC og Cmax for ziprasidon med ca. 35-40%. Andre hemmere av CYP3A4 forventes å ha lignende effekter.
Cimetidin
Cimetidin i en dose på 800 mg én gang daglig i 2 dager påvirket ikke ziprasidons farmakokinetikk.
Antacida
Samtidig administrering av 30 ml Maalox® med ziprasidon påvirket ikke farmakokinetikken til ziprasidon.
Litium
Ziprasidon i en dose på 40 mg to ganger daglig administrert samtidig med litium i en dose på 450 mg to ganger daglig i 7 dager påvirket ikke steady-state-nivået eller renal clearance av litium. Ziprasidon dosert i tillegg til litium i en vedlikeholdsstudie med bipolare pasienter påvirket ikke gjennomsnittlige terapeutiske litiumnivåer.
Orale prevensjonsmidler
In vivo-studier har ikke avdekket noen effekt av ziprasidon på farmakokinetikken til østrogen- eller progesteronkomponenter. Ziprasidon i en dose på 20 mg to ganger daglig påvirket ikke farmakokinetikken til samtidig administrerte orale prevensjonsmidler, etinyløstradiol (0,03 mg) og levonorgestrel (0,15 mg).
Dekstrometorfan
I samsvar med in vitro-resultater viste en studie med normale friske frivillige at ziprasidon ikke endret metabolismen av dekstrometorfan, et CYP2D6-modellsubstrat, til hovedmetabolitten dekstrorfan. Det var ingen statistisk signifikant endring i forholdet mellom dekstrometorfan og dekstrorfan i urinen.
Valproat
En farmakokinetisk interaksjon mellom ziprasidon og valproat er usannsynlig på grunn av mangelen på felles metabolske veier for de to legemidlene. Ziprasidon dosert i tillegg til valproat i en vedlikeholdsstudie med bipolare pasienter påvirket ikke gjennomsnittlige terapeutiske valproatnivåer.
Annen samtidig medikamentell behandling
Populasjonsfarmakokinetisk analyse av schizofrene pasienter inkludert i kontrollerte kliniske studier har ikke avdekket bevis for noen klinisk signifikante farmakokinetiske interaksjoner med benztropin, propranolol eller lorazepam.
Matinteraksjon
Den absolutte biotilgjengeligheten av en 20 mg dose under matforhold er omtrent 60 %. Absorpsjonen av ziprasidon økes opptil det dobbelte i nærvær av mat [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Økt dødelighet hos eldre pasienter med demensrelatert psykose
Eldre pasienter med demensrelatert psykose behandlet med antipsykotiske legemidler har økt risiko for død. Analyser av 17 placebokontrollerte studier (modal varighet på 10 uker), hovedsakelig hos pasienter som tok atypiske antipsykotiske legemidler, viste en risiko for død hos legemiddelbehandlede pasienter på mellom 1,6 til 1,7 ganger risikoen for død hos placebobehandlede pasienter. I løpet av en typisk 10-ukers kontrollert studie var dødsraten hos medikamentbehandlede pasienter ca. 4,5 %, sammenlignet med en rate på ca. 2,6 % i placebogruppen.
Selv om dødsårsakene var forskjellige, så de fleste dødsfallene ut til å være enten kardiovaskulære (f.eks. hjertesvikt, plutselig død) eller smittsomme (f.eks. lungebetennelse) av natur. GEODON er ikke godkjent for behandling av pasienter med demensrelatert psykose. [se BOKS ADVARSEL , Cerebrovaskulære bivirkninger, inkludert hjerneslag, hos eldre pasienter med demensrelatert psykose ].
Cerebrovaskulære bivirkninger, inkludert hjerneslag, hos eldre pasienter med demensrelatert psykose
I placebokontrollerte studier hos eldre personer med demens, hadde pasienter randomisert til risperidon, aripiprazol og olanzapin en høyere forekomst av hjerneslag og forbigående iskemisk angrep, inkludert fatalt hjerneslag. GEODON er ikke godkjent for behandling av pasienter med demensrelatert psykose [se BOKS ADVARSEL og Økt dødelighet hos eldre pasienter med demensrelatert psykose ].
QT-forlengelse og risiko for plutselig død
Bruk av Ziprasidon bør unngås i kombinasjon med andre legemidler som er kjent for å forlenge QTc-intervallet [se KONTRAINDIKASJONER og NARKOTIKAHANDEL ]. I tillegg bør klinikere være oppmerksomme på identifisering av andre legemidler som konsekvent har blitt observert for å forlenge QTc-intervallet. Slike legemidler bør ikke foreskrives med ziprasidon. Ziprasidon bør også unngås hos pasienter med medfødt lang QT-syndrom og hos pasienter med tidligere hjertearytmier [se KONTRAINDIKASJONER ].
En studie som direkte sammenlignet den QT/QTc-forlengende effekten av oral ziprasidon med flere andre medikamenter som er effektive i behandlingen av schizofreni, ble utført på frivillige pasienter. I den første fasen av forsøket ble EKG oppnådd på tidspunktet for maksimal plasmakonsentrasjon når stoffet ble administrert alene. I den andre fasen av studien ble EKG-er oppnådd på tidspunktet for maksimal plasmakonsentrasjon mens stoffet ble administrert sammen med en hemmer av CYP4503A4-metabolismen til stoffet.
den første fasen av studien ble gjennomsnittlig endring i QTc fra baseline beregnet for hvert medikament, ved å bruke en prøvebasert korreksjon som fjerner effekten av hjertefrekvens på QT-intervallet. Den gjennomsnittlige økningen i QTc fra baseline for ziprasidon varierte fra ca. 9 til 14 msek større enn for fire av komparatorpreparatene (risperidon, olanzapin, kvetiapin og haloperidol), men var ca. 14 msek mindre enn forlengelsen observert for tioridazin.
I den andre fasen av studien ble effekten av ziprasidon på QTc-lengden ikke forsterket av tilstedeværelsen av en metabolsk hemmer (ketokonazol 200 mg to ganger daglig).
placebokontrollerte studier økte oral ziprasidon QTc-intervallet sammenlignet med placebo med ca. 10 msek ved høyeste anbefalte daglige dose på 160 mg. I kliniske studier med oral ziprasidon avslørte elektrokardiogrammene til 2/2988 (0,06 %) pasienter som fikk GEODON 80 mg og 1/440 (0,23 %) pasienter som fikk placebo QTc-intervaller som oversteg den potensielt klinisk relevante terskelen på 500 msek. Hos ziprasidon-behandlede pasienter antydet ingen av tilfellene en rolle som ziprasidon. En pasient hadde en historie med forlenget QTc og en screeningmåling på 489 msek; QTc var 503 msek under ziprasidonbehandling. Den andre pasienten hadde en QTc på 391 msek ved slutten av behandlingen med ziprasidon og ved bytte til tioridazin opplevde QTc-målinger på 518 og 593 msek.
Noen legemidler som forlenger QT/QTc-intervallet har vært assosiert med forekomsten av torsade de pointes og plutselig uforklarlig død. Forholdet mellom QT-forlengelse og torsade de pointes er tydeligst for større økninger (20 msek og mer), men det er mulig at mindre QT/QTc-forlengelser også kan øke risikoen, eller øke den hos mottakelige individer. Selv om torsade de pointes ikke har blitt observert i forbindelse med bruk av ziprasidon i førmarkedsføringsstudier og erfaring er for begrenset til å utelukke økt risiko, har det vært sjeldne rapporter etter markedsføring (i nærvær av flere forstyrrende faktorer) [se BIVIRKNINGER ].
En studie som evaluerte den QT/QTc-forlengende effekten av intramuskulært ziprasidon, med intramuskulært haloperidol som kontroll, ble utført på frivillige pasienter. I studien ble EKG tatt på tidspunktet for maksimal plasmakonsentrasjon etter to injeksjoner med ziprasidon (20 mg og deretter 30 mg) eller haloperidol (7,5 mg og deretter 10 mg) gitt med fire timers mellomrom. Merk at en dose på 30 mg intramuskulært ziprasidon er 50 % høyere enn den anbefalte terapeutiske dosen. Gjennomsnittlig endring i QTc fra baseline ble beregnet for hvert medikament, ved å bruke en prøvebasert korreksjon som fjerner effekten av hjertefrekvens på QT-intervallet. Gjennomsnittlig økning i QTc fra baseline for ziprasidon var 4,6 msek etter den første injeksjonen og 12,8 msek etter den andre injeksjonen. Gjennomsnittlig økning i QTc fra baseline for haloperidol var 6,0 msek etter den første injeksjonen og 14,7 msek etter den andre injeksjonen. I denne studien hadde ingen pasienter et QTc-intervall på over 500 msek.
Som med andre antipsykotiske legemidler og placebo, har plutselige uforklarlige dødsfall blitt rapportert hos pasienter som tar ziprasidon i anbefalte doser. Erfaringen før markedsføring av ziprasidon avslørte ikke økt risiko for dødelighet for ziprasidon sammenlignet med andre antipsykotiske legemidler eller placebo, men omfanget av eksponering var begrenset, spesielt for legemidlene som ble brukt som aktive kontroller og placebo. Ziprasidons større forlengelse av QTc-lengden sammenlignet med flere andre antipsykotiske legemidler øker likevel muligheten for at risikoen for plutselig død kan være større for ziprasidon enn for andre tilgjengelige legemidler for behandling av schizofreni. Denne muligheten må vurderes ved avgjørelse blant alternative legemidler [se INDIKASJONER ].
Visse omstendigheter kan øke risikoen for forekomst av torsade de pointes og/eller plutselig død i forbindelse med bruk av legemidler som forlenger QTc-intervallet, inkludert (1) bradykardi; (2) hypokalemi eller hypomagnesemi; (3) samtidig bruk av andre legemidler som forlenger QTc-intervallet; og (4) tilstedeværelse av medfødt forlengelse av QT-intervallet.
Det anbefales at pasienter som vurderes for ziprasidonbehandling og som har risiko for betydelige elektrolyttforstyrrelser, spesielt hypokalemi, har baseline-målinger av kalium og magnesium i serum. Hypokalemi (og/eller hypomagnesemi) kan øke risikoen for QT-forlengelse og arytmi. Hypokalemi kan skyldes vanndrivende terapi, diaré og andre årsaker. Pasienter med lavt serumkalium og/eller magnesium bør fylles på med disse elektrolyttene før behandlingen fortsetter. Det er viktig å periodisk overvåke serumelektrolytter hos pasienter som får diuretikabehandling under ziprasidonbehandling. Vedvarende forlengede QTc-intervaller kan også øke risikoen for ytterligere forlengelse og arytmi, men det er ikke klart at rutinemessige screening-EKG-tiltak er effektive for å oppdage slike pasienter. Snarere bør ziprasidon unngås hos pasienter med historie med betydelig kardiovaskulær sykdom, f.eks. QT-forlengelse, nylig akutt hjerteinfarkt, ukompensert hjertesvikt eller hjertearytmi. Ziprasidon bør seponeres hos pasienter som viser seg å ha vedvarende QTc-målinger >500 msek.
For pasienter som tar ziprasidon som opplever symptomer som kan indikere forekomst av torsade de pointes, f.eks. svimmelhet, hjertebank eller synkope, bør forskriveren sette i gang ytterligere evaluering, f.eks. kan Holter-overvåking være nyttig.
Malignt nevroleptikasyndrom (NMS)
Et potensielt dødelig symptomkompleks noen ganger referert til som malignt nevroleptikasyndrom (NMS) er rapportert i forbindelse med administrering av antipsykotiske legemidler. Kliniske manifestasjoner av NMS er hyperpyreksi, muskelstivhet, endret mental status og bevis på autonom ustabilitet (uregelmessig puls eller blodtrykk, takykardi, diaforese og hjerterytmeforstyrrelser). Ytterligere tegn kan inkludere forhøyet kreatininfosfokinase, myoglobinuri (rabdomyolyse) og akutt nyresvikt.
Den diagnostiske evalueringen av pasienter med dette syndromet er komplisert. For å komme frem til en diagnose er det viktig å utelukke tilfeller der den kliniske presentasjonen inkluderer både alvorlig medisinsk sykdom (f.eks. lungebetennelse, systemisk infeksjon, etc.) og ubehandlede eller utilstrekkelig behandlede ekstrapyramidale tegn og symptomer (EPS). Andre viktige hensyn i differensialdiagnosen inkluderer sentral antikolinergisk toksisitet, heteslag, medikamentfeber og primær sentralnervesystem (CNS) patologi.
Behandlingen av NMS bør omfatte: (1) umiddelbar seponering av antipsykotiske legemidler og andre legemidler som ikke er avgjørende for samtidig behandling; (2) intensiv symptomatisk behandling og medisinsk overvåking; og (3) behandling av eventuelle samtidige alvorlige medisinske problemer som spesifikke behandlinger er tilgjengelige for. Det er ingen generell enighet om spesifikke farmakologiske behandlingsregimer for NMS.
Dersom en pasient trenger antipsykotisk medikamentbehandling etter bedring fra NMS, bør mulig gjeninnføring av medikamentell behandling vurderes nøye. Pasienten bør overvåkes nøye, siden tilbakefall av NMS er rapportert.
Alvorlige kutane bivirkninger
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS)
Legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) er rapportert ved eksponering for Ziprasidon. DRESS består av en kombinasjon av tre eller flere av følgende: hudreaksjon (som utslett eller eksfoliativ dermatitt), eosinofili, feber, lymfadenopati og en eller flere systemiske komplikasjoner som hepatitt, nefritt, pneumonitt, myokarditt og perikarditt. DRESS er noen ganger dødelig. Seponer ziprasidon hvis det er mistanke om DRESS.
Andre alvorlige kutane bivirkninger
Andre alvorlige kutane bivirkninger, som Stevens-Johnsons syndrom, er rapportert ved eksponering for ziprasidon. Alvorlige kutane bivirkninger er noen ganger dødelige. Seponer ziprasidon hvis det er mistanke om alvorlige kutane bivirkninger.
Tardiv dyskinesi
Et syndrom med potensielt irreversible, ufrivillige, dyskinetiske bevegelser kan utvikles hos pasienter som gjennomgår behandling med antipsykotiske legemidler. Selv om prevalensen av syndromet ser ut til å være høyest blant eldre, spesielt eldre kvinner, er det umulig å stole på prevalensestimater for å forutsi, ved starten av antipsykotisk behandling, hvilke pasienter som sannsynligvis vil utvikle syndromet. Hvorvidt antipsykotiske legemidler er forskjellige i deres potensial til å forårsake tardiv dyskinesi er ukjent.
Risikoen for å utvikle tardiv dyskinesi og sannsynligheten for at den blir irreversibel antas å øke etter hvert som behandlingens varighet og den totale kumulative dosen av antipsykotiske legemidler som gis til pasienten øker. Imidlertid kan syndromet utvikle seg, selv om det er mye mindre vanlig, etter relativt korte behandlingsperioder ved lave doser.
Det er ingen kjent behandling for etablerte tilfeller av tardiv dyskinesi, selv om syndromet kan gi seg, delvis eller fullstendig, dersom antipsykotisk behandling avbrytes. Antipsykotisk behandling i seg selv kan imidlertid undertrykke (eller delvis undertrykke) tegn og symptomer på syndromet, og kan derved muligens maskere den underliggende prosessen. Effekten som symptomatisk undertrykkelse har på det langsiktige forløpet av syndromet er ukjent.
Gitt disse hensynene bør ziprasidon forskrives på en måte som mest sannsynlig minimerer forekomsten av tardiv dyskinesi. Kronisk antipsykotisk behandling bør generelt være forbeholdt pasienter som lider av en kronisk sykdom som (1) er kjent for å reagere på antipsykotiske legemidler, og (2) for hvem alternative, like effektive, men potensielt mindre skadelige behandlinger ikke er tilgjengelige eller hensiktsmessige. Hos pasienter som trenger kronisk behandling, bør den minste dosen og den korteste behandlingsvarigheten som gir en tilfredsstillende klinisk respons søkes. Behovet for fortsatt behandling bør revurderes med jevne mellomrom.
Hvis tegn og symptomer på tardiv dyskinesi vises hos en pasient på ziprasidon, bør seponering av legemidlet vurderes. Noen pasienter kan imidlertid trenge behandling med ziprasidon til tross for tilstedeværelsen av syndromet.
Metabolske endringer
Atypiske antipsykotiske legemidler har vært assosiert med metabolske endringer som kan øke kardiovaskulær/cerebrovaskulær risiko. Disse metabolske endringene inkluderer hyperglykemi, dyslipidemi og kroppsvektøkning. Mens alle medikamentene i klassen har vist seg å produsere noen metabolske endringer, har hvert legemiddel sin egen spesifikke risikoprofil.
Hyperglykemi og diabetes mellitus
Hyperglykemi og diabetes mellitus, i noen tilfeller ekstreme og assosiert med ketoacidose eller hyperosmolar koma eller død, er rapportert hos pasienter behandlet med atypiske antipsykotika. Det har vært få rapporter om hyperglykemi eller diabetes hos pasienter behandlet med GEODON. Selv om færre pasienter har blitt behandlet med GEODON, er det ikke kjent om denne mer begrensede erfaringen er den eneste grunnen til mangelen på slike rapporter. Vurdering av sammenhengen mellom atypisk antipsykotisk bruk og glukoseavvik kompliseres av muligheten for økt bakgrunnsrisiko for diabetes mellitus hos pasienter med schizofreni og den økende forekomsten av diabetes mellitus i befolkningen generelt. Gitt disse konfounderne, er forholdet mellom atypisk antipsykotisk bruk og hyperglykemi-relaterte bivirkninger ikke fullstendig forstått. Nøyaktige risikoestimater for hyperglykemi-relaterte bivirkninger hos pasienter behandlet med atypiske antipsykotika er ikke tilgjengelig.
Pasienter med etablert diagnose diabetes mellitus som starter på atypiske antipsykotika bør overvåkes regelmessig for forverring av glukosekontrollen. Pasienter med risikofaktorer for diabetes mellitus (f.eks. fedme, familiehistorie med diabetes) som starter behandling med atypiske antipsykotika, bør gjennomgå fastende blodsukkertesting i begynnelsen av behandlingen og med jevne mellomrom under behandlingen. Alle pasienter som behandles med atypiske antipsykotika bør overvåkes for symptomer på hyperglykemi, inkludert polydipsi, polyuri, polyfagi og svakhet. Pasienter som utvikler symptomer på hyperglykemi under behandling med atypiske antipsykotika bør gjennomgå fastende blodsukkertesting. I noen tilfeller har hyperglykemi gått over når det atypiske antipsykotikaet ble seponert; noen pasienter trengte imidlertid fortsettelse av antidiabetisk behandling til tross for seponering av det mistenkte legemidlet.
Samlede data fra kortsiktige, placebokontrollerte studier i schizofreni og bipolar lidelse er presentert i tabell 1-4. Merk at for de fleksible dosestudiene i både schizofreni og bipolar lidelse, er hvert individ kategorisert som å ha mottatt enten lav (20-40 mg BID) eller høy (60-80 mg BID) dose basert på individets modale daglige dose. I tabellene som viser kategoriske endringer, er prosentene (%-kolonnen) beregnet som 100x(n/N).

I langtidsstudier (minst 1 år), placebokontrollerte, fleksible doser ved schizofreni, var gjennomsnittlig endring fra baseline i tilfeldig glukose for ziprasidon 20-40 mg to ganger daglig -3,4 mg/dL (N=122); for ziprasidon var 60-80 mg BID +1,3 mg/dL (N=10); og for placebo var +0,3 mg/dL (N=71).
Dyslipidemi
Uønskede endringer i lipider er observert hos pasienter behandlet med atypiske antipsykotika. Sammenslåtte data fra kortsiktige, placebokontrollerte studier i schizofreni og bipolar lidelse er presentert i tabell 5-8.
langtidsstudier (minst 1 år), placebokontrollerte, fleksible doser ved schizofreni, var gjennomsnittlig endring fra baseline i tilfeldige triglyserider for ziprasidon 20-40 mg 2D +26,3 mg/dL (N=15); for ziprasidon var 60-80 mg BID -39,3 mg/dL (N=10); og for placebo var +12,9 mg/dL (N=9). I langtidsstudier (minst 1 år), placebokontrollerte, fleksible doser ved schizofreni var gjennomsnittlig endring fra baseline i tilfeldig totalkolesterol for ziprasidon 20-40 mg 2D +2,5 mg/dL (N=14); for ziprasidon var 60-80 mg BID -19,7 mg/dL (N=10); og for placebo var -28,0 mg/dL (N=9).
Vektøkning
Vektøkning er observert ved atypisk antipsykotisk bruk. Overvåking av vekt anbefales. Samlede data fra kortsiktige, placebokontrollerte studier i schizofreni og bipolar lidelse er presentert i tabell 9-10.
langtidsstudier (minst 1 år), placebokontrollerte, fleksible doser ved schizofreni, var gjennomsnittlig endring fra baselinevekt for ziprasidon 20-40 mg to ganger daglig -2,3 kg (N=124); for ziprasidon var 60-80 mg BID +2,5 kg (N=10); og for placebo var -2,9 kg (N=72). I de samme langtidsstudiene var andelen forsøkspersoner med ≥ 7 % vektøkning fra baseline for ziprasidon 20-40 mg to ganger daglig 5,6 % (N=124); for ziprasidon var 60-80 mg BID 20,0 % (N=10), og for placebo var 5,6 % (N=72). I en langsiktig (minst 1 år), placebokontrollert, fastdosestudie i schizofreni, var gjennomsnittlig endring fra baselinevekt for ziprasidon 20 mg 2D -2,6 kg (N=72); for ziprasidon var 40 mg BID -3,3 kg (N=69); for ziprasidon var 80 mg BID -2,8 kg (N=70) og for placebo var -3,8 kg (N=70). I den samme langtidsstudien med fast dose schizofreni var andelen av personer med ≥ 7 % vektøkning fra baseline for ziprasidon 20 mg to ganger daglig 5,6 % (N=72); for ziprasidon var 40 mg BID 2,9 % (N=69); for ziprasidon var 80 mg BID 5,7 % (N=70) og for placebo var 2,9 % (N=70).
Schizofreni
Andelene av pasienter som oppfyller et vektøkningskriterium på ≥ 7 % av kroppsvekten ble sammenlignet i en samling av fire 4- og 6-ukers placebokontrollerte kliniske studier med schizofreni, som avslørte en statistisk signifikant høyere forekomst av vektøkning for ziprasidon (10 %). ) sammenlignet med placebo (4 %). En median vektøkning på 0,5 kg ble observert hos ziprasidonpasienter sammenlignet med ingen median vektendring hos placebopasienter. I dette settet med kliniske studier ble vektøkning rapportert som en bivirkning hos henholdsvis 0,4 % og 0,4 % av ziprasidon- og placebopasientene. Under langtidsbehandling med ziprasidon avslørte en kategorisering av pasienter ved baseline på grunnlag av kroppsmasseindeks (BMI) den største gjennomsnittlige vektøkningen og høyeste forekomsten av klinisk signifikant vektøkning (> 7 % av kroppsvekten) hos pasienter med lav vekt. BMI (27). Det var en gjennomsnittlig vektøkning på 1,4 kg for de pasientene med en "lav" baseline BMI, ingen gjennomsnittlig endring for pasienter med en "normal" BMI, og et gjennomsnittlig vekttap på 1,3 kg for pasienter som gikk inn i programmet med en "høy" BMI.
Bipolar lidelse
løpet av en 6-måneders placebokontrollert bipolar vedlikeholdsstudie hos voksne med ziprasidon som tillegg til litium eller valproat, var forekomsten av klinisk signifikant vektøkning (≥ 7 % av kroppsvekten) under den dobbeltblinde perioden 5,6 % for både ziprasidon og placebobehandlingsgrupper som fullførte de 6 månedene med observasjon for tilbakefall. Tolkning av disse funnene bør ta i betraktning at bare pasienter som godt nok tolererte ziprasidon gikk inn i den dobbeltblinde fasen av studien, og det var betydelig frafall under den åpne fasen.
Utslett
premarketing-studier med ziprasidon utviklet omtrent 5 % av pasientene utslett og/eller urticaria, med seponering av behandlingen i omtrent en sjettedel av disse tilfellene. Forekomsten av utslett var relatert til dose av ziprasidon, selv om funnet også kan forklares med lengre eksponeringstid hos pasienter med høyere dose. Flere pasienter med utslett hadde tegn og symptomer på assosiert systemisk sykdom, f.eks. forhøyede WBC. De fleste pasientene ble umiddelbart bedre med tilleggsbehandling med antihistaminer eller steroider og/eller ved seponering av ziprasidon, og alle pasienter som opplevde disse reaksjonene ble rapportert å komme seg fullstendig. Ved opptreden av utslett som en alternativ etiologi ikke kan identifiseres for, bør ziprasidon seponeres.
Ortostatisk hypotensjon
Ziprasidon kan indusere ortostatisk hypotensjon assosiert med svimmelhet, takykardi og, hos noen pasienter, synkope, spesielt under den initiale dosetitreringsperioden, sannsynligvis noe som gjenspeiler dets α1-adrenerge antagonistegenskaper. Synkope ble rapportert hos 0,6 % av pasientene behandlet med ziprasidon.
Ziprasidon bør brukes med spesiell forsiktighet hos pasienter med kjent kardiovaskulær sykdom (historie med hjerteinfarkt eller iskemisk hjertesykdom, hjertesvikt eller ledningsforstyrrelser), cerebrovaskulær sykdom eller tilstander som kan disponere pasienter for hypotensjon (dehydrering, hypovolemi og behandling med antihypertensiva). medisiner).
Falls
Antipsykotiske legemidler (som inkluderer GEODON) kan forårsake somnolens, postural hypotensjon og motorisk og sensorisk ustabilitet, noe som kan føre til fall og følgelig brudd eller andre skader. For pasienter med sykdommer, tilstander eller medisiner som kan forverre disse effektene, fullfør fallrisikovurderinger ved oppstart av antipsykotisk behandling og gjentatte ganger for pasienter på langvarig antipsykotisk behandling.
Leukopeni, nøytropeni og agranulocytose
I kliniske studier og erfaring etter markedsføring har hendelser med leukopeni/nøytropeni blitt rapportert som er midlertidig relatert til antipsykotiske midler. Agranulocytose (inkludert dødelige tilfeller) er også rapportert.
Mulige risikofaktorer for leukopeni/nøytropeni inkluderer allerede eksisterende lavt antall hvite blodlegemer (WBC) og historie med legemiddelindusert leukopeni/nøytropeni. Pasienter med eksisterende lavt hvitt blodlegeme eller en historie med legemiddelindusert leukopeni/nøytropeni bør få overvåket fullstendig blodtelling (CBC) ofte i løpet av de første månedene av behandlingen og bør seponere GEODON ved første tegn på nedgang i hvitt blodlegemer i fravær. andre årsaksfaktorer.
Pasienter med nøytropeni bør overvåkes nøye for feber eller andre symptomer eller tegn på infeksjon og behandles umiddelbart dersom slike symptomer eller tegn oppstår. Pasienter med alvorlig nøytropeni (absolutt nøytrofiltall
Anfall
Under kliniske studier forekom anfall hos 0,4 % av pasientene behandlet med ziprasidon. Det var forvirrende faktorer som kan ha bidratt til forekomsten av anfall i mange av disse tilfellene. Som med andre antipsykotiske legemidler, bør ziprasidon brukes med forsiktighet hos pasienter med tidligere anfall eller med tilstander som potensielt senker krampeterskelen, f.eks. Alzheimers demens. Tilstander som senker anfallsterskelen kan være mer utbredt i en befolkning på 65 år eller eldre.
Dysfagi
Esophageal dysmotilitet og aspirasjon har vært assosiert med bruk av antipsykotiske legemidler. Aspirasjonspneumoni er en vanlig årsak til sykelighet og dødelighet hos eldre pasienter, spesielt de med langtkommen Alzheimers demens. Ziprasidon og andre antipsykotiske legemidler bør brukes med forsiktighet hos pasienter med risiko for aspirasjonspneumoni [se BOKS ADVARSEL ].
Hyperprolaktinemi
Som med andre legemidler som antagoniserer dopamin D2-reseptorer, øker ziprasidon prolaktinnivået hos mennesker. Økte prolaktinnivåer ble også observert i dyrestudier med denne forbindelsen, og var assosiert med en økning i brystkjertelneoplasi hos mus; en lignende effekt ble ikke observert hos rotter [se Ikke-klinisk toksikologi ]. Vevskultureksperimenter indikerer at omtrent en tredjedel av brystkreft hos mennesker er prolaktinavhengig in vitro, en faktor av potensiell betydning dersom forskrivning av disse legemidlene vurderes til en pasient med tidligere påvist brystkreft. Verken kliniske studier eller epidemiologiske studier utført til dags dato har vist en sammenheng mellom kronisk administrering av denne klassen medikamenter og tumorgenese hos mennesker; tilgjengelig bevis anses for begrenset til å være avgjørende på dette tidspunktet.
Selv om forstyrrelser som galaktoré, amenoré, gynekomasti og impotens er rapportert med prolaktinøkende forbindelser, er den kliniske betydningen av forhøyede serumprolaktinnivåer ukjent for de fleste pasienter. Langvarig hyperprolaktinemi når assosiert med hypogonadisme kan føre til redusert bentetthet.
Potensial for kognitiv og motorisk svikt
Somnolens var en vanlig rapportert bivirkning hos pasienter behandlet med ziprasidon. I de 4- og 6-ukers placebokontrollerte studiene ble det rapportert somnolens hos 14 % av pasientene på ziprasidon sammenlignet med 7 % av placebopasientene. Somnolens førte til seponering hos 0,3 % av pasientene i kortsiktige kliniske studier. Siden ziprasidon har potensial til å svekke dømmekraft, tenkning eller motoriske ferdigheter, bør pasienter advares mot å utføre aktiviteter som krever mental årvåkenhet, som å betjene et motorkjøretøy (inkludert biler) eller bruke farlige maskiner inntil de er rimelig sikre på at ziprasidonbehandling ikke gjør det. påvirke dem negativt.
Priapisme
Ett tilfelle av priapisme ble rapportert i premarketingdatabasen. Selv om forholdet mellom reaksjonen på bruk av ziprasidon ikke er fastslått, er det rapportert at andre legemidler med alfa-adrenerge blokkerende effekter induserer priapisme, og det er mulig at ziprasidon kan dele denne kapasiteten. Alvorlig priapisme kan kreve kirurgisk inngrep.
Kroppstemperaturregulering
Selv om det ikke er rapportert med ziprasidon i førmarkedsføringsstudier, har forstyrrelse av kroppens evne til å redusere kjernekroppstemperaturen blitt tilskrevet antipsykotiske midler. Passende forsiktighet anbefales ved forskrivning av ziprasidon til pasienter som vil oppleve tilstander som kan bidra til en økning i kjernekroppstemperatur, f.eks. å trene hardt, eksponering for ekstrem varme, samtidig motta medisiner med antikolinerg aktivitet, eller være utsatt for dehydrering.
Selvmord
Muligheten for et selvmordsforsøk er iboende i psykotisk sykdom eller bipolar lidelse, og tett oppfølging av høyrisikopasienter bør følge medikamentell behandling. Resepter for ziprasidon bør skrives ut for den minste mengde kapsler i samsvar med god pasientbehandling for å redusere risikoen for overdosering.
Pasienter med samtidige sykdommer
Klinisk erfaring med ziprasidon hos pasienter med visse samtidige systemiske sykdommer er begrenset [se Bruk i spesifikke populasjoner ].
Ziprasidon har ikke blitt evaluert eller brukt i nevneverdig grad hos pasienter med en nylig historie med hjerteinfarkt eller ustabil hjertesykdom. Pasienter med disse diagnosene ble ekskludert fra kliniske studier før markedsføring. På grunn av risikoen for QTc-forlengelse og ortostatisk hypotensjon med ziprasidon, bør det utvises forsiktighet hos hjertepasienter. [se QT-forlengelse og risiko for plutselig død, ortostatisk hypotensjon ].
Laboratorietester
Pasienter som vurderes for ziprasidon-behandling som er i fare for betydelige elektrolyttforstyrrelser, bør ha baseline-målinger av kalium og magnesium i serum. Lavt serumkalium og magnesium bør erstattes før du fortsetter med behandlingen. Pasienter som starter på diuretika under behandling med Ziprasidon trenger periodisk overvåking av serumkalium og magnesium. Ziprasidon bør seponeres hos pasienter som viser seg å ha vedvarende QTc-målinger >500 msek [se QT-forlengelse og risiko for plutselig død ].
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Administrasjonsinformasjon for kapsler
Råd pasientene til å ta GEODON kapsler hele. Ikke åpne, knus eller tygg kapslene. Instruer pasienter om å ta GEODON kapsler sammen med mat for optimal absorpsjon. Absorpsjonen av ziprasidon økes opptil det dobbelte i nærvær av mat [se DOSERING OG ADMINISTRASJON , NARKOTIKAHANDEL , og KLINISK FARMAKOLOGI ].
QTc-forlengelse
Råd pasientene til å informere helsepersonell om følgende: Anamnese med QT-forlengelse; nylig akutt hjerteinfarkt; ukompensert hjertesvikt; forskrivning av andre legemidler som har vist QT-forlengelse; risiko for betydelige elektrolyttavvik; og historie med hjertearytmi [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Instruer pasienter om å rapportere utbruddet av tilstander som setter dem i fare for betydelige elektrolyttforstyrrelser, spesielt hypokalemi, inkludert men ikke begrenset til oppstart av diuretikabehandling eller langvarig diaré. Instruer i tillegg pasienter om å rapportere symptomer som svimmelhet, hjertebank eller synkope til forskriveren [se ADVARSLER OG FORHOLDSREGLER ].
Alvorlige kutane bivirkninger
Instruer pasienter om å rapportere til helsepersonell så tidlig som mulig, alle tegn eller symptomer som kan være assosiert med legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) eller med alvorlige kutane bivirkninger, som Stevens-Johnsons syndrom [se ADVARSLER OG FORHOLDSREGLER ].
Svangerskap
Råd gravide kvinner til å varsle helsepersonell dersom de blir gravide eller har tenkt å bli gravide under behandling med GEODON. Informer pasienter om at GEODON kan forårsake ekstrapyramidale symptomer og/eller abstinenssymptomer (agitasjon, hypertoni, hypotoni, skjelving, somnolens, pustebesvær og matforstyrrelser) hos en nyfødt. Gi pasienter beskjed om at det finnes et eksponeringsregister for graviditet som overvåker graviditetsutfall hos kvinner som er eksponert for GEODON under graviditet [se Bruk i spesifikke populasjoner ].
Amming
Råd ammende kvinner som bruker GEODON 20mg for å overvåke spedbarn for overdreven sedasjon, irritabilitet, dårlig mating og ekstrapyramidale symptomer (skjelvinger og unormale muskelbevegelser) og å søke medisinsk hjelp hvis de merker disse tegnene [se Bruk i spesifikke populasjoner ].
Infertilitet
Informer kvinner med reproduksjonsevne at GEODON 80 mg kan svekke fertiliteten på grunn av en økning i serumprolaktinnivået. Effektene på fertilitet er reversible [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Livstids karsinogenitetsstudier ble utført med ziprasidon i Long Evans-rotter og CD-1-mus. Ziprasidon ble administrert i 24 måneder i dietten i doser på 2, 6 eller 12 mg/kg/dag til rotter, og 50, 100 eller 200 mg/kg/dag til mus (0,1 til 0,6 og 1 til 5 ganger maksimal anbefalt human dose (MRHD) på 200 mg/dag basert på henholdsvis mg/m2 kroppsoverflate). I rottestudien var det ingen bevis for økt forekomst av svulster sammenlignet med kontrollene. Hos hannmus var det ingen økning i forekomst av svulster i forhold til kontrollene. Hos hunnmus var det doserelaterte økninger i forekomsten av hypofyseadenom og karsinom, og brystkjerteladenokarsinom ved alle testede doser (50 til 200 mg/kg/dag eller 1 til 5 ganger MRHD basert på mg/m2 kropp) flateareal). Proliferative endringer i hypofysen og brystkjertlene til gnagere er observert etter kronisk administrering av andre antipsykotiske midler og anses å være prolaktin-mediert. Økning i serumprolaktin ble observert i en 1-måneds diettstudie på hunnmus, men ikke hannmus, med 100 og 200 mg/kg/dag (eller 2,5 og 5 ganger MRHD basert på mg/m2 kroppsoverflate). Ziprasidon hadde ingen effekt på serumprolaktin hos rotter i en 5-ukers diettstudie ved dosene som ble brukt i karsinogenitetsstudien. Relevansen for human risiko av funn av prolaktin-mediert endokrine svulster hos gnagere er ukjent [se ADVARSLER OG FORHOLDSREGLER ].
Mutagenese
Ziprasidon ble testet i Ames bakteriell mutasjonsanalyse, in vitro pattedyrcellegenmutasjons muselymfomanalyse, in vitro kromosomavviksanalyse i humane lymfocytter og in vivo kromosomavviksanalyse i musebenmarg. Det var en reproduserbar mutagen respons i Ames-analysen i én stamme av S. typhimurium i fravær av metabolsk aktivering. Positive resultater ble oppnådd i både in vitro pattedyrcelle-genmutasjonsanalysen og in vitro kromosomavviksanalysen i humane lymfocytter.
Nedsatt fruktbarhet
Ziprasidon ble vist å øke tiden til kopulering hos Sprague-Dawley-rotter i to fertilitetsstudier og tidlig embryonal utviklingsstudier ved doser på 10 til 160 mg/kg/dag (0,5 til 8 ganger MRHD på 200 mg/dag basert på mg/m2 kropp) flateareal). Fertilitetsraten ble redusert med 160 mg/kg/dag (8 ganger MRHD basert på mg/m2 kroppsoverflate). Det var ingen effekt på fertilitet ved 40 mg/kg/dag (2 ganger MRHD basert på mg/m2 kroppsoverflate). Effekten på fertiliteten så ut til å være hos hunnen siden fertiliteten ikke ble svekket når hanner gitt 160 mg/kg/dag (8 ganger MRHD basert på mg/m2 kroppsoverflate) ble paret med ubehandlede hunner.
Bruk i spesifikke populasjoner
Svangerskap
Eksponeringsregister for graviditet
Det finnes et graviditetseksponeringsregister som overvåker graviditetsutfall hos kvinner som eksponeres for atypiske antipsykotika, inkludert GEODON 40mg, under graviditet. Helsepersonell oppfordres til å registrere pasienter ved å kontakte National Pregnancy Registry for Atypical Antipsychotics på 1-866-961-2388 eller online på http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Risikosammendrag
Nyfødte eksponert for antipsykotiske legemidler, inkludert GEODON, i løpet av tredje trimester har risiko for ekstrapyramidale og/eller abstinenssymptomer etter fødsel (se Kliniske betraktninger ). Samlet tilgjengelige data fra publiserte epidemiologiske studier av gravide kvinner eksponert for ziprasidon har ikke etablert en medikamentassosiert risiko for alvorlige fødselsskader, spontanabort eller ugunstige utfall hos mor eller foster (se Data ). Det er risiko for moren forbundet med ubehandlet schizofreni eller bipolar lidelse I og med eksponering for antipsykotika, inkludert GEODON, under graviditet (se Kliniske betraktninger ).
dyrestudier forårsaket administrasjon av ziprasidon til gravide rotter og kaniner under organogenese utviklingstoksisitet ved doser tilsvarende anbefalte humane doser, og var teratogent hos kaniner ved 3 ganger maksimal anbefalt human dose (MRHD). Rotter eksponert for ziprasidon under drektighet og diegivning viste økt perinatal ungdødelighet og forsinket nevroadferdsmessig og funksjonell utvikling av avkom ved doser mindre enn eller lik humane terapeutiske doser (se Data ).
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for de angitte populasjonene er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 til 4 % og 15 til 20 %.
Kliniske betraktninger
Sykdomsrelatert risiko for mor og/eller embryo/foster
Det er risiko for mor fra ubehandlet schizofreni eller bipolar lidelse I, inkludert økt risiko for tilbakefall, sykehusinnleggelse og selvmord. Schizofreni og bipolar lidelse I er assosiert med økte uønskede perinatale utfall, inkludert prematur fødsel. Det er ikke kjent om dette er et direkte resultat av sykdommen eller andre komorbide faktorer.
Fetale/neonatale bivirkninger
Ekstrapyramidale og/eller abstinenssymptomer, inkludert agitasjon, hypertoni, hypotoni, skjelving, somnolens, pustebesvær og matforstyrrelser er rapportert hos nyfødte som ble eksponert for antipsykotiske legemidler, inkludert GEODON, i løpet av tredje trimester av svangerskapet. Disse symptomene har variert i alvorlighetsgrad. Overvåk nyfødte for ekstrapyramidale og/eller abstinenssymptomer og håndter symptomene på riktig måte. Noen nyfødte kom seg i løpet av timer eller dager uten spesifikk behandling; andre krevde langvarig sykehusinnleggelse.
Data
Menneskelige data
Publiserte data fra observasjonsstudier, fødselsregistre og kasusrapporter om bruk av atypiske antipsykotika under graviditet rapporterer ikke en klar sammenheng med antipsykotika og store fødselsskader. En retrospektiv kohortstudie fra en Medicaid-database med 9258 kvinner eksponert for antipsykotika under graviditet indikerte ikke en samlet økt risiko for alvorlige fødselsskader.
Dyredata
Når ziprasidon ble administrert til drektige kaniner i løpet av organogeneseperioden, ble det observert en økt forekomst av fosterstrukturelle abnormiteter (ventrikkelseptumdefekter og andre kardiovaskulære misdannelser og nyreendringer) ved en dose på 30 mg/kg/dag (3 ganger MRHD). på 200 mg/dag basert på mg/m2 kroppsoverflate). Det var ingen bevis som tyder på at disse utviklingseffektene var sekundære til maternell toksisitet. Utviklingsdosen uten effekt var 10 mg/kg/dag (tilsvarer MRHD basert på mg/m2 kroppsoverflate). Hos rotter ble embryoføtal toksisitet (redusert fostervekt, forsinket skjelettforbening) observert etter administrering av 10 til 160 mg/kg/dag (0,5 til 8 ganger MRHD basert på mg/m2 kroppsoverflate) under organogenese eller gjennom hele svangerskapet, men det var ingen tegn på teratogenitet. Doser på 40 og 160 mg/kg/dag (2 og 8 ganger MRHD basert på mg/m2 kroppsoverflate) var assosiert med maternell toksisitet. Utviklingsdosen uten effekt er 5 mg/kg/dag (0,2 ganger MRHD basert på mg/m2 kroppsoverflate).
Det var en økning i antall unger født døde og en nedgang i postnatal overlevelse gjennom de første 4 dagene av amming blant avkommet til hunnrotter behandlet under drektighet og diegivning med doser på 10 mg/kg/dag (0,5 ganger MRHD-basert på mg/m2 kroppsoverflate) eller mer. Forsinket utvikling av avkom (redusert ungvekt) og nevroatferdsmessig funksjonssvikt (oppretting av luft i øynene) ble observert ved doser på 5 mg/kg/dag (0,2 ganger MRHD basert på mg/m2 kroppsoverflate) eller mer. Det ble ikke etablert et nivå uten effekt for disse effektene.
Amming
Risikosammendrag
Begrensede data fra en publisert kasusrapport indikerer tilstedeværelsen av ziprasidon i morsmelk. Selv om det ikke er rapportert uønskede effekter på et spedbarn som ammes som er eksponert for ziprasidon via morsmelk, er det rapportert om overdreven sedasjon, irritabilitet, dårlig mating og ekstrapyramidale symptomer (skjelvinger og unormale muskelbevegelser) hos spedbarn som er eksponert for andre atypiske antipsykotika gjennom brystet. melk (se Kliniske betraktninger ). Det er ingen informasjon om effekten av ziprasidon på melkeproduksjonen. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for GEODON og eventuelle skadelige effekter på det ammede barnet fra GEODON 20 mg eller fra morens underliggende tilstand.
Kliniske betraktninger
Spedbarn som eksponeres for GEODON bør overvåkes for overdreven sedasjon, irritabilitet, dårlig mating og ekstrapyramidale symptomer (skjelvinger og unormale muskelbevegelser).
Kvinner og menn med reproduktivt potensial
Infertilitet
Kvinner
Basert på den farmakologiske virkningen til ziprasidon (D2-antagonisme), kan behandling med GEODON 40 mg resultere i en økning i serumprolaktinnivået, noe som kan føre til en reversibel reduksjon i fertilitet hos kvinner med reproduksjonspotensial [se ADVARSLER OG FORHOLDSREGLER og Ikke-klinisk toksikologi ].
Pediatrisk bruk
Sikkerhet og effektivitet av ziprasidon hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Av det totale antallet forsøkspersoner i kliniske studier med ziprasidon var 2,4 prosent 65 år eller eldre. Ingen generelle forskjeller i sikkerhet eller effektivitet ble observert mellom disse forsøkspersonene og yngre personer, og annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes. Likevel bør tilstedeværelsen av flere faktorer som kan øke den farmakodynamiske responsen på ziprasidon, eller forårsake dårligere toleranse eller ortostase, føre til vurdering av en lavere startdose, langsommere titrering og nøye overvåking under den innledende doseringsperioden for noen eldre pasienter.
Ziprasidon intramuskulært har ikke blitt systematisk evaluert hos eldre pasienter (65 år og over).
Nedsatt nyrefunksjon
Fordi ziprasidon er høyt metabolisert, med mindre enn 1 % av legemidlet utskilt uendret, er det usannsynlig at nedsatt nyrefunksjon alene vil ha stor innvirkning på farmakokinetikken til ziprasidon. Farmakokinetikken til ziprasidon etter 8 dager med 20 mg to ganger daglig dosering var lik blant personer med varierende grad av nedsatt nyrefunksjon (n=27), og personer med normal nyrefunksjon, noe som indikerer at dosejustering basert på graden av nedsatt nyrefunksjon ikke er nødvendig. . Ziprasidon fjernes ikke ved hemodialyse.
Intramuskulært ziprasidon har ikke blitt systematisk evaluert hos eldre pasienter eller hos pasienter med nedsatt lever- eller nyrefunksjon. Siden cyklodekstrinhjelpestoffet fjernes ved nyrefiltrering, bør ziprasidon intramuskulært administreres med forsiktighet til pasienter med nedsatt nyrefunksjon [se KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Siden ziprasidon elimineres vesentlig av leveren, forventes tilstedeværelsen av nedsatt leverfunksjon å øke AUC for ziprasidon; en flerdosestudie på 20 mg to ganger daglig i 5 dager hos personer (n=13) med klinisk signifikant (Childs-Pugh klasse A og B) skrumplever viste en økning i AUC 0-12 på 13 % og 34 % hos Childs- Pugh klasse A og B, henholdsvis sammenlignet med en matchet kontrollgruppe (n=14). En halveringstid på 7,1 timer ble observert hos personer med cirrhose sammenlignet med 4,8 timer i kontrollgruppen.
Effekter på alder og kjønn
en flerdosestudie (8 dager med behandling) som involverte 32 forsøkspersoner, var det ingen forskjell i farmakokinetikken til ziprasidon mellom menn og kvinner eller mellom eldre (>65 år) og unge (18 til 45 år). I tillegg har populasjonsfarmakokinetisk evaluering av pasienter i kontrollerte studier ikke avdekket klinisk signifikante alders- eller kjønnsrelaterte forskjeller i farmakokinetikken til ziprasidon. Doseendringer for alder eller kjønn anbefales derfor ikke.
Røyking
Basert på in vitro-studier med bruk av humane leverenzymer, er ziprasidon ikke et substrat for CYP1A2; røyking bør derfor ikke ha noen effekt på farmakokinetikken til ziprasidon. I samsvar med disse in vitro-resultatene har ikke populasjonsfarmakokinetisk evaluering avslørt noen signifikante farmakokinetiske forskjeller mellom røykere og ikke-røykere.
OVERDOSE
Menneskelig erfaring
premarketing-studier som involverte mer enn 5400 pasienter og/eller normale forsøkspersoner, ble utilsiktet eller tilsiktet overdosering av oral ziprasidon dokumentert hos 10 pasienter. Alle disse pasientene overlevde uten følgetilstander. Hos pasienten som tok den største bekreftede mengden, 3 240 mg, var de eneste symptomene som ble rapportert minimal sedasjon, sløvhet i tale og forbigående hypertensjon (200/95).
Bivirkninger rapportert ved overdosering av ziprasidon inkluderte ekstrapyramidale symptomer, somnolens, skjelving og angst. [se BIVIRKNINGER ]
Håndtering av overdosering
Ved akutt overdosering, etablere og vedlikeholde en luftvei og sørge for tilstrekkelig oksygenering og ventilasjon. Intravenøs tilgang bør etableres, og mageskylling (etter intubasjon, hvis pasienten er bevisstløs) og administrering av aktivt kull sammen med et avføringsmiddel bør vurderes. Muligheten for fortrengning, anfall eller dystoniske reaksjoner i hode og nakke etter overdose kan skape en risiko for aspirasjon med indusert emesis.
Kardiovaskulær overvåking bør starte umiddelbart og bør inkludere kontinuerlig elektrokardiografisk overvåking for å oppdage mulige arytmier. Hvis antiarytmisk terapi administreres, har disopyramid, prokainamid og kinidin en teoretisk fare for additive QT-forlengende effekter som kan være additive til ziprasidon.
Hypotensjon og sirkulasjonskollaps bør behandles med passende tiltak som intravenøs væske. Hvis sympatomimetika brukes til vaskulær støtte, bør ikke adrenalin og dopamin brukes, siden betastimulering kombinert med α1-antagonisme assosiert med ziprasidon kan forverre hypotensjon. På samme måte er det rimelig å forvente at de alfa-adrenerge blokkerende egenskapene til bretylium kan være additive til de til ziprasidon, noe som resulterer i problematisk hypotensjon.
Ved alvorlige ekstrapyramidale symptomer bør antikolinerge medisiner gis. Det er ingen spesifikk motgift mot ziprasidon, og det er ikke dialyserbart. Muligheten for multippel legemiddelinvolvering bør vurderes. Tett medisinsk tilsyn og overvåking bør fortsette til pasienten blir frisk.
KONTRAINDIKASJONER
QT-forlengelse
På grunn av ziprasidons doserelaterte forlengelse av QT-intervallet og den kjente assosiasjonen av fatale arytmier med QT-forlengelse av enkelte andre legemidler, er ziprasidon kontraindisert:
- . hos pasienter med en kjent historie med QT-forlengelse (inkludert medfødt lang QT-syndrom) . hos pasienter med nylig akutt hjerteinfarkt . hos pasienter med ukompensert hjertesvikt
Farmakokinetiske/farmakodynamiske studier mellom ziprasidon og andre legemidler som forlenger QT-intervallet er ikke utført. En additiv effekt av ziprasidon og andre legemidler som forlenger QT-intervallet kan ikke utelukkes. Ziprasidon bør derfor ikke gis sammen med:
- . dofetilid, sotalol, kinidin, andre antiarytmika av klasse Ia og III, mesoridazin, tioridazin, klorpromazin, droperidol, pimozid, sparfloxacin, gatifloxacin, moksifloksacin, halofantrin, meflokin, pentamidin, dometyloksyd, arsen, tametrylacetat, levolimacetat, levolimacetat, levolimsyre, pentylsyre eller . andre legemidler som har vist QT-forlengelse som en av sine farmakodynamiske effekter og har denne effekten beskrevet i den fullstendige forskrivningsinformasjonen som en kontraindikasjon eller en advarsel i boks eller fet skrift [se ADVARSLER OG FORHOLDSREGLER ].
Overfølsomhet
Ziprasidon er kontraindisert hos personer med kjent overfølsomhet overfor produktet.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Virkningsmekanismen til ziprasidon i behandlingen av de listede indikasjonene kan medieres gjennom en kombinasjon av dopamin type 2 (D2) og serotonin type 2 (5HT2) antagonisme.
Farmakodynamikk
Ziprasidon binder seg med relativt høy affinitet til dopamin D2 og D3, serotonin 5HT2A, 5HT2C, 5HT1A, 5HT1D og α1-adrenerge reseptorer (Ki s på henholdsvis 4.8, 7.2, 0.4, 1.3, 3.1, 2,M og 2,M). og med moderat affinitet til histamin H1-reseptoren (Ki=47 nM). Ziprasidon er en antagonist ved D2-, 5HT2A- og 5HT1D-reseptorene, og en agonist ved 5HT1A-reseptoren. Ziprasidon hemmet synaptisk gjenopptak av serotonin og noradrenalin. Ingen merkbar affinitet ble vist for andre reseptor/bindingssteder som ble testet, inkludert den kolinerge muskarine reseptoren (IC50 >1 μM).
Farmakokinetikk
Oral farmakokinetikk
Ziprasidons aktivitet skyldes først og fremst moderstoffet. Multippeldose-farmakokinetikken til ziprasidon er doseproporsjonal innenfor det foreslåtte kliniske doseområdet, og ziprasidonakkumulering er forutsigbar ved multippel dosering. Eliminering av ziprasidon skjer hovedsakelig via levermetabolisme med en gjennomsnittlig terminal halveringstid på ca. 7 timer innenfor det foreslåtte kliniske doseområdet. Steady-state-konsentrasjoner oppnås innen én til tre dager etter dosering. Gjennomsnittlig tilsynelatende systemisk clearance er 7,5 ml/min/kg. Ziprasidon er usannsynlig å forstyrre metabolismen av legemidler som metaboliseres av cytokrom P450-enzymer.
Absorpsjon
Ziprasidon absorberes godt etter oral administrering og når maksimal plasmakonsentrasjon etter 6 til 8 timer. Den absolutte biotilgjengeligheten av en 20 mg dose under matforhold er omtrent 60 %. Absorpsjonen av ziprasidon økes opptil det dobbelte i nærvær av mat.
Fordeling
Ziprasidon har et gjennomsnittlig tilsynelatende distribusjonsvolum på 1,5 l/kg. Det er mer enn 99 % bundet til plasmaproteiner, og binder primært til albumin og α1-syreglykoprotein. In vitro plasmaproteinbindingen til ziprasidon ble ikke endret av warfarin eller propranolol, to sterkt proteinbundne legemidler, og ziprasidon endret heller ikke bindingen av disse legemidlene i humant plasma. Dermed er potensialet for legemiddelinteraksjoner med ziprasidon på grunn av forskyvning minimal.
Metabolisme og eliminering
Ziprasidon metaboliseres i stor grad etter oral administrering med kun en liten mengde utskilles i urinen (
Intramuskulær farmakokinetikk
Systemisk biotilgjengelighet
Biotilgjengeligheten til ziprasidon administrert intramuskulært er 100 %. Etter intramuskulær administrering av enkeltdoser forekommer maksimale serumkonsentrasjoner vanligvis ca. 60 minutter etter dose eller tidligere, og gjennomsnittlig halveringstid (T½) varierer fra to til fem timer. Eksponeringen øker på en doserelatert måte og etter tre dagers intramuskulær dosering observeres liten akkumulering.
Metabolisme og eliminering
Selv om metabolismen og eliminasjonen av IM ziprasidon ikke har blitt systematisk evaluert, forventes det ikke at den intramuskulære administrasjonsveien endrer metabolske veier.
Kliniske studier
Schizofreni
Effekten av oral ziprasidon i behandlingen av schizofreni ble evaluert i 5 placebokontrollerte studier, 4 korttidsstudier (4- og 6-ukers) og en vedlikeholdsstudie. Alle studier var hos voksne innlagte pasienter, hvorav de fleste oppfylte DSM III-R-kriteriene for schizofreni. Hver studie inkluderte 2 til 3 faste doser ziprasidon samt placebo. Fire av de 5 studiene var i stand til å skille ziprasidon fra placebo; en korttidsstudie gjorde det ikke. Selv om en enkelt fastdose-haloperidolarm ble inkludert som en sammenlignende behandling i en av de tre korttidsstudiene, var denne enkeltstudien utilstrekkelig til å gi en pålitelig og gyldig sammenligning av ziprasidon og haloperidol.
Flere instrumenter ble brukt for å vurdere psykiatriske tegn og symptomer i disse studiene. The Brief Psychiatric Rating Scale (BPRS) og Positive and Negative Syndrome Scale (PANSS) er begge multi-element inventarer av generell psykopatologi som vanligvis brukes til å evaluere effekten av medikamentell behandling ved schizofreni. BPRS-psykoseklyngen (konseptuell desorganisering, hallusinatorisk atferd, mistenksomhet og uvanlig tankeinnhold) anses som en spesielt nyttig undergruppe for vurdering av aktivt psykotiske schizofrene pasienter. En annen mye brukt vurdering, Clinical Global Impression (CGI), gjenspeiler inntrykket av en dyktig observatør, fullt kjent med manifestasjonene av schizofreni, om den generelle kliniske tilstanden til pasienten. I tillegg ble Scale for Assessing Negative Symptoms (SANS) brukt for å vurdere negative symptomer i ett forsøk.
Resultatene av de orale Ziprasidon-forsøkene ved schizofreni følger
- . en 4-ukers, placebokontrollert studie (n=139) som sammenlignet 2 faste doser ziprasidon (20 og 60 mg to ganger daglig) med placebo, var bare 60 mg-dosen overlegen placebo på total BPRS-score og CGI-alvorlighetsgraden. score. Denne høyere dosegruppen var ikke overlegen placebo på BPRS-psykoseklyngen eller på SANS. . I en 6-ukers, placebokontrollert studie (n=302) som sammenlignet 2 faste doser ziprasidon (40 og 80 mg to ganger daglig) med placebo, var begge dosegruppene overlegne placebo på BPRS-totalskåren, BPRS-psykoseklyngen, CGI-alvorlighetsskåren og PANSS totale og negative subskala-score. Selv om 80 mg to ganger daglig hadde en numerisk større effekt enn 40 mg to ganger daglig, var forskjellen ikke statistisk signifikant. . en 6-ukers, placebokontrollert studie (n=419) som sammenlignet 3 faste doser ziprasidon (20, 60 og 100 mg to ganger daglig) med placebo, var alle tre dosegruppene overlegne placebo på PANSS totalscore, BPRS totalscore, BPRS psykosekluster og CGI alvorlighetsgrad. Bare dosegruppen 100 mg to ganger daglig var overlegen placebo på PANSS-negativ subskala-score. Det var ingen klare bevis for en dose-respons sammenheng innenfor doseområdet 20 mg to ganger daglig til 100 mg to ganger daglig. . I en 4-ukers, placebokontrollert studie (n=200) som sammenlignet 3 faste doser av ziprasidon (5, 20 og 40 mg to ganger daglig), var ingen av dosegruppene statistisk overlegne placebo på noen av interessene. . En studie ble utført på stabile kroniske eller subkroniske (CGI-S ≤5 ved baseline) schizofrene inneliggende pasienter (n=294) som hadde vært innlagt på sykehus i ikke mindre enn to måneder. Etter en 3-dagers enkeltblind placebo-innkjøring ble forsøkspersoner randomisert til en av 3 faste doser ziprasidon (20 mg, 40 mg eller 80 mg to ganger daglig) eller placebo og observert for tilbakefall. Pasienter ble observert for "forestående psykotisk tilbakefall", definert som CGI-forbedringsscore på ≤6 (mye verre eller veldig mye verre) og/eller skårer ≤6 (moderat alvorlig) på fiendtlighets- eller manglende samarbeidsevne i PANSS to påfølgende dager . Ziprasidon var signifikant bedre enn placebo i tid til tilbakefall, uten signifikant forskjell mellom de forskjellige dosegruppene. Det var utilstrekkelig data til å undersøke populasjonsundergrupper basert på alder og rase. Undersøkelse av populasjonsundergrupper basert på kjønn avdekket ingen differensiell respons.
Bipolar I-lidelse (akutt blandede eller maniske episoder og vedlikeholdsbehandling som tillegg til litium eller valproat)
Akutt manisk og blandede episoder assosiert med bipolar I-lidelse
Effekten av ziprasidon ble fastslått i 2 placebokontrollerte, dobbeltblinde, 3-ukers monoterapistudier hos pasienter som oppfyller DSM-IV-kriteriene for bipolar I lidelse, manisk eller blandet episode med eller uten psykotiske trekk. Primære vurderingsinstrumenter brukt for å vurdere maniske symptomer i disse forsøkene var: (1) Mania Rating Scale (MRS), som er avledet fra Schedule for Affective Disorders and Schizophrenia-Change Version (SADS-CB) med elementer gruppert som manisk syndrom subskala (forhøyet humør, mindre behov for søvn, overdreven energi, overdreven aktivitet, grandiositet), Behavior and Ideation subscale (irritabilitet, motorisk hyperaktivitet, akselerert tale, løpende tanker, dårlig dømmekraft) og nedsatt innsikt; og (2) Clinical Global Impression-Severity of Illness Scale (CGI-S), som ble brukt til å vurdere den kliniske betydningen av behandlingsrespons.
Resultatene av de orale ziprasidon-studiene ved bipolar I-lidelse hos voksne, manisk/blandet episode følger: i en 3-ukers placebokontrollert studie (n=210), var dosen av ziprasidon 40 mg to ganger daglig på dag 1 og 80 mg to ganger daglig på dag 2. Titrering innenfor området 40-80 mg to ganger daglig (i intervaller på 20 mg to ganger daglig) var tillatt under studiens varighet. Ziprasidon var signifikant mer effektivt enn placebo når det gjaldt reduksjon av MRS total score og CGI-S score. Gjennomsnittlig daglig dose av ziprasidon i denne studien var 132 mg. I en andre 3-ukers placebokontrollert studie (n=205), var dosen av ziprasidon 40 mg to ganger daglig på dag 1. Titrering innenfor området 40-80 mg to ganger daglig (i 20 mg to ganger daglig intervaller) var tillatt for varigheten av studiet (begynner på dag 2). Ziprasidon var signifikant mer effektivt enn placebo når det gjaldt reduksjon av MRS total score og CGI-S score. Gjennomsnittlig daglig dose av ziprasidon i denne studien var 112 mg.
Vedlikeholdsterapi
Effekten av ziprasidon som tilleggsbehandling til litium eller valproat i vedlikeholdsbehandling av bipolar lidelse I ble etablert i en placebokontrollert studie med pasienter som oppfylte DSM-IV-kriteriene for bipolar I-lidelse. Forsøket inkluderte pasienter hvis siste episode var manisk eller blandet, med eller uten psykotiske trekk. I den åpne fasen måtte pasientene stabiliseres på ziprasidon pluss litium eller valproinsyre i minst 8 uker for å bli randomisert. I den dobbeltblinde randomiserte fasen fortsatte pasientene behandlingen med litium eller valproinsyre og ble randomisert til å motta enten ziprasidon (administrert to ganger daglig med totalt 80 mg til 160 mg per dag) eller placebo. Generelt, i vedlikeholdsfasen, fortsatte pasientene på samme dose som de ble stabilisert på under stabiliseringsfasen. Det primære endepunktet i denne studien var tid til gjentakelse av en stemningsepisode (manisk, blandet eller deprimert episode) som krevde intervensjon, som ble definert som ett av følgende: seponering på grunn av en stemningsepisode, klinisk intervensjon for en stemningsepisode (f.eks. initiering av medisinering eller sykehusinnleggelse), eller Mania Rating Scale-score ≥ 18 eller en MADRS-score ≥18 (ved 2 påfølgende vurderinger med ikke mer enn 10 dagers mellomrom). Totalt 584 personer ble behandlet i den åpne stabiliseringsperioden. I den dobbeltblinde randomiseringsperioden ble 127 personer behandlet med ziprasidon, og 112 personer ble behandlet med placebo. Ziprasidon var overlegen placebo når det gjaldt å øke tiden til gjentakelse av en stemningsepisode. Typen av tilbakefallshendelser som ble observert inkluderte depressive, maniske og blandede episoder. Depressive, maniske og blandede episoder utgjorde henholdsvis 53 %, 34 % og 13 % av det totale antallet tilbakefallshendelser i studien.
Akutt behandling av agitasjon ved schizofreni
Effekten av intramuskulært ziprasidon i behandlingen av agiterte schizofrene pasienter ble fastslått i to kortsiktige, dobbeltblindede studier med schizofrene forsøkspersoner som av etterforskerne ble ansett for å være "akutt agiterte" og som hadde behov for IM antipsykotisk medisin. I tillegg ble pasienter pålagt å ha en score på 3 eller mer på minst 3 av følgende elementer i PANSS: angst, spenning, fiendtlighet og spenning. Effekten ble evaluert ved analyse av arealet under kurven (AUC) av Behavioural Activity Rating Scale (BARS) og Clinical Global Impression (CGI) alvorlighetsgrad. BARS er en syvpunktsskala med poeng fra 1 (vanskelig eller ikke i stand til å vekke) til 7 (voldelig, krever tilbakeholdenhet). Pasienter' score på BARS ved baseline var for det meste 5 (tegn på åpenbar aktivitet [fysisk eller verbal], roer seg ned med instruksjoner) og viste en grad av agitasjon som tilsier intramuskulær terapi, som bestemt av etterforskere. Det var få pasienter med en vurdering høyere enn 5 på BARS, ettersom de mest alvorlig agiterte pasientene generelt ikke var i stand til å gi informert samtykke for deltakelse i kliniske studier før markedsføring.
Begge studiene sammenlignet høyere doser av ziprasidon intramuskulært med en kontrolldose på 2 mg. I en studie var den høyere dosen 20 mg, som kunne gis opptil 4 ganger i løpet av studiens 24 timer, med mellomdoseintervaller på ikke mindre enn 4 timer. I den andre studien var den høyere dosen 10 mg, som kunne gis opptil 4 ganger i løpet av studiens 24 timer, med mellomdoseintervaller på ikke mindre enn 2 timer.
Resultatene av de intramuskulære Ziprasidon-forsøkene følger
. I en én-dagers, dobbeltblind, randomisert studie (n=79) som involverte doser av ziprasidon intramuskulært på 20 mg eller 2 mg, opp til QID, var ziprasidon intramuskulært 20 mg statistisk overlegent ziprasidon intramuskulært 2 mg, vurdert ved AUC av BARS etter 0 til 4 timer, og etter CGI-alvorlighet ved 4 timer og studieendepunkt. . en annen en-dagers, dobbeltblind, randomisert studie (n=117) som involverte doser av ziprasidon intramuskulært på 10 mg eller 2 mg, opp til QID, var ziprasidon intramuskulært 10 mg statistisk overlegent ziprasidon intramuskulært 2 mg, vurdert ved AUC av BARS ved 0 til 2 timer, men ikke etter CGI-alvorlighetsgrad.PASIENTINFORMASJON
GEODON® Kapsler (ziprasidon)
Informasjon til pasienter som tar GEODON eller deres omsorgspersoner
Dette sammendraget inneholder viktig informasjon om GEODON. Det er ikke ment å erstatte legens instruksjoner. Les denne informasjonen nøye før du tar GEODON. Spør legen din eller apoteket hvis du ikke forstår noe av denne informasjonen eller hvis du vil vite mer om GEODON.
Hva er GEODON 80mg?
GEODON er en type reseptbelagte medisiner kalt psykotrope, også kjent som et atypisk antipsykotikum. GEODON kan brukes til å behandle symptomer på schizofreni og akutte maniske eller blandede episoder assosiert med bipolar lidelse. GEODON 80mg kan også brukes som vedlikeholdsbehandling av bipolar lidelse når det legges til litium eller valproat.
Hvem bør ta GEODON 20mg?
Bare legen din kan vite om GEODON er riktig for deg. GEODON 20mg kan bli foreskrevet til deg hvis du har schizofreni eller bipolar lidelse.
Symptomer på schizofreni kan omfatte:
- . høre stemmer, se ting eller sanse ting som ikke er der (hallusinasjoner) . tro som ikke er sann (vrangforestillinger) . uvanlig mistenksomhet (paranoia) . å bli trukket tilbake fra familie og venner
Symptomer på maniske eller blandede episoder av bipolar lidelse kan omfatte:
- . ekstremt høyt eller irritabelt humør . økt energi, aktivitet og rastløshet . kjøre tanker eller snakke veldig fort . lett distrahert . lite behov for søvn
Hvis du viser respons på GEODON 40 mg, kan symptomene dine bli bedre. Hvis du fortsetter å ta GEODON 40 mg, er det mindre sjanse for at symptomene dine kommer tilbake. Ikke slutt å ta kapslene selv når du føler deg bedre uten først å diskutere det med legen din.
Det er også viktig å huske at GEODON 40 mg kapsler bør tas sammen med mat.
Hva er den viktigste sikkerhetsinformasjonen jeg bør vite om GEODON 20mg?
GEODON er ikke godkjent for behandling av pasienter med demensrelatert psykose. Eldre pasienter med diagnosen psykose relatert til demens behandlet med antipsykotika har økt risiko for død sammenlignet med pasienter som behandles med placebo (en sukkerpille).
GEODON er et effektivt medikament for å behandle symptomene på schizofreni og de maniske eller blandede episodene av bipolar lidelse. En potensiell bivirkning er imidlertid at den kan endre måten den elektriske strømmen i hjertet ditt fungerer mer enn noen andre medikamenter. Forandringen er liten og det er ikke kjent om dette vil være skadelig, men noen andre medikamenter som forårsaker denne typen endring har i sjeldne tilfeller forårsaket farlige hjerterytmeavvik. På grunn av dette bør GEODON kun brukes etter at legen din har vurdert denne risikoen for GEODON opp mot risikoen og fordelene ved andre medisiner tilgjengelig for behandling av schizofreni eller bipolare maniske og blandede episoder.
Risikoen for farlige endringer i hjerterytmen kan øke hvis du tar visse andre medisiner og hvis du allerede har visse unormale hjertesykdommer. Derfor er det viktig å fortelle legen din om eventuelle andre medisiner du tar, inkludert reseptfrie medisiner, kosttilskudd og urtemedisiner. Du må også fortelle legen din om eventuelle hjerteproblemer du har eller har hatt.
Hvem bør IKKE ta GEODON 40mg?
Eldre pasienter med diagnosen psykose relatert til demens. GEODON er ikke godkjent for behandling av disse pasientene.
Alt som kan øke sjansen for unormal hjerterytme bør unngås. Ta derfor ikke GEODON 80mg hvis:
- . Du har visse hjertesykdommer, for eksempel langt QT-syndrom, et nylig hjerteinfarkt, alvorlig hjertesvikt eller visse uregelmessigheter i hjerterytmen (diskuter detaljene med legen din) . Du tar for øyeblikket medisiner som ikke bør tas i kombinasjon med ziprasidon, for eksempel dofetilid, sotalol, kinidin, andre antiarytmika i klasse Ia og III, mesoridazin, tioridazin, klorpromazin, droperidol, pimozid, sparfloxacin, gatifloxacin, mfloxiantrinacin, halofoxiantrinacin. , meflokin, pentamidin, arsentrioksid, levometadylacetat, dolasetronmesylat, probukol eller takrolimus.
Hva du bør fortelle legen din før du begynner med GEODON
Bare legen din kan avgjøre om GEODON er riktig for deg. Før du starter GEODON, sørg for å fortelle legen din dersom du:
- . har hatt problemer med hvordan hjertet ditt slår eller noen hjerterelatert sykdom eller sykdom . enhver familiehistorie med hjertesykdom, inkludert nylig hjerteinfarkt . har hatt problemer med besvimelse eller svimmelhet . tar eller nylig har tatt reseptbelagte legemidler . tar reseptfrie legemidler du kan kjøpe uten resept, inkludert naturlige/urtemedisiner . har hatt noen problemer med leveren din . er gravid, kan være gravid eller planlegger å bli gravid . ammer eller planlegger å amme . er allergisk mot noen medisiner . noen gang har hatt en allergisk reaksjon på ziprasidon eller noen av de andre innholdsstoffene i GEODON 20 mg kapsler. Spør legen din eller apoteket om en liste over disse ingrediensene . har lave nivåer av kalium eller magnesium i blodet
Legen din vil kanskje at du skal få flere laboratorietester for å se om GEODON 40mg er en passende behandling for deg.
GEODON og andre medisiner
Det er noen medisiner som kan være utrygge å bruke når du tar GEODON, og det er noen medisiner som kan påvirke hvor godt GEODON 40mg virker. Mens du er på GEODON, sjekk med legen din før du starter nye reseptbelagte eller reseptfrie medisiner, inkludert naturlige/urtemedisiner.
Hvordan du tar GEODON
- . Ta GEODON kun som anvist av legen din. . Svelg GEODON kapsler hele. Ikke tygg, knus eller åpne kapslene. . Ta GEODON 40mg kapsler sammen med mat. . Det er best å ta GEODON 80 mg til samme tid hver dag. . Det kan ta noen uker før GEODON 80mg virker. Det er viktig å være tålmodig. . Ikke endre dosen eller slutte å ta medisinen uten legens godkjenning. . Husk å fortsette å ta kapslene dine, selv når du føler deg bedre.
Mulige bivirkninger
Fordi disse problemene kan bety at du har en unormal hjerterytme, kontakt legen din UMIDDELBART hvis du:
- . Besvime eller miste bevisstheten . Føl en endring i måten hjertet ditt slår (hjertebank)
Vanlige bivirkninger av GEODON inkluderer følgende og bør også diskuteres med legen din hvis de oppstår:
- . Føler seg uvanlig trøtt eller trøtt . Kvalme eller urolig mage . Forstoppelse . Svimmelhet . Rastløshet . Unormale muskelbevegelser, inkludert skjelving, stokking og ukontrollerte ufrivillige bevegelser . Diaré . Utslett . Økt hoste/rennende nese
Hvis du utvikler bivirkninger som bekymrer deg, snakk med legen din. Det er spesielt viktig å fortelle legen din dersom du har diaré, oppkast eller en annen sykdom som kan føre til at du mister væske. Legen din vil kanskje sjekke blodet ditt for å forsikre deg om at du har riktig mengde viktige salter etter slike sykdommer.
For en liste over alle bivirkninger som har blitt rapportert, spør legen din eller apoteket om GEODON Professional pakningsvedlegget.
Hva du skal gjøre for en overdose
I tilfelle en overdose, ring legen din eller giftkontrollsenteret med en gang eller gå til nærmeste legevakt.
Annen viktig sikkerhetsinformasjon
En alvorlig tilstand kalt malignt neuroleptisk syndrom (NMS) kan oppstå med alle antipsykotiske medisiner inkludert GEODON. Tegn på NMS inkluderer svært høy feber, stive muskler, risting, forvirring, svette eller økt hjertefrekvens og blodtrykk. NMS er en sjelden, men alvorlig bivirkning som kan være dødelig. Fortell derfor legen din dersom du opplever noen av disse tegnene.
Forsinket medikamentreaksjon kalt legemiddelreaksjon med eosinofili og systemiske symptomer (DRESS) kan oppstå med ziprasidon. Tegn på DRESS kan omfatte utslett, feber og hovne lymfeknuter. Andre alvorlige kutane bivirkninger (SCAR), som Stevens-Johnsons syndrom, kan oppstå med ziprasidon. Tegn på Stevens-Johnsons syndrom kan omfatte utslett med blemmer som kan omfatte sår i munnen, hudavfall, feber og mållignende flekker i huden. DRESS og andre ARR er noen ganger dødelige; Fortell derfor legen din umiddelbart hvis du opplever noen av disse symptomene.
Bivirkninger relatert til høyt blodsukker (hyperglykemi), noen ganger alvorlige, er rapportert hos pasienter behandlet med atypiske antipsykotika. Det har vært få rapporter om hyperglykemi eller diabetes hos pasienter behandlet med GEODON, og det er ikke kjent om GEODON er assosiert med disse reaksjonene. Pasienter som behandles med et atypisk antipsykotikum bør overvåkes for symptomer på hyperglykemi.
Svimmelhet forårsaket av et blodtrykksfall kan oppstå med GEODON, spesielt når du først begynner å ta denne medisinen eller når dosen økes. Hvis dette skjer, vær forsiktig så du ikke reiser deg for raskt, og snakk med legen din om problemet.
Før du tar GEODON, fortell legen din dersom du
- . er gravid eller planlegger å bli gravid.
- . Hvis du blir gravid mens du får GEODON 80mg, snakk med helsepersonell om registrering hos det nasjonale svangerskapsregisteret for atypiske antipsykotika. Du kan registrere deg ved å ringe 1-866-961-2388 eller gå til http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Fordi GEODON 80mg kan forårsake søvnighet, vær forsiktig når du bruker maskiner eller kjører et motorkjøretøy.
Siden medisiner av samme legemiddelklasse som GEODON kan forstyrre kroppens evne til å tilpasse seg varme, er det best å unngå situasjoner som involverer høy temperatur eller fuktighet.
Det er best å unngå å innta alkoholholdige drikker mens du tar GEODON.
Ring legen din umiddelbart hvis du tar mer enn mengden GEODON som er foreskrevet av legen din.
GEODON har ikke vist seg å være trygt eller effektivt ved behandling av barn og tenåringer under 18 år.
Oppbevar GEODON 80mg og alle legemidler utilgjengelig for barn.
Hvordan du oppbevarer GEODON
Oppbevar GEODON 20 mg kapsler ved romtemperatur (59 °F til 86 °F eller 15 °C til 30 °C).
For mer informasjon om GEODON
Dette arket er kun et sammendrag. GEODON 20mg er et reseptbelagt legemiddel og bare legen din kan avgjøre om det er riktig for deg. Hvis du har spørsmål eller ønsker mer informasjon om GEODON, snakk med legen din eller apoteket. Du kan også besøke www.geodon.com.
Merkingen av dette produktet kan ha blitt oppdatert. For den nyeste forskrivningsinformasjonen, vennligst besøk www.pfizer.com
