Remeron 15mg, 30mg Mirtazapine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Remeron og hvordan brukes det?
Remeron er en reseptbelagt medisin som brukes til å behandle symptomer på depresjon. Remeron 30mg kan brukes alene eller sammen med andre medisiner.
Remeron tilhører en klasse legemidler som kalles antidepressiva, alfa-2-antagonister; Antidepressiva, andre.
Det er ikke kjent om Remeron 30mg er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Remeron 30mg?
Remeron kan forårsake alvorlige bivirkninger, inkludert:
- . føler seg rastløs, . løpende tanker, . redusert behov for søvn, . uvanlig risikoatferd, . følelser av ekstrem lykke eller tristhet, . være mer pratsom enn vanlig, . tåkesyn, . tunnelsyn, . øyesmerter eller hevelse, . ser glorier rundt lys, . svimmelhet, . feber, . frysninger, . sår hals, . munnsår, . endringer i vekt eller appetitt, . alvorlig utslett, blemmer eller hevelse på håndflatene eller fotsålene, . kramper (anfall), . hodepine, . forvirring, . utydelig tale, . alvorlig svakhet, . oppkast, . tap av koordinasjon, og . føler seg ustø
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Remeron inkluderer:
- . døsighet, . svimmelhet, . merkelige drømmer, . tørr i munnen, . forstoppelse, . økt appetitt, og . vektøkning
Fortell legen din dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Remeron. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Suicidalitet og antidepressiva
Antidepressiva økte risikoen sammenlignet med placebo for selvmordstenkning og -adferd (suicidalitet) hos barn, ungdom og unge voksne i korttidsstudier av alvorlig depressiv lidelse (MDD) og andre psykiatriske lidelser. Alle som vurderer bruk av REMERON® (mirtazapin) tabletter eller andre antidepressiva hos et barn, ungdom eller ung voksen må balansere denne risikoen med det kliniske behovet. Korttidsstudier viste ikke en økning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne over 24 år; det var en reduksjon i risiko med antidepressiva sammenlignet med placebo hos voksne i alderen 65 år og eldre. Depresjon og visse andre psykiatriske lidelser er i seg selv assosiert med økt risiko for selvmord. Pasienter i alle aldre som starter på antidepressiv behandling bør overvåkes på passende måte og observeres nøye for klinisk forverring, suicidalitet eller uvanlige endringer i atferd. Familier og omsorgspersoner bør informeres om behovet for tett observasjon og kommunikasjon med forskriveren. REMERON er ikke godkjent for bruk hos pediatriske pasienter. (Se ADVARSLER: Klinisk forverring og selvmordsrisiko, PASIENTINFORMASJON og FORHOLDSREGLER: Pediatrisk bruk)
BESKRIVELSE
REMERON® (mirtazapin) tabletter er et oralt administrert legemiddel. Mirtazapin har en tetrasyklisk kjemisk struktur og tilhører piperazino-azepingruppen av forbindelser. Det er betegnet 1,2,3,4,10,14b-heksahydro-2-metylpyrazino[2,1-a]pyrido[2,3-c]benzazepin og har den empiriske formelen C17H19N3. Dens molekylvekt er 265,36. Strukturformelen er følgende og den er den racemiske blandingen:
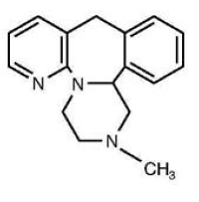
Mirtazapin er et hvitt til kremhvitt krystallinsk pulver som er lett løselig i vann.
REMERON leveres for oral administrering som filmdrasjerte tabletter med delestrek som inneholder 15 eller 30 mg mirtazapin, og filmdrasjerte tabletter uten delekår som inneholder 45 mg mirtazapin. Hver tablett inneholder også maisstivelse, hydroksypropylcellulose, magnesiumstearat, kolloidalt silisiumdioksid, laktose og andre inaktive ingredienser.
INDIKASJONER
REMERON (mirtazapin) tabletter er indisert for behandling av alvorlig depressiv lidelse.
Effekten av REMERON i behandlingen av alvorlig depressiv lidelse ble fastslått i 6-ukers kontrollerte studier av polikliniske pasienter hvis diagnoser samsvarte mest med Diagnostic and Statistical Manual of Mental Disorders - 3. utgave (DSM-III) kategori av alvorlig depressiv lidelse (se KLINISK FARMAKOLOGI ).
En alvorlig depressiv episode (DSM-IV) innebærer en fremtredende og relativt vedvarende (nesten hver dag i minst 2 uker) deprimert eller dysforisk stemning som vanligvis forstyrrer daglig funksjon, og inkluderer minst 5 av følgende 9 symptomer: deprimert humør, tap av interesse for vanlige aktiviteter, betydelig endring i vekt og/eller appetitt, søvnløshet eller hypersomni, psykomotorisk agitasjon eller retardasjon, økt tretthet, skyldfølelse eller verdiløshet, senket tenkning eller nedsatt konsentrasjon, et selvmordsforsøk eller selvmordstanker.
Effektiviteten av REMERON 15 mg hos deprimerte pasienter på sykehus er ikke tilstrekkelig undersøkt.
Effekten av REMERON 15 mg for å opprettholde en respons hos pasienter med alvorlig depressiv lidelse i opptil 40 uker etter 8 til 12 uker med innledende åpen behandling ble vist i en placebokontrollert studie. Likevel bør legen som velger å bruke REMERON 15mg i lengre perioder med jevne mellomrom revurdere den langsiktige nytten av legemidlet for den enkelte pasient (se KLINISK FARMAKOLOGI ).
DOSERING OG ADMINISTRASJON
Innledende behandling
Den anbefalte startdosen for REMERON (mirtazapin) tabletter er 15 mg/dag, administrert i en enkelt dose, helst om kvelden før du skal sove. I de kontrollerte kliniske studiene som etablerte effekten av REMERON ved behandling av alvorlig depressiv lidelse, var det effektive doseområdet vanligvis 15 til 45 mg/dag. Selv om forholdet mellom dose og tilfredsstillende respons ved behandling av alvorlig depressiv lidelse for REMERON 15 mg ikke er tilstrekkelig undersøkt, kan pasienter som ikke responderer på den initiale 15 mg dosen ha nytte av doseøkninger opp til maksimalt 45 mg/dag. REMERON har en eliminasjonshalveringstid på ca. 20 til 40 timer; doseendringer bør derfor ikke gjøres med intervaller på mindre enn 1 til 2 uker for å gi tilstrekkelig tid til å evaluere den terapeutiske responsen på en gitt dose.
Eldre og pasienter med nedsatt nyre- eller leverfunksjon
Clearance av mirtazapin er redusert hos eldre pasienter og hos pasienter med moderat til alvorlig nedsatt nyre- eller leverfunksjon. Følgelig bør forskriveren være klar over at plasmanivåene av mirtazapin kan øke hos disse pasientgruppene, sammenlignet med nivåene observert hos yngre voksne uten nedsatt nyre- eller leverfunksjon (se FORHOLDSREGLER og KLINISK FARMAKOLOGI ).
Vedlikehold/utvidet behandling
Det er generelt enighet om at akutte episoder med depresjon krever flere måneder eller lenger med vedvarende farmakologisk behandling utover respons på den akutte episoden. Systematisk evaluering av REMERON (mirtazapin) tabletter har vist at dens effekt ved alvorlig depressiv lidelse opprettholdes i perioder på opptil 40 uker etter 8 til 12 uker med initial behandling med en dose på 15 til 45 mg/dag (se KLINISK FARMAKOLOGI ). Basert på disse begrensede dataene er det ukjent om dosen av REMERON 30 mg som er nødvendig for vedlikeholdsbehandling er identisk med dosen som er nødvendig for å oppnå en initial respons. Pasienter bør regelmessig revurderes for å fastslå behovet for vedlikeholdsbehandling og passende dose for slik behandling.
Bytte en pasient til eller fra en monoaminoksidasehemmer (MAOI) beregnet på å behandle psykiatriske lidelser
Det bør gå minst 14 dager mellom seponering av en MAO-hemmer beregnet på å behandle psykiatriske lidelser og oppstart av behandling med REMERON (mirtazapin) tabletter. Motsatt bør det tillates minst 14 dager etter seponering av REMERON 30 mg før man starter en MAO-hemmer beregnet på å behandle psykiatriske lidelser (se KONTRAINDIKASJONER ).
Bruk av REMERON 15mg med andre MAO-hemmere, som linezolid eller metylenblått
Ikke start REMERON 15mg hos en pasient som behandles med linezolid eller intravenøs metylenblått fordi det er økt risiko for serotonergt syndrom. Hos en pasient som trenger mer akutt behandling av en psykiatrisk tilstand, bør andre intervensjoner, inkludert sykehusinnleggelse, vurderes (se KONTRAINDIKASJONER ).
noen tilfeller kan en pasient som allerede får behandling med REMERON 30 mg trenge akuttbehandling med linezolid eller intravenøs metylenblått. Hvis akseptable alternativer til linezolid eller intravenøs behandling med metylenblått ikke er tilgjengelig og de potensielle fordelene ved behandling med linezolid eller intravenøs metylenblått vurderes å oppveie risikoen for serotonergt syndrom hos en bestemt pasient, bør REMERON 30 mg stoppes umiddelbart, og linezolid eller intravenøs metylen blått kan administreres. Pasienten bør overvåkes for symptomer på serotonergt syndrom i 2 uker eller inntil 24 timer etter siste dose linezolid eller intravenøs metylenblått, avhengig av hva som kommer først. Behandling med REMERON 30 mg kan gjenopptas 24 timer etter siste dose linezolid eller intravenøs metylenblått (se ADVARSLER ).
Risikoen for å administrere metylenblått på ikke-intravenøse veier (som orale tabletter eller ved lokal injeksjon) eller i intravenøse doser mye lavere enn 1 mg/kg med REMERON er uklar. Legen bør likevel være klar over muligheten for nye symptomer på serotonergt syndrom ved slik bruk (se ADVARSLER ).
Seponering av REMERON-behandling
Symptomer forbundet med seponering eller dosereduksjon av REMERON 15 mg tabletter er rapportert. Pasienter bør overvåkes for disse og andre symptomer når behandlingen avsluttes eller under dosereduksjon. En gradvis reduksjon av dosen over flere uker, snarere enn brå seponering, anbefales når det er mulig. Hvis det oppstår utålelige symptomer etter en dosereduksjon eller ved seponering av behandlingen, bør dosetitrering administreres på grunnlag av pasientens kliniske respons (se FORHOLDSREGLER og BIVIRKNINGER ).
Informasjon til pasienter
Pasienter bør informeres om at å ta REMERON kan forårsake mild pupilledilatasjon, som hos følsomme personer kan føre til en episode med lukket vinkelglaukom. Eksisterende glaukom er nesten alltid åpenvinklet glaukom fordi vinkel-lukkende glaukom, når diagnostisert, kan behandles definitivt med iridektomi. Åpenvinklet glaukom er ikke en risikofaktor for lukkevinkelglaukom. Pasienter kan ønske å bli undersøkt for å avgjøre om de er mottakelige for vinkellukking, og ha en profylaktisk prosedyre (f.eks. iridektomi), hvis de er mottakelige.
HVORDAN LEVERES
REMERON (mirtazapin) tabletter leveres som:
15 mg tabletter - oval, riflet, gul, belagt, med “Organon” preget på den ene siden og “T3Z” på den andre siden.
30 flasker NDC 0052-0105-30
30 mg tabletter - oval, riflet, rødbrun, belagt, med «Organon» preget på den ene siden og «T5Z» på den andre siden.
30 flasker NDC 0052-0107-30
45 mg tabletter - oval, hvit, belagt, med "Organon" preget på den ene siden og "T7Z" på den andre siden.
30 flasker NDC 0052-0109-30
Oppbevaring
Oppbevares ved 20°C til 25°C (68°F til 77°F); utflukter tillatt til 15°C til 30°C (59°F til 86°F) [se USP kontrollert romtemperatur ]. Beskytt mot lys og fuktighet.
Produsert for: Merck Sharp & Dohme Corp., et datterselskap av Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Produsert av: NV Organon, Oss, Nederland, et datterselskap av Merck & Co., Inc., Whitehouse Station, NJ 08889, USA. Revidert: juli 2016
BIVIRKNINGER
Assosiert med seponering av behandling
Omtrent 16 % av de 453 pasientene som fikk REMERON (mirtazapin) tabletter i amerikanske 6-ukers kontrollerte kliniske studier, avbrøt behandlingen på grunn av en bivirkning, sammenlignet med 7 % av de 361 placebobehandlede pasientene i disse studiene. De vanligste hendelsene (≥ 1 %) assosiert med seponering og anses å være medikamentrelaterte (dvs. de hendelsene assosiert med frafall i en hastighet som er minst det dobbelte av placebo) er inkludert i tabell 2.
Vanlige observerte bivirkninger i kontrollerte kliniske studier i USA
De vanligst observerte bivirkningene assosiert med bruk av REMERON (mirtazapin) tabletter (forekomst på 5 % eller mer) og som ikke er observert med tilsvarende forekomst blant placebo-behandlede pasienter (REMERON-insidens minst dobbelt så stor som for placebo) er oppført i tabell 3.
Bivirkninger som oppstår med en forekomst på 1 % eller mer blant REMERON-behandlede pasienter
Tabell 4 oppregner uønskede hendelser som oppstod med en forekomst på 1 % eller mer, og som var hyppigere enn i placebogruppen, blant REMERON (mirtazapin) tablettbehandlede pasienter som deltok i kortsiktige amerikanske placebokontrollerte studier der pasienter ble dosert i området 5 til 60 mg/dag. Denne tabellen viser prosentandelen av pasienter i hver gruppe som hadde minst 1 episode av en hendelse på et tidspunkt under behandlingen. Rapporterte uønskede hendelser ble klassifisert ved å bruke en standard COSTART-basert ordbokterminologi.
Forskriveren bør være klar over at disse tallene ikke kan brukes til å forutsi forekomsten av bivirkninger i løpet av vanlig medisinsk praksis der pasientkarakteristikker og andre faktorer avviker fra de som gjorde seg gjeldende i de kliniske forsøkene. Tilsvarende kan de siterte frekvensene ikke sammenlignes med tall hentet fra andre undersøkelser som involverer ulike behandlinger, bruksområder og etterforskere. De siterte tallene gir imidlertid den forskrivende legen et visst grunnlag for å estimere det relative bidraget til medikamentelle og ikke-medikamentelle faktorer til forekomsten av bivirkninger i befolkningen som ble studert.
EKG-endringer
Elektrokardiogrammene for 338 pasienter som fikk REMERON (mirtazapin) tabletter og 261 pasienter som fikk placebo i 6 ukers, placebokontrollerte studier ble analysert. Forlengelse i QTc ≥ 500 msek ble ikke observert blant mirtazapin-behandlede pasienter; gjennomsnittlig endring i QTc var +1,6 msek for mirtazapin og -3,1 msek for placebo. Mirtazapin var assosiert med en gjennomsnittlig økning i hjertefrekvens på 3,4 slag/min, sammenlignet med 0,8 slag/min for placebo. Den kliniske betydningen av disse endringene er ukjent.
Effekten av REMERON (mirtazapin) på QTc-intervallet ble vurdert i en klinisk randomisert studie med placebo og positive (moxifloxacin) kontroller som involverte 54 friske frivillige ved bruk av eksponeringsresponsanalyse. Denne studien viste en positiv sammenheng mellom mirtazapinkonsentrasjoner og forlengelse av QTc-intervallet. Graden av QT-forlengelse observert med både 45 mg (terapeutisk) og 75 mg (supraterapeutisk) doser av mirtazapin var imidlertid ikke på et nivå som generelt ble ansett for å være klinisk meningsfullt.
Andre uønskede hendelser observert under premarketing-evalueringen av REMERON
Under vurderingen før markedsføringen ble flere doser REMERON (mirtazapin) administrert til 2796 pasienter i kliniske studier. Betingelsene og varigheten av eksponeringen for mirtazapin varierte sterkt, og inkluderte (i overlappende kategorier) åpne og dobbeltblinde studier, ukontrollerte og kontrollerte studier, polikliniske og polikliniske studier, fastdose- og titreringsstudier. Uheldige hendelser knyttet til denne eksponeringen ble registrert av kliniske etterforskere ved å bruke terminologi etter eget valg. Følgelig er det ikke mulig å gi et meningsfullt estimat av andelen individer som opplever uønskede hendelser uten først å gruppere lignende typer uheldige hendelser i et mindre antall standardiserte hendelseskategorier.
tabellene som følger, ble rapporterte uønskede hendelser klassifisert ved å bruke en standard COSTART-basert ordbokterminologi. Frekvensene som er presentert representerer derfor andelen av de 2796 pasientene som ble eksponert for flere doser REMERON som opplevde en hendelse av typen nevnt ved minst 1 anledning mens de fikk REMERON. Alle rapporterte hendelser er inkludert bortsett fra de som allerede er oppført i tabell 4, de uønskede opplevelsene som er lagt inn under COSTART-termer som enten er for generelle eller overdrevent spesifikke for å være uinformative, og de hendelsene der en medikamentårsak var svært fjern.
Det er viktig å understreke at selv om de rapporterte hendelsene skjedde under behandling med REMERON 30 mg, var de ikke nødvendigvis forårsaket av det.
Hendelser er videre kategorisert etter kroppssystem og oppført i rekkefølge etter avtagende frekvens i henhold til følgende definisjoner: hyppige bivirkninger er de som forekommer ved 1 eller flere anledninger hos minst 1/100 pasienter; sjeldne bivirkninger er de som forekommer hos 1/100 til 1/1000 pasienter; sjeldne hendelser er de som forekommer hos færre enn 1/1000 pasienter. Bare de hendelsene som ikke allerede er oppført i tabell 4, vises i denne oppføringen. Hendelser av stor klinisk betydning er også beskrevet i avsnittene ADVARSLER og FORHOLDSREGLER.
Kroppen som helhet: hyppig: ubehag, magesmerter, akutt abdominal syndrom; sjeldne: frysninger, feber, ansiktsødem, sår, lysfølsomhetsreaksjon, nakkestivhet, nakkesmerter, forstørret mage; sjeldne: cellulitt, brystsmerter substernal.
Sirkulasjonssystem: hyppig: hypertensjon, vasodilatasjon; sjeldne: angina pectoris, hjerteinfarkt, bradykardi, ventrikulære ekstrasystoler, synkope, migrene, hypotensjon; sjeldne: atriearytmi, bigeminy, vaskulær hodepine, lungeemboli, cerebral iskemi, kardiomegali, flebitt, venstre hjertesvikt.
Fordøyelsessystemet: hyppig: oppkast, anoreksi; sjeldne: eruktasjon, glossitt, kolecystitt, kvalme og oppkast, tannkjøttblødning, stomatitt, kolitt, unormale leverfunksjonstester; sjeldne: misfarging av tungen, ulcerøs stomatitt, spyttkjertelforstørrelse, økt spyttutskillelse, intestinal obstruksjon, pankreatitt, aftøs stomatitt, levercirrhose, gastritt, gastroenteritt, oral moniliasis, tungeødem.
Endokrine system: sjeldne: struma, hypotyreose.
Hemisk og lymfesystem: sjeldne: lymfadenopati, leukopeni, petekia, anemi, trombocytopeni, lymfocytose, pancytopeni.
Metabolske og ernæringsforstyrrelser: hyppig: tørst; sjelden: dehydrering, vekttap; sjeldne: gikt, økt SGOT, unormal tilheling, økt sur fosfatase, økt SGPT, diabetes mellitus, hyponatremi.
Muskel- og skjelettsystemet: hyppig: myasteni, artralgi; sjelden: leddgikt, tenosynovitt; sjeldne: patologisk fraktur, osteoporosefraktur, beinsmerter, myositt, seneruptur, artrose, bursitt.
Nervesystemet: hyppig: hypestesi, apati, depresjon, hypokinesi, vertigo, rykninger, agitasjon, angst, hukommelsestap, hyperkinesi, parestesi; sjeldne: ataksi, delirium, vrangforestillinger, depersonalisering, dyskinesi, ekstrapyramidalt syndrom, økt libido, unormal koordinasjon, dysartri, hallusinasjoner, manisk reaksjon, nevrose, dystoni, fiendtlighet, økte reflekser, emosjonell labilitet, eufori, paranoid reaksjon; sjeldne: afasi, nystagmus, akatisi (psykomotorisk rastløshet), stupor, demens, diplopi, medikamentavhengighet, lammelse, grand mal-kramper, hypotoni, myoklonus, psykotisk depresjon, abstinenssyndrom, serotonergt syndrom.
Luftveiene: hyppig: økt hoste, bihulebetennelse; sjeldne: neseblødning, bronkitt, astma, lungebetennelse; sjeldne: asfyksi, laryngitt, pneumothorax, hikke.
Hud og vedheng: hyppig: kløe, utslett; sjeldne: akne, eksfoliativ dermatitt, tørr hud, herpes simplex, alopecia; sjeldne: urticaria, herpes zoster, hudhypertrofi, seboré, hudsår.
Spesielle sanser: sjeldne: øyesmerter, unormal akkommodasjon, konjunktivitt, døvhet, keratokonjunktivitt, tåreforstyrrelse, vinkelglaukom, hyperakusis, øresmerter; sjeldne: blefaritt, delvis forbigående døvhet, mellomørebetennelse, smakstap, parosmi.
Urogenital system: hyppig: urinveisinfeksjon; sjeldne: nyresten, blærebetennelse, dysuri, urininkontinens, urinretensjon, vaginitt, hematuri, brystsmerter, amenoré, dysmenoré, leukoré, impotens; sjeldne: polyuri, uretritt, metroragi, menoragi, unormal ejakulasjon, brystpropp, brystforstørrelse, urintrang.
Andre uønskede hendelser observert under evaluering av REMERON etter markedsføring
Bivirkninger rapportert siden markedsintroduksjonen, som var tidsmessig (men ikke nødvendigvis kausalt) relatert til mirtazapinbehandling, inkluderer tilfeller av ventrikulær arytmi Torsades de Pointes. I de fleste av disse tilfellene var imidlertid samtidig medikamenter involvert. Tilfeller av alvorlige hudreaksjoner, inkludert Stevens-Johnsons syndrom, bulløs dermatitt, erythema multiforme og toksisk epidermal nekrolyse er også rapportert. Økte kreatinkinasenivåer i blodet og rabdomyolyse er også rapportert.
Narkotikamisbruk og avhengighet
Klasse kontrollert stoff
REMERON (mirtazapin) Tabletter er ikke et kontrollert stoff.
Fysisk og psykologisk avhengighet
REMERON (mirtazapin) tabletter har ikke blitt systematisk studert hos dyr eller mennesker for dets potensiale for misbruk, toleranse eller fysisk avhengighet. Selv om de kliniske studiene ikke avdekket noen tendens til narkotikasøkende atferd, var disse observasjonene ikke systematiske, og det er ikke mulig å forutsi på grunnlag av denne begrensede erfaringen i hvilken grad et CNS-aktivt legemiddel vil bli misbrukt, avledet og /eller misbrukt en gang markedsført. Pasienter bør følgelig evalueres nøye for historie med narkotikamisbruk, og slike pasienter bør observeres nøye for tegn på REMERON misbruk eller misbruk (f.eks. utvikling av toleranse, økning av dose, narkotikasøkende atferd).
NARKOTIKAHANDEL
Som med andre legemidler, er potensialet for interaksjon ved en rekke mekanismer (f.eks. farmakodynamisk, farmakokinetisk hemming eller forsterkning, etc.) en mulighet (se KLINISK FARMAKOLOGI ).
Monoaminoksidasehemmere
(Se KONTRAINDIKASJONER , ADVARSLER , og DOSERING OG ADMINISTRASJON .)
Serotonerge legemidler
(Se KONTRAINDIKASJONER og ADVARSLER .)
Legemidler som påvirker levermetabolismen
Metabolismen og farmakokinetikken til REMERON (mirtazapin) tabletter kan påvirkes av induksjon eller hemming av legemiddelmetaboliserende enzymer.
Legemidler som metaboliseres av og/eller hemmer cytokrom P450-enzymer
CYP enzymindusere
(disse studiene brukte begge legemidlene ved steady state)
Fenytoin
Hos friske mannlige pasienter (n=18) økte fenytoin (200 mg daglig) mirtazapin (30 mg daglig) clearance omtrent 2 ganger, noe som resulterte i en reduksjon i gjennomsnittlig plasmakonsentrasjon av mirtazapin på 45 %. Mirtazapin påvirket ikke farmakokinetikken til fenytoin signifikant.
Karbamazepin
Hos friske mannlige pasienter (n=24) økte karbamazepin (400 mg to ganger daglig) mirtazapin (15 mg to ganger daglig) clearance omtrent 2 ganger, noe som resulterte i en reduksjon i gjennomsnittlig plasmakonsentrasjon av mirtazapin på 60 %.
Når fenytoin, karbamazepin eller en annen induserer av levermetabolisme (som rifampicin) legges til mirtazapinbehandling, kan det hende at mirtazapindosen må økes. Hvis behandlingen med et slikt legemiddel seponeres, kan det være nødvendig å redusere mirtazapindosen.
CYP enzymhemmere
Cimetidin
Hos friske mannlige pasienter (n=12), når cimetidin, en svak hemmer av CYP1A2, CYP2D6 og CYP3A4, gitt 800 mg to ganger daglig ved steady state, ble administrert samtidig med mirtazapin (30 mg daglig) ved steady state, Area Under the Curve (AUC) av mirtazapin økte med mer enn 50 %. Mirtazapin forårsaket ikke relevante endringer i farmakokinetikken til cimetidin. Mirtazapindosen må kanskje reduseres når samtidig behandling med cimetidin startes, eller økes når cimetidinbehandlingen avbrytes.
Ketokonazol
Hos friske, mannlige, kaukasiske pasienter (n=24), økte samtidig administrering av den potente CYP3A4-hemmeren ketokonazol (200 mg to ganger i 6,5 dager) de maksimale plasmanivåene og AUC for en enkeltdose på 30 mg mirtazapin med omtrent 40 % og 50 %, henholdsvis.
Forsiktighet bør utvises ved samtidig administrering av mirtazapin med potente CYP3A4-hemmere, HIV-proteasehemmere, azol-antifungale midler, erytromycin eller nefazodon.
Paroksetin
I en in vivo interaksjonsstudie hos friske pasienter med CYP2D6-ekstensiv metabolisering (n=24), forårsaket ikke mirtazapin (30 mg/dag), ved steady state, relevante endringer i farmakokinetikken til steady state paroksetin (40 mg/dag), en CYP2D6-hemmer.
Andre legemiddel-medikamentinteraksjoner
Amitriptylin
Hos friske pasienter med omfattende CYP2D6-metabolisering (n=32), forårsaket ikke amitriptylin (75 mg daglig), ved steady state, relevante endringer i farmakokinetikken til steady state mirtazapin (30 mg daglig); mirtazapin forårsaket heller ikke relevante endringer i farmakokinetikken til amitriptylin.
Warfarin
Hos friske mannlige forsøkspersoner (n=16), forårsaket mirtazapin (30 mg daglig), ved steady state, en liten (0,2) men statistisk signifikant økning i International Normalized Ratio (INR) hos personer behandlet med warfarin. Ettersom en mer uttalt effekt ikke kan utelukkes ved en høyere dose mirtazapin, er det tilrådelig å overvåke INR ved samtidig behandling av warfarin og mirtazapin.
Litium
Ingen relevante kliniske effekter eller signifikante endringer i farmakokinetikken er observert hos friske mannlige forsøkspersoner ved samtidig behandling med subterapeutiske nivåer av litium (600 mg/dag i 10 dager) ved steady state og en enkelt 30 mg dose mirtazapin. Effekten av høyere doser litium på farmakokinetikken til mirtazapin er ukjent.
Risperidon
I en in vivo, ikke-randomisert interaksjonsstudie, viste forsøkspersoner (n=6) med behov for behandling med et antipsykotisk og antidepressivt legemiddel at mirtazapin (30 mg daglig) ved steady state ikke påvirket farmakokinetikken til risperidon (opptil 3 mg). bud).
Alkohol
Samtidig administrering av alkohol (tilsvarer 60 g) hadde en minimal effekt på plasmanivåene av mirtazapin (15 mg) hos 6 friske mannlige forsøkspersoner. Imidlertid ble svekkelsen av kognitive og motoriske ferdigheter produsert av REMERON vist å være additiv med de som produseres av alkohol. Pasienter bør derfor rådes til å unngå alkohol mens de tar REMERON.
Diazepam
Samtidig administrering av diazepam (15 mg) hadde en minimal effekt på plasmanivåene av mirtazapin (15 mg) hos 12 friske personer. Imidlertid har svekkelsen av motoriske ferdigheter produsert av REMERON 30mg vist seg å være additiv med de som forårsakes av diazepam. Pasienter bør derfor rådes til å unngå diazepam og andre lignende legemidler mens de tar REMERON.
QTc-forlengende legemidler
Risikoen for QT-forlengelse og/eller ventrikulære arytmier (f.eks. Torsades de Pointes) kan øke ved samtidig bruk av legemidler som forlenger QTc-intervallet (f.eks. noen antipsykotika og antibiotika) og ved overdosering av mirtazapin (se BIVIRKNINGER og OVERDOSE seksjoner).
ADVARSLER
Klinisk forverring og selvmordsrisiko
Pasienter med alvorlig depressiv lidelse (MDD), både voksne og barn, kan oppleve forverring av depresjonen og/eller fremveksten av selvmordstanker og -adferd (suicidalitet) eller uvanlige endringer i atferd, enten de tar antidepressive medisiner eller ikke, og dette risikoen kan vedvare inntil betydelig remisjon oppstår. Selvmord er en kjent risiko for depresjon og visse andre psykiatriske lidelser, og disse lidelsene er i seg selv de sterkeste prediktorene for selvmord. Det har imidlertid vært en langvarig bekymring for at antidepressiva kan ha en rolle i å indusere forverring av depresjon og fremveksten av suicidalitet hos visse pasienter i de tidlige faser av behandlingen. Samlede analyser av kortsiktige placebokontrollerte studier av antidepressive legemidler (SSRI og andre) viste at disse legemidlene øker risikoen for selvmordstenkning og selvmordsatferd (suicidalitet) hos barn, ungdom og unge voksne (18-24 år) med alvorlig depressiv sykdom. lidelse (MDD) og andre psykiatriske lidelser. Korttidsstudier viste ikke en økning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne over 24 år; det var en reduksjon i risiko med antidepressiva sammenlignet med placebo hos voksne i alderen 65 år og eldre.
De samlede analysene av placebokontrollerte studier hos barn og ungdom med MDD, tvangslidelse (OCD) eller andre psykiatriske lidelser inkluderte totalt 24 korttidsstudier av 9 antidepressiva med over 4400 pasienter. De samlede analysene av placebokontrollerte studier hos voksne med MDD eller andre psykiatriske lidelser inkluderte totalt 295 korttidsstudier (median varighet på 2 måneder) med 11 antidepressiva med over 77 000 pasienter. Det var betydelig variasjon i risiko for suicidalitet blant legemidler, men en tendens til en økning i yngre pasienter for nesten alle legemidler som ble studert. Det var forskjeller i absolutt risiko for suicidalitet på tvers av ulike indikasjoner, med den høyeste forekomsten av MDD. Risikoforskjellene (legemiddel vs. placebo) var imidlertid relativt stabile innenfor aldersstrata og på tvers av indikasjoner. Disse risikoforskjellene (medikament-placebo-forskjell i antall tilfeller av suicidalitet per 1000 behandlede pasienter) er gitt i tabell 1.
Ingen selvmord skjedde i noen av de pediatriske studiene. Det var selvmord i voksenforsøkene, men antallet var ikke tilstrekkelig til å komme til noen konklusjon om legemiddeleffekt på selvmord.
Det er ukjent om suicidalitetsrisikoen strekker seg til langvarig bruk, dvs. utover flere måneder. Det er imidlertid betydelig bevis fra placebokontrollerte vedlikeholdsforsøk hos voksne med depresjon på at bruk av antidepressiva kan forsinke tilbakefall av depresjon.
Alle pasienter som behandles med antidepressiva for enhver indikasjon bør overvåkes hensiktsmessig og observeres nøye for klinisk forverring, suicidalitet og uvanlige endringer i atferd, spesielt i løpet av de første månedene av en medikamentell behandlingskur, eller ved doseendringer, enten økninger eller synker.
Følgende symptomer, angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshet), hypomani og mani, er rapportert hos voksne og pediatriske pasienter som også behandles med antidepressiva for alvorlig depressiv lidelse som for andre indikasjoner, både psykiatriske og ikke-psykiatriske. Selv om det ikke er etablert en årsakssammenheng mellom fremveksten av slike symptomer og enten forverring av depresjon og/eller fremveksten av selvmordsimpulser, er det bekymring for at slike symptomer kan representere forløpere til fremvoksende suicidalitet.
Det bør vurderes å endre det terapeutiske regimet, inkludert eventuelt seponering av medisinen, hos pasienter hvis depresjon er vedvarende verre, eller som opplever ny suicidalitet eller symptomer som kan være forløpere til forverring av depresjon eller suicidalitet, spesielt hvis disse symptomene er alvorlige, brå i debut, eller var ikke en del av pasientens tilstedeværende symptomer.
Familier og omsorgspersoner til pasienter som behandles med antidepressiva for alvorlig depressiv lidelse eller andre indikasjoner, både psykiatriske og ikke-psykiatriske, bør varsles om behovet for å overvåke pasienter for fremveksten av agitasjon, irritabilitet, uvanlige endringer i atferd og de andre symptomene beskrevet ovenfor , så vel som fremveksten av suicidalitet, og å rapportere slike symptomer umiddelbart til helsepersonell . Slik overvåking bør inkludere daglig observasjon av familier og omsorgspersoner. Resepter for REMERON (mirtazapin) Tabletter bør skrives ut for den minste mengde tabletter i samsvar med god pasientbehandling, for å redusere risikoen for overdosering.
Screening av pasienter for bipolar lidelse
En alvorlig depressiv episode kan være den første presentasjonen av bipolar lidelse. Det er generelt antatt (men ikke etablert i kontrollerte studier) at behandling av en slik episode med et antidepressivum alene kan øke sannsynligheten for utfelling av en blandet/manisk episode hos pasienter med risiko for bipolar lidelse. Hvorvidt noen av symptomene beskrevet ovenfor representerer en slik konvertering er ukjent. Før behandling med et antidepressivum startes, bør imidlertid pasienter med depressive symptomer undersøkes tilstrekkelig for å avgjøre om de har risiko for bipolar lidelse; slik screening bør inkludere en detaljert psykiatrisk historie, inkludert en familiehistorie med selvmord, bipolar lidelse og depresjon. Det skal bemerkes at REMERON (mirtazapin) tabletter ikke er godkjent for bruk ved behandling av bipolar depresjon.
Agranulocytose
kliniske studier før markedsføring utviklet 2 (1 med Sjögrens syndrom) av 2796 pasienter behandlet med REMERON (mirtazapin) tabletter agranulocytose [absolutt nøytrofiltall (ANC)
Serotonin syndrom
Utvikling av et potensielt livstruende serotonergt syndrom er rapportert med SNRI og SSRI, inkludert REMERON 30 mg, alene, men spesielt ved samtidig bruk av andre serotonerge legemidler (inkludert triptaner, trisykliske antidepressiva, fentanyl, litium, tramadol, tryptofan, buspiron, johannesurt), og med legemidler som hemmer metabolismen av serotonin (spesielt MAO-hemmere, både de som er beregnet på å behandle psykiatriske lidelser og også andre, som linezolid og intravenøs metylenblått).
Symptomer på serotonergt syndrom kan omfatte endringer i mental status (f.eks. agitasjon, hallusinasjoner, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtrykk, svimmelhet, diaforese, rødme, hypertermi), nevromuskulære symptomer (f.eks. tremor, rigiditet, myoklonus, hyperrefleksi, inkoordinering), anfall og/eller gastrointestinale symptomer (f.eks. kvalme, oppkast, diaré). Pasienter bør overvåkes for fremveksten av serotonergt syndrom.
Samtidig bruk av REMERON 15 mg og MAO-hemmere beregnet på å behandle psykiatriske lidelser er kontraindisert. REMERON bør heller ikke startes hos en pasient som behandles med MAO-hemmere som linezolid eller intravenøs metylenblått. Alle rapporter med metylenblått som ga informasjon om administreringsveien involverte intravenøs administrering i doseområdet 1 mg/kg til 8 mg/kg. Ingen rapporter involverte administrering av metylenblått på andre måter (som orale tabletter eller lokal vevsinjeksjon) eller ved lavere doser. Det kan være omstendigheter når det er nødvendig å starte behandling med en MAO-hemmer som linezolid eller intravenøs metylenblått hos en pasient som tar REMERON. REMERON 15 mg bør seponeres før behandling med MAO-hemmeren startes (se KONTRAINDIKASJONER og DOSERING OG ADMINISTRASJON ).
Hvis samtidig bruk av REMERON 30mg med andre serotonerge legemidler, inkludert triptaner, trisykliske antidepressiva, fentanyl, litium, tramadol, buspiron, tryptofan og johannesurt, er klinisk berettiget, vær oppmerksom på en potensiell økt risiko for serotonergt syndrom, spesielt under behandlingsstart og doseøkninger.
Behandling med REMERON 30 mg og eventuelle samtidige serotonerge midler bør seponeres umiddelbart hvis ovennevnte hendelser inntreffer og støttende symptomatisk behandling bør startes.
Vinkel-lukkende glaukom
Pupilleutvidelsen som oppstår etter bruk av mange antidepressiva, inkludert REMERON 15mg, kan utløse et vinkellukkingsanfall hos en pasient med anatomisk trange vinkler som ikke har patentert iridektomi.
QT-forlengelse og Torsades de Pointes
Effekten av REMERON (mirtazapin) på QTc-intervallet ble vurdert i en klinisk randomisert studie med placebo og positive (moxifloxacin) kontroller som involverte 54 friske frivillige ved bruk av eksponeringsresponsanalyse. Denne studien viste en positiv sammenheng mellom mirtazapinkonsentrasjoner og forlengelse av QTc-intervallet. Graden av QT-forlengelse observert med både 45 mg (terapeutisk) og 75 mg (supraterapeutisk) doser av mirtazapin var imidlertid ikke på et nivå som generelt ble ansett for å være klinisk meningsfullt. Under bruk av mirtazapin etter markedsføring er det rapportert tilfeller av QT-forlengelse, Torsades de Pointes, ventrikulær takykardi og plutselig død (se BIVIRKNINGER ). Flertallet av rapportene skjedde i forbindelse med overdosering eller hos pasienter med andre risikofaktorer for QT-forlengelse, inkludert samtidig bruk av QTc-forlengende legemidler (se NARKOTIKAHANDEL og OVERDOSE seksjoner). Forsiktighet bør utvises når REMERON forskrives til pasienter med kjent kardiovaskulær sykdom eller familiehistorie med QT-forlengelse, og ved samtidig bruk med andre legemidler som antas å forlenge QTc-intervallet.
FORHOLDSREGLER
Generell
Seponeringssymptomer
Det har vært rapporter om bivirkninger etter seponering av REMERON (mirtazapin) tabletter (spesielt når det er brå), inkludert men ikke begrenset til følgende: svimmelhet, unormale drømmer, sensoriske forstyrrelser (inkludert parestesi og elektrisk sjokk), agitasjon, angst, tretthet, forvirring, hodepine, skjelving, kvalme, oppkast og svette eller andre symptomer som kan være av klinisk betydning. Flertallet av de rapporterte tilfellene er milde og selvbegrensende. Selv om disse har blitt rapportert som bivirkninger, bør man være klar over at disse symptomene kan være relatert til underliggende sykdom.
Pasienter som for tiden tar REMERON bør IKKE avbryte behandlingen brått på grunn av risiko for seponeringssymptomer. På det tidspunktet det tas en medisinsk beslutning om å avbryte behandlingen med REMERON, anbefales en gradvis reduksjon i dosen, snarere enn en brå seponering.
Akatisi/psykomotorisk rastløshet
Bruk av antidepressiva har vært assosiert med utvikling av akatisi, karakterisert ved en subjektivt ubehagelig eller plagsom rastløshet og behov for å bevege seg, ofte ledsaget av manglende evne til å sitte eller stå stille. Dette er mest sannsynlig i løpet av de første ukene av behandlingen. Hos pasienter som utvikler disse symptomene, kan økning av dosen være skadelig.
Hyponatremi
Hyponatremi er rapportert svært sjelden ved bruk av mirtazapin. Forsiktighet bør utvises hos pasienter med risiko, for eksempel eldre pasienter eller pasienter som samtidig behandles med medisiner som er kjent for å forårsake hyponatremi.

Søvnighet
kontrollerte studier i USA ble det rapportert somnolens hos 54 % av pasientene behandlet med REMERON (mirtazapin) tabletter, sammenlignet med 18 % for placebo og 60 % for amitriptylin. I disse studiene resulterte somnolens i seponering for 10,4 % av REMERON-behandlede pasienter, sammenlignet med 2,2 % for placebo. Det er uklart om det utvikles toleranse for de somnolente effektene av REMERON. På grunn av de potensielt signifikante effektene av REMERON 30 mg på nedsatt ytelse, bør pasienter advares mot å delta i aktiviteter som krever årvåkenhet inntil de har vært i stand til å vurdere stoffets effekt på sin egen psykomotoriske ytelse (se PASIENTINFORMASJON ).
Svimmelhet
I kontrollerte studier i USA ble svimmelhet rapportert hos 7 % av pasientene behandlet med REMERON, sammenlignet med 3 % for placebo og 14 % for amitriptylin. Det er uklart om det utvikles toleranse for svimmelheten observert i forbindelse med bruk av REMERON.
Økt appetitt/vektøkning
kontrollerte studier i USA ble appetittøkning rapportert hos 17 % av pasientene behandlet med REMERON 30 mg, sammenlignet med 2 % for placebo og 6 % for amitriptylin. I disse samme studiene ble det rapportert vektøkning på ≥ 7 % av kroppsvekten hos 7,5 % av pasientene behandlet med mirtazapin, sammenlignet med 0 % for placebo og 5,9 % for amitriptylin. I en samling av amerikanske førmarkedsføringsstudier, inkludert mange pasienter for langvarig, åpen behandling, avbrøt 8 % av pasientene som fikk REMERON 30 mg på grunn av vektøkning. I en 8 uker lang pediatrisk klinisk studie med doser mellom 15 og 45 mg/dag, hadde 49 % av REMERON-behandlede pasienter en vektøkning på minst 7 %, sammenlignet med 5,7 % av placebo-behandlede pasienter (se FORHOLDSREGLER : Pediatrisk bruk ).
Kolesterol/triglyserider
kontrollerte studier i USA ble ikke-fastende kolesteroløkninger til ≥ 20 % over de øvre normalgrensene observert hos 15 % av pasientene behandlet med REMERON 30 mg, sammenlignet med 7 % for placebo og 8 % for amitriptylin. I disse samme studiene ble ikke-fastende triglyseridøkninger til ≥ 500 mg/dL observert hos 6 % av pasientene behandlet med mirtazapin, sammenlignet med 3 % for placebo og 3 % for amitriptylin.
Transaminaseforhøyelser
Klinisk signifikante ALAT (SGPT)-økninger (≥ 3 ganger øvre grense for normalområdet) ble observert hos 2,0 % (8/424) av pasienter eksponert for REMERON 30 mg i en samling av kortsiktige amerikanske kontrollerte studier, sammenlignet med 0,3 % (1/328) av placebopasientene og 2,0 % (3/181) av amitriptylinpasientene. De fleste av disse pasientene med ALAT-økninger utviklet ikke tegn eller symptomer assosiert med nedsatt leverfunksjon. Mens noen pasienter ble seponert på grunn av ALAT-økningene, returnerte enzymnivåene i andre tilfeller til det normale til tross for fortsatt REMERON-behandling. REMERON bør brukes med forsiktighet hos pasienter med nedsatt leverfunksjon (se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRASJON ).
Aktivering av mani/hypomani
Mani/hypomani forekom hos ca. 0,2 % (3/1299 pasienter) av REMERON-behandlede pasienter i amerikanske studier. Selv om forekomsten av mani/hypomani var svært lav under behandling med mirtazapin, bør det brukes forsiktig hos pasienter med en historie med mani/hypomani.
Anfall
kliniske studier før markedsføring ble det bare rapportert 1 anfall blant de 2796 amerikanske og ikke-amerikanske pasientene behandlet med REMERON. Det er imidlertid ikke utført kontrollerte studier hos pasienter med anfallshistorie. Derfor bør det utvises forsiktighet når mirtazapin brukes til disse pasientene.
Bruk hos pasienter med samtidig sykdom
Klinisk erfaring med REMERON hos pasienter med samtidig systemisk sykdom er begrenset. Følgelig er forsiktighet tilrådelig ved forskrivning av mirtazapin til pasienter med sykdommer eller tilstander som påvirker metabolisme eller hemodynamiske responser.
REMERON har ikke blitt systematisk evaluert eller brukt i nevneverdig grad hos pasienter med en nylig historie med hjerteinfarkt eller annen betydelig hjertesykdom. REMERON var assosiert med signifikant ortostatisk hypotensjon i tidlige kliniske farmakologiske studier med normale frivillige. Ortostatisk hypotensjon ble sjelden observert i kliniske studier med deprimerte pasienter. REMERON 15 mg bør brukes med forsiktighet hos pasienter med kjent kardiovaskulær eller cerebrovaskulær sykdom som kan forverres av hypotensjon (historie med hjerteinfarkt, angina eller iskemisk hjerneslag) og tilstander som vil disponere pasienter for hypotensjon (dehydrering, hypovolemi og behandling med antihypertensiva). medisiner).
Mirtazapin-clearance er redusert hos pasienter med moderat [glomerulær filtrasjonshastighet (GFR)=11 - 39 ml/min/1,73 m²] og alvorlig [GFR KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRASJON ).
Informasjon til pasienter
Forskrivere eller annet helsepersonell bør informere pasienter, deres familier og deres omsorgspersoner om fordelene og risikoene forbundet med behandling med REMERON (mirtazapin) tabletter og bør gi dem råd om riktig bruk. En pasient Medisinveiledning om "Antidepressive medisiner, depresjon og andre alvorlige psykiske sykdommer, og selvmordstanker eller handlinger" er tilgjengelig for REMERON. Forskriveren eller helsepersonell bør instruere pasienter, deres familier og deres omsorgspersoner om å lese Medisinveiledning og skal hjelpe dem med å forstå innholdet. Pasienter bør gis mulighet til å diskutere innholdet i Medisinveiledning og for å få svar på spørsmål de måtte ha. Den komplette teksten til Medisinveiledning er trykket på nytt på slutten av dette dokumentet.
Pasienter bør informeres om følgende problemer og bes om å varsle sin forskriver dersom disse oppstår mens de tar REMERON.
Klinisk forverring og selvmordsrisiko
Pasienter, deres familier og deres omsorgspersoner bør oppmuntres til å være oppmerksomme på fremveksten av angst, agitasjon, panikkanfall, søvnløshet, irritabilitet, fiendtlighet, aggressivitet, impulsivitet, akatisi (psykomotorisk rastløshet), hypomani, mani, andre uvanlige endringer i atferd. , forverring av depresjon og selvmordstanker, spesielt tidlig under antidepressiv behandling og når dosen justeres opp eller ned. Familier og omsorgspersoner til pasienter bør rådes til å se etter forekomsten av slike symptomer på daglig basis, siden endringer kan være brå. Slike symptomer bør rapporteres til pasientens forskriver eller helsepersonell, spesielt hvis de er alvorlige, plutselige eller ikke var en del av pasientens symptomer. Symptomer som disse kan være assosiert med økt risiko for suicidal tenkning og atferd og indikerer behov for svært tett oppfølging og muligens endringer i medisinen.
Agranulocytose
Pasienter som skal få REMERON bør advares om risikoen for å utvikle agranulocytose. Pasienter bør rådes til å kontakte legen sin dersom de opplever indikasjoner på infeksjon som feber, frysninger, sår hals, slimhinnesår eller andre mulige tegn på infeksjon. Spesiell oppmerksomhet bør rettes mot eventuelle influensalignende plager eller andre symptomer som kan tyde på infeksjon.
Interferens med kognitiv og motorisk ytelse
REMERON 15mg kan svekke dømmekraft, tenkning og spesielt motoriske ferdigheter på grunn av dens fremtredende beroligende effekt. Døsigheten forbundet med bruk av mirtazapin kan svekke en pasients evne til å kjøre bil, bruke maskiner eller utføre oppgaver som krever årvåkenhet. Pasienter bør derfor advares om å delta i farlige aktiviteter inntil de er rimelig sikre på at REMERON-terapi ikke påvirker deres evne til å delta i slike aktiviteter negativt.
Fullført terapikurs
Mens pasienter kan merke bedring med REMERON 15 mg-behandling i løpet av 1 til 4 uker, bør de rådes til å fortsette behandlingen som anvist.
Samtidig medisinering
Pasienter bør rådes til å informere legen sin dersom de tar, eller har til hensikt å ta, reseptbelagte eller reseptfrie legemidler, siden det er en mulighet for at REMERON kan interagere med andre legemidler.
Pasienter bør gjøres oppmerksomme på en potensiell økt risiko for serotonergt syndrom dersom samtidig bruk av REMERON 15mg med andre serotonerge legemidler, inkludert triptaner, trisykliske antidepressiva, fentanyl, litium, tramadol, buspiron, tryptofan og johannesurt, er klinisk berettiget, spesielt under behandlingsstart og doseøkninger.
Alkohol
Den svekkelsen av kognitive og motoriske ferdigheter produsert av REMERON har vist seg å være additiv til de som produseres av alkohol. Pasienter bør derfor rådes til å unngå alkohol mens de tar mirtazapin.
Svangerskap
Pasienter bør rådes til å varsle legen dersom de blir gravide eller planlegger å bli gravide under behandling med REMERON.
Sykepleie
Pasienter bør rådes til å varsle legen dersom de ammer et spedbarn.
Laboratorietester
Det er ingen rutinemessige laboratorietester anbefalt.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Karsinogenitetsstudier ble utført med mirtazapin gitt i dietten i doser på 2, 20 og 200 mg/kg/dag til mus og 2, 20 og 60 mg/kg/dag til rotter. De høyeste dosene som brukes er omtrent 20 og 12 ganger den maksimale anbefalte humane dosen (MRHD) på 45 mg/dag på mg/m²-basis hos henholdsvis mus og rotter. Det var en økt forekomst av hepatocellulært adenom og karsinom hos hannmus ved høy dose. Hos rotter var det en økning i hepatocellulært adenom hos hunner ved middels og høye doser og i hepatocellulære svulster og follikulært skjoldbruskkjerteladenom/cystadenom og karsinom hos hanner ved høy dose. Dataene tyder på at effektene ovenfor muligens kan formidles av ikke-genotoksiske mekanismer, hvis relevans for mennesker ikke er kjent.
Dosene brukt i musestudien har kanskje ikke vært høye nok til å fullt ut karakterisere det karsinogene potensialet til REMERON (mirtazapin) tabletter.
Mutagenese
Mirtazapin var ikke mutagent eller klastogent og induserte ikke generell DNA-skade som bestemt i flere genotoksisitetstester: Ames-test, in vitro genmutasjonsanalyse i kinesisk hamster V 79-celler, in vitro søsterkromatidutvekslingsanalyse i dyrkede kaninlymfocytter, in vivo benmarg mikronukleustest hos rotter, og ikke-planlagt DNA-synteseanalyse i HeLa-celler.
Nedsatt fruktbarhet
I en fertilitetsstudie på rotter ble mirtazapin gitt i doser opp til 100 mg/kg [20 ganger maksimal anbefalt human dose (MRHD) på mg/m-basis]. Parring og unnfangelse ble ikke påvirket av stoffet, men brunstsyklusen ble forstyrret ved doser som var 3 eller flere ganger MRHD, og preimplantasjonstap skjedde ved 20 ganger MRHD.
Svangerskap
Teratogene effekter
Graviditetskategori C
Reproduksjonsstudier på gravide rotter og kaniner ved doser opp til henholdsvis 100 mg/kg og 40 mg/kg [20 og 17 ganger maksimal anbefalt human dose (MRHD) på henholdsvis mg/m²-basis], har ikke avdekket bevis for teratogene effekter. Hos rotter var det imidlertid en økning i postimplantasjonstap hos damer behandlet med mirtazapin. Det var en økning i valpedødsfall i løpet av de første 3 dagene av diegivningen og en nedgang i fødselsvektene. Årsaken til disse dødsfallene er ikke kjent. Effektene oppsto ved doser som var 20 ganger MRHD, men ikke ved 3 ganger MRHD, på mg/m²-basis. Det finnes ingen tilstrekkelige og godt kontrollerte studier på gravide kvinner. Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for menneskelig respons, bør dette legemidlet kun brukes under graviditet hvis det er klart nødvendig.
Ammende mødre
Fordi noe REMERON kan skilles ut i morsmelk, bør det utvises forsiktighet når REMERON (mirtazapin) tabletter gis til ammende kvinner.
Pediatrisk bruk
Sikkerhet og effektivitet i den pediatriske populasjonen er ikke fastslått (se ADVARSEL i boks og ADVARSLER : Klinisk forverring og selvmordsrisiko ). To placebokontrollerte studier med 258 pediatriske pasienter med MDD har blitt utført med REMERON (mirtazapin) tabletter, og dataene var ikke tilstrekkelige til å støtte en påstand om bruk hos pediatriske pasienter. Alle som vurderer bruk av REMERON 30mg hos et barn eller ungdom, må balansere den potensielle risikoen med det kliniske behovet.
I en 8 uker lang pediatrisk klinisk studie med doser mellom 15 og 45 mg/dag, hadde 49 % av REMERON-behandlede pasienter en vektøkning på minst 7 %, sammenlignet med 5,7 % av placebo-behandlede pasienter. Gjennomsnittlig vektøkning var 4 kg (2 kg SD) for REMERON-behandlede pasienter versus 1 kg (2 kg SD) for placebo-behandlede pasienter (se FORHOLDSREGLER : Økt appetitt/vektøkning ).
Geriatrisk bruk
Omtrent 190 eldre individer (≥ 65 år) deltok i kliniske studier med REMERON (mirtazapin) tabletter. Dette legemidlet er kjent for å utskilles i stor grad av nyrene (75 %), og risikoen for redusert clearance av dette legemidlet er større hos pasienter med nedsatt nyrefunksjon. Fordi det er mer sannsynlig at eldre pasienter har nedsatt nyrefunksjon, bør det utvises forsiktighet ved doseringsvalg. Sederende medikamenter kan forårsake forvirring og oversedasjon hos eldre. Ingen uvanlige uønskede aldersrelaterte fenomener ble identifisert i denne gruppen. Farmakokinetiske studier viste redusert clearance hos eldre. Forsiktighet er indisert ved administrering av REMERON til eldre pasienter (se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRASJON ).
OVERDOSE
Menneskelig erfaring
Det er svært begrenset erfaring med overdosering av REMERON (mirtazapin) tabletter. I kliniske studier før markedsføring var det 8 rapporter om overdosering av REMERON alene eller i kombinasjon med andre farmakologiske midler. Den eneste overdosedødsfall som ble rapportert mens du tok REMERON var i kombinasjon med amitriptylin og klorprotiksen i en ikke-amerikansk klinisk studie. Basert på plasmanivåer var REMERON 15 mg-dosen som ble tatt 30 til 45 mg, mens plasmanivåer av amitriptylin og klorprotiksen ble funnet å være på toksiske nivåer. Alle andre tilfeller av overdosering før markedsføring resulterte i full bedring. Tegn og symptomer rapportert i forbindelse med overdose inkluderte desorientering, døsighet, nedsatt hukommelse og takykardi. Det var ingen rapporter om EKG-avvik, koma eller kramper etter overdosering med REMERON alene.
Basert på rapporter etter markedsføring er det imidlertid en mulighet for mer alvorlige utfall (inkludert dødsfall) ved doser som er mye høyere enn den terapeutiske dosen, spesielt ved blandede overdoser. I disse tilfellene har QT-forlengelse og Torsades de Pointes også blitt rapportert (se NARKOTIKAHANDEL og BIVIRKNINGER seksjoner).
Overdosebehandling
Behandlingen bør bestå av de generelle tiltakene som brukes i håndteringen av overdosering med et hvilket som helst medikament som er effektivt i behandlingen av alvorlig depressiv lidelse. Sørg for tilstrekkelig luftvei, oksygenering og ventilasjon. Overvåk EKG-parametere (inkludert hjerterytme) og vitale tegn. Generelle støttende og symptomatiske tiltak anbefales også. Induksjon av brekninger anbefales ikke. Mageskylling med en orogastrisk sonde med stor boring med passende luftveisbeskyttelse, om nødvendig, kan være indisert dersom det utføres kort tid etter inntak, eller hos symptomatiske pasienter. Aktivt kull bør administreres. Det er ingen erfaring med bruk av tvungen diurese, dialyse, hemoperfusjon eller byttetransfusjon ved behandling av overdosering av mirtazapin. Ingen spesifikke motgift for mirtazapin er kjent.
Ved håndtering av overdosering bør du vurdere muligheten for involvering av flere legemidler. Legen bør vurdere å kontakte et giftkontrollsenter for ytterligere informasjon om behandling av enhver overdose. Telefonnumre til sertifiserte giftkontrollsentre er oppført i Physicians' Desk Reference (PDR).
KONTRAINDIKASJONER
Overfølsomhet
REMERON (mirtazapin) tabletter er kontraindisert hos pasienter med kjent overfølsomhet overfor mirtazapin eller overfor noen av hjelpestoffene.
Monoaminoksidasehemmere
Bruk av monoaminoksidasehemmere (MAO-hemmere) beregnet på å behandle psykiatriske lidelser med REMERON 15 mg tabletter eller innen 14 dager etter avsluttet behandling med REMERON 15 mg er kontraindisert på grunn av økt risiko for serotonergt syndrom. Bruk av REMERON 15 mg innen 14 dager etter seponering av en MAO-hemmer beregnet på å behandle psykiatriske lidelser er også kontraindisert (se ADVARSLER og DOSERING OG ADMINISTRASJON ).
Å starte REMERON hos en pasient som behandles med MAO-hemmere som linezolid eller intravenøs metylenblått er også kontraindisert på grunn av økt risiko for serotonergt syndrom (se ADVARSLER og DOSERING OG ADMINISTRASJON ).
KLINISK FARMAKOLOGI
Farmakodynamikk
Virkningsmekanismen til REMERON (mirtazapin) tabletter, som med andre legemidler som er effektive i behandlingen av alvorlig depressiv lidelse, er ukjent.
Bevis samlet i prekliniske studier tyder på at mirtazapin øker sentral noradrenerg og serotonerg aktivitet. Disse studiene har vist at mirtazapin virker som en antagonist ved sentrale presynaptiske α2 - adrenerge hemmende autoreseptorer og heteroreseptorer, en virkning som er postulert å resultere i en økning i sentral noradrenerg og serotonerg aktivitet.
Mirtazapin er en potent antagonist av 5-HT2- og 5-HT3-reseptorer. Mirtazapin har ingen signifikant affinitet for 5-HT1A- og 5-HT1B-reseptorene.
Mirtazapin er en potent antagonist av histamin (H1) reseptorer, en egenskap som kan forklare dens fremtredende beroligende effekt.
Mirtazapin er en moderat perifer α-adrenerg antagonist, en egenskap som kan forklare den sporadiske ortostatiske hypotensjonen som er rapportert i forbindelse med bruken.
Mirtazapin er en moderat antagonist på muskarine reseptorer, en egenskap som kan forklare den relativt lave forekomsten av antikolinerge bivirkninger forbundet med bruken.
Farmakokinetikk
REMERON (mirtazapin) tabletter absorberes raskt og fullstendig etter oral administrering og har en halveringstid på ca. 20 til 40 timer. Maksimal plasmakonsentrasjon nås innen ca. 2 timer etter en oral dose. Tilstedeværelsen av mat i magen har minimal effekt på både hastigheten og omfanget av absorpsjon og krever ingen dosejustering.
Mirtazapin metaboliseres i stor grad etter oral administrering. Hovedveier for biotransformasjon er demetylering og hydroksylering etterfulgt av glukuronidkonjugering. In vitro-data fra humane levermikrosomer indikerer at cytokrom 2D6 og 1A2 er involvert i dannelsen av 8-hydroksymetabolitten til mirtazapin, mens cytokrom 3A anses å være ansvarlig for dannelsen av N-desmetyl- og N-oksidmetabolitten. Mirtazapin har en absolutt biotilgjengelighet på ca. 50 %. Det elimineres hovedsakelig via urin (75 %) med 15 % i avføring. Flere ukonjugerte metabolitter har farmakologisk aktivitet, men er tilstede i plasma i svært lave nivåer. (-)-enantiomeren har en eliminasjonshalveringstid som er omtrent dobbelt så lang som (+)-enantiomeren og oppnår derfor plasmanivåer som er omtrent 3 ganger så høye som for (+)-enantiomeren.
Plasmanivåer er lineært relatert til dose over et doseområde på 15 til 80 mg. Gjennomsnittlig eliminasjonshalveringstid for mirtazapin etter oral administrering varierer fra ca. 20 til 40 timer på tvers av alders- og kjønnsundergrupper, med kvinner i alle aldre som viser signifikant lengre eliminasjonshalveringstid enn menn (gjennomsnittlig halveringstid på 37 timer for kvinner vs. 26 timer) for menn). Steady state plasmanivåer av mirtazapin oppnås innen 5 dager, med ca. 50 % akkumulering (akkumuleringsforhold = 1,5).
Mirtazapin er omtrent 85 % bundet til plasmaproteiner over et konsentrasjonsområde på 0,01 til 10 mcg/ml.
Spesielle populasjoner
Geriatrisk
Etter oral administrering av REMERON (mirtazapin) tabletter 20 mg/dag i 7 dager til forsøkspersoner i varierende alder (område, 25 - 74), ble oral clearance av mirtazapin redusert hos eldre sammenlignet med yngre individer. Forskjellene var mest slående hos menn, med 40 % lavere clearance hos eldre menn sammenlignet med yngre menn, mens clearance hos eldre kvinner kun var 10 % lavere sammenlignet med yngre kvinner. Forsiktighet er indisert ved administrering av REMERON 30 mg til eldre pasienter (se FORHOLDSREGLER og DOSERING OG ADMINISTRASJON ).
Pediatri
Sikkerhet og effekt av mirtazapin i den pediatriske populasjonen er ikke fastslått (se FORHOLDSREGLER ).
Kjønn
Gjennomsnittlig eliminasjonshalveringstid for mirtazapin etter oral administrering varierer fra omtrent 20 til 40 timer på tvers av alders- og kjønnsundergrupper, med kvinner i alle aldre som viser signifikant lengre eliminasjonshalveringstid enn menn (gjennomsnittlig halveringstid på 37 timer for kvinner vs. 26 timer for menn) (se Farmakokinetikk ).
Løp
Det har ikke vært noen kliniske studier for å evaluere effekten av rase på farmakokinetikken til REMERON.
Nyreinsuffisiens
Disponeringen av mirtazapin ble undersøkt hos pasienter med varierende grad av nyrefunksjon. Eliminering av mirtazapin er korrelert med kreatininclearance. Total kroppsclearance av mirtazapin ble redusert med ca. 30 % hos pasienter med moderat (Clcr=11 - 39 ml/min/1,73 m²) og ca. 50 % hos pasienter med alvorlig (Clcr= FORHOLDSREGLER og DOSERING OG ADMINISTRASJON ).
Leverinsuffisiens
Etter en enkelt 15 mg oral dose av REMERON ble oral clearance av mirtazapin redusert med ca. 30 % hos pasienter med nedsatt leverfunksjon sammenlignet med personer med normal leverfunksjon. Forsiktighet er indisert ved administrering av REMERON til pasienter med nedsatt leverfunksjon (se FORHOLDSREGLER og DOSERING OG ADMINISTRASJON ).
Kliniske studier som viser effektivitet
Effekten av REMERON (mirtazapin) tabletter som behandling for alvorlig depressiv lidelse ble fastslått i 4 placebokontrollerte, 6-ukers studier hos voksne polikliniske pasienter som oppfyller DSM-III-kriteriene for alvorlig depressiv lidelse. Pasientene ble titrert med mirtazapin fra et doseområde på 5 mg opp til 35 mg/dag. Totalt sett viste disse studiene at mirtazapin er overlegen placebo på minst 3 av de følgende 4 målene: 21-Item Hamilton Depression Rating Scale (HDRS) total poengsum; HDRS Deprimert stemning Element; CGI-alvorlighetspoeng; og Montgomery og Asberg Depression Rating Scale (MADRS). Overlegenhet av mirtazapin over placebo ble også funnet for visse faktorer ved HDRS, inkludert angst/somatiseringsfaktor og søvnforstyrrelsesfaktor. Gjennomsnittlig mirtazapindose for pasienter som fullførte disse 4 studiene varierte fra 21 til 32 mg/dag. En femte studie med lignende design brukte en høyere dose (opptil 50 mg) per dag og viste også effektivitet.
Undersøkelse av alders- og kjønnsundergrupper av befolkningen avslørte ingen differensiell respons på grunnlag av disse undergruppene.
I en langtidsstudie ble pasienter som oppfyller (DSM-IV) kriterier for alvorlig depressiv lidelse som hadde respondert i løpet av de første 8 til 12 uker med akutt behandling med REMERON 30 mg randomisert til fortsettelse av REMERON 15 mg eller placebo i opptil 40 uker med observasjon for tilbakefall. Respons under den åpne fasen ble definert som å ha oppnådd en HAM-D 17 totalscore på ≤ 8 og en CGI-forbedringsscore på 1 eller 2 ved 2 påfølgende besøk som startet med uke 6 av de 8 til 12 ukene i den åpne fasen. av studiet. Tilbakefall under den dobbeltblinde fasen ble bestemt av de individuelle etterforskerne. Pasienter som fikk fortsatt REMERON 30 mg-behandling opplevde signifikant lavere tilbakefallsrater i løpet av de påfølgende 40 ukene sammenlignet med de som fikk placebo. Dette mønsteret ble demonstrert hos både mannlige og kvinnelige pasienter.
PASIENTINFORMASJON
REMERON® (rem' - e - ron) (mirtazapin) Tabletter
Hva er den viktigste informasjonen jeg bør vite om REMERON®?
REMERON 15mg og andre antidepressiva kan forårsake alvorlige bivirkninger, inkludert:
1. Selvmordstanker eller -handlinger:
- . REMERON 30mg og andre antidepressiva kan øke selvmordstanker eller -handlinger hos noen barn, tenåringer eller unge voksne i løpet av de første månedene av behandlingen eller når dosen endres. . Depresjon eller andre alvorlige psykiske lidelser er de viktigste årsakene til selvmordstanker eller -handlinger. . Se etter disse endringene og ring helsepersonell med en gang hvis du legger merke til:
- . Nye eller plutselige endringer i humør, atferd, handlinger, tanker eller følelser, spesielt hvis det er alvorlig. . Vær spesielt oppmerksom på slike endringer når REMERON startes eller når dosen endres.
Hold alle oppfølgingsbesøk hos helsepersonell og ring mellom besøkene hvis du er bekymret for symptomer.
Ring helsepersonell med en gang hvis du har noen av følgende symptomer, eller ring 911 hvis en nødsituasjon, spesielt hvis de er nye, verre eller bekymrer deg:
- . forsøk på å begå selvmord . handler på farlige impulser . opptrer aggressivt eller voldelig . tanker om selvmord eller å dø . ny eller verre depresjon . nye eller verre angst- eller panikkanfall . føler seg urolig, rastløs, sint eller irritabel . problemer med å sove . økt aktivitet eller å snakke mer enn det som er normalt for deg . andre uvanlige endringer i atferd eller humør
Ring helsepersonell med en gang hvis du har noen av følgende symptomer, eller ring 911 hvis en nødsituasjon. REMERON kan være assosiert med disse alvorlige bivirkningene:
2. Maniske episoder:
- . kraftig økt energi . hensynsløs oppførsel . snakker mer eller raskere enn vanlig . alvorlige søvnproblemer . uvanlig store ideer . racing tanker . overdreven lykke eller irritabilitet
3. Redusert antall hvite blodceller kalt nøytrofiler, som er nødvendige for å bekjempe infeksjoner. Fortell legen din dersom du har indikasjoner på infeksjon som feber, frysninger, sår hals eller munn- eller nesesår, spesielt symptomer som er influensalignende.
4. Serotoninsyndrom. Denne tilstanden kan være livstruende og kan omfatte:
- . agitasjon, hallusinasjoner, koma eller andre endringer i mental status . løpende hjerterytme, høyt eller lavt blodtrykk . kvalme, oppkast eller diaré . koordinasjonsproblemer eller muskelrykninger (overaktive reflekser) . svette eller feber . muskelstivhet
5. Synsproblemer
- . øyesmerter . endringer i synet . hevelse eller rødhet i eller rundt øyet
Bare noen mennesker er i faresonen for disse problemene. Det kan være lurt å gjennomgå en øyeundersøkelse for å se om du er i faresonen og få forebyggende behandling hvis du er det.
6. Anfall
7. Lavt saltnivå (natrium) i blodet.
Eldre mennesker kan ha større risiko for dette. Symptomer kan omfatte:
- . hodepine . forvirring, problemer med å konsentrere seg eller tenke eller hukommelsesproblemer . svakhet eller ustabilitet
8. Søvnighet. Det er best å ta REMERON nær leggetid.
9. Alvorlige hudreaksjoner: Ring legen din umiddelbart hvis du har noen eller alle av følgende symptomer:
- . alvorlig utslett med hevelse i huden (inkludert på håndflatene og fotsålene) . smertefull rødhet i huden, blemmer eller sår på kroppen eller i munnen
10. Alvorlige allergiske reaksjoner: problemer med å puste, hevelse i ansikt, tunge, øyne eller munn
- . utslett, kløende svulster (elveblest) eller blemmer, alene eller med feber eller leddsmerter
11. Økning i appetitt eller vekt. Barn og ungdom bør ha høyde og vekt overvåket under behandlingen.
12. Økte kolesterol- og triglyseridnivåer i blodet ditt
Ikke s topp REMERON 15mg uten først å snakke med helsepersonell. Å stoppe REMERON 15mg for raskt kan forårsake potensielt alvorlige symptomer, inkludert:
- . svimmelhet . utmattelse . kriblende følelse . unormale drømmer . forvirring . kvalme oppkast . opphisselse . hodepine . svette . angst . rister
Hva er REMERON 15mg?
REMERON 15mg er et reseptbelagt legemiddel som brukes til å behandle depresjon. Det er viktig å snakke med helsepersonell om risikoen ved å behandle depresjon og også risikoen ved å ikke behandle den. Du bør diskutere alle behandlingsvalg med helsepersonell.
Snakk med helsepersonell hvis du ikke tror at tilstanden din blir bedre med REMERON-behandling.
Hvem bør ikke ta REMERON 15mg?
Ikke ta REMERON:
- . dersom du er allergisk mot mirtazapin eller noen av innholdsstoffene i REMERON. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser i REMERON. . hvis du tar en monoaminoksidasehemmer (MAO-hemmer). Spør helsepersonell eller apotek hvis du ikke er sikker på om du tar en MAO-hemmer, inkludert antibiotikum linezolid. . Ikke ta en MAO-hemmer innen 2 uker etter at du har sluttet med REMERON med mindre du blir bedt om å gjøre det av helsepersonell. . Ikke start REMERON hvis du sluttet å ta en MAO-hemmer i løpet av de siste 2 ukene med mindre du har fått beskjed om det fra helsepersonell.
Personer som tar REMERON 15mg nær en MAO-hemmer kan ha alvorlige eller til og med livstruende bivirkninger. Få medisinsk hjelp umiddelbart hvis du har noen av disse symptomene:
- . høy feber . raske endringer i hjertefrekvens eller blodtrykk . ukontrollerte muskelspasmer . forvirring . stive muskler . tap av bevissthet (besvimelse)
Hva bør jeg fortelle helsepersonell før jeg tar REMERON?
Før du tar REMERON, fortell helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
- . tar visse legemidler som:
- . Triptaner brukes til å behandle migrenehodepine . Medisiner som brukes til å behandle humør, angst, psykotiske eller tankeforstyrrelser, inkludert trisykliske, litium, SSRI, SNRI eller antipsykotika . Tramadol brukes til å behandle smerte . Reseptfrie kosttilskudd som tryptofan eller johannesurt . Fenytoin, karbamazepin eller rifampicin (disse legemidlene kan redusere blodnivået av REMERON) . Cimetidin eller ketokonazol (disse legemidlene kan øke blodnivået av REMERON) . Medisiner som kan påvirke hjerterytmen (som visse antibiotika og noen antipsykotika)
- . leverproblemer . nyreproblemer . hjerteproblemer eller visse tilstander som kan endre hjerterytmen din . anfall eller kramper . bipolar lidelse eller mani . en tendens til å bli svimmel eller besvime
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. REMERON og noen medisiner kan interagere med hverandre, virker kanskje ikke like bra, eller kan forårsake alvorlige bivirkninger.
Helsepersonell eller apotek kan fortelle deg om det er trygt å ta REMERON 15mg sammen med andre legemidler. Ikke start eller stopp noen medisin mens du tar REMERON uten å snakke med helsepersonell først. Hvis du tar REMERON 30mg, bør du ikke ta andre legemidler som inneholder mirtazapin, inkludert REMERON 30mgSolTab®.
Hvordan skal jeg ta REMERON?
- . Ta REMERON nøyaktig som foreskrevet. Det kan hende at helsepersonell må endre dosen av REMERON 15 mg til det er riktig dose for deg. . Ta REMERON til samme tid hver dag, helst om kvelden ved sengetid. . Svelg REMERON 15mg som anvist. . Det er vanlig at antidepressiva som REMERON tar opptil noen uker før du begynner å føle deg bedre. Ikke slutt å ta REMERON 15mg hvis du ikke føler resultater med en gang. . Ikke slutt å ta eller endre dosen av REMERON 15 mg uten først å snakke med legen din, selv om du føler deg bedre. . REMERON kan tas med eller uten mat. . Hvis du glemmer en dose av REMERON 30 mg, ta den glemte dosen så snart du husker det. Hvis det nesten er tid for neste dose, hopp over den glemte dosen og ta neste dose til vanlig tid. Ikke ta to doser REMERON 15mg samtidig. . Hvis du tar for mye REMERON 15mg, ring helsepersonell eller giftkontrollsenter med en gang, eller få akuttbehandling. Tegnene på en overdose av REMERON (uten andre medisiner eller alkohol) inkluderer:
- . forvirring, . hukommelsesproblemer . døsighet . økt hjertefrekvens.
Symptomene på en mulig overdose kan omfatte endringer i hjerterytmen din (rask, uregelmessig hjerterytme) eller besvimelse, som kan være symptomer på en livstruende tilstand kjent som Torsades de Pointes.
Hva bør jeg unngå mens jeg tar REMERON 15mg?
- . REMERON kan forårsake søvnighet eller kan påvirke din evne til å ta avgjørelser, tenke klart eller reagere raskt. Du bør ikke kjøre bil, bruke tunge maskiner eller gjøre andre farlige aktiviteter før du vet hvordan REMERON påvirker deg. . Unngå å drikke alkohol eller ta diazepam (et legemiddel som brukes mot for eksempel angst, søvnløshet og anfall) eller lignende medisiner mens du tar REMERON. Hvis du er usikker på om visse medisiner kan tas sammen med REMERON 30mg, vennligst snakk med legen din.
Hva er de mulige bivirkningene av REMERON?
REMERON kan forårsake alvorlige bivirkninger:
- . Se "Hva er den viktigste informasjonen jeg bør vite om REMERON?"
De vanligste bivirkningene av REMERON inkluderer:
- . søvnighet . forstoppelse . økt appetitt . svimmelhet . vektøkning . unormale drømmer i munntørrhet
Dette er ikke alle mulige bivirkninger av REMERON.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan skal jeg rive REMERON?
- . Oppbevar REMERON 15mg ved romtemperatur mellom 68°F til 77°F (20°C til 25°C). . Hold REMERON 15 mg unna lys. . Hold REMERON 30 mg-flasken tett lukket.
Oppbevar REMERON 30mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av REMERON.
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk REMERON 15mg for en tilstand det ikke er foreskrevet for. Ikke gi REMERON til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem. Du kan spørre apoteket eller helsepersonell om informasjon om REMERON 30mg som er skrevet for helsepersonell.
Hva er ingrediensene i REMERON 15mg?
Aktiv ingrediens: mirtazapin
Inaktive ingredienser:
- . 15 mg tabletter: Stivelse (mais), hydroksypropylcellulose, magnesiumstearat, kolloidalt silisiumdioksid, laktose, hypromellose, polyetylenglykol 8000, titandioksid, jernoksid (gul). . 30 mg tabletter: Stivelse (mais), hydroksypropylcellulose, magnesiumstearat, kolloidalt silisiumdioksid, laktose, hypromellose, polyetylenglykol 8000, titandioksid, jernoksid (gult), jernoksid (rødt). . 45 mg tabletter: Stivelse (mais), hydroksypropylcellulose, magnesiumstearat, kolloidalt silisiumdioksid, laktose, hypromellose, polyetylenglykol 8000, titandioksid.
