Medisiner mot depresjon: Celexa 10mg, 20mg Citalopram Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Celexa og hvordan brukes det?
Celexa er et reseptbelagt legemiddel som brukes til å behandle symptomene på depresjon. Celexa kan brukes alene eller sammen med andre medisiner.
Celexa 20mg tilhører en klasse legemidler som kalles antidepressiva, SSRI.
Hva er de mulige bivirkningene av Celexa?
Celexa kan forårsake alvorlige bivirkninger, inkludert:
- . svimmelhet, . tåkesyn, . tunnelsyn, . øyesmerter eller hevelse, . ser glorier rundt lys, . hodepine med brystsmerter og alvorlig svimmelhet, . besvimelse, . rask eller bankende hjerterytme, . veldig stive (stive) muskler, . feber eller høy feber, . svette, . forvirring, . skjelvinger, . opphisselse, . hallusinasjoner, . overaktive reflekser, . kvalme, . oppkast, . diaré, . tap av koordinasjon, . hodepine, . utydelig tale, . alvorlig svakhet, og . føler seg ustø
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Celexa 20mg inkluderer:
- . hukommelsesproblemer, . konsentrasjonsvansker, . hodepine, . døsighet, . tørr i munnen, . øke svette, . nummenhet eller prikking, . økt appetitt, . kvalme, . diaré, . gass, . raske hjerteslag, . føler meg skjelven, . søvnproblemer (søvnløshet), . føler meg sliten, . forkjølelsessymptomer (tett nese, nysing, sår hals), . vektendringer, og . problemer med å få orgasme
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Celexa. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Suicidalitet og antidepressiva
Antidepressiva økte risikoen sammenlignet med placebo for selvmordstenkning og -adferd (suicidalitet) hos barn, ungdom og unge voksne i korttidsstudier av alvorlig depressiv lidelse (MDD) og andre psykiatriske lidelser. Alle som vurderer bruk av Celexa eller andre antidepressiva hos et barn, ungdom eller ung voksen må balansere denne risikoen med det kliniske behovet. Korttidsstudier viste ikke en økning i risikoen for suicidalitet med antidepressiva sammenlignet med placebo hos voksne over 24 år; det var en reduksjon i risiko med antidepressiva sammenlignet med placebo hos voksne i alderen 65 år og eldre. Depresjon og visse andre psykiatriske lidelser er i seg selv assosiert med økt risiko for selvmord. Pasienter i alle aldre som starter på antidepressiv behandling bør overvåkes på passende måte og observeres nøye for klinisk forverring, suicidalitet eller uvanlige endringer i atferd. Familier og omsorgspersoner bør informeres om behovet for tett observasjon og kommunikasjon med forskriveren. Celexa 10mg er ikke godkjent for bruk hos pediatriske pasienter. (Se ADVARSLER: Klinisk forverring og selvmordsrisiko, PASIENTINFORMASJON og FORHOLDSREGLER: Pediatrisk bruk.)
BESKRIVELSE
Celexa® (citalopram HBr) er en oralt administrert selektiv serotoninreopptakshemmer (SSRI) med en kjemisk struktur som ikke er relatert til strukturen til andre SSRI eller trisykliske, tetrasykliske eller andre tilgjengelige antidepressiva. Citalopram HBr er et racemisk bicyklisk ftalanderivat betegnet (±)-1-(3-dimetylaminopropyl)-1-(4-fluorfenyl)-1,3-dihydroisobenzofuran-5-karbonitril, HBr med følgende strukturformel:
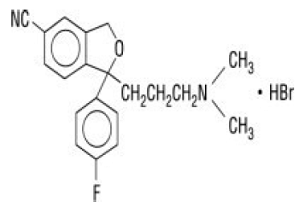
Molekylformelen er C20H22BrFN2O og dens molekylvekt er 405,35.
Citalopram HBr forekommer som et fint, hvitt til off-white pulver. Citalopram HBr er lite løselig i vann og løselig i etanol.
Celexa (citalopramhydrobromid) er kun tilgjengelig i tablettdoseringsform.
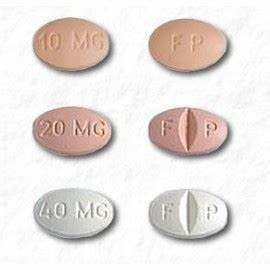
Celexa 10 mg er filmdrasjerte, ovale tabletter som inneholder citalopram HBr i styrker tilsvarende 10 mg citalopram base. Celexa 20 mg og 40 mg er filmdrasjerte, ovale tabletter med delestrek som inneholder citalopram HBr i styrker tilsvarende 20 mg eller 40 mg citalopram base. Tablettene inneholder også følgende inaktive ingredienser: kopolyvidon, maisstivelse, krysskarmellosenatrium, glyserin, laktosemonohydrat, magnesiumstearat, hypromellose, mikrokrystallinsk cellulose, polyetylenglykol og titandioksid. Jernoksider brukes som fargestoffer i beige (10 mg) og rosa (20 mg) tabletter.
INDIKASJONER
CELEXA 20 mg er indisert for behandling av alvorlig depressiv lidelse (MDD) hos voksne [se Kliniske studier ].
DOSERING OG ADMINISTRASJON
Anbefalt dosering
Administrer CELEXA én gang daglig, med eller uten mat, med en startdose på 20 mg én gang daglig, med en økning til en maksimal dose på 40 mg én gang daglig med et intervall på ikke mindre enn én uke.
Doser over 40 mg én gang daglig anbefales ikke på grunn av risikoen for QT-forlengelse [se ADVARSLER OG FORHOLDSREGLER ].
Skjerm for bipolar lidelse før oppstart av CELEXA
Før oppstart av behandling med CELEXA 20 mg eller et annet antidepressivum, screen pasienter for en personlig eller familiehistorie med bipolar lidelse, mani eller hypomani [Se ADVARSLER OG FORHOLDSREGLER ].
Anbefalt dosering for spesifikke populasjoner
Maksimal anbefalt dose av CELEXA 10 mg for pasienter som er eldre enn 60 år, pasienter med nedsatt leverfunksjon og for CYP2C19-fattige metabolisatorer er 20 mg én gang daglig [se ADVARSLER OG FORHOLDSREGLER , KLINISK FARMAKOLOGI ].
Doseendringer ved samtidig bruk av CYP2C19-hemmere
Den maksimale anbefalte dosen av CELEXA 20 mg når det brukes samtidig med en CYP2C19-hemmer er 20 mg én gang daglig [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL ].
Bytte pasienter til eller fra et monoaminoksidasehemmer antidepressivt middel
Det må gå minst 14 dager mellom seponering av et monoaminoksidasehemmer (MAOI) antidepressivum og oppstart av behandling med CELEXA. Motsatt må det gå minst 14 dager etter seponering av CELEXA før du starter et MAO-antidepressivum [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
Avbryte behandlingen med CELEXA
Bivirkninger kan oppstå ved seponering av CELEXA [se ADVARSLER OG FORHOLDSREGLER ]. Reduser dosen gradvis i stedet for å stoppe CELEXA brått når det er mulig.
HVORDAN LEVERES
Doseringsformer og styrker
CELEXA 10 mg tabletter er tilgjengelig som:
- . 10 mg: beige, oval med "FP" påtrykt på den ene siden, "10 mg" påtrykt på den andre siden . 20 mg: rosa, oval, merket med "F" påtrykt på venstre side av bruddstreken og "P" påtrykt på høyre side av bruddstreken, "20 mg" påtrykt på siden uten skår. . 40 mg: hvit, oval, merket med "F" påtrykt på venstre side av bruddstreken og "P" påtrykt på høyre side av bruddstreken, "40 mg" påtrykt på siden uten skår.
CELEXA (citalopram) tabletter leveres som følger:
Oppbevaring og håndtering
CELEXA 10 mg tabletter skal oppbevares ved 20-25°C (68 til 77°F); utflukter tillatt mellom 15 og 30°C (59-86°F) [se USP kontrollert romtemperatur ].
Distribuert av: Allergan USA, Inc. Revidert: februar 2022
BIVIRKNINGER
Følgende bivirkninger er omtalt mer detaljert i andre deler av merkingen:
- . Overfølsomhetsreaksjoner [se KONTRAINDIKASJONER ] . Selvmordstanker og -atferd hos ungdom og unge voksne [se ADVARSLER OG FORHOLDSREGLER ] . QT-forlengelse og torsade de pointes [se ADVARSLER OG FORHOLDSREGLER ] . Serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ] . Økt risiko for blødning [se ADVARSLER OG FORHOLDSREGLER ] . Aktivering av mani eller hypomani [se ADVARSLER OG FORHOLDSREGLER ] . Seponeringssyndrom [se ADVARSLER OG FORHOLDSREGLER ] . Anfall [se ADVARSLER OG FORHOLDSREGLER ] . Vinkel-lukkende glaukom [se ADVARSLER OG FORHOLDSREGLER ] . Hyponatremi [se ADVARSLER OG FORHOLDSREGLER ] . Seksuell dysfunksjon [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i klinisk praksis.
Sikkerheten for CELEXA 20 mg inkluderte eksponeringer for citalopram hos pasienter og/eller friske personer fra 3 forskjellige grupper av studier: 429 friske personer i klinisk farmakologi/farmakokinetiske studier; 4 422 eksponeringer fra pasienter i kontrollerte og ukontrollerte kliniske studier, tilsvarende ca. 1 370 pasienteksponeringsår. Det var i tillegg over 19 000 eksponeringer fra hovedsakelig åpne europeiske studier etter markedsføring. Betingelsene og varigheten av behandlingen med CELEXA 10 mg varierte sterkt og inkluderte (i overlappende kategorier) åpne og dobbeltblinde studier, polikliniske og polikliniske studier, studier med faste doser og dosetitrering, og korttids- og langtidseksponering. .
Bivirkninger forbundet med seponering av behandling
Blant 1 063 pasienter med MDD som fikk CELEXA 10 mg i doser fra 10 mg til 80 mg én gang daglig i placebokontrollerte studier av opptil 6 ukers varighet, avbrøt 16 % behandlingen på grunn av en bivirkning, sammenlignet med 8 % av 446 pasienter. får placebo. Bivirkningene forbundet med seponering (dvs. assosiert med seponering hos minst 1 % av CELEXA-behandlede pasienter med en hastighet som er minst dobbelt så stor som placebo) er vist i tabell 2.
Tabell 3 oppregner forekomsten av bivirkninger som oppsto blant 1 063 pasienter med MDD som fikk CELEXA 20 mg i doser fra 10 mg til 80 mg én gang daglig i placebokontrollerte studier av opptil 6 ukers varighet.
Den vanligste bivirkningen som oppstod hos CELEXA-behandlede pasienter med en forekomst på 5 % eller høyere og minst dobbelt så høy hos placebopasienter, var ejakulasjonsforstyrrelser (primært ejakulatorisk forsinkelse) hos mannlige pasienter (se tabell 3).
Doseavhengige bivirkninger
Den potensielle sammenhengen mellom dosen av CELEXA 10 mg og forekomsten av bivirkninger ble undersøkt i en fastdosestudie hos pasienter med MDD som fikk placebo eller CELEXA 10 mg, 20 mg 40 mg eller 60 mg (1,5 ganger den maksimale anbefalte dosen) . En positiv doserespons (p
Mannlig og kvinnelig seksuell dysfunksjon med SSRI
Selv om endringer i seksuell lyst, seksuell ytelse og seksuell tilfredshet ofte forekommer som manifestasjoner av en psykiatrisk lidelse, kan de også være en konsekvens av SSRI-behandling. Pålitelige estimater av forekomsten og alvorlighetsgraden av uheldige opplevelser som involverer seksuell lyst, ytelse og tilfredshet er imidlertid vanskelig å oppnå, delvis fordi pasienter og helsepersonell kan være motvillige til å diskutere dem. Følgelig kan estimater av forekomsten av uønsket seksuell opplevelse og ytelse nevnt i merkingen undervurdere deres faktiske forekomst.
Tabell 4 viser forekomsten av seksuelle bivirkninger rapportert av minst 2 % av mannlige pasienter som tar CELEXA 20 mg i en gruppe placebokontrollerte kliniske studier hos pasienter med depresjon.
Hos kvinnelige deprimerte pasienter som fikk CELEXA 20 mg, var den rapporterte forekomsten av redusert libido og anorgasmi henholdsvis 1,3 % (n=638 kvinner) og 1,1 % (n=252 kvinner).
Vektendringer
Pasienter behandlet med CELEXA i kontrollerte studier opplevde et vekttap på ca. 0,5 kg sammenlignet med ingen endring for placebopasienter.
EKG-endringer
I en grundig QT-studie ble CELEXA funnet å være assosiert med en doseavhengig økning i QTc-intervallet.
Elektrokardiogrammer fra gruppene CELEXA (N=802) og placebo (N=241) ble sammenlignet med hensyn til uteliggere definert som personer med QTc-endringer over 60 msek fra baseline eller absolutte verdier over 500 msek etter dose, og forsøkspersoner med hjertefrekvensøkninger til over 100 bpm eller synker til mindre enn 50 bpm med en 25 % endring fra baseline (henholdsvis takykardisk eller bradykardisk uteligger). I CELEXA-gruppen hadde 1,9 % av pasientene en endring fra baseline i QTcF >60 msek sammenlignet med 1,2 % av pasientene i placebogruppen. Ingen av pasientene i placebogruppen hadde en post-dose QTcF >500 msek sammenlignet med 0,5 % av pasientene i CELEXA 10 mg-gruppen. Forekomsten av takykardiske uteliggere var 0,5 % i CELEXA-gruppen og 0,4 % i placebogruppen. Forekomsten av bradykardiske uteliggere var 0,9 % i CELEXA 10 mg-gruppen og 0,4 % i placebogruppen.
Andre bivirkninger observert under evalueringen av CELEXA før markedsføring
Følgende liste over bivirkninger inkluderer ikke reaksjoner som er: 1) inkludert i tabell 3 eller andre steder i merkingen, 2) der en medikamentårsak var fjern, 3) som var så generelle at de var uinformative, og de som bare forekommer i én pasient.
Bivirkninger er kategorisert etter kroppssystem og oppført i rekkefølge etter avtagende frekvens i henhold til følgende definisjoner: hyppige bivirkninger er de som forekommer ved en eller flere anledninger hos minst 1/100 pasienter; sjeldne bivirkninger er de som forekommer hos mindre enn 1/100 pasienter til 1/1000 pasienter; sjeldne bivirkninger er de som forekommer hos færre enn 1/1000 pasienter.
Kardiovaskulær - Hyppig: takykardi, postural hypotensjon, hypotensjon. Sjeldne: hypertensjon, bradykardi, ødem (ekstremiteter), angina pectoris, ekstrasystoler, hjertesvikt, rødme, hjerteinfarkt, cerebrovaskulær ulykke, myokardiskemi. Sjeldne: forbigående iskemisk anfall, flebitt, atrieflimmer, hjertestans, grenblokk.
Forstyrrelser i det sentrale og perifere nervesystemet - Hyppig: parestesi, migrene. Sjeldne: hyperkinesi, svimmelhet, hypertoni, ekstrapyramidale lidelser, leggkramper, ufrivillige muskelsammentrekninger, hypokinesi, nevralgi, dystoni, unormal gange, hypoestesi, ataksi. Sjeldne: unormal koordinasjon, hyperestesi, ptosis, stupor.
Endokrine lidelser -Sjelden: hypotyreose, struma, gynekomasti.
Gastrointestinale lidelser -Hyppig: økt spytt, flatulens. Sjeldne: gastritt, gastroenteritt, stomatitt, eruktasjon, hemoroider, dysfagi, tanngnissing, gingivitt, øsofagitt. Sjeldne: kolitt, magesår, kolecystitt, kolelitiasis, duodenalsår, gastroøsofageal refluks, glossitt, gulsott, divertikulitt, rektal blødning, hikke.
Generelt -Sjelden : hetetokter, strenghet, alkoholintoleranse, synkope, influensalignende symptomer. Sjelden: høysnue.
Hemiske og lymfatiske lidelser -Sjelden: purpura, anemi, neseblødning, leukocytose, leukopeni, lymfadenopati. Sjeldne: lungeemboli, granulocytopeni, lymfocytose, lymfopeni, hypokrom anemi, koagulasjonsforstyrrelser, gingival blødning.
Metabolske og ernæringsforstyrrelser -Hyppig: redusert vekt, økt vekt. Sjeldne: økte leverenzymer, tørste, tørre øyne, økt alkalisk fosfatase, unormal glukosetoleranse. Sjeldne: bilirubinemi, hypokalemi, fedme, hypoglykemi, hepatitt, dehydrering.
Sykdommer i muskel- og skjelettsystemet -Sjelden: leddgikt, muskelsvakhet, skjelettsmerter. Sjeldne: bursitt, osteoporose.
Psykiatriske lidelser -Hyppig: nedsatt konsentrasjon, hukommelsestap, apati, depresjon, økt appetitt, forverret depresjon, selvmordsforsøk, forvirring. Sjelden: økt libido, aggressiv reaksjon, paroniria, narkotikaavhengighet, depersonalisering, hallusinasjoner, eufori, psykotisk depresjon, vrangforestillinger, paranoid reaksjon, emosjonell labilitet, panikkreaksjon, psykose. Sjelden: katatonisk reaksjon, melankoli.
Reproduksjonsforstyrrelser/kvinnelig* -Hyppig: amenoré. Sjeldne: galaktoré, brystsmerter, brystforstørrelse, vaginal blødning. (* % bare basert på kvinnelige forsøkspersoner: 2955)
Sykdommer i luftveiene -Hyppig: hoste. Sjelden: bronkitt, dyspné, lungebetennelse. Sjeldne: astma, laryngitt, bronkospasme, pneumonitt, økt sputum.
Hud- og vedhengslidelser - Hyppig: utslett, kløe. Sjelden: lysfølsomhetsreaksjon, urticaria, akne, misfarging av huden, eksem, alopecia, dermatitt, tørr hud, psoriasis. Sjeldne: hypertrikose, redusert svetting, melanose, keratitt, cellulitt, pruritus ani.
Spesielle sanser - Hyppig: unormal overnatting, smaksperversjon. Sjelden: tinnitus, konjunktivitt, øyesmerter. Sjeldne: mydriasis, fotofobi, diplopi, unormal tåredannelse, grå stær, smakstap.
Forstyrrelser i urinveiene - Hyppig: polyuri. Sjelden: vannlatingsfrekvens, urininkontinens, urinretensjon, dysuri. Sjeldne: ansiktsødem, hematuri, oliguri, pyelonefritt, nyrestein, nyresmerter.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk etter godkjenning av citalopram, racematet eller escitalopram, S-enantiomeren av citalopram. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Blod og lymfesystem lidelser: hemolytisk anemi, trombocytopeni, redusert protrombin
Hjertelidelser: torsade de pointes, ventrikulær arytmi, QT-forlenget
Endokrine lidelser: hyperprolaktinemi
Øyelidelser: vinkel-lukkende glaukom
Gastrointestinale lidelser: gastrointestinal blødning, pankreatitt
Generelle lidelser og administrative nettstedsbetingelser: abstinenssyndrom
Lever og gallesykdommer: levernekrose
Forstyrrelser i immunsystemet: anafylaksi, allergisk reaksjon
Muskel- og bindevevslidelser: rabdomyolyse
Forstyrrelser i nervesystemet: grand mal krampeanfall(er), myoklonus, koreoatetose, dyskinesi, akatisi, nystagmus
Graviditet, puerperium og perinatale tilstander: spontanabort
Psykiatriske lidelser: delirium
Nyre- og urinveislidelser: akutt nyresvikt
Reproduktive system og brystsykdommer: priapisme
Hud- og subkutane vevslidelser: Stevens Johnsons syndrom, epidermal nekrolyse, angioødem, erythema multiforme, ekkymose
Vaskulære lidelser: trombose
NARKOTIKAHANDEL
Tabell 5 viser klinisk viktige legemiddelinteraksjoner med CELEXA.
Narkotikamisbruk og avhengighet
Kontrollert stoff
CELEXA (citalopram HBr) er ikke et kontrollert stoff.
Misbruke
Dyrestudier tyder på at misbruksansvaret for CELEXA 20mg er lavt. CELEXA har ikke blitt systematisk studert hos mennesker for potensialet for misbruk, toleranse eller fysisk avhengighet. Den kliniske erfaringen før markedsføring med CELEXA avslørte ingen legemiddelsøkende atferd. Disse observasjonene var imidlertid ikke systematiske, og det er ikke mulig å forutsi, på grunnlag av denne begrensede erfaringen, i hvilken grad et CNS-aktivt legemiddel vil bli misbrukt, omdirigert og/eller misbrukt når det først er markedsført. Følgelig bør helsepersonell nøye vurdere CELEXA 20 mg-pasienter for historie med narkotikamisbruk og følge slike pasienter nøye, observere dem for tegn på misbruk eller misbruk (f.eks. utvikling av toleranse, økninger av doser, narkotikasøkende atferd).
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Selvmordstanker og -adferd hos ungdom og unge voksne
sammenslåtte analyser av placebokontrollerte studier av antidepressiva (SSRI og andre antidepressiva klasser) som inkluderte omtrent 77 000 voksne pasienter og 4500 pediatriske pasienter, var forekomsten av selvmordstanker og -atferd hos antidepressiva-behandlede pasienter i alderen 24 år og yngre høyere enn hos placebobehandlede pasienter. Det var betydelig variasjon i risiko for selvmordstanker og selvmordsatferd blant rusmidler, men det var en økt risiko identifisert hos unge pasienter for de fleste medikamenter som ble studert. Det var forskjeller i absolutt risiko for selvmordstanker og -adferd på tvers av de forskjellige indikasjonene, med høyest forekomst hos pasienter med MDD. Medikament-placebo-forskjellene i antall tilfeller av selvmordstanker og selvmordsatferd per 1000 behandlede pasienter er gitt i tabell 1.
Det er ukjent om risikoen for selvmordstanker og selvmordsatferd hos barn, ungdom og unge voksne strekker seg til lengre tids bruk, dvs. utover fire måneder. Imidlertid er det betydelig bevis fra placebokontrollerte vedlikeholdsforsøk hos voksne med MDD på at antidepressiva forsinker tilbakefall av depresjon og at depresjon i seg selv er en risikofaktor for selvmordstanker og selvmordsatferd.
Overvåk alle antidepressiva-behandlede pasienter for klinisk forverring og fremvekst av selvmordstanker og -adferd, spesielt i løpet av de første månedene med medikamentell behandling og ved doseendringer. Rådfør familiemedlemmer eller omsorgspersoner til pasienter om å overvåke for endringer i atferd og å varsle helsepersonell. Vurder å endre det terapeutiske regimet, inkludert eventuelt seponering av CELEXA, hos pasienter hvis depresjon er vedvarende verre, eller som opplever nye selvmordstanker eller selvmordsatferd.
QT-forlengelse og Torsade De Pointes
CELEXA forårsaker doseavhengig QTc-forlengelse, en EKG-avvik som har vært assosiert med Torsade de Pointes (TdP), ventrikulær takykardi og plutselig død, som alle er observert i postmarketingrapporter for citalopram [se BIVIRKNINGER ].
På grunn av risikoen for QTc-forlengelse ved høyere CELEXA 20 mg doser, anbefales det at CELEXA ikke gis i doser over 40 mg én gang daglig [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ].
CELEXA bør unngås hos pasienter med medfødt lang QT-syndrom, bradykardi, hypokalemi eller hypomagnesemi, nylig akutt hjerteinfarkt eller ukompensert hjertesvikt med mindre fordelene oppveier risikoen for en bestemt pasient. CELEXA bør også unngås hos pasienter som tar andre legemidler som forlenger QTc-intervallet [se NARKOTIKAHANDEL ]. Slike legemidler inkluderer klasse 1A (f.eks. kinidin, prokainamid) eller klasse III (f.eks. amiodaron, sotalol) antiarytmiske medisiner, antipsykotiske medisiner (f.eks. klorpromazin, tioridazin), antibiotika (f.eks. gatifloxacin, moxifloxacin) eller en hvilken som helst annen klasse med medisiner. kjent for å forlenge QTc-intervallet (f.eks. pentamidin, levometadylacetat, metadon).
Citalopramdosen bør begrenses i visse populasjoner. Maksimal dose bør begrenses til 20 mg én gang daglig hos pasienter som er dårlige CYP2C19-metabolisatorer eller pasienter som samtidig får cimetidin eller en annen CYP2C19-hemmer, siden høyere citaloprameksponering kan forventes. Maksimal dose bør også begrenses til 20 mg én gang daglig hos pasienter med nedsatt leverfunksjon og hos pasienter som er eldre enn 60 år på grunn av forventet høyere eksponering [se DOSERING OG ADMINISTRASJON , NARKOTIKAHANDEL , Bruk i spesifikke populasjoner , KLINISK FARMAKOLOGI ].
Elektrolytt- og/eller EKG-overvåking anbefales under visse omstendigheter. Pasienter som vurderes for behandling med CELEXA 20 mg og som har risiko for betydelige elektrolyttforstyrrelser, bør ha baseline-målinger av kalium og magnesium i serum med periodisk overvåking. Hypokalemi (og/eller hypomagnesemi) kan øke risikoen for QTc-forlengelse og arytmi, og bør korrigeres før behandlingsstart og overvåkes med jevne mellomrom. EKG-overvåking anbefales hos pasienter der bruk av CELEXA 10 mg ikke anbefales med mindre fordelene klart oppveier risikoen for en bestemt pasient (se ovenfor ). Disse inkluderer de pasientene med hjertetilstandene nevnt ovenfor, og de som tar andre legemidler som kan forlenge QTc-intervallet.
Seponer CELEXA 10 mg hos pasienter som viser seg å ha vedvarende QTc-målinger >500 ms. Hvis pasienter som tar CELEXA opplever symptomer som kan indikere forekomst av hjertearytmier, f.eks. svimmelhet, hjertebank eller synkope, bør forskriveren starte ytterligere evaluering, inkludert hjerteovervåking.
Serotonin syndrom
SSRI, inkludert CELEXA 20 mg, kan utløse serotonergt syndrom, en potensielt livstruende tilstand. Risikoen øker ved samtidig bruk av andre serotonerge legemidler (inkludert triptaner, trisykliske antidepressiva, fentanyl, litium, tramadol, tryptofan, buspiron, amfetamin og johannesurt) og med legemidler som hemmer metabolismen av serotonin, dvs. MAO-hemmere [se KONTRAINDIKASJONER , NARKOTIKAHANDEL ]. Serotonergt syndrom kan også oppstå når disse stoffene brukes alene. Symptomer på serotonergt syndrom ble observert hos 0,1 % av MDD-pasienter behandlet med CELEXA 20 mg i kliniske studier før markedsføring.
Tegn og symptomer på serotonergt syndrom kan omfatte endringer i mental status (f.eks. agitasjon, hallusinasjoner, delirium og koma), autonom ustabilitet (f.eks. takykardi, labilt blodtrykk, svimmelhet, diaforese, rødme, hypertermi), nevromuskulære symptomer (f.eks. tremor, rigiditet, myoklonus, hyperrefleksi, inkoordinasjon), anfall og gastrointestinale symptomer (f.eks. kvalme, oppkast, diaré).
Samtidig bruk av CELEXA og MAO-hemmere er kontraindisert. I tillegg må CELEXA 20 mg ikke startes hos en pasient som behandles med MAO-hemmere som linezolid eller intravenøs metylenblått. Ingen rapporter involverte administrering av metylenblått på andre måter (som orale tabletter eller lokal vevsinjeksjon). Hvis det er nødvendig å starte behandling med en MAO-hemmer som linezolid eller intravenøs metylenblått hos en pasient som tar CELEXA 10 mg, seponer CELEXA 20 mg før du starter behandling med MAO-hemmeren [se KONTRAINDIKASJONER , NARKOTIKAHANDEL ].
Overvåk alle pasienter som tar CELEXA 20 mg for fremveksten av serotonergt syndrom. Seponer behandlingen med CELEXA og eventuelle samtidige serotonerge midler umiddelbart hvis symptomene ovenfor oppstår, og start støttende symptomatisk behandling. Hvis samtidig bruk av CELEXA med andre serotonerge legemidler er klinisk berettiget, informer pasientene om økt risiko for serotonergt syndrom og overvåk for symptomer.
Økt risiko for blødning
Legemidler som forstyrrer serotoninreopptakshemming, inkludert CELEXA 20mg, øker risikoen for blødningshendelser. Samtidig bruk av aspirin, ikke-steroide antiinflammatoriske legemidler (NSAIDS), andre blodplatehemmende legemidler, warfarin og andre antikoagulantia kan øke denne risikoen. Kasusrapporter og epidemiologiske studier (kasuskontroll og kohortdesign) har vist en sammenheng mellom bruk av medikamenter som forstyrrer serotoningjenopptak og forekomst av gastrointestinal blødning. Blødningshendelser relatert til legemidler som forstyrrer serotonin-gjenopptaket har variert fra ekkymose, hematom, neseblødning og petekkier til livstruende blødninger.
Informer pasienter om økt risiko for blødning forbundet med samtidig bruk av CELEXA 20 mg og blodplatehemmere eller antikoagulantia. For pasienter som tar warfarin, overvåk nøye det internasjonale normaliserte forholdet [se NARKOTIKAHANDEL ].
Aktivering av mani eller hypomani
Hos pasienter med bipolar lidelse kan behandling av en depressiv episode med CELEXA eller et annet antidepressivum utløse en blandet/manisk episode. I kontrollerte kliniske studier ble pasienter med bipolar lidelse ekskludert; Imidlertid ble symptomer på mani eller hypomani rapportert hos 0,1 % av udiagnostiserte pasienter behandlet med CELEXA. Før du starter behandling med CELEXA 10mg, screen pasienter for personlig eller familiehistorie med bipolar lidelse, mani eller hypomani [se DOSERING OG ADMINISTRASJON ].
Seponeringssyndrom
Bivirkninger etter seponering av serotonerge antidepressiva, spesielt etter brå seponering, inkluderer: kvalme, svette, dysforisk stemning, irritabilitet, agitasjon, svimmelhet, føleforstyrrelser (f.eks. parestesi, som elektrisk sjokk), skjelving, angst, forvirring, hodepine, sløvhet, emosjonell labilitet, søvnløshet, hypomani, tinnitus og anfall. En gradvis reduksjon i dosen i stedet for brå seponering anbefales når det er mulig [se DOSERING OG ADMINISTRASJON ].
Anfall
CELEXA 20mg har ikke blitt systematisk evaluert hos pasienter med anfallsforstyrrelser. Pasienter med anfallshistorie ble ekskludert fra kliniske studier. I kliniske studier med CELEXA 20 mg oppstod anfall hos 0,3 % av pasientene behandlet med CELEXA (en frekvens på én pasient per 98 års eksponering) og 0,5 % av pasientene behandlet med placebo (en frekvens på én pasient per 50 års eksponering). CELEXA 10 mg bør forskrives med forsiktighet til pasienter med anfallsforstyrrelser.
Vinkellukkende glaukom
Pupilleutvidelsen som oppstår etter bruk av mange antidepressiva, inkludert CELEXA, kan utløse et vinkelangrep hos en pasient med anatomisk smale vinkler som ikke har patentert iridektomi. Unngå bruk av antidepressiva, inkludert CELEXA, hos pasienter med ubehandlede anatomisk smale vinkler.
Hyponatremi
Hyponatremi kan oppstå som følge av behandling med SSRI, inkludert CELEXA. Tilfeller av serumnatrium lavere enn 110 mmol/L er rapportert. Tegn og symptomer på hyponatremi inkluderer hodepine, konsentrasjonsvansker, hukommelsessvikt, forvirring, svakhet og ustabilitet, som kan føre til fall. Tegn og symptomer assosiert med mer alvorlige og/eller akutte tilfeller har inkludert hallusinasjoner, synkope, anfall, koma, pustestans og død. I mange tilfeller ser denne hyponatremien ut til å være et resultat av syndromet med upassende antidiuretisk hormonsekresjon (SIADH).
Hos pasienter med symptomatisk hyponatremi, seponer CELEXA og iverksett passende medisinsk intervensjon. Eldre pasienter, pasienter som tar diuretika og de som er volumfattige kan ha større risiko for å utvikle hyponatremi med SSRI [se Bruk i spesifikke populasjoner ].
Seksuell dysfunksjon
Bruk av SSRI, inkludert CELEXA, kan forårsake symptomer på seksuell dysfunksjon [se BIVIRKNINGER ]. Hos mannlige pasienter kan bruk av SSRI resultere i ejakulatorisk forsinkelse eller svikt, redusert libido og erektil dysfunksjon. Hos kvinnelige pasienter kan bruk av SSRI resultere i redusert libido og forsinket eller manglende orgasme.
Det er viktig for forskrivere å spørre om seksuell funksjon før oppstart av CELEXA og å spørre spesifikt om endringer i seksuell funksjon under behandlingen, fordi seksuell funksjon kanskje ikke er spontant rapportert. Ved evaluering av endringer i seksuell funksjon er det viktig å få en detaljert anamnese (inkludert tidspunkt for symptomdebut) fordi seksuelle symptomer kan ha andre årsaker, inkludert den underliggende psykiatriske lidelsen. Diskuter potensielle ledelsesstrategier for å støtte pasienter i å ta informerte beslutninger om behandling.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( Medisinveiledning ).
Selvmordstanker og -adferd
Råd pasienter og omsorgspersoner til å se etter fremveksten av suicidalitet, spesielt tidlig under behandlingen og når dosen justeres opp eller ned, og instruer dem om å rapportere slike symptomer til helsepersonell [se ADVARSEL i boks , ADVARSLER OG FORHOLDSREGLER ].
QT-forlengelse og Torsade De Pointes
Råd pasienter til å konsultere helsepersonell umiddelbart hvis de føler seg besvimte, mister bevisstheten eller har hjertebank. Instruer pasienter om å informere helsepersonell om at de tar CELEXA før de tar noen nye medisiner [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL ].
Serotonin syndrom
Vær oppmerksom på risikoen for serotonergt syndrom, spesielt ved samtidig bruk av CELEXA 20 mg og andre serotonerge legemidler, inkludert triptaner, trisykliske antidepressiva, fentanyl, litium, tramadol, tryptofan, buspiron, amfetamin, johannesurt og med legemidler som hemmer metabolismen av serotonin (spesielt MAO-hemmere, både de som er beregnet på å behandle psykiatriske lidelser og også andre, som linezolid). Instruer pasienter om å kontakte helsepersonell eller rapportere til legevakten hvis de opplever tegn eller symptomer på serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL ].
Økt risiko for blødning
Informer pasienter om samtidig bruk av CELEXA 10 mg og acetylsalisylsyre, NSAIDs, andre blodplatehemmende legemidler, warfarin eller andre antikoagulantia fordi den kombinerte bruken har vært assosiert med økt risiko for blødning. Råd pasientene til å informere helsepersonell dersom de tar eller planlegger å ta reseptbelagte eller reseptfrie medisiner som øker risikoen for blødning [se ADVARSLER OG FORHOLDSREGLER ].
Aktivering av mani eller hypomani
Råd pasienter og deres omsorgspersoner om å observere tegn på aktivering av mani/hypomani og instruere dem om å rapportere slike symptomer til helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Seponeringssyndrom
Råd pasientene til ikke å avbryte behandlingen med CELEXA brått og å diskutere eventuelle nedtrappingsregimer med helsepersonell. Informer pasienter om at bivirkninger kan oppstå når CELEXA 20 mg seponeres [Se ADVARSLER OG FORHOLDSREGLER ].
Seksuell dysfunksjon
Informer pasienter om at bruk av CELEXA kan forårsake symptomer på seksuell dysfunksjon hos både mannlige og kvinnelige pasienter. Informer pasienter om at de bør diskutere eventuelle endringer i seksuell funksjon og potensielle behandlingsstrategier med helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Svangerskap
- . Råd pasienter til å varsle helsepersonell dersom de blir gravide eller har tenkt å bli gravide under behandling med CELEXA [se Bruk i spesifikke populasjoner ]. . Informer pasienter om at bruk av CELEXA sent i svangerskapet kan føre til økt risiko for neonatale komplikasjoner som krever langvarig sykehusinnleggelse, respirasjonsstøtte, sondeernæring og/eller vedvarende pulmonal hypertensjon hos nyfødte (PPHN) [se Bruk i spesifikke populasjoner ]. . Gi kvinner beskjed om at det finnes et eksponeringsregister for graviditet som overvåker graviditetsutfall hos kvinner som er eksponert for citalopram under graviditet [se Bruk i spesifikke populasjoner ].
Amming
Råd ammende kvinner til å overvåke spedbarn for overdreven sedasjon, rastløshet, agitasjon, dårlig mating og dårlig vektøkning og å søke medisinsk hjelp hvis de merker disse tegnene [se Bruk i spesifikke populasjoner ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese
Citalopram økte forekomsten av tynntarmskarsinom hos rotter behandlet i 24 måneder med doser på 8 og 24 mg/kg/dag i dietten, som er omtrent 2 og 6 ganger den maksimale anbefalte humane dosen (MRHD) på henholdsvis 40 mg, basert på mg/m² kroppsoverflate. Et no-effect level (NOEL) for dette funnet ble ikke etablert.
Citalopram økte ikke forekomsten av svulster hos mus behandlet i 18 måneder ved doser opp på 240 mg/kg/dag i dietten, som er omtrent 30 ganger MRDH på 40 mg basert på mg/m² kroppsoverflate.
Mutagenese
Citalopram var mutagent i in vitro bakteriell revers mutasjonsanalyse (Ames-test) i 2 av 5 bakteriestammer (Salmonella TA98 og TA1537) i fravær av metabolsk aktivering. Det var klastogent i in vitro kinesisk hamster-lungecelleanalyse for kromosomavvik i nærvær og fravær av metabolsk aktivering. Citalopram var ikke mutagent i in vitro pattedyrforover-genmutasjonsanalyse (HPRT) i muselymfomceller eller i in vitro/in vivo uplanlagt DNA-syntese (UDS)-analyse i rottelever. Det var ikke klastogent i in vitro-kromosomavviksanalysen i humane lymfocytter eller i to in vivo musemikronukleusanalyser.
Nedsatt fruktbarhet
Citalopram ble administrert oralt til hunn- og hannrotter i doser på 32, 48 og 72 mg/kg/dag før og gjennom parring og fortsatt til svangerskapet. Disse dosene er omtrent 8, 12 og 17 ganger MRHD på 40 mg basert på mg/m² kroppsoverflate. Paring og fertilitet ble redusert ved doser ≥ 32 mg/kg/dag, som er omtrent 8 ganger MRHD.
Svangerskapsvarigheten ble økt med 48 mg/kg/dag, som er omtrent 12 ganger MRHD.
Bruk i spesifikke populasjoner
Svangerskap
Eksponeringsregister for graviditet
Det finnes et graviditetseksponeringsregister som overvåker graviditetsutfall hos kvinner som er eksponert for antidepressiva under graviditet. Helsepersonell oppfordres til å registrere pasienter ved å ringe National Pregnancy Registry for Antidepressants på 1-844-405-6185 eller besøke online på https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
Risikosammendrag
Tilgjengelige data fra publiserte epidemiologiske studier og postmarkedsføringsrapporter med bruk av citalopram under graviditet har ikke etablert økt risiko for alvorlige fødselsskader eller spontanabort. Publiserte studier viste at citalopram-nivåer i både navlestrengsblod og fostervann er lik de som er observert i mors serum. Det er risiko for vedvarende pulmonal hypertensjon hos nyfødte (PPHN) (se Data ) og/eller dårlig neonatal tilpasning med eksponering for selektive serotoninreopptakshemmere (SSRI), inkludert CELEXA, under graviditet. Det er også risiko forbundet med ubehandlet depresjon under graviditet (se Kliniske betraktninger ).
I reproduksjonsstudier på dyr forårsaket citalopram uønskede embryo-/fostereffekter ved doser som forårsaket maternell toksisitet (se Data ).
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i de klinisk anerkjente svangerskapene henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-/fosterrisiko
Kvinner som slutter med antidepressiva under svangerskapet har større sannsynlighet for å få tilbakefall av alvorlig depresjon enn kvinner som fortsetter med antidepressiva. Dette funnet er fra en prospektiv longitudinell studie av 201 gravide kvinner med en historie med alvorlig depressiv lidelse som var euthymic og tok antidepressiva i begynnelsen av svangerskapet. Vurder risikoen for ubehandlet depresjon når du avbryter eller endrer behandling med antidepressiva under graviditet og etter fødsel.
Fetale/neonatale bivirkninger
Nyfødte eksponert for CELEXA og andre SSRI-er sent i tredje trimester har utviklet komplikasjoner som krever langvarig sykehusinnleggelse, pustestøtte og sondeernæring. Slike komplikasjoner kan oppstå umiddelbart etter levering. Rapporterte kliniske funn har inkludert pustebesvær, cyanose, apné, anfall, temperaturustabilitet, matvansker, oppkast, hypoglykemi, hypotoni, hypertoni, hyperrefleksi, skjelving, urolighet, irritabilitet og konstant gråt. Disse funnene stemmer overens med enten en direkte toksisk effekt av SSRI eller muligens et medikamentavbruddssyndrom. Det skal bemerkes at i noen tilfeller er det kliniske bildet i samsvar med serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER ].
Data
Menneskelige data
Eksponering sent i svangerskapet for SSRI kan ha økt risiko for vedvarende pulmonal hypertensjon hos nyfødte (PPHN). PPHN forekommer hos 1-2 per 1000 levendefødte i den generelle befolkningen og er assosiert med betydelig neonatal morbiditet og dødelighet.
Dyredata
Citalopram ble administrert oralt til gravide rotter i løpet av organogeneseperioden i doser på 32, 56 og 112 mg/kg/dag, som er omtrent 8, 14 og 27 ganger den maksimale anbefalte humane dosen (MRHD) på 40 mg, basert på mg/m² kroppsoverflate. Citalopram forårsaket maternal toksisitet av CNS kliniske tegn og redusert vektøkning ved 112 mg/kg/dag, som er 27 ganger MRHD. Ved denne maternalt toksiske dosen reduserte citalopram embryo/føtal vekst og overlevelse og økte fosteravvik (inkludert kardiovaskulære og skjelettdefekter). Det ingen observerte bivirkningsnivået (NOAEL) for maternell og embryoføtal toksisitet er 56 mg/kg/dag, som er omtrent 14 ganger MRHD.
Citalopram ble administrert oralt til drektige kaniner i løpet av organogeneseperioden i doser på opptil 16 mg/kg/dag, som er omtrent 8 ganger MRHD på 40 mg, basert på mg/m² kroppsoverflate. Ingen maternell eller embryoføtal toksisitet ble observert. NOAEL for maternell og embryoføtal toksisitet er 16 mg/kg/dag, som er omtrent 8 ganger MRHD.
Citalopram ble administrert oralt til gravide rotter under sen drektighet og diegivningsperioder i doser på 4,8, 12,8 og 32 mg/kg/dag, som er omtrent 1, 3 og 8 ganger MRHD på 40 mg, basert på mg/m² kropp flateareal. Citalopram økte avkomsdødeligheten i løpet av de første 4 dagene av fødselen og reduserte avkomsveksten ved 32 mg/kg/dag, som er omtrent 8 ganger MRHD. NOAEL for utviklingstoksisitet er 12,8 mg/kg/dag, som er omtrent 3 ganger MRHD. I en separat studie ble lignende effekter på avkomsdødelighet og vekst sett når mødre ble behandlet gjennom hele drektigheten og tidlig diegivning med doser ≥ 24 mg/kg/dag, som er omtrent 6 ganger MRHD. En NOAEL ble ikke bestemt i den studien.
Amming
Risikosammendrag
Data fra publisert litteratur rapporterer tilstedeværelsen av citalopram i morsmelk ved relative spedbarnsdoser som varierer mellom 0,7 og 9,4 % av mors vektjusterte dose og et melk/plasma-forhold som varierer mellom 0,78 og 4,3. Det er rapportert om spedbarn som ammes som er eksponert for citalopram som har opplevd irritabilitet, rastløshet, overdreven somnolens, redusert mating og vekttap (se Kliniske betraktninger ). Det er ingen informasjon om effekter av citalopram på melkeproduksjonen.
De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for CELEXA 20mg og eventuelle potensielle bivirkninger på det ammede barnet fra CELEXA 20mg eller fra den underliggende morens tilstand.
Kliniske betraktninger
Overvåk spedbarn som ammer for bivirkninger, som irritabilitet, rastløshet, overdreven søvnighet, redusert mating og vekttap.
Pediatrisk bruk
Sikkerheten og effektiviteten til CELEXA er ikke fastslått hos pediatriske pasienter. To placebokontrollerte studier med 407 pediatriske pasienter med MDD har blitt utført med CELEXA 20 mg, og dataene var ikke tilstrekkelige til å støtte bruk hos pediatriske pasienter.
Antidepressiva øker risikoen for selvmordstanker og -adferd hos pediatriske pasienter [se ADVARSEL i boks , ADVARSLER OG FORHOLDSREGLER ]. Redusert appetitt og vekttap har blitt observert i forbindelse med bruk av SSRI hos pediatriske pasienter.
Geriatrisk bruk
Av 4422 pasienter i kliniske studier med CELEXA 20 mg, var 1357 60 og over, 1034 var 65 og over, og 457 var 75 og over. I to farmakokinetiske studier økte citalopram AUC med henholdsvis 23 % og 30 % hos personer ≥ 60 år sammenlignet med yngre personer, og halveringstiden økte med henholdsvis 30 % og 50 % [se KLINISK FARMAKOLOGI ]. Derfor er den maksimale anbefalte dosen hos pasienter 60 år og eldre lavere enn yngre pasienter [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER ].
SSRI, inkludert CELEXA, har vært assosiert med tilfeller av klinisk signifikant hyponatremi hos eldre pasienter, som kan ha større risiko for denne bivirkningen [se ADVARSLER OG FORHOLDSREGLER ].
Nedsatt leverfunksjon
Økt eksponering for citalopram forekommer hos pasienter med nedsatt leverfunksjon. Maksimal anbefalt dose av CELEXA 10 mg er lavere hos pasienter med nedsatt leverfunksjon [se DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI ].
OVERDOSE
Følgende er rapportert ved overdosering av Celexa tabletter:
- . Anfall, som kan være forsinket, og endret mental status inkludert koma. . Kardiovaskulær toksisitet, som kan være forsinket, inkludert QRS- og QTc-intervallforlengelse, omfattende komplekse takyarytmier og torsade de pointes. Hypertensjon ses oftest, men kan sjelden se hypotensjon alene eller med samtidig inntak, inkludert alkohol. . Serotonergt syndrom (pasienter med en overdosering av flere medikamenter med andre proserotonerge legemidler kan ha høyere risiko).
Langvarig hjerteovervåking anbefales ved inntak av Celexa-overdosering på grunn av risikoen for arytmi. Gastrointestinal dekontaminering med aktivt kull bør vurderes hos pasienter som melder seg tidlig etter en Celexa 10 mg overdose. Vurder å kontakte et giftsenter (1-800-221-2222) eller en medisinsk toksikolog for ytterligere anbefalinger om overdosering.
KONTRAINDIKASJONER
CELEXA er kontraindisert hos pasienter:
- . tar, eller innen 14 dager etter seponering, MAO-hemmere (inkludert MAO-hemmere som linezolid eller intravenøs metylenblått) på grunn av økt risiko for serotonergt syndrom [se ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL ]. . tar pimozid på grunn av risiko for QT-forlengelse [se NARKOTIKAHANDEL ]. . med kjent overfølsomhet overfor citalopram eller noen av de inaktive ingrediensene i CELEXA. Reaksjoner har inkludert angioødem og anafylaksi [se BIVIRKNINGER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Virkningsmekanismen til citalopram er uklar, men antas å være relatert til potensering av serotonerg aktivitet i sentralnervesystemet (CNS) som følge av dets hemming av CNS-neuronalt gjenopptak av serotonin (5-HT).
Farmakodynamikk
In vitro og in vivo studier på dyr tyder på at citalopram er en selektiv serotoninreopptakshemmer (SSRI) med minimal effekt på noradrenalin (NE) og dopamin (DA) neuronalt gjenopptak.
Citalopram har ingen eller svært lav affinitet for 5-HT1A, 5-HT2A, dopamin D1 og D2, α1-, α2- og β-adrenerge, histamin H1, gamma-aminosmørsyre (GABA), muskarine kolinerge og benzodiazepinreseptorer.
Hjerteelektrofysiologi
Individuelt korrigert QTc (QTcNi) intervall ble evaluert i en randomisert, placebo og aktiv (moxifloxacin 400 mg) kontrollert cross-over, eskalerende flerdosestudie med 119 friske forsøkspersoner. Maksimal gjennomsnittlig (øvre grense av 95 % ensidig konfidensintervall) forskjell fra placebo var 8,5 (10,8) og 18,5 (21,0) msek for henholdsvis 20 mg og 60 mg (1,5 ganger den maksimale anbefalte dosen) citalopram. Basert på det etablerte eksponering-respons-forholdet, er den anslåtte QTcNi-endring fra placebo (øvre grense av 95 % ensidig konfidensintervall) under Cmax for dosen på 40 mg 12,6 (14,3) msek [se ADVARSLER OG FORHOLDSREGLER ].
Farmakokinetikk
Enkelt- og flerdose-farmakokinetikken til citalopram er lineær og doseproporsjonal i et doseområde på 10 til 40 mg/dag. Biotransformasjon av citalopram er hovedsakelig lever, med en gjennomsnittlig terminal halveringstid på ca. 35 timer. Ved dosering én gang daglig oppnås steady state plasmakonsentrasjoner innen ca. en uke. Ved steady state forventes graden av akkumulering av citalopram i plasma, basert på halveringstiden, å være 2,5 ganger plasmakonsentrasjonen observert etter en enkeltdose.
Absorpsjon
Etter en enkelt oral dose (40 mg tablett) av citalopram, oppstår toppnivåer i blodet etter ca. 4 timer. Den absolutte biotilgjengeligheten av citalopram var ca. 80 % i forhold til en intravenøs dose, og absorpsjonen påvirkes ikke av mat.
Fordeling
Distribusjonsvolumet av citalopram er ca. 12 l/kg og bindingen av citalopram (CT), demetylcitalopram (DCT) og didemethylcitalopram (DDCT) til humane plasmaproteiner er ca. 80 %.
Eliminering
Metabolisme
Citalopram metaboliseres til demetylcitalopram (DCT), didemetylcitalopram (DDCT), citalopram-N-oksid og et deaminert propionsyrederivat. Hos mennesker er uendret citalopram den dominerende forbindelsen i plasma. Ved steady state er konsentrasjonen av citaloprams metabolitter, DCT og DDCT, i plasma henholdsvis omtrent halvparten og en tiendedel av det opprinnelige legemidlet. In vitro-studier viser at citalopram er minst 8 ganger mer potent enn dets metabolitter når det gjelder hemming av serotonin-reopptak, noe som tyder på at de evaluerte metabolittene sannsynligvis ikke bidrar signifikant til de antidepressive virkningene til citalopram.
In vitro-studier med humane levermikrosomer indikerte at CYP3A4 og CYP2C19 er de primære isozymene involvert i N-demetyleringen av citalopram.
Utskillelse
Etter intravenøs administrering av citalopram var andelen av legemidlet gjenvunnet i urinen som citalopram og DCT henholdsvis ca. 10 % og 5 %. Den systemiske clearance av citalopram var 330 ml/min, med ca. 20 % av den på grunn av renal clearance.
Spesifikke populasjoner
Geriatriske pasienter
Citaloprams farmakokinetikk hos personer ≥ 60 år ble sammenlignet med yngre personer i to normale frivillige studier. I en enkeltdosestudie økte citalopram AUC og halveringstid hos personer ≥ 60 år med henholdsvis 30 % og 50 %, mens de i en flerdosestudie økte med henholdsvis 23 % og 30 %[ se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner ].
Mannlige og kvinnelige pasienter
I tre farmakokinetiske studier (totalt N=32), var citalopram AUC hos kvinner halvannen til to ganger høyere enn hos menn. Denne forskjellen ble ikke observert i fem andre farmakokinetiske studier (totalt N=114). I kliniske studier ble det ikke sett forskjeller i steady state serum citalopram nivåer mellom menn (N=237) og kvinner (N=388). Det var ingen kjønnsforskjeller i farmakokinetikken til DCT og DDCT.
Pasienter med nedsatt leverfunksjon
Citalopram oral clearance ble redusert med 37 % og halveringstiden ble doblet hos pasienter med redusert leverfunksjon sammenlignet med normale personer [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , Bruk i spesifikke populasjoner ].
Pasienter med nedsatt nyrefunksjon
Hos pasienter med mild til moderat nedsatt nyrefunksjon ble oral clearance av citalopram redusert med 17 % sammenlignet med normale personer. Ingen dosejustering for slike pasienter anbefales. Ingen informasjon er tilgjengelig om farmakokinetikken til citalopram hos pasienter med alvorlig nedsatt nyrefunksjon (kreatininclearance
CYP2C19 Dårlige metaboliserere
Hos CYP2C19-fattige metabolisatorer ble citalopram steady state Cmax og AUC økt med henholdsvis 68 % og 107 % [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER ].
CYP2D6 Dårlige metaboliserere
Citalopram steady state-nivåer var ikke signifikant forskjellig hos lavt metaboliserte og omfattende metaboliserere av CYP2D6.
Legemiddelinteraksjonsstudier
In vitro enzymhemmingsdata avslørte ikke en hemmende effekt av citalopram på CYP3A4, -2C9 eller -2E1, men antydet at det er en svak hemmer av CYP1A2, -2D6 og -2C19. Citalopram forventes å ha liten hemmende effekt på in vivo metabolisme mediert av disse enzymene. Imidlertid er in vivo-data for å løse dette spørsmålet begrenset.
CYP3A4- og CYP2C19-hemmere
Siden CYP3A4 og CYP2C19 er de primære enzymene involvert i metabolismen av citalopram, forventes det at potente hemmere av CYP3A4 (f.eks. ketokonazol, itrakonazol og makrolidantibiotika) og hemmere av CYP2C19 (f.eks. omeprazol) kan redusere clearance av cimetidin. citalopram. Samtidig administrering av citalopram og den potente CYP3A4-hemmeren ketokonazol påvirket imidlertid ikke farmakokinetikken til citalopram signifikant. 20 mg/dag er maksimal anbefalt citalopramdose hos pasienter som samtidig tar cimetidin eller en annen CYP2C19-hemmer, på grunn av risikoen for QT-forlengelse [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER ].
Cimetidin
Hos personer som hadde fått 21 dager med 40 mg/dag CELEXA 10 mg, resulterte kombinert administrering av 400 mg cimetidin to ganger daglig i 8 dager i en økning i citalopram AUC og Cmax på henholdsvis 43 % og 39 % [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , NARKOTIKAHANDEL ].
CYP2D6-hemmere
Samtidig administrering av et legemiddel som hemmer CYP2D6 med citalopram vil neppe ha klinisk signifikante effekter på citalopram-metabolismen, basert på studieresultatene hos CYP2D6-fattige metabolisatorer.
Digoksin
Hos personer som hadde fått 21 dager med 40 mg/dag CELEXA 20 mg, påvirket ikke kombinert administrering av CELEXA og digoksin (enkeltdose på 1 mg) farmakokinetikken til verken citalopram eller digoksin signifikant.
Litium
Samtidig administrering av CELEXA (40 mg/dag i 10 dager) og litium (30 mmol/dag i 5 dager) hadde ingen signifikant effekt på farmakokinetikken til citalopram eller litium.
Pimozide
en kontrollert studie var en enkeltdose pimozid 2 mg administrert sammen med citalopram 40 mg gitt én gang daglig i 11 dager assosiert med en gjennomsnittlig økning i QTc-verdier på ca. 10 msek sammenlignet med pimozid gitt alene. Citalopram endret ikke gjennomsnittlig AUC eller Cmax for pimozid. Mekanismen for denne farmakodynamiske interaksjonen er ikke kjent [se KONTRAINDIKASJONER , ADVARSLER OG FORHOLDSREGLER ].
Teofyllin
Kombinert administrering av CELEXA (40 mg/dag i 21 dager) og CYP1A2-substratet teofyllin (enkeltdose på 300 mg) påvirket ikke farmakokinetikken til teofyllin. Effekten av teofyllin på farmakokinetikken til citalopram ble ikke evaluert.
Warfarin
Administrering av 40 mg/dag CELEXA i 21 dager påvirket ikke farmakokinetikken til warfarin, et CYP3A4-substrat. Protrombintiden ble økt med 5 %, den kliniske betydningen av dette er ukjent.
Karbamazepin
Kombinert administrering av CELEXA (40 mg/dag i 14 dager) og karbamazepin (titrert til 400 mg/dag i 35 dager) påvirket ikke farmakokinetikken til karbamazepin, et CYP3A4-substrat signifikant. Selv om de laveste plasmanivåene av citalopram var upåvirket, gitt de enzyminduserende egenskapene til karbamazepin, bør muligheten for at karbamazepin kan øke clearance av citalopram vurderes dersom de to legemidlene administreres samtidig.
Triazolam
Kombinert administrering av CELEXA (titrert til 40 mg/dag i 28 dager) og CYP3A4-substratet triazolam (enkeltdose på 0,25 mg) påvirket ikke farmakokinetikken til verken citalopram eller triazolam signifikant.
Ketokonazol
Kombinert administrering av CELEXA (40 mg) og ketokonazol (200 mg) reduserte Cmax og AUC for ketokonazol med henholdsvis 21 % og 10 %, og påvirket ikke farmakokinetikken til citalopram signifikant.
Metoprolol
Administrering av 40 mg/dag CELEXA 20 mg i 22 dager resulterte i en to ganger økning i plasmanivåene av den betaadrenerge blokkeren metoprolol. Økte plasmanivåer av metoprolol har vært assosiert med redusert kardioselektivitet. Samtidig administrering av CELEXA 10 mg og metoprolol hadde ingen klinisk signifikant effekt på blodtrykk eller hjertefrekvens.
Imipramin og andre trisykliske antidepressiva (TCA)
In vitro-studier tyder på at citalopram er en relativt svak hemmer av CYP2D6. Samtidig administrering av CELEXA (40 mg/dag i 10 dager) med TCA imipramin (enkeltdose på 100 mg), et substrat for CYP2D6, påvirket ikke plasmakonsentrasjonene av imipramin eller citalopram signifikant. Konsentrasjonen av imipraminmetabolitten desipramin ble imidlertid økt med omtrent 50 %. Den kliniske betydningen av desipraminforandringen er ukjent.
Dyretoksikologi og/eller farmakologi
Netthinneforandringer hos rotter
Patologiske endringer (degenerasjon/atrofi) ble observert i netthinnen til albinorotter i den 2-årige karsinogenitetsstudien med citalopram. Det var en økning i både forekomst og alvorlighetsgrad av retinal patologi hos både hann- og hunnrotter som fikk 80 mg/kg/dag, som er omtrent 19 ganger MRHD på 40 mg basert på mg/m² kroppsoverflate. Lignende funn var ikke til stede hos rotter behandlet i to år med dosen 24 mg/kg/dag, hos mus behandlet i 18 måneder med doser opp til 240 mg/kg/dag, eller hos hunder behandlet i ett år med doser opptil 20 mg/kg/dag, som er henholdsvis omtrent 6, 29 og 17 ganger MRHD, basert på mg/m² kroppsoverflate.
Ytterligere studier for å undersøke mekanismen for denne patologien er ikke utført, og den potensielle betydningen av denne effekten hos mennesker er ikke fastslått.
Kliniske studier
Effekten av CELEXA som behandling for alvorlig depressiv lidelse ble fastslått i to placebokontrollerte studier (av 4 til 6 ukers varighet) hos voksne polikliniske pasienter (alder 18-66) som oppfyller DSM-III- eller DSM-III-R-kriteriene for alvorlig depressiv sykdom. lidelse (MDD) (studie 1 og 2).
Studie 1, en 6-ukers studie der pasienter fikk faste CELEXA 10 mg doser på 10 mg, 20 mg, 40 mg og 60 mg daglig, viste at CELEXA 40 daglig og 60 mg daglig (1,5 ganger den maksimale anbefalte daglige dosen) var effektiv målt ved Hamilton Depression Rating Scale (HAMD) totalscore, det primære effektendepunktet. HAMD-17 er en skala med 17 punkter, klinikervurdert som brukes til å vurdere alvorlighetsgraden av depressive symptomer. Poeng på HAMD-17 varierer fra 0 til 52, med høyere poengsum som indikerer mer alvorlig depresjon. Denne studien viste ingen klar effekt av 10 mg og 20 mg daglige doser, og 60 mg daglig dose var ikke mer effektiv enn 40 mg daglig dose. På grunn av risikoen for QTc-forlengelse og ventrikulære arytmier, er den maksimale anbefalte dosen av CELEXA 10 mg 40 mg én gang daglig.
studie 2, en 4-ukers, placebokontrollert studie med pasienter med MDD, var startdosen 20 mg daglig, etterfulgt av titrering til maksimal tolerert dose eller maksimal dose på 80 mg daglig (2 ganger maksimal anbefalt daglig dose ). Pasienter behandlet med CELEXA 20 mg viste statistisk signifikant større forbedring enn placebopasienter på HAMD-totalskåren, det primære effektendepunktet. I ytterligere tre placebokontrollerte studier med pasienter med MDD, var forskjellen i respons på behandling mellom pasienter som fikk CELEXA og pasienter som fikk placebo ikke statistisk signifikant.
to langtidsstudier ble pasienter med MDD som hadde respondert på CELEXA 10 mg i løpet av de første 6 eller 8 uker med akutt behandling randomisert til fortsettelse av CELEXA 10 mg eller placebo. I en studie fikk pasientene faste doser av CELEXA 20 mg eller 40 mg daglig, og i den andre studien fikk pasientene fleksible doser av CELEXA 20 mg daglig til 60 mg daglig (1,5 ganger den maksimale anbefalte daglige dosen). I begge studiene opplevde pasienter som fikk fortsatt CELEXA-behandling statistisk signifikant lavere tilbakefallsrater over de påfølgende 6 månedene sammenlignet med de som fikk placebo. I fastdosestudien var den reduserte frekvensen av tilbakefall av depresjon lik hos pasienter som fikk 20 mg eller 40 mg daglig CELEXA. På grunn av risikoen for QTc-forlengelse og ventrikulære arytmier, er den maksimale anbefalte dosen av CELEXA 20 mg 40 mg én gang daglig.
Analyser av sammenhengen mellom behandlingsresultat og alder, kjønn og rase antydet ingen differensiell respons på grunnlag av disse pasientkarakteristikkene.
PASIENTINFORMASJON
CELEXA® (Suh-leks-uh) (citalopram) Tabletter, til oral bruk
Hva er den viktigste informasjonen jeg bør vite om CELEXA?
CELEXA 20mg kan forårsake alvorlige bivirkninger, inkludert:
- . Økt risiko for selvmordstanker og -handlinger. CELEXA 10mg og andre antidepressiva kan øke selvmordstanker og -handlinger hos noen barn, ungdom og unge voksne spesielt i løpet av de første månedene av behandlingen eller når dosen endres. CELEXA skal ikke brukes til barn.
- . Depresjon og andre psykiske lidelser er de viktigste årsakene til selvmordstanker og -handlinger.
Hvordan kan jeg se etter og prøve å forhindre selvmordstanker og -handlinger hos meg selv eller et familiemedlem?
- . Vær nøye med eventuelle endringer, spesielt plutselige endringer i humør, atferd, tanker eller følelser, eller hvis du utvikler selvmordstanker eller -handlinger. Dette er svært viktig når en antidepressiv medisin startes eller når dosen endres. . Ring helsepersonell med en gang for å rapportere nye eller plutselige endringer i humør, oppførsel, tanker eller følelser. . Hold alle oppfølgingsbesøk hos helsepersonell som planlagt. Ring helsepersonell mellom besøkene etter behov, spesielt hvis du har bekymringer om symptomer.
Ring helsepersonell eller få akutt medisinsk hjelp med en gang hvis du eller familiemedlemmet ditt har noen av følgende symptomer, spesielt hvis de er nye, verre eller bekymrer deg:
- . tanker om selvmord eller å dø . ny eller verre depresjon . føler meg veldig urolig eller rastløs . problemer med å sove (søvnløshet) . opptrer aggressivt, er sint eller voldelig . en ekstrem økning i aktivitet eller prat (mani) . forsøk på å begå selvmord . ny eller verre angst . handler på farlige impulser . panikk anfall . ny eller verre irritabilitet . andre uvanlige endringer i atferd eller humør
Hva er CELEXA?
CELEXA 10mg er et reseptbelagt legemiddel som brukes til å behandle en viss type depresjon kalt Major Depressive Disorder (MDD) hos voksne.
Det er ikke kjent om CELEXA 10mg er trygt og effektivt for bruk hos barn.
Hvem bør ikke ta CELEXA?
Ikke ta CELEXA hvis du:
- . ta en monoaminoksidasehemmer (MAOI) . har sluttet å ta en MAO-hemmer de siste 14 dagene . behandles med antibiotikum linezolid eller intravenøs metylenblått . ta pimozid . er allergisk mot citalopram eller noen av ingrediensene i CELEXA. Se slutten av denne medisinveiledningen for en fullstendig liste over ingredienser i CELEXA.
Spør helsepersonell eller apotek hvis du ikke er sikker på om du tar en MAO-hemmer, inkludert MAO-hemmere som linezolid eller intravenøs metylenblått.
Ikke begynn å ta en MAO-hemmer i minst 14 dager etter at du har avsluttet behandlingen med CELEXA.
Før du tar CELEXA, fortell helsepersonell om alle dine medisinske tilstander, inkludert hvis du:
- . har eller har en familiehistorie med selvmord, depresjon, bipolar lidelse, mani eller hypomani . har en unormal hjerterytme kalt QT-forlengelse . har eller hatt hjerteproblemer, inkludert hjerteinfarkt, hjertesvikt, unormal hjerterytme eller lang QT-syndrom . har lave nivåer av kalium, magnesium eller natrium i blodet . har eller hatt blødningsproblemer . har eller hatt anfall (kramper) . har høyt trykk i øyet (grønn stær) . har eller hatt nyre- eller leverproblemer . er gravid eller planlegger å bli gravid. CELEXA 20 mg kan skade det ufødte barnet ditt. Å ta CELEXA sent i svangerskapet kan føre til økt risiko for visse problemer hos den nyfødte. Snakk med helsepersonell om risikoene og fordelene ved å behandle depresjon under graviditet.
- . Fortell legen din med en gang hvis du blir gravid eller tror du kan være gravid under behandling med CELEXA. . Det finnes et svangerskapsregister for kvinner som er eksponert for CELEXA under graviditet. Formålet med registeret er å samle informasjon om helsen til kvinner som er utsatt for CELEXA og deres baby. Hvis du blir gravid under behandling med CELEXA 10mg, snakk med helsepersonell om registrering hos National Pregnancy Registry for Antidepressants. Du kan registrere deg ved å ringe 1-844-405-6185 eller besøke online på https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
- . Hvis du ammer under behandling med CELEXA 20 mg, ring legen din med en gang hvis babyen din utvikler søvnighet eller masete, eller ikke spiser eller går opp i vekt.
Fortell helsepersonell om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
CELEXA 10mg og andre legemidler kan påvirke hverandre og forårsake mulige alvorlige bivirkninger. CELEXA kan påvirke måten andre medisiner virker på, og andre medisiner kan påvirke måten CELEXA virker på.
Fortell spesielt helsepersonell hvis du tar:
- . medisiner som brukes til å behandle migrenehodepine kjent som triptaner . trisykliske antidepressiva . fentanyl . litium . tramadol . tryptofan . buspiron . amfetamin . Johannesurt . medisiner som kan påvirke blodpropp som aspirin, ikke-steroide antiinflammatoriske legemidler (NSAIDs) og warfarin . diuretika . metadon . gatifloxacin eller moxifloxacin . medisiner som brukes til å kontrollere hjertefrekvensen eller rytmen (antiarytmika) . legemidler som brukes til å behandle humør, angst, psykotiske eller tankeforstyrrelser, inkludert selektive serotoninreopptakshemmere (SSRI) og serotonin noradrenalin reopptakshemmere (SNRI)
Spør helsepersonell hvis du ikke er sikker på om du tar noen av disse medisinene. Helsepersonell kan fortelle deg om det er trygt å ta CELEXA 10mg sammen med andre legemidler.
Ikke start eller stopp andre legemidler under behandling med CELEXA uten å snakke med helsepersonell først. Å stoppe CELEXA plutselig kan føre til at du får alvorlige bivirkninger. Se, "Hva er de mulige bivirkningene av CELEXA?"
Kjenn til medisinene du tar. Hold en liste over dem for å vise til helsepersonell og apotek når du får en ny medisin.
Hvordan bør jeg ta CELEXA 10mg?
- . Ta CELEXA 20mg nøyaktig slik helsepersonell ber deg ta det. Ikke endre dosen eller slutt å ta CELEXA uten først å snakke med helsepersonell. . Det kan hende at helsepersonell må endre dosen av CELEXA til den er riktig dose for deg. . Ta CELEXA 1 gang hver dag med eller uten mat. . Hvis du tar for mye CELEXA 20mg, ring helsepersonell eller giftkontrollsenter på 1-800-222-1222, eller gå til nærmeste legevakt umiddelbart.
Hva er de mulige bivirkningene av CELEXA 20mg?
CELEXA kan forårsake alvorlige bivirkninger, inkludert:
- . Se, "Hva er den viktigste informasjonen jeg bør vite om CELEXA?" . Hjerterytmeproblemer. CELEXA kan forårsake en alvorlig endring i hjerterytmen (en rask eller uregelmessig hjerterytme) som kan forårsake død. Fortell legen din med en gang hvis du føler deg besvimt eller besvimer, eller hvis du har en endring i hjerterytmen. . Serotonergt syndrom. Å ta CELEXA kan forårsake et potensielt livstruende problem som kalles serotonergt syndrom. Risikoen for å utvikle serotonergt syndrom øker når CELEXA 20 mg tas sammen med visse andre legemidler. Se, "Hvem bør ikke ta CELEXA?" Ring helsepersonell eller gå til nærmeste legevakt med en gang dersom du har noen av følgende tegn og symptomer på serotonergt syndrom:
- . opphisselse . se eller høre ting som ikke er ekte (hallusinasjoner) . forvirring . koma . rask hjerteslag . blodtrykksendringer . svimmelhet . svette . rødming . høy kroppstemperatur (hypertermi) . skjelvinger, stive muskler eller muskelrykninger . tap av koordinasjon . anfall . kvalme, oppkast, diaré
- . kraftig økt energi . alvorlige søvnproblemer . racing tanker . hensynsløs oppførsel . uvanlig store ideer . overdreven lykke eller irritabilitet . snakker mer eller raskere enn vanlig
- . kvalme . svette . endringer i humøret ditt . hodepine . irritabilitet og agitasjon . tretthet . svimmelhet . problemer med å sove . elektrisk støtfølelse (parestesi) . hypomani . angst . øresus (tinnitus) . forvirring . anfall
- . hodepine . konsentrasjonsvansker . hukommelsesendringer . forvirring . svakhet og ustøhet på føttene som kan føre til fall
I alvorlige eller mer plutselige tilfeller inkluderer tegn og symptomer:
- .
- . hallusinasjoner (se eller høre ting som ikke er ekte) . besvimelse . anfall . koma . å slutte å puste . død
Symptomer hos menn kan omfatte:
- . Forsinket utløsning eller manglende evne til å få utløsning . Nedsatt sexlyst . Problemer med å få eller beholde ereksjon
Symptomer hos kvinner kan omfatte:
- . Nedsatt sexlyst . Forsinket orgasme eller manglende evne til å få orgasme
Snakk med helsepersonell hvis du utvikler endringer i din seksuelle funksjon eller hvis du har spørsmål eller bekymringer om seksuelle problemer under behandling med DRIZALMA SPRINKLE. Det kan være behandlinger som helsepersonell kan foreslå.
Den vanligste bivirkningen av CELEXA er forsinket ejakulasjon.
Dette er ikke alle mulige bivirkninger av CELEXA.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
Hvordan bør jeg oppbevare CELEXA?
- . Oppbevar CELEXA ved romtemperatur mellom 68 °F til 77 °F (20 °C til 25 °C). . Oppbevar CELEXA 20mg og alle legemidler utilgjengelig for barn.
Generell informasjon om sikker og effektiv bruk av CELEXA
Medisiner er noen ganger foreskrevet for andre formål enn de som er oppført i en medisinveiledning. Ikke bruk CELEXA 20 mg for en tilstand det ikke er foreskrevet for. Ikke gi CELEXA til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem. Du kan spørre helsepersonell eller apotek om informasjon om CELEXA som er skrevet for helsepersonell.
Hva er ingrediensene i CELEXA?
Aktiv ingrediens: citalopram hydrobromid
Inaktive ingredienser: kopolyvidon, maisstivelse, krysskarmellosenatrium, glyserin, laktosemonohydrat, magnesiumstearat, hypromellose, mikrokrystallinsk cellulose, polyetylenglykol, titandioksid og jerndioksid for farging.
Denne medisinveiledningen er godkjent av US Food and Drug Administration.
