Aceon 2mg, 4mg, 8mg Perindopril Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Aceon 4mg og hvordan brukes det?
Aceon 8mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på høyt blodtrykk (hypertensjon) og stabil koronararteriesykdom (CAD). Aceon kan brukes alene eller sammen med andre medisiner.
Aceon tilhører en klasse legemidler som kalles ACE-hemmere.
Det er ikke kjent om Aceon er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Aceon 4mg?
Aceon kan forårsake alvorlige bivirkninger, inkludert:
- . utslett, . pustevansker, . hevelse i ansiktet, leppene, tungen eller halsen, . svakhet, . langsom eller uregelmessig hjerterytme, . besvimelse, . kvalme, . oppkast, . tap av Appetit, . magesmerter, . gulfarging av øyne eller hud (gulsott), . mørk urin, og . alvorlig svimmelhet
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Aceon 2mg inkluderer:
- . svimmelhet, . svimmelhet, . tretthet, og . tørrhoste
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Aceon. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
- . Når graviditet oppdages, seponer ACEON 4mg så snart som mulig. ADVARSLER OG FORHOLDSREGLER . Legemidler som virker direkte på renin-angiotensin-systemet kan forårsake skade og død for det utviklende fosteret. ADVARSLER OG FORHOLDSREGLER
BESKRIVELSE
ACEON® (perindopril erbumin) Tabletter inneholder tert-butylaminsaltet av perindopril, etylesteren av en ikke-sulfhydrylangiotensin-konverterende enzym (ACE)-hemmer. Perindopril erbumin er kjemisk beskrevet som (2S,3DS,7DS)-1-[(S)-N-[(S)-1-karboksy-butyl]alanyl]heksahydro-2-indolinkarboksylsyre, 1-etylester, forbindelse med tert-butylamin (1:1). Dens molekylformel er C19H32N2O5C4H11N. Dens strukturformel er:
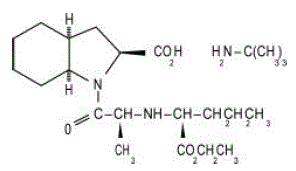
Perindopril erbumin er et hvitt, krystallinsk pulver med en molekylvekt på 368,47 (fri syre) eller 441,61 (saltform). Det er fritt løselig i vann (60% w/w), alkohol og kloroform.
Perindopril er den frie syreformen av perindopril erbumin, er et prodrug og metaboliseres in vivo ved hydrolyse av estergruppen for å danne perindoprilat, den biologisk aktive metabolitten.
ACEON er tilgjengelig i styrker på 2 mg, 4 mg og 8 mg for oral administrering. I tillegg til perindopril erbumin, inneholder hver tablett følgende inaktive ingredienser: kolloidal silika (hydrofob), laktose, magnesiumstearat og mikrokrystallinsk cellulose. 4 mg og 8 mg tablettene inneholder også jernoksid.
INDIKASJONER
Hypertensjon
ACEON er indisert for behandling av pasienter med essensiell hypertensjon. ACEON kan brukes alene eller gis sammen med andre klasser av antihypertensiva, spesielt tiaziddiuretika.
Stabil koronararteriesykdom
ACEON 8mg er indisert for behandling av pasienter med stabil koronararteriesykdom for å redusere risikoen for kardiovaskulær dødelighet eller ikke-fatalt hjerteinfarkt. ACEON kan brukes sammen med konvensjonell behandling for behandling av koronararteriesykdom, slik som blodplatehemmende, antihypertensiv eller lipidsenkende behandling.
DOSERING OG ADMINISTRASJON
Hypertensjon
Bruk hos ukompliserte hypertensive pasienter
Hos pasienter med essensiell hypertensjon er den anbefalte startdosen 4 mg én gang daglig. Dosen kan titreres etter behov til maksimalt 16 mg per dag. Det vanlige vedlikeholdsdoseområdet er 4 mg til 8 mg administrert som en enkelt daglig dose eller i to oppdelte doser.
Bruk hos eldre pasienter
Den anbefalte daglige startdosen av ACEON 4 mg for eldre er 4 mg daglig, gitt i én eller to oppdelte doser. Erfaring med ACEON er begrenset hos eldre ved doser over 8 mg. Doser over 8 mg bør administreres med nøye blodtrykksovervåking og dosetitrering [se Bruk i spesifikke populasjoner ].
Bruk med diuretika
Hos pasienter som for tiden behandles med et vanndrivende middel, kan symptomatisk hypotensjon oppstå etter startdosen av ACEON. Vurder å redusere dosen av vanndrivende middel før du starter ACEON [se NARKOTIKAHANDEL ].
Stabil koronararteriesykdom
Hos pasienter med stabil koronararteriesykdom bør ACEON 4 mg gis med en startdose på 4 mg én gang daglig i 2 uker, og deretter økes etter tolerering til en vedlikeholdsdose på 8 mg én gang daglig. Hos eldre pasienter (over 70 år) bør ACEON gis som en dose på 2 mg én gang daglig den første uken, etterfulgt av 4 mg én gang daglig i den andre uken og 8 mg én gang daglig for vedlikeholdsdose hvis tolerert.
Dosejustering ved nedsatt nyrefunksjon og dialyse
Eliminasjonen av perindoprilat er redusert hos pasienter med nedsatt nyrefunksjon. ACEON anbefales ikke til pasienter med kreatininclearance
HVORDAN LEVERES
Doseringsformer og styrker
Tablettene er avlange med en skåre på den ene siden.
2 mg tablett er hvit og merket med "ACN 2" på siden uten delestrek.
4 mg tablett er rosa og merket med "ACN 4" på siden uten skår.
8 mg tablett er laks og merket med "ACN 8" på siden uten skår.
Oppbevaring og håndtering
Tablettene er avlange med en skåre på den ene siden.
Oppbevares utilgjengelig for barn.
Oppbevares ved kontrollert romtemperatur 20° til 25°C (68° til 77°F) [se USP]. Beskytt mot fuktighet.
For mer informasjon, vennligst ring vår medisinske kommunikasjonsavdeling gratis på 888-985-7657.
Produsert av: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 USA. Revidert: september 2017
BIVIRKNINGER
Fordi kliniske studier utføres under vidt forskjellige forhold, kan ikke uønskede hendelsesrater observert i de kliniske utprøvingene av et medikament direkte sammenlignes med rater i de kliniske utprøvingene av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Erfaring fra kliniske forsøk
Følgende bivirkninger er omtalt andre steder i merkingen:
- . Anafylaktoide reaksjoner, inkludert angioødem [se ADVARSLER OG FORHOLDSREGLER ] . Hypotensjon [se ADVARSLER OG FORHOLDSREGLER ] . Nøytropeni og agranulocytose [se ADVARSLER OG FORHOLDSREGLER ] . Nedsatt nyrefunksjon [se ADVARSLER OG FORHOLDSREGLER ] . Hyperkalemi [se ADVARSLER OG FORHOLDSREGLER ] . Hoste [se ADVARSLER OG FORHOLDSREGLER ]
Hypertensjon
ACEON 4mg har blitt evaluert for sikkerhet hos ca. 3400 pasienter med hypertensjon i amerikanske og utenlandske kliniske studier. Dataene som presenteres her er basert på resultater fra de 1 417 ACEON-behandlede pasientene som deltok i de amerikanske kliniske studiene. Over 220 av disse pasientene ble behandlet med ACEON® (perindopril erbumin) i minst ett år.
placebokontrollerte amerikanske kliniske studier var forekomsten av for tidlig seponering av behandlingen på grunn av bivirkninger 6,5 % hos pasienter behandlet med ACEON 2 mg og 6,7 % hos pasienter behandlet med placebo. De vanligste årsakene var hoste, hodepine, asteni og svimmelhet.
Blant 1 012 pasienter i placebokontrollerte amerikanske studier, var den totale frekvensen av rapporterte bivirkninger lik hos pasienter behandlet med ACEON og hos de behandlet med placebo (omtrent 75 % i hver gruppe). De eneste bivirkningene hvis forekomst på ACEON 4 mg var minst 2 % høyere enn på placebo, var hoste (12 % vs. 4,5 %) og ryggsmerter (5,8 % vs. 3,1 %).
Svimmelhet ble ikke rapportert hyppigere i perindoprilgruppen (8,2 %) enn i placebogruppen (8,5 %), men sannsynligheten økte med dosen, noe som tyder på en årsakssammenheng med perindopril.
Stabil koronararteriesykdom
Perindopril har blitt evaluert for sikkerhet i EUROPA, en dobbeltblind, placebokontrollert studie på 12 218 pasienter med stabil koronarsykdom. Den totale frekvensen av seponering var ca. 22 % på legemiddel og placebo. De vanligste medisinske årsakene til seponering som var hyppigere på perindopril enn placebo var hoste, legemiddelintoleranse og hypotensjon.
Postmarketing-erfaring
Frivillige rapporter om bivirkninger hos pasienter som tar ACEON som har blitt mottatt siden markedsintroduksjonen og som er av ukjent årsakssammenheng med ACEON 8mg inkluderer: hjertestans, eosinofil pneumonitt, nøytropeni/agranulocytose, pancytopeni, anemi (inkludert hemolytisk og aplastisk), trombocytt. nyresvikt, nefritt, leversvikt, gulsott (hepatocellulær eller kolestatisk), symptomatisk hyponatremi, bulløs pemfigoid, pemfigus, akutt pankreatitt, fall, psoriasis, eksfoliativ dermatitt og et syndrom som kan omfatte: leddgikt/leddgikt, sekret, vaskulitt, vaskulitt, , utslett eller andre dermatologiske manifestasjoner, et positivt antinukleært antistoff (ANA), leukocytose, eosinofili eller en forhøyet erytrocyttsedimentasjonsrate (ESR).
Funn fra kliniske laboratorieprøver
Hematologi
Små reduksjoner i hemoglobin og hematokrit forekommer hyppig hos hypertensive pasienter behandlet med ACEON 8mg, men er sjelden av klinisk betydning. I kontrollerte kliniske studier ble ingen pasienter avbrutt fra behandlingen på grunn av utvikling av anemi. Leukopeni (inkludert nøytropeni) ble observert hos 0,1 % av pasientene i amerikanske kliniske studier [se ADVARSLER OG FORHOLDSREGLER ].
Leverfunksjonstester
Økning i ALAT (1,6 % ACEON versus 0,9 % placebo) og ASAT (0,5 % ACEON 2 mg versus 0,4 % placebo) er observert i placebokontrollerte kliniske studier. Forhøyelsene var generelt milde og forbigående og forsvant etter seponering av behandlingen.
NARKOTIKAHANDEL
Diuretika
Pasienter på diuretika, og spesielt de som er startet nylig, kan av og til oppleve en overdreven reduksjon av blodtrykket etter oppstart av ACEON-behandling. Muligheten for hypotensive effekter kan minimeres ved enten å redusere dosen av eller seponere diuretika eller øke saltinntaket før oppstart av behandling med perindopril. Hvis vanndrivende terapi ikke kan endres, gi nøye medisinsk tilsyn med den første dosen av ACEON, i minst to timer og til blodtrykket har stabilisert seg i ytterligere en time [se ADVARSLER OG FORHOLDSREGLER ].
Hastigheten og omfanget av perindopril absorpsjon og eliminasjon påvirkes ikke av samtidig diuretika. Biotilgjengeligheten av perindoprilat ble imidlertid redusert av diuretika, og dette var assosiert med en reduksjon i plasma ACE-hemming.
Kaliumtilskudd og kaliumsparende diuretika
ACEON 8mg kan øke serumkalium på grunn av potensialet til å redusere aldosteronproduksjonen. Bruk av kaliumsparende diuretika (spironolakton, amilorid, triamteren og andre), kaliumtilskudd eller andre legemidler som kan øke serumkalium (indometacin, heparin, ciklosporin og andre) kan øke risikoen for hyperkalemi. Derfor, hvis samtidig bruk av slike midler er indisert, overvåk pasientens serumkalium ofte.
Litium
Økt serumlitium og symptomer på litiumtoksisitet er rapportert hos pasienter som samtidig får litium- og ACE-hemmerbehandling. Hyppig overvåking av serumlitiumkonsentrasjon anbefales. Bruk av et vanndrivende middel kan ytterligere øke risikoen for litiumtoksisitet.
Gull
Nitritoidreaksjoner (symptomer inkluderer rødme i ansiktet, kvalme, oppkast og hypotensjon) har i sjeldne tilfeller blitt rapportert hos pasienter på behandling med injiserbart gull (natriumaurotiomalat) og samtidig behandling med ACE-hemmere inkludert ACEON.
Digoksin
En kontrollert farmakokinetisk studie har ikke vist noen effekt på plasmakonsentrasjonen av digoksin ved samtidig administrering med ACEON, men en effekt av digoksin på plasmakonsentrasjonen av perindopril/perindoprilat er ikke utelukket.
Gentamicin
Dyredata har antydet muligheten for interaksjon mellom perindopril og gentamicin. Dette er imidlertid ikke undersøkt i studier på mennesker.
Ikke-steroide antiinflammatoriske midler, inkludert selektive cyklooksygenase-2-hemmere (COX-2-hemmere)
Hos eldre pasienter, volumfattige (inkludert de som får diuretikabehandling), eller med nedsatt nyrefunksjon, kan samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med ACE-hemmere, inkludert perindopril, føre til forverring av nyrefunksjonen , inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får perindopril og NSAID-behandling.
Den antihypertensive effekten av ACE-hemmere, inkludert perindopril, kan svekkes av NSAIDs inkludert selektive COX-2-hemmere.
Dobbel blokade av Renin-Angiotensin-systemet (RAS)
Dobbel blokkering av RAS med angiotensinreseptorblokkere, ACE-hemmere eller aliskiren er assosiert med økt risiko for hypotensjon, hyperkalemi og endringer i nyrefunksjon (inkludert akutt nyresvikt) sammenlignet med monoterapi. De fleste pasienter som får kombinasjonen av to RAS-hemmere oppnår ingen ekstra fordel sammenlignet med monoterapi. Generelt, unngå kombinert bruk av RAS-hemmere. Overvåk nøye blodtrykk, nyrefunksjon og elektrolytter hos pasienter på ACEON 2mg og andre midler som påvirker RAS.
Ikke gi aliskiren samtidig med ACEON 8mg hos pasienter med diabetes. Unngå bruk av aliskiren med ACEON 2mg hos pasienter med nedsatt nyrefunksjon (GFR
mTOR-hemmere
Pasienter som samtidig tar behandling med mTOR-hemmere (pattedyrmål for rapamycin) kan ha økt risiko for angioødem [se ADVARSLER OG FORHOLDSREGLER ].
Neprilysin-hemmer
Pasienter som samtidig tar neprilysinhemmere kan ha økt risiko for angioødem. [se ADVARSLER OG FORHOLDSREGLER ]
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Anafylaktoide og muligens relaterte reaksjoner
Antagelig fordi angiotensin-konverterende enzymhemmere påvirker metabolismen av eikosanoider og polypeptider, inkludert endogent bradykinin, kan pasienter som får ACE-hemmere (inkludert ACEON) bli utsatt for en rekke uønskede hendelser, noen av dem alvorlige. Svarte pasienter som får ACE-hemmere har en høyere forekomst av angioødem sammenlignet med ikke-svarte.
Hode og nakke angioødem
Angioødem i ansikt, ekstremiteter, lepper, tunge, glottis eller strupehode er rapportert hos pasienter behandlet med ACE-hemmere, inkludert ACEON (0,1 % av pasientene behandlet med ACEON i amerikanske kliniske studier). Angioødem forbundet med involvering av tungen, glottis eller strupehodet kan være dødelig. I slike tilfeller, avbryt behandlingen med ACEON umiddelbart og observer til hevelsen forsvinner. Når involvering av tungen, glottis eller strupehodet ser ut til å forårsake luftveisobstruksjon, gis egnet behandling, for eksempel subkutan epinefrinoppløsning 1:1000 (0,3 til 0,5 ml), umiddelbart.
Pasienter som samtidig tar behandling med mTOR-hemmere (f.eks. temsirolimus) eller en neprilysinhemmer kan ha økt risiko for angioødem [se NARKOTIKAHANDEL ].
Intestinalt angioødem
Intestinalt angioødem er rapportert hos pasienter behandlet med ACE-hemmere. Disse pasientene fikk magesmerter (med eller uten kvalme eller oppkast); i noen tilfeller var det ingen tidligere angioødem i ansiktet, og C-1-esterasenivåene var normale. Angioødem ble diagnostisert ved prosedyrer inkludert abdominal CT-skanning eller ultralyd, eller ved operasjon, og symptomene forsvant etter seponering av ACE-hemmeren. Intestinalt angioødem bør inkluderes i differensialdiagnosen for pasienter på ACE-hemmere med magesmerter.
Hypotensjon
ACEON 4mg kan forårsake symptomatisk hypotensjon. ACEON har vært assosiert med hypotensjon hos 0,3 % av ukompliserte hypertensive pasienter i amerikanske placebokontrollerte studier. Symptomer relatert til ortostatisk hypotensjon ble rapportert hos ytterligere 0,8 % av pasientene.
Symptomatisk hypotensjon er mest sannsynlig hos pasienter som har vært volum- eller saltfattige som følge av langvarig vanndrivende terapi, saltbegrensning i kosten, dialyse, diaré eller oppkast [se DOSERING OG ADMINISTRASJON ].
ACE-hemmere kan forårsake overdreven hypotensjon, og kan være assosiert med oliguri eller azotemi, og sjelden med akutt nyresvikt og død. Hos pasienter med iskemisk hjertesykdom eller cerebrovaskulær sykdom kan et for høyt blodtrykksfall resultere i et hjerteinfarkt eller en cerebrovaskulær ulykke.
Hos pasienter med risiko for overdreven hypotensjon, bør ACEON-behandling startes under svært nøye medisinsk tilsyn. Pasienter bør følges nøye de første to ukene av behandlingen og hver gang dosen av ACEON 2 mg og/eller diuretikum økes.
Hvis overdreven hypotensjon oppstår, bør pasienten umiddelbart plasseres i ryggleie og om nødvendig behandles med en intravenøs infusjon av fysiologisk saltvann. ACEON 4 mg-behandling kan vanligvis fortsettes etter gjenoppretting av volum og blodtrykk.

Nøytropeni/Agranulocytose
ACE-hemmere har vært assosiert med agranulocytose og benmargsdepresjon, oftest hos pasienter med nedsatt nyrefunksjon, spesielt pasienter med en kollagen vaskulær sykdom som systemisk lupus erythematosus eller sklerodermi.
Fostertoksisitet
Graviditetskategori D
Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer ACEON 4mg så snart som mulig [se Bruk i spesifikke populasjoner ].
Nedsatt nyrefunksjon
Som en konsekvens av hemming av renin-angiotensin-aldosteron-systemet, kan endringer i nyrefunksjonen forventes hos følsomme personer. Nyrefunksjonen bør overvåkes regelmessig hos pasienter som får ACEON [se DOSERING OG ADMINISTRASJON ], [se NARKOTIKAHANDEL ].
Hos pasienter med alvorlig kongestiv hjertesvikt, hvor nyrefunksjonen kan avhenge av aktiviteten til renin-angiotensinaldosteronsystemet, kan behandling med ACE-hemmere, inkludert ACEON, være assosiert med oliguri, progressiv azotemi, og i sjeldne tilfeller akutt nyresvikt og død.
Hos hypertensive pasienter med unilateral eller bilateral nyrearteriestenose kan økning i blodurea-nitrogen og serumkreatinin forekomme; vanligvis reversibel ved seponering av ACE-hemmeren. Hos slike pasienter bør nyrefunksjonen overvåkes i løpet av de første ukene av behandlingen.
Noen ACEON-behandlede pasienter har utviklet mindre og forbigående økninger i blod urea nitrogen og serum kreatinin, spesielt hos de som samtidig behandles med et vanndrivende middel.
Hyperkalemi
Forhøyelser av serumkalium er observert hos noen pasienter behandlet med ACE-hemmere, inkludert ACEON. De fleste tilfellene var isolerte enkeltverdier som ikke virket klinisk relevante og som sjelden var årsak til seponering. Risikofaktorer for utvikling av hyperkalemi inkluderer nyreinsuffisiens, diabetes mellitus og samtidig bruk av midler som kaliumsparende diuretika, kaliumtilskudd og/eller kaliumholdige salterstatninger [se NARKOTIKAHANDEL ].
Serumkalium bør overvåkes regelmessig hos pasienter som får ACEON.
Hoste
Antagelig på grunn av hemming av nedbrytningen av endogent bradykinin, har vedvarende ikke-produktiv hoste blitt rapportert med alle ACE-hemmere, som generelt går over etter seponering av behandlingen. Vurder ACE-hemmerindusert hoste i differensialdiagnosen av hoste.
Leversvikt
sjeldne tilfeller har ACE-hemmere vært assosiert med et syndrom som starter med kolestatisk gulsott og utvikler seg til fulminant levernekrose og noen ganger død. Mekanismen for dette syndromet er ikke forstått. Pasienter som får ACE-hemmere og som utvikler gulsott eller markerte økninger i leverenzymer bør seponere ACE-hemmeren og få passende medisinsk oppfølging.
Kirurgi/anestesi
Hos pasienter som gjennomgår kirurgi eller under anestesi med midler som produserer hypotensjon, kan ACEON blokkere angiotensin II-dannelse som ellers ville oppstå sekundært til kompenserende reninfrigjøring. Hypotensjon som kan tilskrives denne mekanismen kan korrigeres ved volumutvidelse.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Kreftfremkallende egenskaper
Ingen bevis for kreftfremkallende effekt ble observert i studier på rotter og mus når perindopril ble administrert i doser opptil 20 ganger (mg/kg) eller 2 til 4 ganger (mg/m2) den maksimale foreslåtte kliniske dosen (16 mg/dag) for 104 uker.
Mutagenese
Det ble ikke påvist noe gentoksisk potensial for ACEON, perindoprilat og andre metabolitter i forskjellige in vitro- og in vivo-undersøkelser, inkludert Ames-testen, Saccharomyces cerevisiae D4-testen, dyrkede humane lymfocytter, TK ± muselymfomanalyse, mus og rotte mikronukleustester og kinesisk hamster benmargsanalyse.
Nedsatt fruktbarhet
Det var ingen betydningsfull effekt på reproduksjonsevne eller fertilitet hos rotter gitt opptil 30 ganger (mg/kg) eller 6 ganger (mg/m2) den foreslåtte maksimale kliniske dosen av ACEON 2 mg i løpet av spermatogeneseperioden hos hanner eller oogenese og svangerskap. hos kvinner.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori D [se BOKS ADVARSEL og ADVARSLER OG FORHOLDSREGLER ].
Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer ACEON så snart som mulig. Disse uønskede utfallene er vanligvis forbundet med bruk av disse stoffene i andre og tredje trimester av svangerskapet. De fleste epidemiologiske studier som undersøker føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester har ikke skilt medisiner som påvirker renin-angiotensin-systemet fra andre antihypertensiva.
Riktig behandling av mors hypertensjon under graviditet er viktig for å optimalisere resultatene for både mor og foster.
det uvanlige tilfellet at det ikke er noe passende alternativ til behandling med legemidler som påvirker renin-angiotensin-systemet for en bestemt pasient, informere moren om den potensielle risikoen for fosteret. Utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Hvis oligohydramnios observeres, seponer ACEON 2mg, med mindre det anses som livreddende for moren. Fostertesting kan være aktuelt, basert på graviditetsuken. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade. Følg nøye med spedbarn med historie om in utero eksponering for ACEON for hypotensjon, oliguri og hyperkalemi [se Pediatrisk bruk ].
Radioaktivitet var påviselig hos fostre etter administrering av 14C-perindopril til drektige rotter.
Ammende mødre
Melk fra diegivende rotter inneholdt radioaktivitet etter administrering av 14C-perindopril. Det er ikke kjent om perindopril skilles ut i morsmelk. Fordi mange legemidler skilles ut i morsmelk, bør det utvises forsiktighet når ACEON gis til ammende mødre.
Pediatrisk bruk
Nyfødte med en historie med eksponering for ACEON i livmoren
Hvis oliguri eller hypotensjon oppstår, må du rette oppmerksomheten mot støtte av blodtrykk og nyreperfusjon. Utvekslingstransfusjoner eller dialyse kan være nødvendig som et middel for å reversere hypotensjon og/eller erstatte forstyrret nyrefunksjon. Perindopril, som krysser placenta, kan teoretisk fjernes fra den neonatale sirkulasjonen på denne måten, men begrenset erfaring har ikke vist at slik fjerning er sentral i behandlingen av disse spedbarnene.
Sikkerhet og effektivitet av ACEON 8mg hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Gjennomsnittlig blodtrykkseffekt av perindopril var noe mindre hos pasienter over 60 enn hos yngre pasienter, selv om forskjellen ikke var signifikant. Plasmakonsentrasjoner av både perindopril og perindoprilat var økt hos eldre pasienter sammenlignet med konsentrasjoner hos yngre pasienter. Ingen bivirkninger var tydelig økt hos eldre pasienter med unntak av svimmelhet og muligens utslett.
Start med en lav dose og titrér sakte etter behov. Overvåk for svimmelhet på grunn av risiko for fall.
Erfaring med ACEON 8 mg hos eldre pasienter ved daglige doser over 8 mg er begrenset.
Nedsatt nyrefunksjon
Dosejustering kan være nødvendig hos pasienter med nedsatt nyrefunksjon [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Biotilgjengeligheten av perindoprilat er økt hos pasienter med nedsatt leverfunksjon [se KLINISK FARMAKOLOGI ].
OVERDOSE
Hos dyr var doser av perindopril opptil 2500 mg/kg hos mus, 3000 mg/kg hos rotter og 1600 mg/kg hos hunder ikke-dødelige. Tidligere erfaringer var få, men antydet at overdosering med andre ACE-hemmere også ble ganske godt tolerert av mennesker. Den mest sannsynlige manifestasjonen er hypotensjon, og behandlingen bør være symptomatisk og støttende. Behandling med ACE-hemmeren bør seponeres, og pasienten bør observeres. Dehydrering, elektrolyttubalanse og hypotensjon bør behandles etter etablerte prosedyrer.
Blant de rapporterte tilfellene av overdosering av perindopril trengte pasienter som var kjent for å ha inntatt en dose på 80 mg til 120 mg assistert ventilasjon og sirkulasjonsstøtte. En ekstra pasient utviklet hypotermi, sirkulasjonsstans og døde etter inntak av opptil 180 mg perindopril. Intervensjonen for overdosering av perindopril kan kreve kraftig støtte.
Laboratoriebestemmelser av serumnivåer av perindopril og dets metabolitter er ikke allment tilgjengelige, og slike bestemmelser har i alle fall ingen etablert rolle i behandlingen av overdosering av perindopril.
Ingen data er tilgjengelige som tyder på fysiologiske manøvrer (f.eks. manøvrer for å endre pH i urinen) som kan akselerere eliminering av perindopril og dets metabolitter. Perindopril kan fjernes ved hemodialyse, med clearance på 52 ml/min for perindopril og 67 ml/min for perindoprilat.
Angiotensin II kan antagelig tjene som en spesifikk antagonist-motgift ved avvikling av perindopril-overdose, men angiotensin II er i hovedsak utilgjengelig utenfor spredte forskningsfasiliteter. Fordi den hypotensive effekten av perindopril oppnås gjennom vasodilatasjon og effektiv hypovolemi, er det rimelig å behandle perindopril overdose ved infusjon av normal saltvannsoppløsning.
KONTRAINDIKASJONER
ACEON® (perindopril erbumin) er kontraindisert hos pasienter som er kjent for å være overfølsomme (inkludert angioødem) overfor dette produktet eller andre ACE-hemmere. ACEON 4mg er også kontraindisert hos pasienter med arvelig eller idiopatisk angioødem.
Ikke gi aliskiren samtidig med ACEON hos pasienter med diabetes. [se NARKOTIKAHANDEL ]
ACEON er kontraindisert i kombinasjon med neprilysinhemmer (f.eks. sacubitril). Ikke administrer ACEON 8mg innen 36 timer etter bytte til eller fra sacubitril/valsartan, en neprilysinhemmer [se ADVARSLER OG FORHOLDSREGLER ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
ACEON® (perindopril erbumin) er et prodrug for perindoprilat, som hemmer ACE hos mennesker og dyr. Mekanismen som perindoprilat senker blodtrykket gjennom, antas først og fremst å være hemming av ACE-aktivitet. ACE er en peptidyldipeptidase som katalyserer omdannelsen av det inaktive dekapeptidet, angiotensin I, til vasokonstriktoren, angiotensin II. Angiotensin II er en potent perifer vasokonstriktor, som stimulerer aldosteronsekresjon av binyrebarken, og gir negativ tilbakemelding på reninsekresjon. Hemming av ACE resulterer i redusert plasmaangiotensin II, noe som fører til redusert vasokonstriksjon, økt plasmareninaktivitet og redusert aldosteronsekresjon. Sistnevnte resulterer i diurese og natriurese og kan være assosiert med en liten økning av serumkalium.
ACE er identisk med kininase II, et enzym som bryter ned bradykinin. Hvorvidt økte nivåer av bradykinin, et potent vasodepressorpeptid, spiller en rolle i den terapeutiske effekten av ACEON 4mg gjenstår å avklare.
Mens den viktigste mekanismen til perindopril i blodtrykksreduksjon antas å være gjennom renin-angiotensinaldosteronsystemet, har ACE-hemmere en viss effekt selv ved tilsynelatende lav-reninhypertensjon. Perindopril har blitt studert hos relativt få svarte pasienter, vanligvis en lav-renin-populasjon, og gjennomsnittlig respons av diastolisk blodtrykk på perindopril var omtrent halvparten av responsen sett hos ikke-svarte pasienter, et funn som samsvarer med tidligere erfaring med andre ACE-hemmere.
Farmakodynamikk
Etter administrering av perindopril hemmes ACE på en dose- og blodkonsentrasjonsrelatert måte, med maksimal hemming på 80 til 90 % oppnådd ved 8 mg ved i 10 til 12 timer. 24 timers ACE-hemming er omtrent 60 % etter disse dosene. Graden av ACE-hemming oppnådd ved en gitt dose ser ut til å avta over tid (ID50 øker). Pressorresponsen på en angiotensin I-infusjon reduseres av perindopril, men denne effekten er ikke like vedvarende som effekten på ACE; det er ca. 35 % hemming 24 timer etter en dose på 12 mg.
Farmakokinetikk
Absorpsjon
Oral administrering av ACEON resulterer i maksimale plasmakonsentrasjoner som inntreffer etter ca. 1 time. Den absolutte orale biotilgjengeligheten av perindopril er ca. 75 %. Etter absorpsjon hydrolyseres ca. 30 til 50 % av systemisk tilgjengelig perindopril til dens aktive metabolitt, perindoprilat, som har en gjennomsnittlig biotilgjengelighet på ca. 25 %. Maksimal plasmakonsentrasjon av perindoprilat oppnås 3 til 7 timer etter administrering av perindopril. Oral administrering av ACEON 8 mg sammen med mat reduserer ikke hastigheten eller omfanget av perindoprilabsorpsjon signifikant i forhold til fastende tilstand. Imidlertid reduseres graden av biotransformasjon av perindopril til den aktive metabolitten, perindoprilat, med ca. 43 %, noe som resulterer i en reduksjon i plasma ACE-hemmingskurven på ca. 20 %, sannsynligvis klinisk ubetydelig. I kliniske studier ble perindopril vanligvis administrert i en ikke-fastende tilstand.
Med 4 mg, 8 mg og 16 mg doser av ACEON, øker Cmax og AUC for perindopril og perindoprilat på en doseproporsjonal måte etter både oral enkeltdosering og ved steady state under et regime med flere doser én gang daglig.
Fordeling
Omtrent 60 % av sirkulerende perindopril er bundet til plasmaproteiner, og bare 10 til 20 % av perindoprilat er bundet. Derfor forventes ikke legemiddelinteraksjoner mediert gjennom effekter på proteinbinding.
Metabolisme og eliminering
Etter oral administrering viser perindopril multikompartment farmakokinetikk inkludert et dypt vevsrom (ACE-bindingsseter). Gjennomsnittlig halveringstid for perindopril assosiert med det meste av eliminasjonen er ca. 0,8 til 1 time.
Perindopril metaboliseres i stor grad etter oral administrering, med bare 4 til 12 % av dosen gjenfunnet uendret i urinen. Seks metabolitter som følge av hydrolyse, glukuronidering og cyklisering via dehydrering er identifisert. Disse inkluderer den aktive ACE-hemmeren, perindoprilat (hydrolysert perindopril), perindopril og perindoprilat glukuronider, dehydrert perindopril og diastereoisomerene av dehydrert perindoprilat. Hos mennesker ser det ut til at hepatisk esterase er ansvarlig for hydrolysen av perindopril.
Den aktive metabolitten, perindoprilat, viser også multikompartment farmakokinetikk etter oral administrering av ACEON. Dannelsen av perindoprilat skjer gradvis med maksimale plasmakonsentrasjoner mellom 3 og 7 timer. Den påfølgende reduksjonen i plasmakonsentrasjon viser en tilsynelatende gjennomsnittlig halveringstid på 3 til 10 timer for størstedelen av eliminasjonen, med en forlenget terminal eliminasjonshalveringstid på 30 til 120 timer som følge av langsom dissosiasjon av perindoprilat fra plasma/vev ACE-binding nettsteder. Ved gjentatt oral dosering én gang daglig med perindopril, akkumuleres perindoprilat ca. 1,5 til 2 ganger og oppnår steady state plasmanivåer i løpet av 3 til 6 dager. Clearance av perindoprilat og dets metabolitter er nesten utelukkende renal.
Eldre
Plasmakonsentrasjoner av både perindopril og perindoprilat hos eldre pasienter (over 70 år) er omtrent det dobbelte av de som ble observert hos yngre pasienter, noe som reflekterer både økt omdannelse av perindopril til perindoprilat og redusert renal utskillelse av perindoprilat [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Hjertefeil
Perindoprilatclearance er redusert hos pasienter med kongestiv hjertesvikt, noe som resulterer i et 40 % høyere doseintervall AUC.
Nedsatt nyrefunksjon
Med perindopril doser på 2 mg til 4 mg, øker perindoprilat AUC med redusert nyrefunksjon. Ved kreatininclearance på 30 til 80 ml/min er AUC omtrent det dobbelte av ved 100 ml/min. Når kreatininclearance faller under 30 ml/min, øker AUC mer markert.
Hos et begrenset antall studerte pasienter varierte perindoprilclearance ved dialyse fra ca. 40 til 80 ml/min. Perindoprilat-clearance ved dialyse varierte fra ca. 40 til 90 ml/min [se DOSERING OG ADMINISTRASJON ].
Nedsatt leverfunksjon
Biotilgjengeligheten av perindoprilat er økt hos pasienter med nedsatt leverfunksjon. Plasmakonsentrasjoner av perindoprilat hos pasienter med nedsatt leverfunksjon var omtrent 50 % høyere enn de som ble observert hos friske personer eller hypertensive pasienter med normal leverfunksjon.
Kliniske studier
Hypertensjon
placebokontrollerte studier av perindopril monoterapi (2 mg til 16 mg én gang daglig) hos pasienter med et gjennomsnittlig blodtrykk på ca. 150/100 mm Hg, hadde 2 mg liten effekt, men doser på 4 mg til 16 mg senket blodtrykket. Dosene på 8 mg og 16 mg kunne ikke skilles, og begge hadde større effekt enn dosen på 4 mg. I disse studiene ga doser på 8 mg og 16 mg per dag liggende, lave blodtrykksreduksjoner på 9 til 15/5 til 6 mm Hg. Når dosering én gang daglig og to ganger daglig dosering ble sammenlignet, var doseringsregimet to ganger daglig generelt litt bedre, men med ikke mer enn ca. 0,5 mm Hg til 1 mm Hg. Etter 2 mg til 16 mg doser av perindopril, var de laveste gjennomsnittlige systoliske og diastoliske blodtrykkseffektene omtrent 75 til 100 % av toppeffektene.
Perindoprils effekt på blodtrykket var lik når det ble gitt alene eller på en bakgrunn av 25 mg hydroklortiazid. Generelt oppsto effekten av perindopril umiddelbart, med effekten som økte litt over flere uker.
Formelle interaksjonsstudier av ACEON® (perindopril erbumin) er ikke utført med andre antihypertensiva enn tiazider. Begrenset erfaring fra kontrollerte og ukontrollerte studier med samtidig administrering av ACEON 2mg med en kalsiumkanalblokker, et loop-diuretikum eller trippelterapi (betablokker, vasodilatator og et diuretikum), tyder ikke på noen uventede interaksjoner. Generelt har ACE-hemmere mindre enn additive effekter når de gis med beta-adrenerge blokkere, antagelig fordi begge virker delvis gjennom renin-angiotensinsystemet.
I ukontrollerte studier hos pasienter med insulinavhengig diabetes, så det ikke ut til at perindopril påvirket glykemisk kontroll. Ved langtidsbruk ble det ikke sett noen effekt på proteinutskillelse i urin hos disse pasientene.
Effekten av ACEON 4mg ble ikke påvirket av sex, og den var mindre effektiv hos svarte pasienter enn hos ikke-svarte pasienter. Hos eldre pasienter (større enn eller lik 60 år) var gjennomsnittlig blodtrykkseffekt noe mindre enn hos yngre pasienter, selv om forskjellen ikke var signifikant.
Stabil koronararteriesykdom
Den europeiske studien på reduksjon av hjertehendelser med Perindopril ved stabil koronararteriesykdom (EUROPA) var en multisenter, randomisert, dobbeltblind og placebokontrollert studie utført på 12 218 pasienter som hadde tegn på stabil koronararteriesykdom uten klinisk hjertesvikt. Pasientene hadde tegn på koronararteriesykdom dokumentert ved tidligere hjerteinfarkt mer enn 3 måneder før screening, koronar revaskularisering mer enn 6 måneder før screening, angiografiske tegn på stenose (minst 70 % innsnevring av en eller flere store koronararterier) eller positivt stress test hos menn med en historie med brystsmerter. Etter en innkjøringsperiode på 4 uker hvor alle pasientene fikk perindopril 2 mg til 8 mg, ble pasientene tilfeldig tildelt perindopril 8 mg én gang daglig (n=6110) eller matchende placebo (n=6108). Gjennomsnittlig oppfølging var 4,2 år. Studien undersøkte langtidseffektene av perindopril på tid til første hendelse av kardiovaskulær dødelighet, ikke-fatalt hjerteinfarkt eller hjertestans hos pasienter med stabil koronararteriesykdom.
Gjennomsnittsalderen til pasientene var 60 år; 85 % var menn, 92 % tok blodplatehemmere, 63 % tok β-blokkere og 56 % tok lipidsenkende behandling. EUROPA-studien viste at perindopril signifikant reduserte den relative risikoen for de primære endepunkthendelsene (tabell 1). Denne gunstige effekten kan i stor grad tilskrives en reduksjon i risikoen for ikke-fatalt hjerteinfarkt. Denne gunstige effekten av perindopril på det primære resultatet var tydelig etter omtrent ett års behandling (figur 1). Resultatet var likt på tvers av alle forhåndsdefinerte undergrupper etter alder, underliggende sykdom eller samtidig medisinering (figur 2).
Figur 1. Tid til første forekomst av primært endepunkt 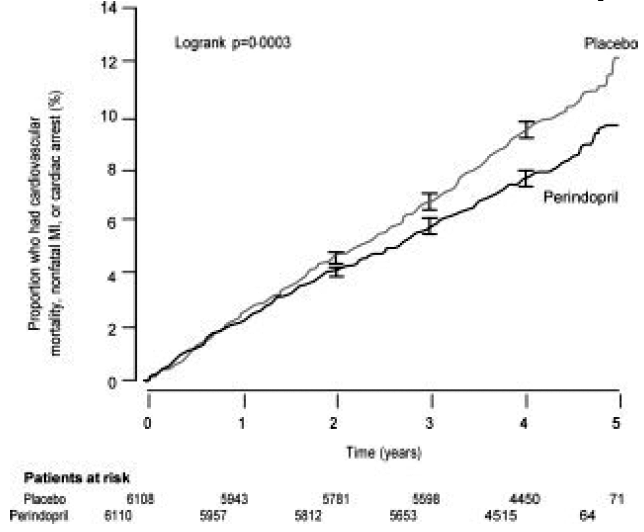
Figur 2. Gunstig effekt av perindoprilbehandling på primært endepunkt i forhåndsdefinerte undergrupper 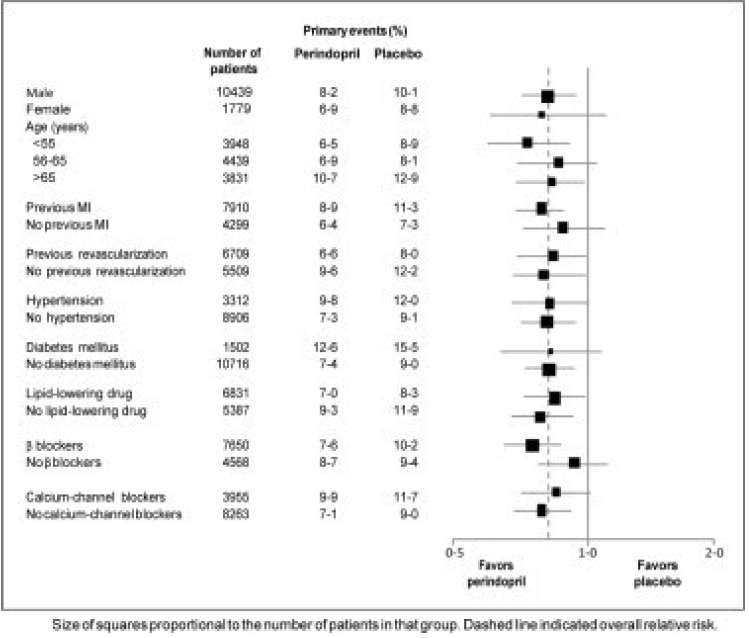
PASIENTINFORMASJON
Kvinnelige pasienter i fertil alder bør informeres om konsekvensene av eksponering for ACEON 2 mg under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Pasienter bør bes om å rapportere graviditet til legen så snart som mulig.
Fortell pasientene å rapportere omgående enhver indikasjon på infeksjon (f.eks. sår hals, feber) som kan være et tegn på nøytropeni.
