Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Coreg 25mg og hvordan brukes det?
Coreg er en reseptbelagt medisin som brukes til å behandle symptomer på hjertesvikt og høyt blodtrykk (hypertensjon). Coreg 25mg kan brukes alene eller sammen med andre medisiner.
Coreg tilhører en klasse med stoffer som kalles Beta-blokkere, Alpha Activity.
Det er ikke kjent om Coreg 25mg er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Coreg?
Coreg kan forårsake alvorlige bivirkninger, inkludert:
- . svimmelhet, . sakte eller ujevne hjerteslag, . kald følelse eller nummenhet i fingrene eller tærne, . brystsmerter, . tørrhoste, . hvesing, . tetthet i brystet, . opphovning, . rask vektøkning, . føler kortpustethet, . økt tørst, . økt vannlating, . tørr munn, og . fruktig pust lukt
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Coreg 6,25mg inkluderer:
- . svimmelhet, . sakte hjerteslag, . diaré, . vektøkning, . tørre øyne, og . problemer med å bruke kontaktlinser
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Coreg. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
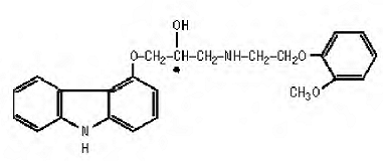
Carvedilol er et ikke-selektivt β-adrenerg blokkeringsmiddel med α1-blokkerende aktivitet. Det er (±)-1(karbazol-4-yloksy)-3-[[2-(o-metoksyfenoksy)etyl]amino]-2-propanol. Carvedilol er en racemisk blanding med følgende struktur:
COREG 6,25 mg er en hvit, oval, filmdrasjert tablett som inneholder 3,125 mg, 6,25 mg, 12,5 mg eller 25 mg karvedilol. 6,25 mg, 12,5 mg og 25 mg tabletter er TILTAB-tabletter. Inaktive ingredienser består av kolloidalt silisiumdioksid, krospovidon, hypromellose, laktose, magnesiumstearat, polyetylenglykol, polysorbat 80, povidon, sukrose og titandioksid.
Carvedilol er et hvitt til off-white pulver med en molekylvekt på 406,5 og en molekylformel på C24H26N2O4. Det er fritt løselig i dimetylsulfoksid; løselig i metylenklorid og metanol; lite løselig i 95 % etanol og isopropanol; lett løselig i etyleter; og praktisk talt uløselig i vann, magevæske (simulert, TS, pH 1,1) og tarmvæske (simulert, TS uten pankreatin, pH 7,5).
INDIKASJONER
Hjertefeil
COREG er indisert for behandling av mild til alvorlig kronisk hjertesvikt av iskemisk eller kardiomyopatisk opprinnelse, vanligvis i tillegg til diuretika, ACE-hemmere og digitalis, for å øke overlevelsen og også for å redusere risikoen for sykehusinnleggelse [se NARKOTIKAHANDEL , Kliniske studier ].
Dysfunksjon i venstre ventrikkel etter hjerteinfarkt
COREG er indisert for å redusere kardiovaskulær dødelighet hos klinisk stabile pasienter som har overlevd den akutte fasen av et hjerteinfarkt og har en venstre ventrikkel ejeksjonsfraksjon på mindre enn eller lik 40 % (med eller uten symptomatisk hjertesvikt) [se Kliniske studier ].
Hypertensjon
COREG 25mg er indisert for behandling av essensiell hypertensjon [se Kliniske studier ]. Det kan brukes alene eller i kombinasjon med andre antihypertensiva, spesielt diuretika av tiazidtypen [se NARKOTIKAHANDEL ].
DOSERING OG ADMINISTRASJON
COREG bør tas sammen med mat for å redusere absorpsjonshastigheten og redusere forekomsten av ortostatiske effekter.
Hjertefeil
DOSERING MÅ VÆRE INDIVIDUALISERT OG NØT OVERVÅKES AV EN LEGE UNDER OPPTITRERING. Før oppstart av COREG 12,5 mg, anbefales det at væskeretensjon minimeres. Den anbefalte startdosen av COREG er 3,125 mg to ganger daglig i 2 uker. Hvis de tolereres, kan dosen økes til 6,25, 12,5 og 25 mg to ganger daglig over påfølgende intervaller på minst 2 uker. Pasienter bør opprettholdes på lavere doser hvis høyere doser ikke tolereres. En maksimal dose på 50 mg to ganger daglig er gitt til pasienter med mild til moderat hjertesvikt som veier over 85 kg (187 lbs).
Pasienter bør informeres om at oppstart av behandling og (i mindre grad) doseøkning kan være assosiert med forbigående symptomer på svimmelhet eller ørhet (og sjelden synkope) innen den første timen etter dosering. I disse periodene bør pasienter unngå situasjoner som kjøring eller farlige oppgaver, der symptomer kan føre til skade. Vasodilatoriske symptomer krever ofte ikke behandling, men det kan være nyttig å skille tidspunktet for dosering av COREG 6,25 mg fra tidspunktet for ACE-hemmeren eller midlertidig redusere dosen av ACE-hemmeren. Dosen av COREG 12,5 mg bør ikke økes før symptomene på forverret hjertesvikt eller vasodilatasjon er stabilisert.
Væskeretensjon (med eller uten forbigående forverrede hjertesviktsymptomer) bør behandles med en økning i dosen av diuretika.
Dosen av COREG bør reduseres dersom pasienter opplever bradykardi (hjertefrekvens mindre enn 55 slag per minutt).
Episoder med svimmelhet eller væskeretensjon under oppstart av COREG 3,12 mg kan generelt håndteres uten seponering av behandlingen og utelukker ikke påfølgende vellykket titrering av, eller en gunstig respons på, karvedilol.
Dysfunksjon i venstre ventrikkel etter hjerteinfarkt
DOSERING MÅ VÆRE INDIVIDUALISERT OG OVERVÅKES UNDER OPPTITRERING. Behandling med COREG kan startes som poliklinisk eller poliklinisk pasient og bør startes etter at pasienten er hemodynamisk stabil og væskeretensjon er minimert. Det anbefales at COREG 3,12 mg startes med 6,25 mg to ganger daglig og økes etter 3 til 10 dager, basert på toleranse, til 12,5 mg to ganger daglig, deretter igjen til måldosen på 25 mg to ganger daglig. En lavere startdose kan brukes (3,125 mg to ganger daglig) og/eller opptitreringshastigheten kan reduseres hvis det er klinisk indisert (f.eks. på grunn av lavt blodtrykk eller hjertefrekvens, eller væskeretensjon). Pasienter bør opprettholdes på lavere doser hvis høyere doser ikke tolereres. Det anbefalte doseringsregimet trenger ikke endres hos pasienter som fikk behandling med en IV eller oral β-blokker under den akutte fasen av hjerteinfarktet.
Hypertensjon
DOSERING MÅ VÆRE INDIVIDUALISERT. Den anbefalte startdosen på COREG 6,25 mg er 6,25 mg to ganger daglig. Hvis denne dosen tolereres, med stående systolisk trykk målt ca. 1 time etter dosering som en veiledning, bør dosen opprettholdes i 7 til 14 dager, og deretter økes til 12,5 mg to ganger daglig om nødvendig, basert på bunnblodtrykk, igjen ved å bruke stående systolisk trykk 1 time etter dosering som veiledning for toleranse. Denne dosen bør også opprettholdes i 7 til 14 dager og kan deretter justeres opp til 25 mg to ganger daglig hvis det tolereres og er nødvendig. Den fulle antihypertensive effekten av COREG 6,25 mg sees innen 7 til 14 dager. Total daglig dose bør ikke overstige 50 mg.
Samtidig administrering med et diuretikum kan forventes å gi additive effekter og overdrive den ortostatiske komponenten av karvedilols virkning.
Nedsatt leverfunksjon
COREG 25 mg skal ikke gis til pasienter med alvorlig nedsatt leverfunksjon [se KONTRAINDIKASJONER ].
HVORDAN LEVERES
Dosering og styrker
De hvite, ovale, filmdrasjerte tablettene er tilgjengelige i følgende styrker:
- . 3,125 mg - gravert med "39" og "SB" . 6,25 mg - gravert med "4140" og "SB" . 12,5 mg - gravert med "4141" og "SB" . 25 mg - gravert med "4142" og "SB"
Oppbevaring og håndtering
De hvite, ovale, filmdrasjerte tablettene er tilgjengelige i følgende styrker:
- . 3,125 mg - gravert med "39" og "SB" . 6,25 mg - gravert med "4140" og "SB" . 12,5 mg - gravert med "4141" og "SB" . 25 mg - gravert med "4142" og "SB"
6,25 mg, 12,5 mg og 25 mg tabletter er TILTAB-tabletter.
- . 3,125 mg flasker à 100: NDC 0007-4139-20 . 6,25 mg flasker à 100: NDC 0007-4140-20 . 12,5 mg flasker à 100: NDC 0007-4141-20 . 25 mg flasker à 100: NDC 0007-4142-20
Oppbevares under 30°C (86°F). Beskytt mot fuktighet. Dispenser i en tett, lysbestandig beholder.
Produsert for: GlaxoSmithKline Research Triangle Park, NC 27709. Revidert: sep 2017.
BIVIRKNINGER
Erfaring fra kliniske studier
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
COREG 25 mg har blitt evaluert for sikkerhet hos personer med hjertesvikt (mild, moderat og alvorlig), hos personer med venstre ventrikkeldysfunksjon etter hjerteinfarkt og hos hypertensive personer. Den observerte bivirkningsprofilen var i samsvar med farmakologien til legemidlet og helsestatusen til forsøkspersonene i de kliniske forsøkene. Bivirkninger rapportert for hver av disse pasientpopulasjonene er gitt nedenfor. Ekskludert er bivirkninger som anses for generelle til å være informative, og de som ikke er rimelig forbundet med bruken av stoffet fordi de var assosiert med tilstanden som behandles eller er svært vanlige i den behandlede befolkningen. Hyppigheten av bivirkninger var generelt like på tvers av demografiske undergrupper (menn og kvinner, eldre og ikke-eldre, svarte og ikke-svarte).
Hjertefeil
COREG 12,5mg har blitt evaluert for sikkerhet ved hjertesvikt hos mer enn 4500 personer over hele verden, hvorav mer enn 2100 deltok i placebokontrollerte kliniske studier. Omtrent 60 % av den totale behandlede populasjonen i placebokontrollerte kliniske studier fikk COREG 3,12 mg i minst 6 måneder og 30 % fikk COREG i minst 12 måneder. I COMET-studien ble 1511 personer med mild til moderat hjertesvikt behandlet med COREG i opptil 5,9 år (gjennomsnittlig: 4,8 år). Både i amerikanske kliniske studier med mild til moderat hjertesvikt som sammenlignet COREG 3,12 mg i daglige doser opptil 100 mg (n = 765) med placebo (n = 437), og i en multinasjonal klinisk studie med alvorlig hjertesvikt (COPERNICUS ) som sammenlignet COREG i daglige doser opptil 50 mg (n = 1 156) med placebo (n = 1 133), var seponeringsfrekvensen for uønskede opplevelser lik hos karvedilol- og placebopersoner. I placebokontrollerte kliniske studier var den eneste årsaken til seponering over 1 % og som forekom oftere med karvedilol svimmelhet (1,3 % på karvedilol, 0,6 % på placebo i COPERNICUS-studien).
Tabell 1 viser uønskede hendelser rapportert hos personer med mild til moderat hjertesvikt registrert i amerikanske placebokontrollerte kliniske studier, og med alvorlig hjertesvikt registrert i COPERNICUS-studien. Det er vist bivirkninger som forekom hyppigere hos legemiddelbehandlede personer enn placebobehandlede personer med en forekomst på mer enn 3 % hos personer behandlet med karvedilol uavhengig av årsakssammenheng. Median eksponering for medisinering var 6,3 måneder for både karvedilol og placebo-personer i forsøkene med mild til moderat hjertesvikt og 10,4 måneder i forsøket med personer med alvorlig hjertesvikt. Bivirkningsprofilen til COREG 3,12 mg observert i langtidsstudien med COMET var generelt lik den som ble observert i de amerikanske hjertesviktstudiene.
Hjertesvikt og dyspné ble også rapportert i disse studiene, men ratene var like eller høyere hos personer som fikk placebo.
Følgende bivirkninger ble rapportert med en frekvens på større enn 1 %, men mindre enn eller lik 3 % og hyppigere med COREG 3,12 mg i enten de amerikanske placebokontrollerte studiene hos personer med mild til moderat hjertesvikt eller hos personer med alvorlig hjertesvikt i COPERNICUS-studien.
Forekomst større enn 1 % til mindre enn eller lik 3 %
Kroppen som helhet: Allergi, ubehag, hypovolemi, feber, benødem.
Kardiovaskulær: Væskeoverbelastning, postural hypotensjon, forverret angina pectoris, AV-blokk, hjertebank, hypertensjon.
Sentral- og perifert nervesystem: Hypestesi, vertigo, parestesi.
Gastrointestinale: Melena, periodontitt.
Lever og gallesystem: SGPT økte, SGOT økte.
Metabolsk og ernæringsmessig: Hyperurikemi, hypoglykemi, hyponatremi, økt alkalisk fosfatase, glykosuri, hypervolemi, diabetes mellitus, økt GGT, vekttap, hyperkalemi, økt kreatinin.
Muskuloskeletal: Muskel kramper.
Blodplater, blødninger og koagulering: Protrombin redusert, purpura, trombocytopeni.
Psykiatrisk: Søvnighet.
Reproduktiv, mannlig: Maktesløshet.
Spesielle sanser: Tåkesyn.
Urinsystemet: Nyresvikt, albuminuri, hematuri.
Dysfunksjon i venstre ventrikkel etter hjerteinfarkt
COREG har blitt evaluert for sikkerhet hos overlevende av et akutt hjerteinfarkt med venstre ventrikkeldysfunksjon i CAPRICORN-studien som involverte 969 personer som fikk COREG 6,25 mg og 980 som fikk placebo. Omtrent 75 % av forsøkspersonene fikk COREG 25 mg i minst 6 måneder og 53 % fikk COREG 12,5 mg i minst 12 måneder. Forsøkspersonene ble behandlet i gjennomsnittlig 12,9 måneder og 12,8 måneder med henholdsvis COREG 12,5 mg og placebo.
De vanligste bivirkningene rapportert med COREG 25 mg i CAPRICORN-studien var i samsvar med stoffets profil i de amerikanske hjertesviktstudiene og COPERNICUS-studiene. De eneste tilleggsbivirkningene som ble rapportert i STINBOKK hos mer enn 3 % av pasientene og mer vanlig på karvedilol var dyspné, anemi og lungeødem. Følgende bivirkninger ble rapportert med en frekvens på større enn 1 %, men mindre enn eller lik 3 % og hyppigere med COREG: influensasyndrom, cerebrovaskulær ulykke, perifer vaskulær lidelse, hypotoni, depresjon, gastrointestinale smerter, leddgikt og gikt. Den totale frekvensen av seponeringer på grunn av uønskede hendelser var lik i begge grupper av forsøkspersoner. I denne databasen var hypotensjon hypotensjon (1,5 % på karvedilol, 0,2 % på placebo) den eneste årsaken til seponering på mer enn 1 % og som forekommer oftere med karvedilol.
Hypertensjon
COREG har blitt evaluert for sikkerhet ved hypertensjon hos mer enn 2 193 personer i amerikanske kliniske studier og i 2 976 personer i internasjonale kliniske studier. Omtrent 36 % av den totale behandlede befolkningen fikk COREG i minst 6 måneder. De fleste bivirkningene rapportert under behandling med COREG 25 mg var av mild til moderat alvorlighetsgrad. I amerikanske kontrollerte kliniske studier som direkte sammenlignet COREG 12,5 mg i doser opp til 50 mg (n = 1 142) med placebo (n = 462), ble 4,9 % av pasientene som fikk COREG 6,25 mg avbrutt på grunn av bivirkninger mot 5,2 % av pasientene med placebo. Selv om det ikke var noen generell forskjell i seponeringsfrekvenser, var seponeringer mer vanlig i karvedilolgruppen for postural hypotensjon (1 % versus 0). Den totale forekomsten av bivirkninger i amerikanske placebokontrollerte studier økte med økende dose av COREG. For individuelle bivirkninger kunne dette bare skjelnes for svimmelhet, som økte i frekvens fra 2 % til 5 % ettersom total daglig dose økte fra 6,25 mg til 50 mg.
Tabell 2 viser uønskede hendelser i amerikanske placebokontrollerte kliniske studier for hypertensjon som oppstod med en forekomst på større enn eller lik 1 % uavhengig av årsakssammenheng og som var hyppigere hos medikamentbehandlede personer enn placebobehandlede.
Dyspné og tretthet ble også rapportert i disse studiene, men ratene var like eller høyere hos personer som fikk placebo.
Følgende bivirkninger som ikke er beskrevet ovenfor, ble rapportert som mulig eller sannsynligvis relatert til COREG 25mg i verdensomspennende åpne eller kontrollerte studier med COREG 12,5mg hos personer med hypertensjon eller hjertesvikt.
Forekomst større enn 0,1 % til mindre enn eller lik 1 %
Kardiovaskulær: Perifer iskemi, takykardi.
Sentralt og perifert nervesystem m: Hypokinesi.
Gastrointestinale: Bilirubinemi, økte leverenzymer (0,2 % av pasientene med hypertensjon og 0,4 % av pasientene med hjertesvikt ble avbrutt fra behandlingen på grunn av økning i leverenzymer) [se Postmarketing-erfaring ].
Psykiatrisk: Nervøsitet, søvnforstyrrelser, forverret depresjon, nedsatt konsentrasjon, unormal tenkning, paroniria, emosjonell labilitet.
Luftveiene: Astma [se KONTRAINDIKASJONER ].
Reproduktiv, mannlig: Redusert libido.
Hud og vedheng: Kløe, erytematøst utslett, makulopapulær utslett, psoriaform utslett, fotosensitivitetsreaksjon.
Spesielle sanser: Tinnitus.
Urinsystemet: Miksjonsfrekvensen økte.
Autonome nervesystem: Munntørrhet, økt svette.
Metabolsk og ernæringsmessig: Hypokalemi, hypertriglyseridemi.
Hematologisk: Anemi, leukopeni.
Følgende hendelser ble rapportert hos mindre enn eller lik 0,1 % av pasientene og er potensielt viktige: fullstendig AV-blokk, grenblokk, myokardiskemi, cerebrovaskulær lidelse, kramper, migrene, nevralgi, pareser, anafylaktoid reaksjon, alopecia, eksfoliativ dermatitt, hukommelsestap, GI-blødning, bronkospasme, lungeødem, nedsatt hørsel, respiratorisk alkalose, økt BUN, redusert HDL, pancytopeni og atypiske lymfocytter.
Laboratorieavvik
Reversible økninger i serumtransaminaser (ALAT eller ASAT) er observert under behandling med COREG. Hyppigheten av transaminaseøkninger (2 til 3 ganger øvre normalgrense) observert under kontrollerte kliniske studier har generelt vært lik mellom pasienter behandlet med COREG og de behandlet med placebo. Imidlertid har transaminaseøkninger, bekreftet ved ny behandling, blitt observert med COREG. I en langsiktig, placebokontrollert studie med alvorlig hjertesvikt, hadde forsøkspersoner behandlet med COREG 25mg lavere verdier for levertransaminaser enn forsøkspersoner behandlet med placebo, muligens fordi forbedringer i hjertefunksjonen indusert av COREG 6,25mg førte til mindre leveroverbelastning og/ eller forbedret leverblodstrøm.
COREG 25mg har ikke vært assosiert med klinisk signifikante endringer i serumkalium, totale triglyserider, totalkolesterol, HDL-kolesterol, urinsyre, ureanitrogen i blodet eller kreatinin. Ingen klinisk relevante endringer ble observert i fastende serumglukose hos hypertensive pasienter; fastende serumglukose ble ikke evaluert i de kliniske studiene med hjertesvikt.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av COREG etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Blod og lymfesystem lidelser
Aplastisk anemi.
Forstyrrelser i immunsystemet
Overfølsomhet (f.eks. anafylaktiske reaksjoner, angioødem, urticaria).
Nyre- og urinveislidelser
Urininkontinens.
Respiratoriske, thorax- og mediastinumsykdommer
Interstitiell pneumonitt.
Hud- og subkutane vevslidelser
Stevens-Johnsons syndrom, toksisk epidermal nekrolyse, erythema multiforme.
NARKOTIKAHANDEL
CYP2D6-hemmere og dårlige metabolisatorer
Interaksjoner mellom karvedilol og potente hemmere av CYP2D6-isoenzym (som kinidin, fluoksetin, paroksetin og propafenon) er ikke studert, men disse legemidlene forventes å øke blodnivået av R(+)-enantiomeren av karvedilol [se KLINISK FARMAKOLOGI ]. Retrospektiv analyse av bivirkninger i kliniske studier viste at dårlige 2D6-metabolisatorer hadde en høyere grad av svimmelhet under opptitrering, antagelig et resultat av vasodilaterende effekter av de høyere konsentrasjonene av den α-blokkerende R(+)-enantiomeren.
hypotensive midler
Pasienter som tar en β-blokker og et legemiddel som kan redusere katekolaminer (f.eks. reserpin- og monoaminoksidasehemmere) bør observeres nøye for tegn på hypotensjon og/eller alvorlig bradykardi.
Samtidig administrering av klonidin og en β-blokker kan forårsake hypotensjon og bradykardi. Når samtidig behandling med en β-blokker og klonidin skal avsluttes, bør β-blokkeren seponeres først. Klonidinbehandling kan deretter avbrytes flere dager senere ved gradvis å redusere dosen.
Syklosporin
Beskjeden økning i gjennomsnittlig bunnkonsentrasjon av ciklosporin ble observert etter oppstart av karvedilolbehandling hos 21 nyretransplanterte personer som led av kronisk vaskulær avstøtning. Hos omtrent 30 % av forsøkspersonene måtte dosen av ciklosporin reduseres for å opprettholde konsentrasjonen av ciklosporin innenfor det terapeutiske området, mens det for resten ikke var nødvendig med justering. I gjennomsnitt for gruppen ble dosen av ciklosporin redusert med ca. 20 % hos disse forsøkspersonene. På grunn av stor interindividuell variasjon i dosejusteringen som kreves, anbefales det at ciklosporinkonsentrasjoner overvåkes nøye etter oppstart av karvedilolbehandling og at dosen av ciklosporin justeres etter behov.
Digitalis glykosider
Både digitalisglykosider og β-blokkere bremser atrioventrikulær ledning og reduserer hjertefrekvensen. Samtidig bruk kan øke risikoen for bradykardi. Digoksinkonsentrasjonen økes med ca. 15 % når digoksin og karvedilol administreres samtidig. Derfor anbefales økt overvåking av digoksin ved oppstart, justering eller seponering av COREG [se KLINISK FARMAKOLOGI ].
Induktorer/hemmere av levermetabolisme
Rifampin reduserte plasmakonsentrasjonen av karvedilol med ca. 70 % [se KLINISK FARMAKOLOGI ]. Cimetidin økte AUC med ca. 30 %, men forårsaket ingen endring i Cmax [se KLINISK FARMAKOLOGI ].
Amiodaron
Amiodaron og dets metabolitt desetylamiodaron, hemmere av CYP2C9 og P-glykoprotein økte konsentrasjonen av S(-)-enantiomeren av karvedilol med minst 2 ganger [se KLINISK FARMAKOLOGI ]. Samtidig administrering av amiodaron eller andre CYP2C9-hemmere som flukonazol med COREG kan øke den β-blokkerende aktiviteten, noe som resulterer i ytterligere nedgang i hjertefrekvensen eller hjerteledning. Pasienter bør observeres for tegn på bradykardi eller hjerteblokk, spesielt når ett middel legges til eksisterende behandling med det andre.
Kalsiumkanalblokkere
Ledningsforstyrrelser (sjelden med hemodynamisk kompromittering) har blitt observert når COREG 25 mg administreres samtidig med diltiazem. Som med andre β-blokkere, hvis COREG 25mg administreres med kalsiumkanalblokkere av verapamil- eller diltiazem-typen, anbefales det at EKG og blodtrykk overvåkes.
Insulin eller orale hypoglykemiske midler
β-blokkere kan forsterke den blodsukkerreduserende effekten av insulin og orale hypoglykemiske midler. Derfor anbefales regelmessig overvåking av blodsukker hos pasienter som tar insulin eller orale hypoglykemiske midler [se ADVARSLER OG FORHOLDSREGLER ].
Anestesi
Hvis behandlingen med COREG skal fortsette perioperativt, bør det utvises spesiell forsiktighet når anestesimidler som demper myokardfunksjonen, som eter, cyklopropan og trikloretylen, brukes [se OVERDOSE ].
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Avslutning av terapi
Pasienter med koronararteriesykdom, som behandles med COREG, bør frarådes brå seponering av behandlingen. Alvorlig forverring av angina og forekomst av hjerteinfarkt og ventrikulære arytmier er rapportert hos pasienter med angina etter brå seponering av behandling med β-blokkere. De siste 2 komplikasjonene kan oppstå med eller uten forutgående forverring av angina pectoris. Som med andre β-blokkere, når seponering av COREG er planlagt, bør pasientene observeres nøye og rådes til å begrense fysisk aktivitet til et minimum. COREG bør seponeres over 1 til 2 uker når det er mulig. Hvis angina forverres eller akutt koronar insuffisiens utvikler seg, anbefales det at COREG gjenopptas umiddelbart, i det minste midlertidig. Fordi koronararteriesykdom er vanlig og kanskje ikke gjenkjennes, kan det være lurt å ikke avbryte behandlingen med COREG 3,12 mg brått selv hos pasienter som kun behandles for hypertensjon eller hjertesvikt.
Bradykardi
kliniske studier forårsaket COREG 25 mg bradykardi hos ca. 2 % av hypertensive personer, 9 % av pasienter med hjertesvikt og 6,5 % av pasienter med hjerteinfarkt og venstre ventrikkeldysfunksjon. Hvis pulsen faller under 55 slag per minutt, bør dosen reduseres.
Hypotensjon
kliniske studier med primært mild til moderat hjertesvikt, forekom hypotensjon og postural hypotensjon hos 9,7 % og synkope hos 3,4 % av pasientene som fikk COREG sammenlignet med henholdsvis 3,6 % og 2,5 % av placebopersonene. Risikoen for disse hendelsene var høyest i løpet av de første 30 dagene av doseringen, tilsvarende opptitreringsperioden og var en årsak til seponering av behandlingen hos 0,7 % av pasientene som fikk COREG 12,5 mg, sammenlignet med 0,4 % av placebopersonene. I en langsiktig, placebokontrollert studie med alvorlig hjertesvikt (COPERNICUS), forekom hypotensjon og postural hypotensjon hos 15,1 % og synkope hos 2,9 % av pasientene med hjertesvikt som fikk COREG sammenlignet med henholdsvis 8,7 % og 2,3 % av placebopersonene. Disse hendelsene var en årsak til seponering av behandlingen hos 1,1 % av pasientene som fikk COREG, sammenlignet med 0,8 % av placebopersonene.
Postural hypotensjon forekom hos 1,8 % og synkope hos 0,1 % av hypertensive pasienter, primært etter startdosen eller på tidspunktet for doseøkning, og var en årsak til seponering av behandlingen hos 1 % av pasientene.
I CAPRICORN-studien med overlevende etter et akutt hjerteinfarkt forekom hypotensjon eller postural hypotensjon hos 20,2 % av pasientene som fikk COREG sammenlignet med 12,6 % av placebopersonene. Synkope ble rapportert hos henholdsvis 3,9 % og 1,9 % av pasientene. Disse hendelsene var en årsak til seponering av behandlingen hos 2,5 % av pasientene som fikk COREG, sammenlignet med 0,2 % av placebopersonene.
Starter med en lav dose, administrering med mat og gradvis opptitrering bør redusere sannsynligheten for synkope eller overdreven hypotensjon [se DOSERING OG ADMINISTRASJON ]. Under oppstart av behandlingen bør pasienten advares om å unngå situasjoner som kjøring eller farlige oppgaver, der det kan oppstå skade dersom synkope skulle oppstå.
Hjertesvikt/væskeretensjon
Forverret hjertesvikt eller væskeretensjon kan forekomme under opptitrering av karvedilol. Hvis slike symptomer oppstår, bør diuretika økes og karvediloldosen bør ikke økes før klinisk stabilitet gjenopptas [se DOSERING OG ADMINISTRASJON ]. Noen ganger er det nødvendig å senke karvediloldosen eller midlertidig avbryte den. Slike episoder utelukker ikke påfølgende vellykket titrering av, eller en gunstig respons på, karvedilol. I en placebokontrollert studie av personer med alvorlig hjertesvikt, ble forverring av hjertesvikt i løpet av de første 3 månedene rapportert i tilsvarende grad med karvedilol og med placebo. Når behandlingen ble opprettholdt utover 3 måneder, ble forverring av hjertesvikt rapportert sjeldnere hos personer behandlet med karvedilol enn med placebo. Forverring av hjertesvikt observert under langtidsbehandling er mer sannsynlig å være relatert til pasientenes underliggende sykdom enn til behandling med karvedilol.
Ikke-allergisk bronkospasme
Pasienter med bronkospastisk sykdom (f.eks. kronisk bronkitt, emfysem) bør generelt ikke få β-blokkere. COREG kan imidlertid brukes med forsiktighet hos pasienter som ikke reagerer på eller ikke tåler andre antihypertensiva. Hvis COREG brukes, er det fornuftig å bruke den minste effektive dosen, slik at hemming av endogene eller eksogene β-agonister minimeres.
I kliniske studier av personer med hjertesvikt ble personer med bronkospastisk sykdom inkludert hvis de ikke trengte oral eller inhalert medisin for å behandle sin bronkospastiske sykdom. Hos slike pasienter anbefales det at karvedilol brukes med forsiktighet. Doseringsanbefalingene bør følges nøye, og dosen bør senkes hvis det observeres tegn på bronkospasme under opptitrering.
Glykemisk kontroll ved type 2 diabetes
Generelt kan β-blokkere maskere noen av manifestasjonene av hypoglykemi, spesielt takykardi. Ikke-selektive β-blokkere kan potensere insulinindusert hypoglykemi og forsinke gjenoppretting av serumglukosenivåer. Pasienter utsatt for spontan hypoglykemi eller diabetespasienter som får insulin eller orale hypoglykemiske midler bør advares om disse mulighetene.
Hos pasienter med hjertesvikt og diabetes kan karvedilolbehandling føre til forverring av hyperglykemi, som reagerer på intensivering av hypoglykemisk behandling. Det anbefales at blodsukker overvåkes når karvediloldosering settes i gang, justeres eller seponeres. Forsøk designet for å undersøke effekten av karvedilol på glykemisk kontroll hos pasienter med diabetes og hjertesvikt har ikke blitt utført.
en studie designet for å undersøke effekten av karvedilol på glykemisk kontroll i en populasjon med mild til moderat hypertensjon og godt kontrollert type 2 diabetes mellitus, hadde karvedilol ingen negativ effekt på glykemisk kontroll, basert på HbA1c-målinger [se Kliniske studier ].
Perifer vaskulær sykdom
β-blokkere kan utløse eller forverre symptomer på arteriell insuffisiens hos pasienter med perifer vaskulær sykdom. Forsiktighet bør utvises hos slike individer.
Forverring av nyrefunksjonen
sjeldne tilfeller har bruk av karvedilol hos pasienter med hjertesvikt resultert i forverring av nyrefunksjonen. Risikopasienter ser ut til å være de med lavt blodtrykk (systolisk blodtrykk mindre enn 100 mm Hg), iskemisk hjertesykdom og diffus vaskulær sykdom og/eller underliggende nyresvikt. Nyrefunksjonen har gått tilbake til baseline da karvedilol ble stoppet. Hos pasienter med disse risikofaktorene anbefales det at nyrefunksjonen overvåkes under opptitrering av karvedilol og at legemidlet seponeres eller dosen reduseres dersom nyrefunksjonen forverres.
Stor operasjon
Kronisk administrert β-blokkerende behandling bør ikke rutinemessig seponeres før større operasjoner; Imidlertid kan den svekkede evnen til hjertet til å reagere på refleks adrenerge stimuli øke risikoen for generell anestesi og kirurgiske prosedyrer.
Tyreotoksikose
β-adrenerg blokade kan maskere kliniske tegn på hypertyreose, som takykardi. Brå seponering av β-blokkade kan følges av en forverring av symptomene på hypertyreose eller kan utløse skjoldbruskkjertelstorm.
Feokromocytom
Hos pasienter med feokromocytom bør et α-blokkerende middel initieres før bruk av et β-blokkerende middel. Selv om karvedilol har både α- og β-blokkerende farmakologiske aktiviteter, har det ikke vært erfaring med bruk i denne tilstanden. Derfor bør det utvises forsiktighet ved administrering av karvedilol til pasienter som mistenkes for å ha feokromocytom.
Prinzmetals variant angina
Midler med ikke-selektiv β-blokkerende aktivitet kan provosere brystsmerter hos pasienter med Prinzmetals variant angina. Det har ikke vært noen klinisk erfaring med karvedilol hos disse pasientene, selv om α-blokkerende aktivitet kan forhindre slike symptomer. Imidlertid bør det utvises forsiktighet ved administrering av karvedilol til pasienter som mistenkes for å ha Prinzmetals variant angina.
Risiko for anafylaktisk reaksjon
Mens de tar β-blokkere, kan pasienter med en historie med alvorlig anafylaktisk reaksjon på en rekke allergener være mer reaktive overfor gjentatt utfordring, enten utilsiktet, diagnostisk eller terapeutisk. Slike pasienter kan ikke reagere på de vanlige dosene av adrenalin som brukes til å behandle allergisk reaksjon.
Intraoperativt Floppy Iris Syndrome
Intraoperativt Floppy Iris Syndrome (IFIS) har blitt observert under kataraktkirurgi hos noen pasienter behandlet med alfa-1 blokkere (COREG er en alfa/beta blokker). Denne varianten av lite pupillsyndrom er preget av kombinasjonen av en slapp iris som bølger som respons på intraoperative irrigasjonsstrømmer, progressiv intraoperativ miose til tross for preoperativ dilatasjon med standard mydriatiske legemidler, og potensiell prolaps av iris mot fakoemulsifiseringssnittene. Pasientens øyelege bør være forberedt på mulige modifikasjoner av operasjonsteknikken, slik som bruk av iriskroker, irisdilatatorringer eller viskoelastiske stoffer. Det ser ikke ut til å være noen fordel ved å stoppe alfa-1-blokkerbehandlingen før kataraktoperasjon.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Pasienter som tar COREG bør informeres om følgende:
- . Pasienter bør ta COREG med mat. . Pasienter bør ikke avbryte eller slutte å bruke COREG 25mg uten råd fra lege. . Pasienter med hjertesvikt bør konsultere legen sin hvis de opplever tegn eller symptomer på forverret hjertesvikt som vektøkning eller økende kortpustethet. . Pasienter kan oppleve et blodtrykksfall når de står, noe som resulterer i svimmelhet og i sjeldne tilfeller besvimelse. Pasienter bør sitte eller legge seg når disse symptomene på senket blodtrykk oppstår. . Hvis de opplever svimmelhet eller tretthet, bør pasienter unngå kjøring eller farlige oppgaver. . Pasienter bør konsultere lege dersom de opplever svimmelhet eller besvimelse, i tilfelle dosen bør justeres. . Diabetikere bør rapportere eventuelle endringer i blodsukkernivået til legen sin. . Kontaktlinsebrukere kan oppleve redusert tåredannelse.
COREG 25mg, COREG 3.12mg CR og TILTAB er varemerker eid av eller lisensiert til GSK-gruppen av selskaper.
Det andre merket som er oppført er et varemerke som eies av eller er lisensiert til eieren, og er ikke eid av eller lisensiert til GSK-gruppen av selskaper. Produsenten av dette merket er ikke tilknyttet og støtter ikke GSK-gruppen av selskaper eller dens produkter.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
I 2-års studier utført på rotter gitt karvedilol i doser opptil 75 mg per kg per dag (12 ganger MRHD som mg per m2) eller på mus gitt opptil 200 mg per kg per dag (16 ganger MRHD som mg pr. m2), hadde karvedilol ingen kreftfremkallende effekt.
Carvedilol var negativ når den ble testet i en rekke genotoksisitetsanalyser, inkludert Ames- og CHO/HGPRT-analysene for mutagenitet og in vitro-hamstermikronukleus og in vivo humane lymfocyttcelletester for klastogenisitet.
en kombinert fertilitets-/utviklings-/postnatal toksisitetsstudie ble rotter gitt karvedilol (12, 60, 300 mg per kg per dag) oralt ved sonde i 2 uker før paring og gjennom paring, drektighet og avvenning for hunner og i 62 dager før og gjennom paring for hanner. Ved en dose på 300 mg per kg per dag (større enn eller lik 50 ganger MRHD som mg per m2) var karvedilol giftig for voksne rotter (sedasjon, redusert vektøkning) og var assosiert med et redusert antall vellykkede parringer, forlenget parringstid, færre corpora lutea og implantater per mor, færre levende unger per kull og forsinkelser i fysisk vekst/utvikling. Ingen-effektnivået for åpenbar toksisitet og svekkelse av fertilitet var 60 mg per kg per dag (10 ganger MRHD som mg per m2).
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Tilgjengelige data angående bruk av COREG 12,5 mg hos gravide kvinner er utilstrekkelige til å avgjøre om det er legemiddelrelaterte risikoer for uønskede utviklingsresultater. Det er risikoer for mor og foster forbundet med dårlig kontrollert hypertensjon under svangerskapet. Bruk av betablokkere i tredje trimester av svangerskapet kan øke risikoen for hypotensjon, bradykardi, hypoglykemi og respirasjonsdepresjon hos nyfødte [ se kliniske vurderinger ]. I reproduksjonsstudier på dyr var det ingen bevis for uønskede utviklingsresultater ved klinisk relevante doser [ se Data ]. Oral administrering av karvedilol til gravide rotter under organogenese resulterte i post-implantasjonstap, redusert føtal kroppsvekt og en økt frekvens av forsinket føtal skjelettutvikling ved maternalt toksiske doser som var 50 ganger maksimal anbefalt human dose (MRHD). I tillegg resulterte oral administrering av karvedilol til drektige kaniner under organogenese i økt post-implantasjonstap ved doser 25 ganger MRHD [ se Data ].
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for de angitte populasjonene er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-/fosterrisiko
Hypertensjon i svangerskapet øker mors risiko for svangerskapsforgiftning, svangerskapsdiabetes, for tidlig fødsel og fødselskomplikasjoner (f.eks. behov for keisersnitt og blødning etter fødselen). Hypertensjon øker fosterets risiko for intrauterin vekstbegrensning og intrauterin død. Gravide kvinner med hypertensjon bør overvåkes nøye og behandles deretter.
Fetale/neonatale bivirkninger
Nyfødte av kvinner med hypertensjon som behandles med betablokkere i tredje trimester av svangerskapet kan ha økt risiko for hypotensjon, bradykardi, hypoglykemi og respirasjonsdepresjon. Observer nyfødte for symptomer på hypotensjon, bradykardi, hypoglykemi og respirasjonsdepresjon og administrer deretter.
Data
Dyredata
Studier utført på rotter og kaniner gitt karvedilol under føtal organogenese viste økt post-implantasjonstap hos rotter ved en maternal toksisk dose på 300 mg per kg per dag (50 ganger MRHD som mg per m2) og hos kaniner (i fravær av maternal toksisitet) ved doser på 75 mg per kg per dag (25 ganger MRHD som mg per m2). Hos rottene var det også en reduksjon i fosterets kroppsvekt med 300 mg per kg per dag (50 ganger MRHD som mg per m2) ledsaget av økt forekomst av fostre med forsinket skjelettutvikling. Hos rotter var ingen-effektnivået for embryo-føtal toksisitet 60 mg per kg per dag (10 ganger MRHD som mg per m2); hos kaniner var den 15 mg per kg per dag (5 ganger MRHD som mg per m2). I en pre- og postnatal utviklingsstudie på rotter som fikk carvedilol fra sen drektighet til amming, ble økt embryodødelighet observert ved en maternalt toksisk dose på 200 mg per kg per dag (omtrent 32 ganger MRHD som mg per m2), og valpedødelighet og forsinkelser i fysisk vekst/utvikling ble observert ved 60 mg per kg per dag (10 ganger MRHD som mg per m2) i fravær av maternell toksisitet. Ingen-effektnivået var 12 mg per kg per dag (2 ganger MRHD som mg per m2). Carvedilol var tilstede i føtalt rottevev.
Amming
Risikosammendrag
Det er ingen data om tilstedeværelsen av karvedilol i morsmelk, effekten på spedbarnet som ammes, eller effekten på melkeproduksjonen. Carvedilol finnes i melken til diegivende rotter. De utviklingsmessige og helsemessige fordelene ved amming bør vurderes sammen med morens kliniske behov for COREG og eventuelle skadelige effekter på det ammede spedbarnet fra COREG 3,12 mg eller fra den underliggende morens tilstand.
Pediatrisk bruk
Effektiviteten av COREG 3,12 mg hos pasienter yngre enn 18 år er ikke fastslått.
en dobbeltblind studie, 161 barn (gjennomsnittsalder: 6 år; område: 2 måneder til 17 år; 45 % yngre enn 2 år) med kronisk hjertesvikt [NYHA klasse II-IV, venstre ventrikkel ejeksjonsfraksjon mindre enn 40 % for barn med systemisk venstre ventrikkel (LV) og moderat alvorlig ventrikkeldysfunksjon kvalitativt ved ekko for de med systemisk ventrikkel som ikke var en LV] som fikk standard bakgrunnsbehandling ble randomisert til placebo eller til 2 dosenivåer av karvedilol. Disse dosenivåene ga placebokorrigert hjertefrekvensreduksjon på 4 til 6 hjerteslag per minutt, noe som indikerer β-blokkadeaktivitet. Eksponering så ut til å være lavere hos pediatriske personer enn hos voksne. Etter 8 måneders oppfølging var det ingen signifikant effekt av behandlingen på kliniske utfall. Bivirkninger i denne studien som forekom hos mer enn 10 % av pasientene behandlet med COREG og dobbelt så mange som placebo-behandlede, inkluderte brystsmerter (17 % versus 6 %), svimmelhet (13 % versus 2 %) og dyspné ( 11 % mot 0 %).
Geriatrisk bruk
Av de 765 pasientene med hjertesvikt randomisert til COREG 6,25 mg i amerikanske kliniske studier, var 31 % (235) i alderen 65 år eller eldre, og 7,3 % (56) var 75 år eller eldre. Av de 1 156 forsøkspersonene randomisert til COREG 3,12 mg i en langtids, placebokontrollert studie med alvorlig hjertesvikt, var 47 % (547) i alderen 65 år eller eldre, og 15 % (174) var 75 år eller eldre. Av 3 025 forsøkspersoner som fikk COREG 6,25 mg i hjertesviktstudier over hele verden, var 42 % i alderen 65 år eller eldre.
Av de 975 pasientene med hjerteinfarkt randomisert til COREG i CAPRICORN-studien, var 48 % (468) i alderen 65 år eller eldre, og 11 % (111) var 75 år eller eldre.
Av de 2 065 hypertensive pasientene i amerikanske kliniske studier av effekt eller sikkerhet som ble behandlet med COREG 25 mg, var 21 % (436) i alderen 65 år eller eldre. Av 3 722 personer som fikk COREG i kliniske studier med hypertensjon utført over hele verden, var 24 % i alderen 65 år eller eldre.
Med unntak av svimmelhet hos hypertensive personer (forekomst 8,8 % hos eldre mot 6 % hos yngre personer), ble det ikke observert noen generelle forskjeller i sikkerhet eller effektivitet (se figur 2 og 4) mellom de eldre og yngre forsøkspersonene i hver av de disse populasjonene. Tilsvarende har ikke annen rapportert klinisk erfaring identifisert forskjeller i respons mellom eldre og yngre personer, men større sensitivitet hos enkelte eldre individer kan ikke utelukkes.
OVERDOSE
Overdosering kan forårsake alvorlig hypotensjon, bradykardi, hjerteinsuffisiens, kardiogent sjokk og hjertestans. Luftveisproblemer, bronkospasmer, oppkast, bevissthetssvikt og generaliserte anfall kan også forekomme.
Pasienten bør plasseres i ryggleie og om nødvendig holdes under observasjon og behandles under intensivbehandlingsforhold. Følgende midler kan administreres:
For overdreven bradykardi : Atropin, 2 mg IV.
For å støtte kardiovaskulær funksjon Glukagon, 5 til 10 mg IV raskt over 30 sekunder, etterfulgt av en kontinuerlig infusjon på 5 mg per time; sympatomimetika (dobutamin, isoprenalin, adrenalin) i doser i henhold til kroppsvekt og effekt.
Hvis perifer vasodilatasjon dominerer, kan det være nødvendig å administrere adrenalin eller noradrenalin med kontinuerlig overvåking av sirkulasjonstilstander. For terapiresistent bradykardi bør pacemakerbehandling utføres. Ved bronkospasme bør β-sympathomimetika (som aerosol eller IV) eller aminofyllin IV gis. Ved anfall anbefales langsom IV-injeksjon av diazepam eller klonazepam.
MERK: Ved alvorlig forgiftning der det er symptomer på sjokk, må behandling med motgift fortsette i en tilstrekkelig lang tidsperiode i samsvar med halveringstiden på 7 til 10 timer for karvedilol.
Tilfeller av overdosering med COREG 3,12 mg alene eller i kombinasjon med andre legemidler er rapportert. Mengder inntatt oversteg i noen tilfeller 1000 milligram. Symptomer som ble opplevd inkluderte lavt blodtrykk og hjertefrekvens. Standard støttende behandling ble gitt og individer ble friske.
KONTRAINDIKASJONER
COREG 25mg er kontraindisert under følgende forhold:
- . Bronkial astma eller relaterte bronkospastiske tilstander. Dødsfall av status asthmaticus er rapportert etter enkeltdoser av COREG. . Andre eller tredje grads AV-blokk. . Syk sinus syndrom. . Alvorlig bradykardi (med mindre en permanent pacemaker er på plass). . Pasienter med kardiogent sjokk eller som har dekompensert hjertesvikt som krever bruk av intravenøs inotropisk behandling. Slike pasienter bør først avvennes fra intravenøs behandling før oppstart av COREG. . Pasienter med alvorlig nedsatt leverfunksjon. . Pasienter med en historie med en alvorlig overfølsomhetsreaksjon (f.eks. Stevens-Johnsons syndrom, anafylaktisk reaksjon, angioødem) overfor en hvilken som helst komponent i denne medisinen eller andre medisiner som inneholder karvedilol.
KLINISK FARMAKOLOGI
Virkningsmekanismen
COREG 3,12mg er en racemisk blanding der ikke-selektiv β-adrenoreseptorblokkerende aktivitet er tilstede i S(-)-enantiomeren og α1-adrenerg blokkerende aktivitet er tilstede i både R(+)- og S(-)-enantiomerer med lik styrke. COREG 6,25mg har ingen iboende sympatomimetisk aktivitet.
Farmakodynamikk
Hjertefeil
Grunnlaget for de gunstige effektene av COREG ved hjertesvikt er ikke etablert.
To placebokontrollerte studier sammenlignet de akutte hemodynamiske effektene av COREG med baseline-målinger hos 59 og 49 personer med NYHA klasse II-IV hjertesvikt som fikk diuretika, ACE-hemmere og digitalis. Det var signifikante reduksjoner i systemisk blodtrykk, pulmonalarterietrykk, pulmonalkapillærkiletrykk og hjertefrekvens. De første effektene på hjertevolum, slagvolumindeks og systemisk vaskulær motstand var små og varierende.
Disse forsøkene målte hemodynamiske effekter igjen etter 12 til 14 uker. COREG 25mg reduserte signifikant systemisk blodtrykk, pulmonalarterietrykk, høyre atrietrykk, systemisk vaskulær motstand og hjertefrekvens, mens slagvolumindeksen ble økt.
Blant 839 personer med NYHA klasse II-III hjertesvikt behandlet i 26 til 52 uker i 4 amerikanske placebokontrollerte studier, økte gjennomsnittlig venstre ventrikkel ejeksjonsfraksjon (EF) målt ved radionuklid ventrikulografi med 9 EF-enheter (%) hos forsøkspersoner som fikk COREG 6,25 mg og med 2 EF-enheter hos placebopersoner med en måldose på 25 til 50 mg to ganger daglig. Effektene av karvedilol på ejeksjonsfraksjonen var relatert til dose. Doser på 6,25 mg to ganger daglig, 12,5 mg to ganger daglig og 25 mg to ganger daglig var assosiert med placebokorrigerte økninger i EF på henholdsvis 5 EF-enheter, 6 EF-enheter og 8 EF-enheter; hver av disse effektene var nominelt statistisk signifikante.
Dysfunksjon i venstre ventrikkel etter hjerteinfarkt
Grunnlaget for de gunstige effektene av COREG 25mg hos pasienter med venstre ventrikkeldysfunksjon etter et akutt hjerteinfarkt er ikke etablert.
Hypertensjon
Mekanismen som β-blokkade gir en antihypertensiv effekt er ikke fastslått.
β-adrenoreseptorblokkerende aktivitet har blitt demonstrert i dyre- og menneskestudier som viser at karvedilol (1) reduserer hjerteutgang hos normale forsøkspersoner, (2) reduserer trenings- og/eller isoproterenol-indusert takykardi, og (3) reduserer refleksortostatisk takykardi. Betydelig β-adrenoreseptorblokkerende effekt ses vanligvis innen 1 time etter legemiddeladministrering.
α1-adrenoreseptorblokkerende aktivitet er påvist i studier på mennesker og dyr, som viser at karvedilol (1) demper pressoreffekten av fenylefrin, (2) forårsaker vasodilatasjon og (3) reduserer perifer vaskulær motstand. Disse effektene bidrar til reduksjon av blodtrykket og ses vanligvis innen 30 minutter etter legemiddeladministrering.
På grunn av den α1-reseptorblokkerende aktiviteten til karvedilol, senkes blodtrykket mer i stående enn i liggende stilling, og symptomer på postural hypotensjon (1,8 %), inkludert sjeldne tilfeller av synkope, kan oppstå. Etter oral administrering, når postural hypotensjon har oppstått, har den vært forbigående og er uvanlig når COREG administreres sammen med mat i anbefalt startdose og titreringsøkninger følges nøye [se DOSERING OG ADMINISTRASJON ].
Hos hypertensive pasienter med normal nyrefunksjon reduserte terapeutiske doser av COREG renal vaskulær motstand uten endring i glomerulær filtrasjonshastighet eller renal plasmastrøm. Endringer i utskillelse av natrium, kalium, urinsyre og fosfor hos hypertensive pasienter med normal nyrefunksjon var like etter COREG og placebo.
COREG 3,12mg har liten effekt på plasmakatekolaminer, plasmaaldosteron eller elektrolyttnivåer, men det reduserer plasmareninaktiviteten betydelig når det gis i minst 4 uker. Det øker også nivåene av atrialt natriuretisk peptid.
Farmakokinetikk
COREG absorberes raskt og omfattende etter oral administrering, med en absolutt biotilgjengelighet på ca. 25 % til 35 % på grunn av en betydelig grad av first-pass metabolisme. Etter oral administrering varierer den tilsynelatende gjennomsnittlige terminale eliminasjonshalveringstiden for karvedilol vanligvis fra 7 til 10 timer. Plasmakonsentrasjoner som oppnås er proporsjonale med den orale dosen som administreres. Når det administreres sammen med mat, reduseres absorpsjonshastigheten, noe som fremgår av en forsinkelse i tiden for å nå maksimale plasmanivåer, uten signifikant forskjell i grad av biotilgjengelighet. Å ta COREG sammen med mat bør minimere risikoen for ortostatisk hypotensjon.
Carvedilol metaboliseres i stor grad. Etter oral administrering av radiomerket karvedilol til friske frivillige, utgjorde karvedilol bare ca. 7 % av den totale radioaktiviteten i plasma målt ved arealet under kurven (AUC). Mindre enn 2 % av dosen ble skilt ut uendret i urinen. Carvedilol metaboliseres primært ved aromatisk ringoksidasjon og glukuronidering.
De oksidative metabolittene metaboliseres videre ved konjugering via glukuronidering og sulfatering. Metabolittene til karvedilol skilles primært ut via gallen til avføringen. Demetylering og hydroksylering ved fenolringen produserer 3 aktive metabolitter med β-reseptorblokkerende aktivitet. Basert på prekliniske studier er 4'-hydroksyfenylmetabolitten omtrent 13 ganger mer potent enn karvedilol for β-blokkering.
Sammenlignet med karvedilol viser de 3 aktive metabolittene svak vasodilaterende aktivitet. Plasmakonsentrasjoner av de aktive metabolittene er omtrent en tiendedel av de som er observert for karvedilol og har farmakokinetikk som ligner på foreldrenes.
Carvedilol gjennomgår stereoselektiv first-pass metabolisme med plasmanivåer av R(+)-carvedilol omtrent 2 til 3 ganger høyere enn S(-)-carvedilol etter oral administrering hos friske personer. Den gjennomsnittlige tilsynelatende terminale eliminasjonshalveringstiden for R(+)-carvedilol varierer fra 5 til 9 timer sammenlignet med 7 til 11 timer for S(-)-enantiomeren.
De primære P450-enzymene som er ansvarlige for metabolismen av både R(+) og S(-)-carvedilol i humane levermikrosomer var CYP2D6 og CYP2C9 og i mindre grad CYP3A4, 2C19, 1A2 og 2E1. CYP2D6 antas å være hovedenzymet i 4'- og 5'-hydroksyleringen av karvedilol, med et potensielt bidrag fra 3A4. CYP2C9 antas å være av primær betydning i O-metyleringsveien til S(-)-carvedilol.
Carvedilol er utsatt for effektene av genetisk polymorfisme med dårlige metabolisatorer av debrisoquin (en markør for cytokrom P450 2D6) som viser 2 til 3 ganger høyere plasmakonsentrasjoner av R(+)-carvedilol sammenlignet med omfattende metabolisatorer. Derimot økes plasmanivåene av S(-)-carvedilol bare med ca. 20 % til 25 % hos dårlige metabolisatorer, noe som indikerer at denne enantiomeren metaboliseres i mindre grad av cytokrom P450 2D6 enn R(+)-carvedilol. Farmakokinetikken til karvedilol ser ikke ut til å være forskjellig hos dårlige metabolisatorer av S-mefenytoin (pasienter med mangel på cytokrom P450 2C19).
Carvedilol er mer enn 98 % bundet til plasmaproteiner, primært med albumin. Plasmaproteinbindingen er uavhengig av konsentrasjon over det terapeutiske området. Carvedilol er en basisk, lipofil forbindelse med et steady-state distribusjonsvolum på ca. 115 L, noe som indikerer betydelig distribusjon til ekstravaskulært vev. Plasmaklaring varierer fra 500 til 700 ml/min.
Spesifikke populasjoner
Hjertefeil
Steady-state plasmakonsentrasjoner av karvedilol og dets enantiomerer økte proporsjonalt over doseområdet 6,25 til 50 mg hos personer med hjertesvikt. Sammenlignet med friske forsøkspersoner hadde forsøkspersoner med hjertesvikt økte gjennomsnittlige AUC- og Cmax-verdier for karvedilol og dets enantiomerer, med opptil 50 % til 100 % høyere verdier observert hos 6 personer med NYHA klasse IV hjertesvikt. Den gjennomsnittlige tilsynelatende terminale eliminasjonshalveringstiden for karvedilol var lik den som ble observert hos friske personer.
Geriatrisk
Plasmanivåer av karvedilol er i gjennomsnitt omtrent 50 % høyere hos eldre sammenlignet med unge forsøkspersoner. Nedsatt leverfunksjon Sammenlignet med friske forsøkspersoner viser pasienter med alvorlig nedsatt leverfunksjon (cirrhose) en 4- til 7 ganger økning i karvedilolnivåer. Carvedilol er kontraindisert hos pasienter med alvorlig nedsatt leverfunksjon.
Nedsatt nyrefunksjon
Selv om karvedilol primært metaboliseres i leveren, har plasmakonsentrasjoner av karvedilol blitt rapportert å øke hos pasienter med nedsatt nyrefunksjon. Basert på gjennomsnittlige AUC-data ble ca. 40 % til 50 % høyere plasmakonsentrasjoner av karvedilol observert hos personer med hypertensjon og moderat til alvorlig nedsatt nyrefunksjon sammenlignet med en kontrollgruppe av personer med hypertensjon og normal nyrefunksjon. Områdene for AUC-verdier var imidlertid like for begge gruppene. Endringer i gjennomsnittlige maksimale plasmanivåer var mindre uttalte, ca. 12 % til 26 % høyere hos personer med nedsatt nyrefunksjon.
I samsvar med dens høye grad av plasmaproteinbinding, ser det ikke ut til at karvedilol elimineres signifikant ved hemodialyse.
Legemiddel-legemiddelinteraksjoner
Siden karvedilol gjennomgår betydelig oksidativ metabolisme, kan metabolismen og farmakokinetikken til karvedilol bli påvirket av induksjon eller hemming av cytokrom P450-enzymer.
Amiodaron
en farmakokinetisk studie utført på 106 japanske forsøkspersoner med hjertesvikt, resulterte samtidig administrering av små belastnings- og vedlikeholdsdoser av amiodaron med karvedilol i minst en 2 ganger økning i steady-state bunnkonsentrasjoner av S(-)-karvedilol [se NARKOTIKAHANDEL ].
Cimetidin
I en farmakokinetisk studie utført med 10 friske mannlige forsøkspersoner, økte cimetidin (1000 mg per dag) steady-state AUC for karvedilol med 30 % uten endring i Cmax [se NARKOTIKAHANDEL ].
Digoksin
Etter samtidig administrering av karvedilol (25 mg én gang daglig) og digoksin (0,25 mg én gang daglig) i 14 dager, økte steady-state AUC og bunnkonsentrasjoner av digoksin med henholdsvis 14 % og 16 % hos 12 personer med hypertensjon [se NARKOTIKAHANDEL ].
Glyburide
Hos 12 friske forsøkspersoner resulterte ikke kombinert administrering av karvedilol (25 mg én gang daglig) og en enkelt dose glyburid i en klinisk relevant farmakokinetisk interaksjon for noen av forbindelsene.
Hydroklortiazid
En enkelt oral dose av karvedilol 25 mg endret ikke farmakokinetikken til en enkelt oral dose hydroklortiazid 25 mg hos 12 personer med hypertensjon. På samme måte hadde hydroklortiazid ingen effekt på farmakokinetikken til karvedilol.
Rifampin
I en farmakokinetisk studie utført med 8 friske mannlige forsøkspersoner, reduserte rifampin (600 mg daglig i 12 dager) AUC og Cmax for karvedilol med omtrent 70 % [se NARKOTIKAHANDEL ].
Torsemid
I en studie med 12 friske forsøkspersoner resulterte ikke kombinert oral administrering av karvedilol 25 mg én gang daglig og torsemid 5 mg én gang daglig i 5 dager i noen signifikante forskjeller i deres farmakokinetikk sammenlignet med administrering av legemidlene alene.
Warfarin
Carvedilol (12,5 mg to ganger daglig) hadde ingen effekt på steady-state protrombintidsforhold og endret ikke farmakokinetikken til R(+)- og S(-)-warfarin etter samtidig administrering med warfarin hos 9 friske frivillige.
Kliniske studier
Hjertefeil
Totalt 6 975 personer med mild til alvorlig hjertesvikt ble evaluert i placebokontrollerte studier med karvedilol.
Mild til moderat hjertesvikt
Carvedilol ble studert i 5 multisenter, placebokontrollerte studier og i 1 aktiv-kontrollert studie (COMET-studie) som involverte personer med mild til moderat hjertesvikt.
Fire amerikanske multisenter, dobbeltblinde, placebokontrollerte studier inkluderte 1094 forsøkspersoner (696 randomisert til karvedilol) med NYHA klasse II-III hjertesvikt og ejeksjonsfraksjon mindre enn eller lik 0,35. De aller fleste var på digitalis, diuretika og en ACE-hemmer ved inngangen til forsøket. Pasientene ble tildelt forsøkene basert på treningsevne. En Australia-New Zealand dobbeltblind, placebokontrollert studie inkluderte 415 personer (halvparten randomisert til karvedilol) med mindre alvorlig hjertesvikt. Alle protokoller ekskluderte personer som forventes å gjennomgå hjertetransplantasjon i løpet av 7,5 til 15 måneder med dobbeltblind oppfølging. Alle randomiserte forsøkspersoner hadde tolerert en 2-ukers kurs med karvedilol 6,25 mg to ganger daglig.
hver studie var det et primært endepunkt, enten progresjon av hjertesvikt (1 amerikansk prøve) eller treningstoleranse (2 amerikanske forsøk som oppfyller påmeldingsmålene og Australia-New Zealand-prøven). Det var mange sekundære endepunkter spesifisert i disse studiene, inkludert NYHA-klassifisering, globale vurderinger av pasient og lege og kardiovaskulær sykehusinnleggelse. Andre analyser som ikke var prospektivt planlagt inkluderte summen av dødsfall og totale kardiovaskulære sykehusinnleggelser. I situasjoner der de primære endepunktene i en studie ikke viser en signifikant fordel ved behandling, er tildeling av signifikansverdier til de andre resultatene komplisert, og slike verdier må tolkes med forsiktighet.
Resultatene av forsøkene i USA og Australia-New Zealand var som følger:
Bremse progresjon av hjertesvikt
En amerikansk multisenterstudie (366 forsøkspersoner) hadde som sitt primære endepunkt summen av kardiovaskulær dødelighet, kardiovaskulær sykehusinnleggelse og vedvarende økning i hjertesviktmedisiner. Hjertesviktprogresjon ble redusert, i løpet av en gjennomsnittlig oppfølging på 7 måneder, med 48 % (P = 0,008).
I Australia-New Zealand-studien ble dødsfall og totale sykehusinnleggelser redusert med omtrent 25 % over 18 til 24 måneder. I de 3 største amerikanske studiene ble dødsfall og totale sykehusinnleggelser redusert med 19 %, 39 % og 49 %, nominelt statistisk signifikant i de to siste studiene. Australia-New Zealand-resultatene var statistisk på grensen.
Funksjonelle tiltak
Ingen av multisenterstudiene hadde NYHA-klassifisering som et primært endepunkt, men alle slike forsøk hadde det som et sekundært endepunkt. Det var i det minste en trend mot forbedring i NYHA-klassen i alle forsøk. Treningstoleranse var det primære endepunktet i 3 forsøk; hos ingen ble det funnet en statistisk signifikant effekt.
Subjektive tiltak
Helserelatert livskvalitet, målt med et standard spørreskjema (et primært endepunkt i 1 studie), var upåvirket av karvedilol. Pasientenes og etterforskernes globale vurderinger viste imidlertid betydelig forbedring i de fleste studier.
Dødelighet
Døden var ikke et forhåndsspesifisert endepunkt i noen rettssak, men ble analysert i alle forsøk. Totalt sett, i disse 4 amerikanske forsøkene, ble dødeligheten redusert, nominelt signifikant i 2 forsøk.
COMET-rettssaken
denne dobbeltblinde studien ble 3 029 personer med NYHA klasse II-IV hjertesvikt (venstre ventrikkel ejeksjonsfraksjon mindre enn eller lik 35%) randomisert til å motta enten karvedilol (måldose: 25 mg to ganger daglig) eller metoprolol med umiddelbar frigjøring tartrat (måldose: 50 mg to ganger daglig). Gjennomsnittsalderen til forsøkspersonene var omtrent 62 år, 80 % var menn, og gjennomsnittlig venstre ventrikkel ejeksjonsfraksjon ved baseline var 26 %. Omtrent 96 % av forsøkspersonene hadde NYHA klasse II eller III hjertesvikt. Samtidig behandling inkluderte diuretika (99 %), ACE-hemmere (91 %), digitalis (59 %), aldosteronantagonister (11 %) og "statin" lipidsenkende midler (21 %). Gjennomsnittlig varighet av oppfølgingen var 4,8 år. Gjennomsnittlig dose av karvedilol var 42 mg per dag.
Forsøket hadde 2 primære endepunkter: dødelighet av alle årsaker og sammensetningen av død pluss sykehusinnleggelse uansett årsak. Resultatene av COMET er presentert i tabell 3 nedenfor. Dødelighet av alle årsaker hadde det meste av den statistiske vekten og var den primære determinanten for forsøksstørrelsen. Dødelighet av alle årsaker var 34 % hos pasientene behandlet med karvedilol og var 40 % i metoprololgruppen med umiddelbar frigjøring (P = 0,0017; hazard ratio = 0,83, 95 % KI: 0,74 til 0,93). Effekten på dødelighet skyldtes først og fremst en reduksjon i kardiovaskulær død. Forskjellen mellom de 2 gruppene med hensyn til det sammensatte endepunktet var ikke signifikant (P = 0,122). Estimert gjennomsnittlig overlevelse var 8,0 år med karvedilol og 6,6 år med metoprolol med umiddelbar frigjøring.
Det er ikke kjent om denne formuleringen av metoprolol i noen dose eller denne lave dosen av metoprolol i noen formulering har noen effekt på overlevelse eller sykehusinnleggelse hos pasienter med hjertesvikt. Dermed forlenger denne studien tiden som karvedilol viser fordeler på overlevelse ved hjertesvikt, men det er ikke bevis på at karvedilol forbedrer resultatet i forhold til formuleringen av metoprolol (TOPROL-XL) med fordeler ved hjertesvikt.
Alvorlig hjertesvikt (COPERNICUS)
en dobbeltblind studie (COPERNICUS), 2289 personer med hjertesvikt i hvile eller med minimal anstrengelse og venstre ventrikkel ejeksjonsfraksjon mindre enn 25 % (gjennomsnittlig 20 %), til tross for digitalis (66 %), diuretika (99 %) og ACE-hemmere (89 %) ble randomisert til placebo eller karvedilol. Carvedilol ble titrert fra en startdose på 3,125 mg to ganger daglig til maksimal tolerert dose eller opp til 25 mg to ganger daglig i løpet av minimum 6 uker. De fleste forsøkspersoner oppnådde måldosen på 25 mg. Rettssaken ble gjennomført i Øst- og Vest-Europa, USA, Israel og Canada. Tilsvarende antall forsøkspersoner per gruppe (ca. 100) trakk seg i løpet av titreringsperioden.
Det primære endepunktet for studien var dødelighet av alle årsaker, men årsaksspesifikk dødelighet og risiko for død eller sykehusinnleggelse (total, kardiovaskulær [CV] eller hjertesvikt [HF]) ble også undersøkt. De utviklende prøvedataene ble fulgt av en dataovervåkingskomité, og dødelighetsanalyser ble justert for disse flere utseendene. Studien ble stoppet etter en median oppfølging på 10 måneder på grunn av en observert 35 % reduksjon i dødelighet (fra 19,7 % per pasientår på placebo til 12,8 % på karvedilol; hazard ratio 0,65, 95 % KI: 0,52 til 0,81, P = 0,0014, justert) (se figur 1). Resultatene av COPERNICUS er vist i tabell 4.
Figur 1. Overlevelsesanalyse for COPERNICUS (Intent-to-Treat) 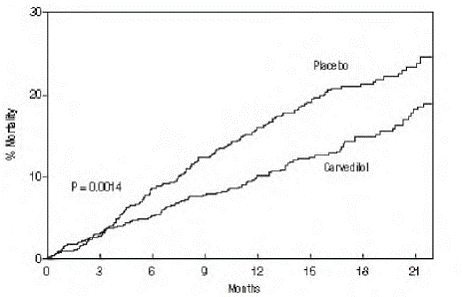
Effekten på dødelighet var hovedsakelig et resultat av en reduksjon i frekvensen av plutselig død blant forsøkspersoner uten forverring av hjertesvikt.
Pasientenes globale vurderinger, der karvedilolbehandlede forsøkspersoner ble sammenlignet med placebo, var basert på forhåndsspesifiserte, periodiske selvevalueringer av pasienten med hensyn til om klinisk status etter behandling viste bedring, forverring eller ingen endring sammenlignet med baseline. Personer behandlet med karvedilol viste signifikante forbedringer i globale vurderinger sammenlignet med de som ble behandlet med placebo i COPERNICUS.
Protokollen spesifiserte også at sykehusinnleggelser ville bli vurdert. Færre personer på COREG 6,25 mg enn på placebo ble innlagt på sykehus uansett årsak (372 versus 432, P = 0,0029), av kardiovaskulære årsaker (246 versus 314, P = 0,0003), eller for forverret hjertesvikt (198 versus 2600, P = 10). ).
COREG 6,25 mg hadde en konsistent og gunstig effekt på dødelighet av alle årsaker så vel som de kombinerte endepunktene for dødelighet av alle årsaker pluss sykehusinnleggelse (totalt, CV eller hjertesvikt) i den totale forsøkspopulasjonen og i alle undergrupper undersøkte, inkludert menn og kvinner, eldre og ikke-eldre, svarte og ikke-svarte, og diabetikere og ikke-diabetikere (se figur 2).
Figur 2. Effekter på dødelighet for undergrupper i COPERNICUS 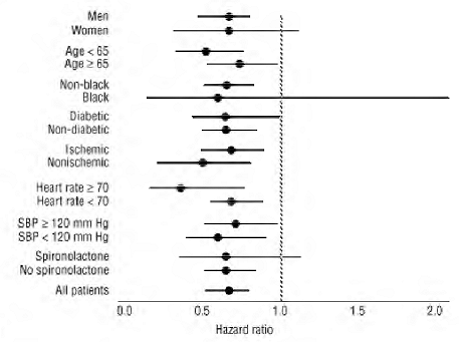
Dysfunksjon i venstre ventrikkel etter hjerteinfarkt
CAPRICORN var en dobbeltblind studie som sammenlignet karvedilol og placebo hos 1 959 personer med et nylig hjerteinfarkt (innen 21 dager) og venstre ventrikkel ejeksjonsfraksjon på mindre enn eller lik 40 %, med (47 %) eller uten symptomer på hjertesvikt. Personer som fikk karvedilol fikk 6,25 mg to ganger daglig, titrert som tolerert til 25 mg to ganger daglig. Forsøkspersonene måtte ha et systolisk blodtrykk større enn 90 mm Hg, en sittende hjertefrekvens større enn 60 slag per minutt, og ingen kontraindikasjon for bruk av β-blokkere. Behandling av indeksinfarktet inkluderte aspirin (85%), IV eller orale β-blokkere (37%), nitrater (73%), heparin (64%), trombolytika (40%) og akutt angioplastikk (12%). Bakgrunnsbehandling inkluderte ACE-hemmere eller angiotensinreseptorblokkere (97 %), antikoagulantia (20 %), lipidsenkende midler (23 %) og diuretika (34 %). Baseline-populasjonskarakteristika inkluderte en gjennomsnittsalder på 63 år, 74 % menn, 95 % kaukasiske, gjennomsnittlig blodtrykk 121/74 mm Hg, 22 % med diabetes og 54 % med hypertensjon i anamnesen. Gjennomsnittlig oppnådd dose av karvedilol var 20 mg to ganger daglig; gjennomsnittlig varighet av oppfølgingen var 15 måneder.
Dødelighet av alle årsaker var 15 % i placebogruppen og 12 % i karvedilolgruppen, noe som indikerer en risikoreduksjon på 23 % hos personer behandlet med karvedilol (95 % KI: 2 % til 40 %, P = 0,03), som vist i figuren 3. Effektene på dødelighet i ulike undergrupper er vist i figur 4. Nesten alle dødsfall var kardiovaskulære (som ble redusert med 25 % av karvedilol), og de fleste av disse dødsfallene var plutselige eller relatert til pumpesvikt (begge dødstyper ble redusert av carvedilol). Et annet endepunkt for forsøket, total dødelighet og sykehusinnleggelse av alle årsaker, viste ingen signifikant forbedring.
Det ble også observert en signifikant 40 % reduksjon i dødelig eller ikke-dødelig hjerteinfarkt i gruppen behandlet med karvedilol (95 % KI: 11 % til 60 %, P = 0,01). En lignende reduksjon i risikoen for hjerteinfarkt ble også observert i en metaanalyse av placebokontrollerte studier av karvedilol ved hjertesvikt.
Figur 3. Overlevelsesanalyse for STINBOKK (Intent-to-Treat) 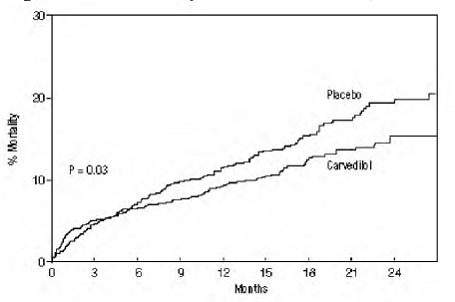
Figur 4. Effekter på dødelighet for undergrupper i STINBUKK 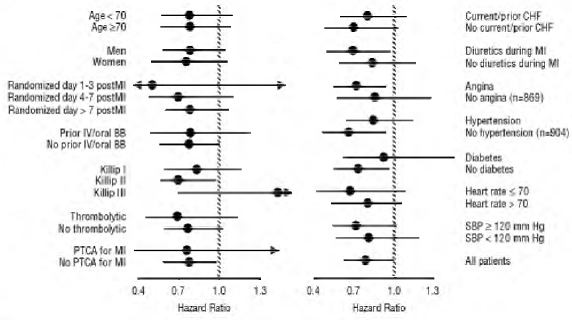
Hypertensjon
COREG 25 mg ble studert i 2 placebokontrollerte studier som brukte to ganger daglig dosering med totale daglige doser på 12,5 til 50 mg. I disse og andre studier oversteg ikke startdosen 12,5 mg. Ved 50 mg per dag reduserte COREG sittende blodtrykk (12-timers) med ca. 9/5,5 mm Hg; ved 25 mg per dag var effekten ca. 7,5/3,5 mm Hg. Sammenligninger av bunn-til-topp-blodtrykk viste et bunn-til-topp-forhold for blodtrykksrespons på omtrent 65 %. Hjertefrekvensen falt med omtrent 7,5 slag per minutt ved 50 mg per dag. Generelt, som for andre β-blokkere, var responsene mindre hos svarte enn ikke-svarte personer. Det var ingen alders- eller kjønnsrelaterte forskjeller i responsen.
Den maksimale antihypertensive effekten oppsto 1 til 2 timer etter en dose. Den doserelaterte blodtrykksresponsen ble ledsaget av en doserelatert økning i bivirkninger [se BIVIRKNINGER ].
Hypertensjon med type 2 diabetes mellitus
en dobbeltblind studie (GEMINI) ble COREG 25 mg, lagt til en ACE-hemmer eller angiotensin-reseptorblokker, evaluert i en populasjon med mild til moderat hypertensjon og godt kontrollert type 2 diabetes mellitus. Gjennomsnittlig HbA1c ved baseline var 7,2 %. COREG ble titrert til en gjennomsnittlig dose på 17,5 mg to ganger daglig og opprettholdt i 5 måneder. COREG hadde ingen negativ effekt på glykemisk kontroll, basert på HbA1c-målinger (gjennomsnittlig endring fra baseline på 0,02 %, 95 % KI: -0,06 til 0,10, P = NS) [se ADVARSLER OG FORHOLDSREGLER ].
PASIENTINFORMASJON
COREG (Co-REG) (carvedilol) Tabletter
Les pasientinformasjonen som følger med COREG før du begynner å ta den og hver gang du får påfyll. Det kan komme ny informasjon. Denne informasjonen erstatter ikke å snakke med legen din om din medisinske tilstand eller din behandling. Spør legen din eller apoteket hvis du har spørsmål om COREG 3,12mg.
Hva er COREG 3,12mg?
COREG er et reseptbelagt legemiddel som tilhører en gruppe legemidler som kalles "betablokkere". COREG 6,25mg brukes, ofte sammen med andre medisiner, for følgende tilstander:
- . å behandle pasienter med visse typer hjertesvikt . å behandle pasienter som hadde et hjerteinfarkt som forverret hvor godt hjertet pumper . for å behandle pasienter med høyt blodtrykk (hypertensjon)
COREG er ikke godkjent for bruk hos barn under 18 år.
Hvem bør ikke ta COREG?
Ikke ta COREG 6,25 mg hvis du:
- . har alvorlig hjertesvikt og er innlagt på intensivavdelingen eller krever visse intravenøse medisiner som bidrar til å støtte sirkulasjonen (inotrope medisiner). . er utsatt for astma eller andre pusteproblemer. . har en langsom hjerterytme eller et hjerte som hopper over et slag (uregelmessig hjerterytme). . har leverproblemer. . er allergisk mot noen av ingrediensene i COREG. Den aktive ingrediensen er karvedilol. Se slutten av dette pakningsvedlegget for en liste over alle ingrediensene i COREG.
Hva bør jeg fortelle legen min før jeg tar COREG?
Fortell legen din om alle dine medisinske tilstander, inkludert hvis du:
- . har astma eller andre lungeproblemer (som bronkitt eller emfysem). . har problemer med blodstrømmen i føttene og bena (perifer karsykdom). COREG 3,12 mg kan gjøre noen av symptomene dine verre. . har diabetes. . har problemer med skjoldbruskkjertelen. . har en tilstand som kalles feokromocytom. . har hatt alvorlige allergiske reaksjoner. . er gravid eller prøver å bli gravid. Det er ikke kjent om COREG er trygt for din ufødte baby. Du og legen din bør snakke om den beste måten å kontrollere høyt blodtrykk på under graviditet. . ammer. Det er ikke kjent om COREG går over i morsmelk. Snakk med legen din om den beste måten å mate babyen din på hvis du tar COREG. . er planlagt for operasjon og vil få anestesimidler. . er planlagt for kataraktoperasjon og har tatt eller tar COREG. . tar reseptbelagte eller reseptfrie medisiner, vitaminer og urtetilskudd. COREG og visse andre medisiner kan påvirke hverandre og forårsake alvorlige bivirkninger. COREG 3,12 mg kan påvirke måten andre medisiner virker på. Andre medisiner kan også påvirke hvor godt COREG 25mg virker.
Hold en liste over alle medisinene du tar. Vis denne listen til legen din og apoteket før du begynner på et nytt legemiddel.
Hvordan bør jeg ta COREG?
Det er viktig for deg å ta medisinen hver dag som anvist av legen din. Hvis du slutter å ta COREG plutselig, kan du få brystsmerter og/eller hjerteinfarkt. Hvis legen din bestemmer at du skal slutte å ta COREG 6,25 mg, kan legen sakte redusere dosen over en periode før den slutter helt.
- . Ta COREG nøyaktig som foreskrevet. Legen din vil fortelle deg hvor mange tabletter du skal ta og hvor ofte. For å minimere mulige bivirkninger, kan legen din begynne med en lav dose og deretter sakte øke dosen. . Ikke slutt å ta COREG og ikke endre mengden COREG du tar uten å snakke med legen din. . Fortell legen din dersom du går opp i vekt eller har problemer med å puste mens du tar COREG. . Ta COREG med mat. . Hvis du glemmer en dose på COREG 3,12 mg, ta dosen så snart du husker det, med mindre det er på tide å ta neste dose. Ta neste dose til vanlig tid. Ikke ta 2 doser samtidig. . Hvis du tar for mye COREG 25mg, ring legen din eller giftkontrollsenteret umiddelbart.
Hva bør jeg unngå mens jeg tar COREG 3,12mg?
- . COREG kan føre til at du føler deg svimmel, trøtt eller besvimer. Ikke kjør bil, bruk maskiner eller gjør noe som krever at du er på vakt hvis du har disse symptomene.
Hva er mulige bivirkninger av COREG?
- . Lavt blodtrykk (som kan forårsake svimmelhet eller besvimelse når du reiser deg). Hvis dette skjer, sett deg eller legg deg ned med en gang og fortell legen din. . Tretthet. Hvis du føler deg trøtt eller svimmel, bør du ikke kjøre bil, bruke maskiner eller gjøre noe som krever at du er på vakt. . Langsom hjerterytme. . Endringer i blodsukkeret ditt. Hvis du har diabetes, fortell legen din dersom du har endringer i blodsukkernivået. . COREG kan skjule noen av symptomene på lavt blodsukker, spesielt en rask hjerterytme. . COREG kan maskere symptomene på hypertyreose (overaktiv skjoldbruskkjertel). . Forverring av alvorlige allergiske reaksjoner. . Sjeldne, men alvorlige allergiske reaksjoner (inkludert elveblest eller hevelse i ansikt, lepper, tunge og/eller svelg som kan forårsake problemer med å puste eller svelge) har forekommet hos pasienter som var på COREG. Disse reaksjonene kan være livstruende.
Andre bivirkninger av COREG inkluderer kortpustethet, vektøkning, diaré og færre tårer eller tørre øyne som blir plagsomme hvis du bruker kontaktlinser.
Ring legen din hvis du har noen bivirkninger som plager deg eller ikke forsvinner.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA1088.
Hvordan bør jeg oppbevare COREG 6,25mg?
- . Oppbevar COREG ved mindre enn 86 °F (30 °C). Hold tablettene tørre. . Kast trygt COREG som er utdatert eller ikke lenger er nødvendig. . Oppbevar COREG 6,25mg og alle medisiner utilgjengelig for barn.
Generell informasjon om COREG
Medisiner foreskrives noen ganger for andre tilstander enn de som er beskrevet i pakningsvedlegg. Ikke bruk COREG 3,12 mg for en tilstand det ikke er foreskrevet for. Ikke gi COREG til andre mennesker, selv om de har de samme symptomene du har. Det kan skade dem.
Dette pakningsvedlegget oppsummerer den viktigste informasjonen om COREG. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre legen din eller apoteket om informasjon om COREG 6,25mg som er skrevet for helsepersonell.
Hva er ingrediensene i COREG?
Aktiv ingrediens: carvedilol.
Inaktive ingredienser: kolloidalt silisiumdioksid, krospovidon, hypromellose, laktose, magnesiumstearat, polyetylenglykol, polysorbat 80, povidon, sukrose og titandioksid.
Carvedilol tabletter kommer i følgende styrker: 3,125 mg, 6,25 mg, 12,5 mg, 25 mg.
Hva er høyt blodtrykk (hypertensjon)?
Blodtrykk er blodets kraft i blodårene når hjertet slår og når hjertet hviler. Du har høyt blodtrykk når kraften er for stor. Høyt blodtrykk gjør at hjertet jobber hardere for å pumpe blod gjennom kroppen og forårsaker skade på blodårene. COREG kan hjelpe blodårene til å slappe av slik at blodtrykket blir lavere. Medisiner som senker blodtrykket kan redusere sjansen for å få hjerneslag eller hjerteinfarkt.
