Vasotec 2.5mg, 5mg, 10mg Enalapril Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Vasotec og hvordan brukes det?
Vasotec er et reseptbelagt legemiddel som brukes til å behandle symptomer på høyt blodtrykk (hypertensjon), venstre ventrikkel dysfunksjon og kongestiv hjertesvikt. Vasotec kan brukes alene eller sammen med andre medisiner.
- . Vasotec tilhører en klasse legemidler som kalles ACE-hemmere. . Det er ikke kjent om Vasotec er trygt og effektivt hos barn yngre enn 1 måned.
Hva er de mulige bivirkningene av Vasotec 2,5 mg?
Vasotec 2,5 mg kan forårsake alvorlige bivirkninger inkludert:
- . svimmelhet, . brystsmerter, . gulfarging av hud eller øyne (gulsott), . lite eller ingen vannlating, . feber, . frysninger, . sår hals, . kvalme, . svakhet, . prikkende følelse, . uregelmessige hjerteslag, og . tap av bevegelse
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Vasotec inkluderer:
- . svimmelhet, . tretthet, og . svimmelhet
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Vasotec. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
- . Når graviditet oppdages, seponer VASOTEC® så snart som mulig. . Legemidler som virker direkte på renin-angiotensin-systemet kan forårsake skade og død for det utviklende fosteret. Se ADVARSLER: Fostertoksisitet
BESKRIVELSE
VASOTEC® (Enalapril Maleate) er maleatsaltet av enalapril, etylesteren av en langtidsvirkende angiotensin-konverterende enzymhemmer, enalaprilat. Enalaprilmaleat er kjemisk beskrevet som (S)-1[N-[1-(etoksykarbonyl)-3-fenylpropyl]-L-alanyl]-L-prolin, (Z)-2-butendioatsalt (1:1). Dens empiriske formel er C20H28N2O5•C4H4O4, og dens strukturformel er:
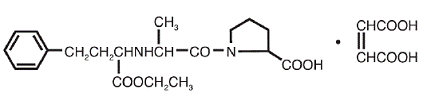
Enalaprilmaleat er et hvitt til off-white, krystallinsk pulver med en molekylvekt på 492,53. Det er lite løselig i vann, løselig i etanol og fritt løselig i metanol.
Enalapril er en pro-drug; etter oral administrering bioaktiveres det ved hydrolyse av etylesteren til enalaprilat, som er den aktive angiotensin-konverterende enzymhemmeren.
Enalaprilmaleat leveres som 2,5 mg, 5 mg, 10 mg og 20 mg tabletter for oral administrering. I tillegg til den aktive ingrediensen enalaprilmaleat, inneholder hver tablett følgende inaktive ingredienser: laktose, magnesiumstearat, natriumbikarbonat og stivelse. 10 mg og 20 mg tablettene inneholder også jernoksider.
INDIKASJONER
Hypertensjon
VASOTEC er indisert for behandling av hypertensjon.
VASOTEC er effektivt alene eller i kombinasjon med andre antihypertensiva, spesielt diuretika av tiazidtypen. De blodtrykkssenkende effektene av VASOTEC 10 mg og tiazider er tilnærmet additive.
Hjertefeil
VASOTEC er indisert for behandling av symptomatisk kongestiv hjertesvikt, vanligvis i kombinasjon med diuretika og digitalis. Hos disse pasientene forbedrer VASOTEC 5mg symptomene, øker overlevelsen og reduserer frekvensen av sykehusinnleggelse (se KLINISK FARMAKOLOGI , Hjertefeil , Dødelighetsforsøk for detaljer og begrensninger for overlevelsesforsøk ).
Asymptomatisk venstre ventrikkel dysfunksjon
Hos klinisk stabile asymptomatiske pasienter med venstre ventrikkel dysfunksjon (ejeksjonsfraksjon ≤ 35 prosent), reduserer VASOTEC 5mg utviklingshastigheten av åpenhjertig hjertesvikt og reduserer forekomsten av sykehusinnleggelse for hjertesvikt (se KLINISK FARMAKOLOGI , Hjertefeil , Dødelighetsforsøk for detaljer og begrensninger for overlevelsesforsøk ).
Ved bruk av VASOTEC 2,5 mg bør det tas hensyn til det faktum at en annen angiotensinkonverterende enzymhemmer, kaptopril, har forårsaket agranulocytose, spesielt hos pasienter med nedsatt nyrefunksjon eller kollagen vaskulær sykdom, og at tilgjengelige data er utilstrekkelige til å vise at VASOTEC 2,5 mg ikke har en lignende risiko (se ADVARSLER ).
Ved vurdering av bruk av VASOTEC bør det bemerkes at i kontrollerte kliniske studier har ACE-hemmere en effekt på blodtrykket som er mindre hos svarte pasienter enn hos ikke-svarte. I tillegg bør det bemerkes at svarte pasienter som får ACE-hemmere har blitt rapportert å ha en høyere forekomst av angioødem sammenlignet med ikke-svarte (se ADVARSLER , Hode og nakke angioødem ).
DOSERING OG ADMINISTRASJON
Hypertensjon
Hos pasienter som for tiden behandles med et diuretikum, kan det av og til oppstå symptomatisk hypotensjon etter startdosen med VASOTEC. Diuretikaet bør om mulig seponeres i to til tre dager før behandling med VASOTEC startes for å redusere sannsynligheten for hypotensjon (se ADVARSLER ). Hvis pasientens blodtrykk ikke kontrolleres med VASOTEC alene, kan diuretikabehandlingen gjenopptas.
Hvis diuretika ikke kan seponeres, bør en startdose på 2,5 mg brukes under medisinsk tilsyn i minst to timer og til blodtrykket har stabilisert seg i minst en ekstra time (se ADVARSLER og FORHOLDSREGLER , NARKOTIKAHANDEL ).
Anbefalt startdose hos pasienter som ikke bruker diuretika er 5 mg én gang daglig. Doseringen bør justeres i henhold til blodtrykksresponsen. Det vanlige doseringsområdet er 10 til 40 mg per dag administrert i en enkelt dose eller to oppdelte doser. Hos noen pasienter som behandles én gang daglig, kan den antihypertensive effekten avta mot slutten av doseringsintervallet. Hos slike pasienter bør en økning i dose eller administrering to ganger daglig vurderes. Hvis blodtrykket ikke kontrolleres med VASOTEC 2,5 mg alene, kan et vanndrivende middel tilsettes. Samtidig administrering av VASOTEC 5mg med kaliumtilskudd, kaliumsalterstatninger eller kaliumsparende diuretika kan føre til økning av serumkalium (se FORHOLDSREGLER ).
Dosejustering hos hypertensive pasienter med nedsatt nyrefunksjon
Den vanlige dosen av enalapril anbefales for pasienter med en kreatininclearance på over 30 ml/min (serumkreatinin på opptil ca. 3 mg/dL). For pasienter med kreatininclearance mindre enn eller lik 30 ml/min (serumkreatinin mer enn eller lik 3 mg/dL), er den første dosen 2,5 mg én gang daglig. Dosen kan titreres oppover til blodtrykket er kontrollert eller til maksimalt 40 mg daglig.
Hjertefeil
VASOTEC er indisert for behandling av symptomatisk hjertesvikt, vanligvis i kombinasjon med diuretika og digitalis. I de placebokontrollerte studiene som viste forbedret overlevelse, ble pasientene titrert som tolerert opp til 40 mg, administrert i to oppdelte doser.
Anbefalt startdose er 2,5 mg. Det anbefalte doseringsområdet er 2,5 til 20 mg gitt to ganger daglig. Doser bør titreres oppover, som tolerert, over en periode på noen dager eller uker. Maksimal daglig dose administrert i kliniske studier var 40 mg i oppdelte doser.
Etter startdosen med VASOTEC, bør pasienten observeres under medisinsk tilsyn i minst to timer og til blodtrykket har stabilisert seg i minst en ekstra time (se ADVARSLER og NARKOTIKAHANDEL ). Hvis mulig, bør dosen av samtidig diuretika reduseres, noe som kan redusere sannsynligheten for hypotensjon. Forekomsten av hypotensjon etter den initiale dosen av VASOTEC utelukker ikke påfølgende forsiktig dosetitrering med legemidlet, etter effektiv behandling av hypotensjonen.
Asymptomatisk venstre ventrikkel dysfunksjon
I studien som viste effekt, ble pasientene startet med 2,5 mg to ganger daglig og ble titrert som tolerert til målrettet daglig dose på 20 mg (i delte doser).
Etter startdosen med VASOTEC 10 mg, bør pasienten observeres under medisinsk tilsyn i minst to timer og til blodtrykket har stabilisert seg i minst en ekstra time (se ADVARSLER og NARKOTIKAHANDEL ). Hvis mulig, bør dosen av samtidig diuretika reduseres, noe som kan redusere sannsynligheten for hypotensjon. Forekomsten av hypotensjon etter den første dosen av VASOTEC 5 mg utelukker ikke påfølgende forsiktig dosetitrering med legemidlet, etter effektiv behandling av hypotensjonen.
Dosejustering hos pasienter med hjertesvikt og nedsatt nyrefunksjon eller hyponatremi
Hos pasienter med hjertesvikt som har hyponatremi (serumnatrium mindre enn 130 mEq/L) eller med serumkreatinin større enn 1,6 mg/dL, bør behandlingen startes med 2,5 mg daglig under nøye medisinsk tilsyn (se Hjertefeil , ADVARSLER og NARKOTIKAHANDEL ). Dosen kan økes til 2,5 mg to ganger daglig, deretter 5 mg to ganger daglig og høyere etter behov, vanligvis med intervaller på fire dager eller mer dersom det ikke er for høy hypotensjon eller signifikant forverring av nyrefunksjonen på tidspunktet for dosejustering. Maksimal daglig dose er 40 mg.
Pediatriske hypertensive pasienter
Vanlig anbefalt startdose er 0,08 mg/kg (opptil 5 mg) én gang daglig. Doseringen bør justeres i henhold til blodtrykksresponsen. Doser over 0,58 mg/kg (eller over 40 mg) er ikke studert hos pediatriske pasienter (se KLINISK FARMAKOLOGI , Klinisk farmakologi hos pediatriske pasienter ).
VASOTEC 5mg anbefales ikke til nyfødte og pediatriske pasienter med glomerulær filtrasjonshastighet mindre enn 30 ml/min/1,73 m², da ingen data er tilgjengelig.
Tilberedning av suspensjon (for 200 ml av en 1,0 mg/ml suspensjon)
Tilsett 50 mL Bicitra® til en polyetylentereftalat (PET)-flaske som inneholder ti 20 mg tabletter med VASOTEC 10 mg og rist i minst 2 minutter. La konsentraten stå i 60 minutter. Etter holdetiden på 60 minutter, rist konsentratet i ytterligere ett minutt. Tilsett 150 mL Ora-Sweet SF™2 til konsentratet i PET-flasken og rist suspensjonen for å spre ingrediensene. Suspensjonen skal oppbevares i kjøleskap ved 2-8°C (36-46°F) og kan oppbevares i opptil 30 dager. Rist suspensjonen før hver bruk.
HVORDAN LEVERES
Oppbevaring
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP kontrollert romtemperatur ].
Hold beholderen tett lukket.
Beskytt mot fuktighet.
Dispenser i en tett beholder i henhold til USP, hvis produktpakken er delt inn.
Produsert for: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA. Produsert av: Valeant Pharmaceuticals International, Inc. Steinbach, MB R5G 1Z7 Canada. Revisjon: juli 2017.
BIVIRKNINGER
VASOTEC har blitt evaluert for sikkerhet hos mer enn 10 000 pasienter, inkludert over 1000 pasienter behandlet i ett år eller mer. VASOTEC 10 mg har vist seg å være generelt godt tolerert i kontrollerte kliniske studier med 2987 pasienter. For det meste var uønskede opplevelser milde og forbigående. I kliniske studier var det nødvendig med seponering av behandlingen på grunn av kliniske bivirkninger hos 3,3 prosent av pasientene med hypertensjon og hos 5,7 prosent av pasientene med hjertesvikt. Frekvensen av bivirkninger var ikke relatert til total daglig dose innenfor de vanlige doseringsområdene. Hos pasienter med hypertensjon var den totale prosentandelen av pasienter behandlet med VASOTEC som rapporterte bivirkninger sammenlignbar med placebo.
Hypertensjon
Bivirkninger som forekommer hos mer enn én prosent av pasienter med hypertensjon behandlet med VASOTEC 2,5 mg i kontrollerte kliniske studier er vist nedenfor. Hos pasienter behandlet med VASOTEC var maksimal behandlingsvarighet tre år; Hos placebobehandlede pasienter var maksimal behandlingsvarighet 12 uker.
Hjertefeil
Bivirkninger som forekommer hos mer enn én prosent av pasienter med hjertesvikt behandlet med VASOTEC 5mg er vist nedenfor. Forekomstene representerer erfaringene fra både kontrollerte og ukontrollerte kliniske studier (maksimal behandlingsvarighet var ca. ett år). Hos placebobehandlede pasienter er forekomsten rapportert fra kontrollerte studier (maksimal behandlingsvarighet er 12 uker). Prosentandelen av pasienter med alvorlig hjertesvikt (NYHA klasse IV) var 29 prosent og 43 prosent for pasienter behandlet med henholdsvis VASOTEC 2,5 mg og placebo.
Andre alvorlige kliniske bivirkninger som har oppstått siden stoffet ble markedsført eller bivirkninger som opptrådte hos 0,5 til 1,0 prosent av pasienter med hypertensjon eller hjertesvikt i kliniske studier er oppført nedenfor, og innenfor hver kategori er de i rekkefølge etter avtagende alvorlighetsgrad.
Kroppen som en helhet
Anafylaktoide reaksjoner (se ADVARSLER , Anafylaktoide og muligens relaterte reaksjoner ).
Kardiovaskulær
Hjertestans; hjerteinfarkt eller cerebrovaskulær ulykke, muligens sekundært til overdreven hypotensjon hos høyrisikopasienter (se ADVARSLER , Hypotensjon ); lungeemboli og infarkt; Lungeødem; rytmeforstyrrelser inkludert atrietakykardi og bradykardi; atrieflimmer; hjertebank, Raynauds fenomen.
Fordøyelseskanal
Ileus, pankreatitt, leversvikt, hepatitt (hepatocellulær [påvist ved ny provokasjon] eller kolestatisk gulsott) (se ADVARSLER , Leversvikt ), melena, anoreksi, dyspepsi, forstoppelse, glossitt, stomatitt, munntørrhet.
Hematologisk
Sjeldne tilfeller av nøytropeni, trombocytopeni og benmargsdepresjon.
Muskuloskeletal
Muskel kramper.
Nervøs/psykiatrisk
Depresjon, forvirring, ataksi, somnolens, søvnløshet, nervøsitet, perifer nevropati (f.eks. parestesi, dysestesi), drømmeabnormitet.
Luftveiene
Bronkospasme, rhinoré, sår hals og heshet, astma, øvre luftveisinfeksjon, lungeinfiltrater, eosinofil pneumonitt.
Hud
Eksfoliativ dermatitt, giftig epidermal nekrolyse, Stevens-Johnsons syndrom, pemphigus, herpes zoster, erythema multiforme, urticaria, pruritus, alopecia, rødme, diaforese, lysfølsomhet.
Spesielle sanser
Tåkesyn, smaksendring, anosmi, tinnitus, konjunktivitt, tørre øyne, tårer.
Urogenital
Nyresvikt, oliguri, nedsatt nyrefunksjon (se FORHOLDSREGLER og DOSERING OG ADMINISTRASJON ), flankesmerter, gynekomasti, impotens.
Diverse
Det er rapportert om et symptomkompleks som kan omfatte noen eller alle av følgende: en positiv ANA, en forhøyet erytrocyttsedimenteringshastighet, artralgi/artritt, myalgi/myositt, feber, serositt, vaskulitt, leukocytose, eosinofili, fotosensitivitet, utslett og andre dermatologiske sykdommer manifestasjoner.
Angioødem
Angioødem er rapportert hos pasienter som får VASOTEC 2,5 mg, med en høyere forekomst hos svarte enn hos ikke-svarte pasienter. Angioødem assosiert med larynxødem kan være dødelig. Hvis det oppstår angioødem i ansikt, ekstremiteter, lepper, tunge, glottis og/eller strupehode, bør behandling med VASOTEC avbrytes og passende behandling settes i gang umiddelbart (se ADVARSLER ).
Hypotensjon
Hos hypertensive pasienter forekom hypotensjon hos 0,9 prosent og synkope hos 0,5 prosent av pasientene etter startdosen eller under forlenget behandling. Hypotensjon eller synkope var en årsak til seponering av behandlingen hos 0,1 prosent av hypertensive pasienter. Hos hjertesviktpasienter forekom hypotensjon hos 6,7 prosent og synkope hos 2,2 prosent av pasientene. Hypotensjon eller synkope var en årsak til seponering av behandlingen hos 1,9 prosent av pasientene med hjertesvikt (se ADVARSLER ).
Hoste
Se FORHOLDSREGLER , Hoste .
Pediatriske pasienter
Bivirkningsprofilen for pediatriske pasienter ser ut til å være lik den som er sett hos voksne pasienter.
Funn fra kliniske laboratorieprøver
Serum elektrolytter
Hyperkalemi (se FORHOLDSREGLER ), hyponatremi.
Kreatinin, Blod Urea Nitrogen
kontrollerte kliniske studier ble mindre økninger i blodurea-nitrogen og serumkreatinin, reversible ved seponering av behandlingen, observert hos omtrent 0,2 prosent av pasientene med essensiell hypertensjon behandlet med VASOTEC alene. Det er mer sannsynlig at økninger forekommer hos pasienter som samtidig får diuretika eller hos pasienter med nyrearteriestenose (se FORHOLDSREGLER ). Hos pasienter med hjertesvikt som også fikk diuretika med eller uten digitalis, ble økninger i blodureanitrogen eller serumkreatinin, vanligvis reversible ved seponering av VASOTEC 5 mg og/eller annen samtidig diuretikabehandling, observert hos omtrent 11 prosent av pasientene. Økning i blod urea nitrogen eller kreatinin var en årsak til seponering hos 1,2 prosent av pasientene.
Hematologi
Små reduksjoner i hemoglobin og hematokrit (gjennomsnittlig reduksjon på henholdsvis ca. 0,3 g prosent og 1,0 volumprosent) forekommer ofte hos pasienter med enten hypertensjon eller kongestiv hjertesvikt som behandles med VASOTEC 5 mg, men er sjelden av klinisk betydning med mindre en annen årsak til anemi eksisterer samtidig. I kliniske studier avbrøt mindre enn 0,1 prosent av pasientene behandlingen på grunn av anemi. Hemolytisk anemi, inkludert tilfeller av hemolyse hos pasienter med G6PD-mangel, er rapportert; en årsakssammenheng til enalapril kan ikke utelukkes.
Leverfunksjonstester
Forhøyelser av leverenzymer og/eller serumbilirubin har forekommet (se ADVARSLER , Leversvikt ).
For å rapportere MISTENTE BIVIRKNINGER, kontakt Valeant Pharmaceuticals North America LLC på 1-800-321-4576 eller FDA på 1-800-FDA-1088 eller www.fda.gov/medwatch.
NARKOTIKAHANDEL
Neprilysin-hemmere
Pasienter som samtidig tar neprilysinhemmere kan ha økt risiko for angioødem. (se ADVARSLER )
Dobbel blokade av Renin-Angiotensin-systemet (RAS)
Dobbel blokkering av RAS med angiotensinreseptorblokkere, ACE-hemmere eller aliskiren er assosiert med økt risiko for hypotensjon, hyperkalemi og endringer i nyrefunksjon (inkludert akutt nyresvikt) sammenlignet med monoterapi. De fleste pasienter som får kombinasjonen av to RAS-hemmere oppnår ingen ekstra fordel sammenlignet med monoterapi. Generelt, unngå kombinert bruk av RAS-hemmere. Overvåk blodtrykk, nyrefunksjon og elektrolytter nøye hos pasienter på VASOTEC 2,5 mg og andre midler som påvirker RAS.
Ikke administrer aliskiren samtidig med VASOTEC 5mg hos pasienter med diabetes. Unngå bruk av aliskiren med VASOTEC hos pasienter med nedsatt nyrefunksjon (GFR
Hypotensjon - Pasienter på vanndrivende terapi
Pasienter på diuretika og spesielt de som nylig har startet behandling med diuretika, kan av og til oppleve en overdreven reduksjon av blodtrykket etter oppstart av behandling med enalapril. Muligheten for hypotensive effekter med enalapril kan minimeres ved enten å seponere diuretika eller øke saltinntaket før oppstart av behandling med enalapril. Hvis det er nødvendig å fortsette med diuretika, gis nøye medisinsk tilsyn etter startdosen i minst to timer og til blodtrykket har stabilisert seg i minst en ekstra time (se ADVARSLER og DOSERING OG ADMINISTRASJON ).
Agenter som forårsaker reninfrigjøring
Den antihypertensive effekten av VASOTEC 10mg forsterkes av antihypertensive midler som forårsaker frigjøring av renin (f.eks. diuretika).
Ikke-steroide antiinflammatoriske midler inkludert selektive cyklooksygenase-2-hemmere (COX-2-hemmere)
Hos eldre pasienter, volumdepletert (inkludert de som får diuretikabehandling), eller med nedsatt nyrefunksjon, kan samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med ACE-hemmere, inkludert enalapril, føre til forverring av nyrefunksjonen, inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får enalapril- og NSAID-behandling.
I en klinisk farmakologisk studie ble indometacin eller sulindak administrert til hypertensive pasienter som fikk VASOTEC. I denne studien var det ingen tegn på at den antihypertensive virkningen av VASOTEC ble sløvet. Rapporter tyder imidlertid på at NSAIDs kan redusere den antihypertensive effekten av ACE-hemmere.
Andre kardiovaskulære midler
VASOTEC 10mg har blitt brukt samtidig med beta-adrenerge blokkere, metyldopa, nitrater, kalsiumblokkerende midler, hydralazin, prazosin og digoksin uten bevis for klinisk signifikante uønskede interaksjoner.
Midler som øker serumkalium
VASOTEC demper kaliumtap forårsaket av diuretika av tiazidtypen. Kaliumsparende diuretika (f.eks. spironolakton, triamteren eller amilorid), kaliumtilskudd eller kaliumholdige salterstatninger kan føre til betydelig økning i serumkalium. Derfor, hvis samtidig bruk av disse midlene er indisert på grunn av påvist hypokalemi, bør de brukes med forsiktighet og med hyppig overvåking av serumkalium. Kaliumsparende midler skal generelt ikke brukes hos pasienter med hjertesvikt som får VASOTEC.
Litium
Litiumtoksisitet er rapportert hos pasienter som får litium samtidig med legemidler som forårsaker eliminering av natrium, inkludert ACE-hemmere. Noen få tilfeller av litiumtoksisitet er rapportert hos pasienter som samtidig fikk VASOTEC og litium og var reversible ved seponering av begge legemidlene. Det anbefales at serumlitiumnivåer overvåkes ofte hvis enalapril administreres samtidig med litium.
Gull
Nitritoidreaksjoner (symptomer inkluderer rødme i ansiktet, kvalme, oppkast og hypotensjon) har i sjeldne tilfeller blitt rapportert hos pasienter på behandling med injiserbart gull (natriumaurotiomalat) og samtidig behandling med ACE-hemmere inkludert VASOTEC.
mTOR (pattedyr Target Of Rapamycin)-hemmere
Pasienter som får samtidig behandling med ACE-hemmer og mTOR-hemmer (f.eks. temsirolimus, sirolimus, everolimus) kan ha økt risiko for angioødem (se ADVARSLER ).
ADVARSLER
Anafylaktoide og muligens relaterte reaksjoner
Antagelig fordi angiotensin-konverterende enzymhemmere påvirker metabolismen av eikosanoider og polypeptider, inkludert endogent bradykinin, kan pasienter som får ACE-hemmere (inkludert VASOTEC) bli utsatt for en rekke bivirkninger, noen av dem alvorlige.
Hode og nakke angioødem
Angioødem i ansikt, ekstremiteter, lepper, tunge, glottis og/eller strupehode er rapportert hos pasienter behandlet med angiotensinkonverterende enzymhemmere, inkludert VASOTEC. Dette kan oppstå når som helst under behandlingen. I slike tilfeller bør VASOTEC 2,5 mg umiddelbart seponeres og passende behandling og overvåking skal gis inntil fullstendig og vedvarende opphør av tegn og symptomer har funnet sted. I tilfeller hvor hevelse har vært begrenset til ansikt og lepper, har tilstanden generelt gått over uten behandling, selv om antihistaminer har vært nyttige for å lindre symptomer. Angioødem assosiert med larynxødem kan være dødelig. Der det er involvering av tungen, glottis eller strupehodet, som sannsynligvis vil forårsake luftveisobstruksjon, bør passende behandling, f.eks. subkutan epinefrinoppløsning 1:1000 (0,3 ml til 0,5 ml) og/eller nødvendige tiltak for å sikre frie luftveier, skje umiddelbart. sørget for (se BIVIRKNINGER ).
Pasienter som får samtidig administrering av ACE-hemmer og mTOR (pattedyrmål for rapamycin)-hemmer (f.eks. temsirolimus, sirolimus, everolimus) eller en neprilysinhemmer kan ha økt risiko for angioødem (se FORHOLDSREGLER ).
Intestinalt angioødem
Intestinalt angioødem er rapportert hos pasienter behandlet med ACE-hemmere. Disse pasientene fikk magesmerter (med eller uten kvalme eller oppkast); i noen tilfeller var det ingen tidligere angioødem i ansiktet, og C-1-esterasenivåene var normale. Angioødem ble diagnostisert ved prosedyrer inkludert abdominal CT-skanning eller ultralyd, eller ved operasjon, og symptomene forsvant etter seponering av ACE-hemmeren. Intestinalt angioødem bør inkluderes i differensialdiagnosen for pasienter på ACE-hemmere med magesmerter.
Pasienter med angioødem i anamnesen som ikke er relatert til ACE-hemmerbehandling kan ha økt risiko for angioødem mens de får en ACE-hemmer (se også INDIKASJONER OG BRUK og KONTRAINDIKASJONER ).
Anafylaktoide reaksjoner under desensibilisering
To pasienter som gjennomgikk desensibiliserende behandling med hymenoptera-gift mens de fikk ACE-hemmere, fikk livstruende anafylaktoide reaksjoner. Hos de samme pasientene ble disse reaksjonene unngått når ACE-hemmere ble midlertidig holdt tilbake, men de dukket opp igjen ved utilsiktet ny behandling.
Anafylaktoide reaksjoner under membraneksponering
Anafylaktoide reaksjoner er rapportert hos pasienter dialysert med høyfluxmembraner og behandlet samtidig med en ACE-hemmer. Anafylaktoide reaksjoner er også rapportert hos pasienter som gjennomgår lipoproteinaferese med lav tetthet med dekstransulfatabsorpsjon.
Hypotensjon
Overdreven hypotensjon er sjelden hos ukompliserte hypertensive pasienter som behandles med VASOTEC 5 mg alene. Pasienter med hjertesvikt gitt VASOTEC har vanligvis en viss reduksjon i blodtrykket, spesielt med den første dosen, men seponering av behandlingen for fortsatt symptomatisk hypotensjon er vanligvis ikke nødvendig når doseringsinstruksjonene følges; Det bør utvises forsiktighet ved oppstart av behandling (se DOSERING OG ADMINISTRASJON ). Pasienter med risiko for overdreven hypotensjon, noen ganger assosiert med oliguri og/eller progressiv azotemi, og sjelden med akutt nyresvikt og/eller død, inkluderer de med følgende tilstander eller karakteristika: hjertesvikt, hyponatremi, høydose diuretikabehandling, nylig intensiv diurese eller økning i diuretikadose, nyredialyse eller alvorlig volum- og/eller saltdeplesjon av enhver etiologi. Det kan være tilrådelig å eliminere diuretikaet (unntatt hos pasienter med hjertesvikt), redusere diuretikadosen eller øke saltinntaket forsiktig før oppstart av behandling med VASOTEC 10 mg hos pasienter med risiko for overdreven hypotensjon som tåler slike justeringer (se NARKOTIKAHANDEL og BIVIRKNINGER ). Hos pasienter med risiko for overdreven hypotensjon, bør behandlingen startes under svært nøye medisinsk tilsyn, og slike pasienter bør følges nøye de første to ukene av behandlingen og hver gang dosen av enalapril og/eller diuretika økes. Lignende hensyn kan gjelde for pasienter med iskemisk hjerte- eller cerebrovaskulær sykdom, hvor et for høyt blodtrykksfall kan resultere i hjerteinfarkt eller cerebrovaskulær ulykke.
Hvis overdreven hypotensjon oppstår, bør pasienten plasseres i ryggleie og om nødvendig få en intravenøs infusjon av vanlig saltvann. En forbigående hypotensiv respons er ikke en kontraindikasjon for ytterligere doser av VASOTEC 2,5 mg, som vanligvis kan gis uten problemer når blodtrykket har stabilisert seg. Hvis symptomatisk hypotensjon utvikles, kan en dosereduksjon eller seponering av VASOTEC eller samtidig diuretika være nødvendig.
Nøytropeni/Agranulocytose
En annen angiotensinkonverterende enzymhemmer, kaptopril, har vist seg å forårsake agranulocytose og benmargsdepresjon, sjelden hos ukompliserte pasienter, men oftere hos pasienter med nedsatt nyrefunksjon, spesielt hvis de også har en kollagen vaskulær sykdom. Tilgjengelige data fra kliniske studier med enalapril er utilstrekkelige til å vise at enalapril ikke forårsaker agranulocytose i tilsvarende forekomst. Markedsføringserfaring har avdekket tilfeller av nøytropeni eller agranulocytose der en årsakssammenheng med enalapril ikke kan utelukkes. Periodisk overvåking av antall hvite blodlegemer hos pasienter med kollagen vaskulær sykdom og nyresykdom bør vurderes.
Leversvikt
sjeldne tilfeller har ACE-hemmere vært assosiert med et syndrom som starter med kolestatisk gulsott og utvikler seg til fulminant levernekrose og (noen ganger) død. Mekanismen for dette syndromet er ikke forstått. Pasienter som får ACE-hemmere og som utvikler gulsott eller markerte økninger i leverenzymer bør seponere ACE-hemmeren og få passende medisinsk oppfølging.
Fostertoksisitet
Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer VASOTEC 10mg så snart som mulig. Disse uønskede utfallene er vanligvis forbundet med bruk av disse stoffene i andre og tredje trimester av svangerskapet. De fleste epidemiologiske studier som undersøker føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester har ikke skilt medisiner som påvirker renin-angiotensin-systemet fra andre antihypertensiva. Riktig behandling av mors hypertensjon under graviditet er viktig for å optimalisere resultatene for både mor og foster.
det uvanlige tilfellet at det ikke er noe passende alternativ til behandling med legemidler som påvirker reninangiotensinsystemet for en bestemt pasient, informere moren om den potensielle risikoen for fosteret. Utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Hvis oligohydramnios observeres, seponer VASOTEC, med mindre det anses som livreddende for moren. Fostertesting kan være aktuelt, basert på graviditetsuken. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade. Følg nøye med spedbarn med historie om in utero eksponering for VASOTEC for hypotensjon, oliguri og hyperkalemi (se FORHOLDSREGLER , Pediatrisk bruk ).
Ingen teratogene effekter av enalapril ble sett i studier av gravide rotter og kaniner. På basis av kroppsoverflate var dosene som ble brukt henholdsvis 57 ganger og 12 ganger den maksimale anbefalte daglige dosen for mennesker (MRHDD).
FORHOLDSREGLER
Generell
Aortastenose/hypertrofisk kardiomyopati
Som med alle vasodilatorer, bør enalapril gis med forsiktighet til pasienter med obstruksjon i utløpskanalen til venstre ventrikkel.
Nedsatt nyrefunksjon
Som en konsekvens av hemming av renin-angiotensin-aldosteron-systemet, kan endringer i nyrefunksjonen forventes hos følsomme personer. Hos pasienter med alvorlig hjertesvikt hvis nyrefunksjon kan avhenge av aktiviteten til renin-angiotensin-aldosteron-systemet, kan behandling med angiotensinkonverterende enzymhemmere, inkludert VASOTEC, være assosiert med oliguri og/eller progressiv azotemi og i sjeldne tilfeller med akutt nyresvikt og /eller død (se NARKOTIKAHANDEL ).
I kliniske studier hos hypertensive pasienter med unilateral eller bilateral nyrearteriestenose, ble økninger i blodurea-nitrogen og serumkreatinin observert hos 20 prosent av pasientene. Disse økningene var nesten alltid reversible ved seponering av enalapril og/eller diuretikabehandling. Hos slike pasienter bør nyrefunksjonen overvåkes i løpet av de første ukene av behandlingen.
Noen pasienter med hypertensjon eller hjertesvikt uten tilsynelatende eksisterende vaskulær nyresykdom har utviklet økninger i blodurea og serumkreatinin, vanligvis mindre og forbigående, spesielt når VASOTEC er gitt samtidig med et vanndrivende middel. Dette er mer sannsynlig hos pasienter med tidligere nedsatt nyrefunksjon. Dosereduksjon og/eller seponering av diuretika og/eller VASOTEC 5 mg kan være nødvendig.
Evaluering av pasienter med hypertensjon eller hjertesvikt bør alltid inkludere vurdering av nyrefunksjon (se DOSERING OG ADMINISTRASJON ).
Hyperkalemi
Forhøyet serumkalium (større enn 5,7 mEq/L) ble observert hos omtrent én prosent av hypertensive pasienter i kliniske studier. I de fleste tilfeller var dette isolerte verdier som forsvant til tross for fortsatt behandling. Hyperkalemi var en årsak til seponering av behandlingen hos 0,28 prosent av hypertensive pasienter. I kliniske studier med hjertesvikt ble hyperkalemi observert hos 3,8 prosent av pasientene, men var ikke en årsak til seponering.
Risikofaktorer for utvikling av hyperkalemi inkluderer nyresvikt, diabetes mellitus og samtidig bruk av kaliumsparende diuretika, kaliumtilskudd og/eller kaliumholdige salterstatninger, som bør brukes med forsiktighet, hvis i det hele tatt, sammen med VASOTEC (se NARKOTIKAHANDEL ).
Hoste
Antagelig på grunn av hemming av nedbrytningen av endogent bradykinin, har vedvarende ikke-produktiv hoste blitt rapportert med alle ACE-hemmere, som alltid forsvinner etter seponering av behandlingen. ACE-hemmerindusert hoste bør vurderes ved differensialdiagnose av hoste.
Kirurgi/anestesi
Hos pasienter som gjennomgår større kirurgi eller under anestesi med midler som produserer hypotensjon, kan enalapril blokkere angiotensin II-dannelse sekundært til kompenserende reninfrigjøring. Hvis hypotensjon oppstår og anses å skyldes denne mekanismen, kan den korrigeres ved volumekspansjon.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Det var ingen tegn på en tumorigen effekt når enalapril ble administrert i 106 uker til hann- og hunnrotter i doser opp til 90 mg/kg/dag eller i 94 uker til hann- og hunnmus i doser opp til 90 og 180 mg/kg/ dag, henholdsvis. Disse dosene er 26 ganger (hos rotter og hunnmus) og 13 ganger (i hannmus) den maksimale anbefalte daglige dosen for mennesker (MRHDD) sammenlignet på basis av kroppsoverflate.
Verken enalaprilmaleat eller den aktive disyren var mutagent i Ames mikrobielle mutagentest med eller uten metabolsk aktivering. Enalapril var også negativ i følgende genotoksisitetsstudier: rec-assay, revers mutasjonsanalyse med E. coli, søsterkromatidutveksling med dyrkede pattedyrceller og mikronukleustesten med mus, samt i en in vivo cytogen studie med musebenmarg .
Det var ingen negative effekter på reproduksjonsevnen til hann- og hunnrotter behandlet med opptil 90 mg/kg/dag enalapril (26 ganger MRHDD sammenlignet med kroppsoverflate).
Svangerskap
Ammende mødre
Enalapril og enalaprilat er påvist i morsmelk hos mennesker. På grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn fra enalapril, bør det tas en beslutning om å avbryte ammingen eller å seponere VASOTEC 2,5 mg, tatt i betraktning stoffets betydning for moren.
Pediatrisk bruk
Nyfødte med en historie med in utero eksponering for VASOTEC
Hvis oliguri eller hypotensjon oppstår, må du rette oppmerksomheten mot støtte av blodtrykk og nyreperfusjon. Utvekslingstransfusjoner eller dialyse kan være nødvendig som et middel for å reversere hypotensjon og/eller erstatte forstyrret nyrefunksjon. Enalapril, som krysser placenta, har blitt fjernet fra neonatal sirkulasjon ved peritonealdialyse med en viss klinisk fordel, og kan teoretisk fjernes ved byttetransfusjon, selv om det ikke er erfaring med sistnevnte prosedyre.
Antihypertensive effekter av VASOTEC er etablert hos hypertensive pediatriske pasienter i alderen 1 måned til 16 år. Bruk av VASOTEC 5 mg i disse aldersgruppene støttes av bevis fra tilstrekkelige og godt kontrollerte studier av VASOTEC 2,5 mg hos pediatriske og voksne pasienter, samt av publisert litteratur hos pediatriske pasienter (se KLINISK FARMAKOLOGI , Klinisk farmakologi hos pediatriske pasienter og DOSERING OG ADMINISTRASJON ).
VASOTEC anbefales ikke til nyfødte og pediatriske pasienter med glomerulær filtrasjonshastighet
OVERDOSE
Begrensede data er tilgjengelige med hensyn til overdosering hos mennesker.
Enkeltdoser av enalapril over 1 000 mg/kg og ≥ 1 775 mg/kg var assosiert med dødelighet hos henholdsvis mus og rotter.
Den mest sannsynlige manifestasjonen av overdosering vil være hypotensjon, hvor den vanlige behandlingen vil være intravenøs infusjon av normal saltvannsoppløsning.
Enalaprilat kan fjernes fra generell sirkulasjon ved hemodialyse og har blitt fjernet fra neonatal sirkulasjon ved peritonealdialyse (se ADVARSLER , Anafylaktoide reaksjoner under membraneksponering ).
KONTRAINDIKASJONER
VASOTEC 2,5 mg er kontraindisert hos pasienter som er overfølsomme overfor dette produktet og hos pasienter med angioødem i anamnesen relatert til tidligere behandling med en angiotensinkonverterende enzymhemmer og hos pasienter med arvelig eller idiopatisk angioødem.
Ikke gi aliskiren samtidig med VASOTEC hos pasienter med diabetes (se NARKOTIKAHANDEL ).
VASOTEC 10 mg er kontraindisert i kombinasjon med en neprilysinhemmer (f.eks. sacubitril). Ikke administrer VASOTEC innen 36 timer etter bytte til eller fra sacubitril/valsartan, en neprilysinhemmer (se ADVARSLER ).
KLINISK FARMAKOLOGI
Virkningsmekanismen
Enalapril, etter hydrolyse til enalaprilat, hemmer angiotensin-konverterende enzym (ACE) hos mennesker og dyr. ACE er en peptidyldipeptidase som katalyserer omdannelsen av angiotensin I til vasokonstriktorstoffet, angiotensin II. Angiotensin II stimulerer også aldosteronsekresjon av binyrebarken. De gunstige effektene av enalapril ved hypertensjon og hjertesvikt ser ut til først og fremst å skyldes undertrykkelse av renin-angiotensin-aldosteronsystemet. Hemming av ACE resulterer i redusert plasmaangiotensin II, noe som fører til redusert vasopressoraktivitet og til redusert aldosteronsekresjon. Selv om den sistnevnte reduksjonen er liten, resulterer den i små økninger av serumkalium. Hos hypertensive pasienter behandlet med VASOTEC alene i opptil 48 uker, ble gjennomsnittlig økning i serumkalium på ca. 0,2 mEq/L observert. Hos pasienter behandlet med VASOTEC 5 mg pluss et tiaziddiuretikum, var det praktisk talt ingen endring i serumkalium (se FORHOLDSREGLER ). Fjerning av angiotensin II negativ tilbakemelding på reninsekresjon fører til økt plasmareninaktivitet.
ACE er identisk med kininase, et enzym som bryter ned bradykinin. Hvorvidt økte nivåer av bradykinin, et potent vasodepressorpeptid, spiller en rolle i den terapeutiske effekten av VASOTEC gjenstår å avklare.
Mens mekanismen som VASOTEC 5mg senker blodtrykket gjennom, antas å primært være undertrykkelse av renin-angiotensin-aldosteronsystemet, er VASOTEC 10mg antihypertensiv selv hos pasienter med lav-reninhypertensjon. Selv om VASOTEC var antihypertensiv i alle undersøkte raser, hadde svarte hypertensive pasienter (vanligvis en lav-renin hypertensiv populasjon) en lavere gjennomsnittlig respons på enalapril monoterapi enn ikke-svarte pasienter.
Farmakokinetikk og metabolisme
Etter oral administrering av VASOTEC inntreffer maksimale serumkonsentrasjoner av enalapril innen ca. en time. Basert på urinrestitusjon er absorpsjonsgraden av enalapril omtrent 60 prosent. Absorpsjonen av enalapril påvirkes ikke av tilstedeværelsen av mat i mage-tarmkanalen. Etter absorpsjon hydrolyseres enalapril til enalaprilat, som er en kraftigere angiotensinkonverterende enzymhemmer enn enalapril; enalaprilat absorberes dårlig når det administreres oralt. Maksimal serumkonsentrasjon av enalaprilat oppstår tre til fire timer etter en oral dose av enalaprilmaleat. Utskillelse av VASOTEC er primært renal. Omtrent 94 prosent av dosen gjenvinnes i urinen og avføringen som enalaprilat eller enalapril. Hovedkomponentene i urinen er enalaprilat, som utgjør omtrent 40 prosent av dosen, og intakt enalapril. Det er ingen tegn på metabolitter av enalapril, annet enn enalaprilat.
Serumkonsentrasjonsprofilen til enalaprilat viser en forlenget terminalfase, som tilsynelatende representerer en liten del av den administrerte dosen som er bundet til ACE. Mengden bundet øker ikke med dosen, noe som indikerer et mettbart bindingssted. Den effektive halveringstiden for akkumulering av enalaprilat etter gjentatte doser av enalaprilmaleat er 11 timer. Disponeringen av enalapril og enalaprilat hos pasienter med nyreinsuffisiens er lik den hos pasienter med normal nyrefunksjon inntil den glomerulære filtrasjonshastigheten er 30 ml/min eller mindre. Med glomerulær filtrasjonshastighet ≤ 30 ml/min øker topp- og bunnnivåer av enalaprilat, tiden til toppkonsentrasjonen øker og tiden til steady state kan bli forsinket. Den effektive halveringstiden for enalaprilat etter gjentatte doser av enalaprilmaleat forlenges ved dette nivået av nyresvikt (se DOSERING OG ADMINISTRASJON ). Enalaprilat er dialyserbart med en hastighet på 62 ml/min.
Studier på hunder indikerer at enalapril krysser blod-hjerne-barrieren dårlig, om i det hele tatt; enalaprilat kommer ikke inn i hjernen. Flere doser av enalaprilmaleat hos rotter resulterer ikke i akkumulering i noe vev. Melk fra diegivende rotter inneholder radioaktivitet etter administrering av 14C-enalaprilmaleat. Radioaktivitet ble funnet å krysse placenta etter administrering av merket medikament til gravide hamstere.
Farmakodynamikk og kliniske effekter
Hypertensjon
Administrering av VASOTEC til pasienter med hypertensjon av alvorlighetsgrad fra mild til alvorlig resulterer i en reduksjon av både liggende og stående blodtrykk vanligvis uten ortostatisk komponent. Symptomatisk postural hypotensjon er derfor sjelden, selv om det kan forventes hos pasienter med volumfattige (se ADVARSLER ).
Hos de fleste studerte pasienter, etter oral administrering av en enkeltdose enalapril, ble antihypertensiv aktivitet sett etter én time med maksimal reduksjon av blodtrykket oppnådd med fire til seks timer.
Ved anbefalte doser har den antihypertensive effekten opprettholdt i minst 24 timer. Hos noen pasienter kan effekten avta mot slutten av doseringsintervallet (se DOSERING OG ADMINISTRASJON ).
Hos noen pasienter kan oppnåelse av optimal blodtrykksreduksjon kreve flere ukers behandling.
De antihypertensive effektene av VASOTEC har fortsatt under langtidsbehandling. Brå seponering av VASOTEC 10 mg har ikke vært assosiert med en rask økning i blodtrykket.
hemodynamiske studier hos pasienter med essensiell hypertensjon ble blodtrykksreduksjon ledsaget av en reduksjon i perifer arteriell motstand med en økning i hjertevolum og liten eller ingen endring i hjertefrekvens. Etter administrering av VASOTEC er det en økning i renal blodstrøm; glomerulær filtrasjonshastighet er vanligvis uendret. Effektene ser ut til å være like hos pasienter med renovaskulær hypertensjon.
Når det gis sammen med diuretika av tiazidtypen, er de blodtrykkssenkende effektene av VASOTEC 5 mg tilnærmet additive.
I en klinisk farmakologisk studie ble indometacin eller sulindak administrert til hypertensive pasienter som fikk VASOTEC. I denne studien var det ingen tegn på at den antihypertensive virkningen av VASOTEC ble sløvet (se NARKOTIKAHANDEL ).
Hjertefeil
studier med pasienter behandlet med digitalis og diuretika, resulterte behandling med enalapril i redusert systemisk vaskulær motstand, blodtrykk, pulmonært kapillært kiletrykk og hjertestørrelse, og økt hjertevolum og treningstoleranse. Hjertefrekvensen var uendret eller svakt redusert, og gjennomsnittlig ejeksjonsfraksjon var uendret eller økt. Det var en gunstig effekt på alvorlighetsgraden av hjertesvikt målt ved New York Heart Association (NYHA) klassifisering og på symptomer på dyspné og tretthet. Hemodynamiske effekter ble observert etter den første dosen og så ut til å opprettholdes i ukontrollerte studier som varte så lenge som fire måneder. Effekter på treningstoleranse, hjertestørrelse og alvorlighetsgrad og symptomer på hjertesvikt ble observert i placebokontrollerte studier som varte fra åtte uker til over ett år.
Hjertesvikt, dødelighetsforsøk
en multisenter, placebokontrollert klinisk studie ble 2 569 pasienter med alle grader av symptomatisk hjertesvikt og ejeksjonsfraksjon ≤ 35 prosent randomisert til placebo eller enalapril og fulgt i opptil 55 måneder (SOLVD-Treatment). Bruk av enalapril var assosiert med 11 prosent reduksjon i dødelighet av alle årsaker og 30 prosent reduksjon i sykehusinnleggelse for hjertesvikt. Sykdommer som ekskluderte pasienter fra å delta i studien inkluderte alvorlig stabil angina (>2 anfall/dag), hemodynamisk signifikant klaffe- eller utløpskanalobstruksjon, nyresvikt (kreatinin >2,5 mg/dL), cerebrovaskulær sykdom (f.eks. signifikant carotisarteriesykdom) , avansert lungesykdom, maligniteter, aktiv myokarditt og konstriktiv perikarditt. Dødelighetsfordelen forbundet med enalapril ser ikke ut til å avhenge av at digitalis er tilstede.
En andre multisenterstudie brukte SOLVD-protokollen for studier av asymptomatiske eller minimalt symptomatiske pasienter. Pasienter med SOLVD-prevensjon, som hadde venstre ventrikkel ejeksjonsfraksjon ≤ 35 % og ingen historie med symptomatisk hjertesvikt, ble randomisert til placebo (n=2117) eller enalapril (n=2111) og fulgt i opptil 5 år. Flertallet av pasientene i SOLVD-prevensjonsstudien hadde en historie med iskemisk hjertesykdom. En historie med hjerteinfarkt var til stede hos 80 prosent av pasientene, nåværende angina pectoris hos 34 prosent, og en historie med hypertensjon hos 37 prosent. Ingen statistisk signifikant dødelighetseffekt ble påvist i denne populasjonen. Enalapril-behandlede personer hadde 32 % færre første sykehusinnleggelser for hjertesvikt, og 32 % færre totale hjertesviktinnleggelser. Sammenlignet med placebo utviklet 32 prosent færre pasienter som fikk enalapril symptomer på åpenbar hjertesvikt. Sykehusinnleggelser av kardiovaskulære årsaker ble også redusert. Det var en ubetydelig reduksjon i sykehusinnleggelser uansett årsak i enalapril-behandlingsgruppen (hhv. for enalapril vs. placebo, 1166 vs. 1201 første sykehusinnleggelser, 2649 vs. 2840 totale sykehusinnleggelser), selv om studien ikke var egnet til å se etter en slik effekt.
SOLVD-prevensjonsstudien var ikke designet for å avgjøre om behandling av asymptomatiske pasienter med lav ejeksjonsfraksjon ville være bedre enn tettere oppfølging og bruk av enalapril med hensyn til å forhindre sykehusinnleggelse ved de tidligste tegn på hjertesvikt. Imidlertid, under betingelsene for oppfølging i SOLVD-forebyggende studie (hver 4. måned ved studieklinikken; personlig lege ved behov), hadde 68 % av pasientene på placebo som ble innlagt på sykehus for hjertesvikt ingen tidligere symptomer som ville ha signaliserte oppstart av behandling.
SOLVD-prevensjonsstudien var heller ikke designet for å vise om enalapril modifiserte progresjonen av underliggende hjertesykdom.
I et annet multisenter, placebokontrollert studie (CONSENSUS) begrenset til pasienter med kongestiv hjertesvikt i NYHA klasse IV og radiografisk tegn på kardiomegali, var bruk av enalapril assosiert med forbedret overlevelse. Resultatene er vist i følgende tabell.
både CONSENSUS- og SOLVD-Treatment-studier fikk pasienter også vanligvis digitalis, diuretika eller begge deler.
Klinisk farmakologi hos pediatriske pasienter
En farmakokinetisk studie med flere doser ble utført på 40 hypertensive mannlige og kvinnelige pediatriske pasienter i alderen 2 måneder til ≤ 16 år etter daglig oral administrering av 0,07 til 0,14 mg/kg enalaprilmaleat. Ved steady state var gjennomsnittlig effektiv halveringstid for akkumulering av enalaprilat 14 timer, og gjennomsnittlig uringjenvinning av totalt enalapril og enalaprilat i løpet av 24 timer var 68 % av administrert dose. Konvertering av enalapril til enalaprilat var i området 63-76 %. De samlede resultatene av denne studien indikerer at farmakokinetikken til enalapril hos hypertensive barn i alderen 2 måneder til ≤ 16 år er konsistente på tvers av de studerte aldersgruppene og i samsvar med farmakokinetiske historiske data hos friske voksne.
en klinisk studie som involverte 110 hypertensive pediatriske pasienter i alderen 6 til 16 år, fikk pasienter som veide
I de ovennevnte pediatriske studiene ble enalaprilmaleat gitt som tabletter av VASOTEC og for de barn og spedbarn som ikke klarte å svelge tabletter eller som trengte en lavere dose enn det som er tilgjengelig i tablettform, ble enalapril administrert i en suspensjonsformulering (se DOSERING OG ADMINISTRASJON , Forberedelse av suspensjon ).
PASIENTINFORMASJON
Angioødem
Angioødem, inkludert larynxødem, kan oppstå når som helst under behandling med angiotensinkonverterende enzymhemmere, inkludert enalapril. Pasienter bør informeres og fortelles om umiddelbart å rapportere alle tegn eller symptomer som tyder på angioødem (hevelse i ansikt, ekstremiteter, øyne, lepper, tunge, vanskeligheter med å svelge eller puste) og ikke ta mer medikament før de har rådført seg med den forskrivende legen.
Hypotensjon
Pasienter bør advares om å rapportere svimmelhet, spesielt i løpet av de første dagene av behandlingen. Hvis faktisk synkope oppstår, bør pasientene få beskjed om å seponere medikamentet til de har konsultert den forskrivende legen. Alle pasienter bør advares om at overdreven svette og dehydrering kan føre til et for høyt blodtrykksfall på grunn av reduksjon i væskevolum. Andre årsaker til volummangel som oppkast eller diaré kan også føre til blodtrykksfall; Pasienter bør rådes til å konsultere legen.
Hyperkalemi
Pasienter bør fortelles om ikke å bruke salterstatninger som inneholder kalium uten å konsultere legen sin.
Nøytropeni
Pasienter bør få beskjed om å rapportere omgående enhver indikasjon på infeksjon (f.eks. sår hals, feber) som kan være tegn på nøytropeni.
Svangerskap
Kvinnelige pasienter i fertil alder bør informeres om konsekvensene av eksponering for VASOTEC under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Pasienter bør bes om å rapportere graviditet til legen så snart som mulig.
MERK: Som med mange andre legemidler, er visse råd til pasienter som behandles med enalapril berettiget. Denne informasjonen er ment å hjelpe til med sikker og effektiv bruk av denne medisinen. Det er ikke en avsløring av alle mulige negative eller tiltenkte effekter.
