Avapro 150mg, 300mg Irbesartan Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Avapro 300mg og hvordan brukes det?
Avapro 300mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på høyt blodtrykk (hypertensjon), nervesmerter forårsaket av type 2-diabetes. Avapro kan brukes alene eller sammen med andre medisiner.
Avapro 300mg tilhører en klasse med legemidler ARB.
Det er ikke kjent om Avapro 150mg er trygt og effektivt hos barn under 6 år.
Hva er de mulige bivirkningene av Avapro 300mg?
Avapro kan forårsake alvorlige bivirkninger, inkludert:
- . uforklarlige muskelsmerter, . ømhet eller svakhet, . feber, . uvanlig tretthet, . mørk farget urin, . svimmelhet, . lite eller ingen vannlating, . opphovning, . rask vektøkning, . forvirring, . tap av Appetit, . oppkast, og . smerter i siden eller korsryggen
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Avapro inkluderer:
- . diaré, . halsbrann, . urolig mage, og . trøtt følelse
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Avapro. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
- . Når graviditet oppdages, seponer AVAPRO så snart som mulig. . Legemidler som virker direkte på renin-angiotenene i systemet kan forårsake skade og død for det utviklende fosteret [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
AVAPRO (irbesartan) er en angiotensin II-reseptor (AT1 subtype) antagonist.
Irbesartan er en ikke-peptidforbindelse, kjemisk beskrevet som en 2-butyl-3-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]-1,3-diazaspiro[4.4]non-1-en-4 -en.
Dens empiriske formel er C25H28N6O, og strukturformelen:
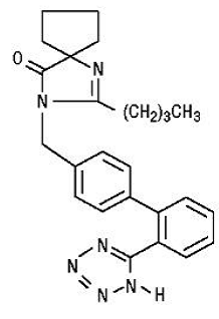
Irbesartan er et hvitt til off-white krystallinsk pulver med en molekylvekt på 428,5. Det er en upolar forbindelse med en fordelingskoeffisient (oktanol/vann) på 10,1 ved pH på 7,4. Irbesartan er lett løselig i alkohol og metylenklorid og praktisk talt uløselig i vann.
AVAPRO er tilgjengelig for oral administrering i tabletter uten skår som inneholder 75 mg, 150 mg eller 300 mg irbesartan. Inaktive ingredienser inkluderer: laktose, mikrokrystallinsk cellulose, pregelatinisert stivelse, kroskarmellosenatrium, poloxamer 188, silisiumdioksid og magnesiumstearat.
INDIKASJONER
Hypertensjon
AVAPRO® er indisert for behandling av hypertensjon, for å senke blodtrykket. Senking av blodtrykket reduserer risikoen for fatale og ikke-dødelige kardiovaskulære (CV) hendelser, primært hjerneslag og hjerteinfarkt. Disse fordelene har blitt sett i kontrollerte studier av antihypertensiva fra en lang rekke farmakologiske klasser, inkludert dette legemidlet.
Kontroll av høyt blodtrykk bør være en del av omfattende kardiovaskulær risikostyring, inkludert, etter behov, lipidkontroll, diabetesbehandling, antitrombotisk terapi, røykeslutt, trening og begrenset natriuminntak. Mange pasienter vil kreve mer enn 1 medikament for å oppnå blodtrykksmål. For spesifikke råd om mål og ledelse, se publiserte retningslinjer, for eksempel de fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Tallrike antihypertensiva, fra en rekke farmakologiske klasser og med forskjellige virkningsmekanismer, har i randomiserte kontrollerte studier vist seg å redusere kardiovaskulær sykelighet og dødelighet, og det kan konkluderes med at det er blodtrykksreduksjon, og ikke noen annen farmakologisk egenskap av stoffene, som i stor grad er ansvarlig for disse fordelene. Den største og mest konsistente fordelen for kardiovaskulær utfall har vært en reduksjon i risikoen for hjerneslag, men reduksjoner i hjerteinfarkt og kardiovaskulær dødelighet har også blitt sett regelmessig.
Forhøyet systolisk eller diastolisk trykk forårsaker økt kardiovaskulær risiko, og den absolutte risikoøkningen per mmHg er større ved høyere blodtrykk, slik at selv beskjedne reduksjoner av alvorlig hypertensjon kan gi betydelig fordel. Relativ risikoreduksjon fra blodtrykksreduksjon er lik på tvers av populasjoner med varierende absolutt risiko, så den absolutte fordelen er større hos pasienter som har høyere risiko uavhengig av deres hypertensjon (for eksempel pasienter med diabetes eller hyperlipidemi), og slike pasienter kan forventes å dra nytte av mer aggressiv behandling til et lavere blodtrykksmål.
Noen antihypertensiva har mindre blodtrykkseffekter (som monoterapi) hos svarte pasienter, og mange antihypertensiva har ytterligere godkjente indikasjoner og effekter (f.eks. på angina, hjertesvikt eller diabetisk nyresykdom). Disse betraktningene kan lede valg av terapi.
AVAPRO 300 mg kan brukes alene eller i kombinasjon med andre antihypertensiva.
Nefropati hos type 2 diabetespasienter
AVAPRO er indisert for behandling av diabetisk nefropati hos pasienter med type 2 diabetes og hypertensjon, forhøyet serumkreatinin og proteinuri (>300 mg/dag). I denne populasjonen reduserer AVAPRO progresjonshastigheten av nefropati målt ved forekomsten av dobling av serumkreatinin eller nyresykdom i sluttstadiet (behov for dialyse eller nyretransplantasjon) [se Kliniske studier ].
DOSERING OG ADMINISTRASJON
Generelle betraktninger
AVAPRO kan administreres sammen med andre antihypertensiva og med eller uten mat.
Hypertensjon
Den anbefalte startdosen av AVAPRO 300 mg er 150 mg én gang daglig. Dosen kan økes til en maksimal dose på 300 mg én gang daglig etter behov for å kontrollere blodtrykket [se Kliniske studier ].
Nefropati hos type 2 diabetespasienter
Den anbefalte dosen er 300 mg én gang daglig [se Kliniske studier ].
Dosejustering i volum og saltfattige pasienter
Den anbefalte startdosen er 75 mg én gang daglig hos pasienter med utarming av intravaskulært volum eller salt (f.eks. pasienter som behandles kraftig med diuretika eller i hemodialyse) [se ADVARSLER OG FORHOLDSREGLER ].
HVORDAN LEVERES
Doseringsformer og styrker
AVAPRO 75 mg er en hvit til off-white, bikonveks oval, filmdrasjert tablett merket med et hjerte på den ene siden og "2871" på den andre.
AVAPRO 150 mg er en hvit til off-white, bikonveks oval, filmdrasjert tablett merket med et hjerte på den ene siden og "2872" på den andre.
AVAPRO 300 mg er en hvit til off-white, bikonveks oval, filmdrasjert tablett merket med et hjerte på den ene siden og "2873" på den andre.
Oppbevaring og håndtering
AVAPRO (irbesartan) er tilgjengelig som hvite til off-white, bikonvekse ovale, filmdrasjerte tabletter, preget med en hjerteform på den ene siden og en kode på den andre (se tabell nedenfor). Enhetsflasker inneholder 30 eller 90 filmdrasjerte tabletter som følger:
Oppbevares ved 25°C (77°F); utflukter tillatt til 15°C–30°C (59°F–86°F) [se USP kontrollert romtemperatur ].
sanofi-aventis US LLC, Bridgewater, NJ 08807, ET SANOFI-SELSKAP. Revidert: september 2021
BIVIRKNINGER
Følgende viktige bivirkninger er beskrevet andre steder i merkingen:
- . Hypotensjon hos pasienter med volum eller saltfattige [se ADVARSLER OG FORHOLDSREGLER ] . Nedsatt nyrefunksjon [se ADVARSLER OG FORHOLDSREGLER ]
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis. Bivirkningsinformasjonen fra kliniske studier gir imidlertid et grunnlag for å identifisere de uønskede hendelsene som ser ut til å være relatert til legemiddelbruk og for å tilnærme rater.
Hypertensjon
AVAPRO har blitt evaluert for sikkerhet hos mer enn 4300 pasienter med hypertensjon og rundt 5000 personer totalt. Denne erfaringen inkluderer 1303 pasienter behandlet i over 6 måneder og 407 pasienter i 1 år eller mer.
placebokontrollerte kliniske studier ble følgende bivirkninger rapportert hos minst 1 % av pasientene behandlet med AVAPRO (n=1965) og med en høyere forekomst sammenlignet med placebo (n=641), ekskludert de som er for generelle til å være informative og de ikke rimelig assosiert med bruk av stoffet fordi de var assosiert med tilstanden som behandles eller er svært vanlige i den behandlede befolkningen, inkluderer: diaré (3 % mot 2 %), dyspepsi/halsbrann (2 % mot 1 %) og tretthet (4 % mot 3 %).
Bruk av irbesartan var ikke assosiert med økt forekomst av tørrhoste, slik det vanligvis er assosiert med bruk av ACE-hemmere. I placebokontrollerte studier var forekomsten av hoste hos irbesartanbehandlede pasienter 2,8 % mot 2,7 % hos pasienter som fikk placebo.
Nefropati hos type 2 diabetespasienter
Hyperkalemi
Irbesartan Diabetic Nephropathy Trial (IDNT) (proteinuri ≥900 mg/dag og serumkreatinin i området 1,0-3,0 mg/dL), var prosentandelen av pasienter med kalium >6 mEq/L 18,6 % i AVAPRO 300 mg-gruppen versus 6,0 % i placebogruppen. Seponeringer på grunn av hyperkalemi i AVAPRO 150 mg-gruppen var 2,1 % mot 0,4 % i placebogruppen.
I IDNT var bivirkningene lik de som ble sett hos pasienter med hypertensjon, med unntak av økt forekomst av ortostatiske symptomer som forekom hyppigere i AVAPRO 150 mg versus placebogruppen: svimmelhet (10,2 % vs 6,0 %), ortostatisk svimmelhet (5,4 %). % vs 2,7 %) og ortostatisk hypotensjon (5,4 % vs 3,2 %).
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av AVAPRO etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å estimere frekvensen på en pålitelig måte eller å etablere en årsakssammenheng med legemiddeleksponering.
Urticaria; angioødem (som involverer hevelse i ansikt, lepper, svelg og/eller tunge); anafylaktisk reaksjon inkludert anafylaktisk sjokk; økte leverfunksjonstester; gulsott; hepatitt; hyperkalemi; anemi; trombocytopeni; økt CPK; tinnitus; og hypoglykemi hos diabetespasienter.
NARKOTIKAHANDEL
Midler som øker serumkalium
Samtidig administrering av AVAPRO med andre legemidler som øker serumkaliumnivået kan føre til hyperkalemi, noen ganger alvorlig. Overvåk serumkalium hos slike pasienter.
Litium
Økning i serumlitiumkonsentrasjoner og litiumtoksisitet er rapportert ved samtidig bruk av irbesartan og litium. Overvåk litiumnivået hos pasienter som får irbesartan og litium.
Ikke-steroide antiinflammatoriske legemidler (NSAIDs) inkludert selektive cyklooksygenase-2-hemmere (COX-2-hemmere)
Hos eldre pasienter, volumfattige (inkludert de som får diuretikabehandling), eller med nedsatt nyrefunksjon, kan samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med angiotensin II-reseptorantagonister (inkludert irbesartan) føre til forverring av nyrefunksjonen. , inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får irbesartan og NSAID-behandling.
Den antihypertensive effekten av angiotensin II-reseptorantagonister, inkludert irbesartan, kan svekkes av NSAIDs inkludert selektive COX-2-hemmere.
Dobbel blokade av Renin-Angiotensin-systemet (RAS)
Dobbel blokkering av RAS med angiotensinreseptorblokkere, ACE-hemmere eller aliskiren er assosiert med økt risiko for hypotensjon, hyperkalemi og endringer i nyrefunksjon (inkludert akutt nyresvikt) sammenlignet med monoterapi. De fleste pasienter som får kombinasjonen av to RAS-hemmere oppnår ingen ekstra fordel sammenlignet med monoterapi. Generelt, unngå kombinert bruk av RAS-hemmere. Overvåk nøye blodtrykk, nyrefunksjon og elektrolytter hos pasienter på AVAPRO 150 mg og andre midler som påvirker RAS.
Ikke gi aliskiren samtidig med AVAPRO hos pasienter med diabetes. Unngå bruk av aliskiren med AVAPRO hos pasienter med nedsatt nyrefunksjon (GFR
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Fostertoksisitet
AVAPRO 150mg kan forårsake fosterskader når det gis til en gravid kvinne. Bruk av legemidler som virker på reninangiotensinsystemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer AVAPRO så snart som mulig [se Bruk i spesifikke populasjoner ].
Hypotensjon hos pasienter med volum eller saltfattige
Hos pasienter med et aktivert renin-angiotensin-system, slik som pasienter med volum eller saltfattige (f.eks. de som behandles med høye doser diuretika), kan symptomatisk hypotensjon oppstå etter initialisering av behandling med AVAPRO. Korriger volum eller saltmangel før administrering av AVAPRO 300 mg eller bruk en lavere startdose [se DOSERING OG ADMINISTRASJON ].
Nedsatt nyrefunksjon
Endringer i nyrefunksjonen inkludert akutt nyresvikt kan være forårsaket av legemidler som hemmer renin-angiotensin-systemet. Pasienter hvis nyrefunksjon delvis kan avhenge av aktiviteten til renin-angiotensin-systemet (f.eks. pasienter med nyrearteriestenose, kronisk nyresykdom, alvorlig hjertesvikt eller volummangel) kan ha særlig risiko for å utvikle akutt nyresvikt eller død på AVAPRO. Overvåk nyrefunksjonen med jevne mellomrom hos disse pasientene. Vurder å holde tilbake eller avbryte behandlingen hos pasienter som utvikler en klinisk signifikant reduksjon i nyrefunksjonen på AVAPRO [se NARKOTIKAHANDEL ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Ingen tegn på karsinogenitet ble observert når irbesartan ble administrert i doser på opptil 500/1000 mg/kg/dag (henholdsvis hanner/hunner) hos rotter og 1000 mg/kg/dag hos mus i opptil 2 år. For hann- og hunnrotter ga 500 mg/kg/dag en gjennomsnittlig systemisk eksponering for irbesartan (AUC 0–24 timer, bundet pluss ubundet) henholdsvis ca. 3 og 11 ganger den gjennomsnittlige systemiske eksponeringen hos mennesker som får maksimalt anbefalt menneskelig eksponering. dose (MRHD) på 300 mg irbesartan/dag, mens 1000 mg/kg/dag (kun gitt til kvinner) ga en gjennomsnittlig systemisk eksponering omtrent 21 ganger det som ble rapportert for mennesker ved MRHD. For hann- og hunnmus ga 1000 mg/kg/dag en eksponering for irbesartan henholdsvis ca. 3 og 5 ganger den menneskelige eksponeringen ved 300 mg/dag.
Irbesartan var ikke mutagent i en rekke in vitro-tester (Ames mikrobiell test, rotte-hepatocytt-DNA-reparasjonstest, V79 pattedyrcelle-forover-gen-mutasjonsanalyse). Irbesartan var negativ i flere tester for induksjon av kromosomavvik (in vitro - human lymfocyttanalyse; in vivo - mikronukleusstudie hos mus).
Irbesartan hadde ingen negative effekter på fertilitet eller parring av hann- eller hunnrotter ved orale doser ≤650 mg/kg/dag, den høyeste dosen ga en systemisk eksponering for irbesartan (AUC 0–24 timer, bundet pluss ubundet) omtrent 5 ganger så mye som funnet hos mennesker som får MRHD på 300 mg/dag.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
AVAPRO kan forårsake fosterskader når det gis til en gravid kvinne. Bruk av medikamenter som virker på reninangiotensin-systemet i andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død [se Kliniske betraktninger ]. De fleste epidemiologiske studier som undersøker føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester har ikke skilt medisiner som påvirker renin-angiotensin-systemet fra andre antihypertensiva. Når graviditet oppdages, seponer AVAPRO 150mg så snart som mulig.
Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall uavhengig av medikamenteksponering. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-fosterrisiko
Hypertensjon i svangerskapet øker mors risiko for svangerskapsforgiftning, svangerskapsdiabetes, for tidlig fødsel og fødselskomplikasjoner (f.eks. behov for keisersnitt og postpartumblødning). Hypertensjon øker fosterets risiko for intrauterin vekstbegrensning og intrauterin død. Gravide kvinner med hypertensjon bør overvåkes nøye og behandles deretter.
Fetale/neonatale bivirkninger
Oligohydramnios hos gravide kvinner som bruker legemidler som påvirker renin-angiotensin-systemet i andre og tredje trimester av svangerskapet kan resultere i følgende: redusert føtal nyrefunksjon som fører til anuri og nyresvikt, føtal lungehypoplasi, skjelettdeformasjoner, inkludert hodeskallehypoplasi, hypotensjon , og døden.
I det uvanlige tilfellet at det ikke er noe passende alternativ til behandling med legemidler som påvirker renin-angiotensin-systemet for en bestemt pasient, informere moren om den potensielle risikoen for fosteret.
Utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Fostertesting kan være aktuelt, basert på graviditetsuken. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade. Hvis oligohydramnios observeres, vurder alternativ behandling. Følg nøye med spedbarn med historier om in utero eksponering for AVAPRO for hypotensjon, oliguri og hyperkalemi og andre symptomer på nedsatt nyrefunksjon. Hos nyfødte med en historie med in utero eksponering for AVAPRO 300 mg, hvis oliguri eller hypotensjon oppstår, må oppmerksomheten rettes mot støtte av blodtrykk og nyreperfusjon. Utvekslingstransfusjon eller dialyse kan være nødvendig for å reversere hypotensjon og/eller erstatte forstyrret nyrefunksjon.
Data
Dyredata
Irbesartan krysser placenta hos rotter og kaniner. Hos hunnrotter som ble gitt irbesartan før paring gjennom drektighet og amming i orale doser på 50, 180 eller 650 mg/kg/dag (1,6 til 21,1 ganger maksimal anbefalt human dose (MRHD) basert på kroppsoverflate), ble fostre undersøkt på Svangerskapsdag 20 viste økt forekomst av hydroureter og nyrebekkenkavitasjon og/eller fravær av nyrepapiller i alle irbesartan-behandlede grupper. Subkutant ødem forekom også hos fostre ved maternelle doser ≥180 mg/kg/dag (5,8 ganger MRHD). Disse anomaliene oppstod når hunnrotter mottok irbesartan fra før paring til og med dag 20 av drektigheten, men ikke ble observert hos valper postnatalt i samme studie, eller når irbesartan ble gitt til drektige rotter kun under organogenese (drektighetsdag 6 til og med drektighetsdag 15) kl. orale doser fra 50 til 450 mg/kg/dag (opptil 14,6 ganger MRHD). I tillegg ble det ikke observert bivirkninger på nyreutviklingen hos unger fra mødre som fikk irbesartan fra drektighetsdag 15 til og med ammingsdag 24 ved doser på 50, 180 eller 650 mg/kg/dag (opptil 21,1 ganger MRHD). De observerte effektene antas å være sene svangerskapseffekter av stoffet. Gravide kaniner som fikk orale doser irbesartan på 30 mg/kg/dag (1,9 ganger MRHD basert på kroppsoverflate) opplevde en høy grad av mødredødelighet og abort. Overlevende kvinner hadde en svak økning i tidlige resorpsjoner og en tilsvarende nedgang i levende fostre.
Radioaktivitet var tilstede hos rotte- og kaninfostre under sen svangerskap etter orale doser av radiomerket irbesartan.
Amming
Det er ingen tilgjengelige data på tilstedeværelsen av irbesartan i morsmelk, effekter på melkeproduksjonen eller spedbarn som ammes. Irbesartan eller en metabolitt av irbesartan skilles ut i melken til diegivende rotter [se KLINISK FARMAKOLOGI ]. På grunn av potensialet for uønskede effekter på det ammende spedbarnet, anbefales ikke bruk av AVAPRO 150mg hos ammende kvinner.
Pediatrisk bruk
Irbesartan, i en studie med en dose på opptil 4,5 mg/kg/dag, én gang daglig, så ikke ut til å senke blodtrykket effektivt hos pediatriske pasienter i alderen 6 til 16 år.
AVAPRO har ikke blitt undersøkt hos pediatriske pasienter under 6 år.
Geriatrisk bruk
Av 4925 personer som fikk AVAPRO i kontrollerte kliniske studier av hypertensjon, var 911 (18,5 %) 65 år og over, mens 150 (3,0 %) var 75 år og eldre. Ingen generelle forskjeller i effektivitet eller sikkerhet ble observert mellom disse forsøkspersonene og yngre forsøkspersoner, men større sensitivitet hos noen eldre individer kan ikke utelukkes. [Se KLINISK FARMAKOLOGI og Kliniske studier ]
OVERDOSE
Ingen data er tilgjengelig med hensyn til overdosering hos mennesker. Imidlertid ble daglige doser på 900 mg i 8 uker godt tolerert. De mest sannsynlige manifestasjonene av overdosering forventes å være hypotensjon og takykardi; bradykardi kan også oppstå ved overdosering. Irbesartan fjernes ikke ved hemodialyse.
Akutt oral toksisitetsstudier med irbesartan hos mus og rotter indikerte at akutte dødelige doser var over henholdsvis 2000 mg/kg, omtrent 25 ganger og 50 ganger MRHD (300 mg) basert på kroppsoverflateareal.
KONTRAINDIKASJONER
AVAPRO 150mg er kontraindisert hos pasienter som er overfølsomme overfor noen komponent i dette produktet.
Ikke administrer aliskiren samtidig med AVAPRO 300mg hos pasienter med diabetes.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Angiotensin II er en potent vasokonstriktor dannet fra angiotensin I i en reaksjon katalysert av angiotensinkonverterende enzym (ACE, kininase II). Angiotensin II er det primære vasoaktive hormonet i reninangiotensinsystemet, og en viktig komponent i patofysiologien til hypertensjon. Det stimulerer også aldosteronsekresjon av binyrebarken. Irbesartan blokkerer de vasokonstriktor- og aldosteron-utskillende effektene av angiotensin II ved selektiv binding til AT1 angiotensin II-reseptoren som finnes i mange vev (f.eks. vaskulær glatt muskulatur, binyrene). Det er også en AT2-reseptor i mange vev, men den er ikke involvert i kardiovaskulær homeostase.
Irbesartan er en spesifikk konkurrerende antagonist av AT1-reseptorer med mye større affinitet (mer enn 8500 ganger) for AT1-reseptoren enn for AT2-reseptoren og uten agonistaktivitet.
Blokkering av AT1-reseptoren fjerner den negative tilbakemeldingen av angiotensin II på reninsekresjon, men den resulterende økte plasmareninaktiviteten og sirkulerende angiotensin II overvinner ikke effekten av irbesartan på blodtrykket.
Irbesartan hemmer ikke ACE eller renin eller påvirker andre hormonreseptorer eller ionekanaler som er kjent for å være involvert i kardiovaskulær regulering av blodtrykk og natriumhomeostase.
Farmakodynamikk
Hos friske personer ga enkelt orale irbesartandoser på opptil 300 mg doseavhengig hemming av pressoreffekten av angiotensin II-infusjoner. Inhiberingen var fullstendig (100 %) 4 timer etter orale doser på 150 mg eller 300 mg, og delvis hemming ble opprettholdt i 24 timer (henholdsvis 60 % og 40 % ved 300 mg og 150 mg).
Hos hypertensive pasienter forårsaker hemming av angiotensin II-reseptor etter kronisk administrering av irbesartan en 1,5- til 2-ganger økning i plasmakonsentrasjonen av angiotensin II og en 2- til 3 ganger økning i plasmareninnivåer. Plasmakonsentrasjonen av aldosteron synker generelt etter administrering av irbesartan, men serumkaliumnivået påvirkes ikke signifikant ved anbefalte doser.
Hos hypertensive pasienter hadde kroniske orale doser av irbesartan (opptil 300 mg) ingen effekt på glomerulær filtrasjonshastighet, renal plasmastrøm eller filtrasjonsfraksjon. I flerdosestudier på hypertensive pasienter var det ingen klinisk viktige effekter på fastende triglyserider, totalkolesterol eller HDL-kolesterolkonsentrasjoner. Det var ingen effekt på serumurinsyre under kronisk oral administrering, og ingen urikosurisk effekt.
Farmakokinetikk
Absorpsjon
Den orale absorpsjonen av irbesartan er rask og fullstendig med en gjennomsnittlig absolutt biotilgjengelighet på 60 % til 80 %. Etter oral administrering av AVAPRO oppnås maksimale plasmakonsentrasjoner av irbesartan 1,5 til 2 timer etter dosering. Mat påvirker ikke biotilgjengeligheten til irbesartan.
Irbesartan viser lineær farmakokinetikk over det terapeutiske doseområdet.
Fordeling
Irbesartan er 90 % bundet til serumproteiner (primært albumin og α-syreglykoprotein) med ubetydelig binding til cellulære komponenter i blodet. Gjennomsnittlig distribusjonsvolum er 53 til 93 liter.
Dyrestudier indikerer at radiomerket irbesartan svakt krysser blod-hjerne-barrieren og placenta. Irbesartan skilles ut i melken til diegivende rotter.
Eliminering
Total plasma- og nyreclearance er i området på henholdsvis 157 til 176 ml/min og 3,0 til 3,5 ml/min. Den terminale eliminasjonshalveringstiden for irbesartan er i gjennomsnitt 11 til 15 timer. Steady-state konsentrasjoner oppnås innen 3 dager. Begrenset akkumulering av irbesartan (
Metabolisme
Irbesartan er et oralt aktivt middel som ikke krever biotransformasjon til en aktiv form. Irbesartan metaboliseres via glukuronidkonjugering og oksidasjon. Etter oral eller intravenøs administrering av Clabeled irbesartan, kan mer enn 80 % av den sirkulerende plasmaradioaktiviteten tilskrives uendret irbesartan. Den primære sirkulerende metabolitten er det inaktive irbesartanglukuronidkonjugatet (ca. 6%). De gjenværende oksidative metabolittene bidrar ikke nevneverdig til irbesartans farmakologiske aktivitet.
In vitro-studier indikerer at irbesartan oksideres hovedsakelig av CYP2C9; metabolisme av CYP3A4 er ubetydelig.
Utskillelse
Irbesartan og dets metabolitter utskilles både via galle og nyre. Etter enten oral eller intravenøs administrering av 14C-merket irbesartan, gjenfinnes ca. 20 % av radioaktiviteten i urinen og resten i feces, som irbesartan eller irbesartanglukuronid.
Spesifikke populasjoner
Kjønn
Ingen kjønnsrelaterte forskjeller i farmakokinetikk er observert hos friske eldre (alder 65–80 år) eller hos friske unge (alder 18–40 år). I studier av hypertensive pasienter er det ingen kjønnsforskjell i halveringstid eller akkumulering, men noe høyere plasmakonsentrasjoner av irbesartan er observert hos kvinner (11 %–44 %). Ingen kjønnsrelatert dosejustering er nødvendig.
Geriatri
Hos eldre forsøkspersoner (65–80 år) er ikke eliminasjonshalveringstiden for irbesartan signifikant endret, men AUC og Cmax-verdier er omtrent 20 % til 50 % høyere enn hos unge forsøkspersoner (alder 18–40 år). Ingen dosejustering er nødvendig hos eldre.
Rase/etnisitet
Hos friske svarte personer er AUC-verdiene for irbesartan omtrent 25 % høyere enn hvite; det er ingen forskjell i Cmax-verdier.
Nedsatt nyrefunksjon
Farmakokinetikken til irbesartan er ikke endret hos pasienter med nedsatt nyrefunksjon eller hos pasienter i hemodialyse. Irbesartan fjernes ikke ved hemodialyse. Ingen dosejustering er nødvendig hos pasienter med lett til alvorlig nedsatt nyrefunksjon med mindre en pasient med nedsatt nyrefunksjon også er volumdepletert [se ADVARSLER OG FORHOLDSREGLER og DOSERING OG ADMINISTRASJON ].
Leverinsuffisiens
Farmakokinetikken til irbesartan etter gjentatt oral administrering er ikke signifikant påvirket hos pasienter med mild til moderat levercirrhose. Ingen dosejustering er nødvendig hos pasienter med leverinsuffisiens.
Legemiddel-legemiddelinteraksjoner
In vitro-studier viser signifikant hemming av dannelsen av oksiderte irbesartan-metabolitter med de kjente cytokrom CYP2C9-substratene/hemmerne sulfenazol, tolbutamid og nifedipin. I kliniske studier var imidlertid konsekvensene av samtidig irbesartan på farmakodynamikken til warfarin ubetydelige. Basert på in vitro-data vil ingen interaksjon forventes med legemidler hvis metabolisme er avhengig av cytokrom P450 isoenzymene 1A1, 1A2, 2A6, 2B6, 2D6, 2E1 eller 3A4.
I separate studier av pasienter som får vedlikeholdsdoser av warfarin, hydroklortiazid eller digoksin, har administrering av irbesartan i 7 dager ingen effekt på farmakodynamikken til warfarin (protrombintid) eller farmakokinetikken til digoksin. Farmakokinetikken til irbesartan påvirkes ikke av samtidig administrering av nifedipin eller hydroklortiazid.
Kliniske studier
Hypertensjon
Den antihypertensive effekten av AVAPRO ble undersøkt i 7 placebokontrollerte 8- til 12-ukers studier hos pasienter med baseline diastolisk blodtrykk på 95 til 110 mmHg. Doser på 1 til 900 mg ble inkludert i disse studiene for å utforske doseområdet for irbesartan fullt ut. Disse studiene tillot sammenligning av regimer én eller to ganger daglig med 150 mg/dag, sammenligninger av topp- og bunneffekter, og sammenligninger av respons etter kjønn, alder og rase. To av de syv placebokontrollerte studiene identifisert ovenfor undersøkte de antihypertensive effektene av irbesartan og hydroklortiazid i kombinasjon.
De 7 studiene med irbesartan monoterapi inkluderte totalt 1915 pasienter randomisert til irbesartan (1–900 mg) og 611 pasienter randomisert til placebo. En gang daglig doser på 150 mg og 300 mg ga statistisk og klinisk signifikante reduksjoner i systolisk og diastolisk blodtrykk med bunneffekter (24 timer etter dose) etter 6 til 12 ukers behandling sammenlignet med placebo, på ca. 8–10/ henholdsvis 5–6 mmHg og 8–12/5–8 mmHg. Ingen ytterligere økning i effekt ble sett ved doser større enn 300 mg. Dose-respons-relasjonene for effekter på systolisk og diastolisk trykk er vist i figur 1 og 2.
Figur 1: Placebo-subtrahert reduksjon i bunnen av SeSBP; integrert analyse
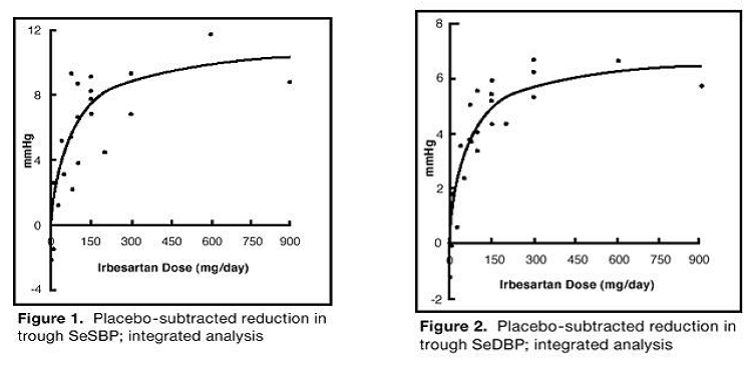
Figur 2: Placebo-subtrahert reduksjon i bunnen av SeSBP; integrert analyse
En gang daglig administrering av terapeutiske doser av irbesartan ga maksimal effekt etter rundt 3 til 6 timer og, i en ambulatorisk blodtrykksmåling, igjen rundt 14 timer. Dette ble sett både ved dosering én gang daglig og to ganger daglig. Trough-to-peak-forhold for systolisk og diastolisk respons var generelt mellom 60 % og 70 %. I en kontinuerlig ambulatorisk blodtrykksovervåkingsstudie ga dosering én gang daglig med 150 mg bunn- og gjennomsnittlig 24-timers respons tilsvarende de som ble observert hos pasienter som fikk dosering to ganger daglig med samme totale daglige dose.
I kontrollerte studier ga tillegg av irbesartan til hydroklortiaziddoser på 6,25 mg, 12,5 mg eller 25 mg ytterligere doserelaterte blodtrykksreduksjoner tilsvarende de som ble oppnådd med samme monoterapidose av irbesartan. HCTZ hadde også en tilnærmet additiv effekt.
Analyse av alder, kjønn og raseundergrupper av pasienter viste at menn og kvinner, og pasienter over og under 65 år, generelt hadde lignende responser. Irbesartan var effektivt for å redusere blodtrykket uavhengig av rase, selv om effekten var noe mindre hos svarte (vanligvis en lav-renin-populasjon).
Effekten av irbesartan er tydelig etter den første dosen, og den er nær den fulle observerte effekten etter 2 uker. Ved slutten av en 8-ukers eksponering var omtrent 2/3 av den antihypertensive effekten fortsatt til stede en uke etter siste dose. Rebound hypertensjon ble ikke observert. Det var praktisk talt ingen endring i gjennomsnittlig hjertefrekvens hos irbesartan-behandlede pasienter i kontrollerte studier.
Nefropati hos type 2 diabetespasienter
Irbesartan Diabetic Nephropathy Trial (IDNT) var en randomisert, placebo- og aktiv-kontrollert, dobbeltblind, multisenterstudie utført over hele verden på 1715 pasienter med type 2 diabetes, hypertensjon (SeSBP >135 mmHg eller SeDBP >85 mmHg) og nefropati (serum). kreatinin 1,0 til 3,0 mg/dL hos kvinner eller 1,2 til 3,0 mg/dL hos menn og proteinuri ≥900 mg/dag). Pasientene ble randomisert til å få AVAPRO 75 mg, amlodipin 2,5 mg eller matchende placebo én gang daglig. Pasientene ble titrert til en vedlikeholdsdose på AVAPRO 300 mg, eller amlodipin 10 mg, som tolerert. Ytterligere antihypertensiva (unntatt ACE-hemmere, angiotensin II-reseptorantagonister og kalsiumkanalblokkere) ble tilsatt etter behov for å oppnå blodtrykksmålet (≤135/85 eller 10 mmHg reduksjon i systolisk blodtrykk hvis høyere enn 160 mmHg) for pasienter i alle grupper .
Studiepopulasjonen var 66,5 % menn, 72,9 % under 65 år og 72 % hvite (asiatiske/stillehavsøyer 5,0 %, svarte 13,3 %, latinamerikanske 4,8 %). Gjennomsnittlig baseline sittende systoliske og diastoliske blodtrykk var henholdsvis 159 mmHg og 87 mmHg. Pasientene gikk inn i studien med en gjennomsnittlig serumkreatinin på 1,7 mg/dL og gjennomsnittlig proteinuri på 4144 mg/dag.
Gjennomsnittlig oppnådd blodtrykk var 142/77 mmHg for AVAPRO, 142/76 mmHg for amlodipin og 145/79 mmHg for placebo. Totalt fikk 83,0 % av pasientene måldosen av irbesartan mer enn 50 % av tiden. Pasientene ble fulgt i en gjennomsnittlig varighet på 2,6 år.
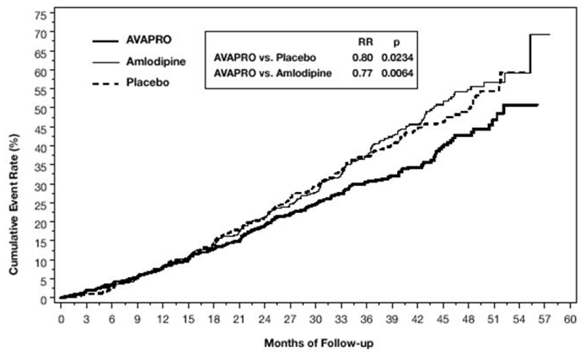
Det primære sammensatte endepunktet var tiden til forekomst av en av følgende hendelser: dobling av baseline serumkreatinin, nyresykdom i sluttstadiet (ESRD; definert ved serumkreatinin ≥6 mg/dL, dialyse eller nyretransplantasjon) eller død . Behandling med AVAPRO 150 mg resulterte i en 20 % risikoreduksjon versus placebo (p=0,0234) (se figur 3 og tabell 1). Behandling med AVAPRO 150 mg reduserte også forekomsten av vedvarende dobling av serumkreatinin som et separat endepunkt (33 %), men hadde ingen signifikant effekt på ESRD alene og ingen effekt på total dødelighet (se tabell 1).
Figur 3: IDNT: Kaplan-Meier estimater av primært endepunkt (dobling av serumkreatinin, nyresykdom i sluttstadiet eller dødelighet av alle årsaker)
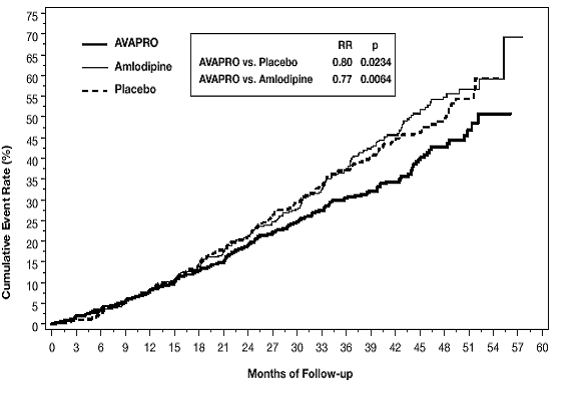
Prosentandelen av pasienter som opplever en hendelse i løpet av studien kan sees i tabell 1 nedenfor:
Det sekundære endepunktet for studien var en sammensetning av kardiovaskulær dødelighet og sykelighet (hjerteinfarkt, sykehusinnleggelse for hjertesvikt, hjerneslag med permanent nevrologisk underskudd, amputasjon). Det var ingen statistisk signifikante forskjeller mellom behandlingsgruppene i disse endepunktene. Sammenlignet med placebo reduserte AVAPRO 150 mg proteinuri signifikant med ca. 27 %, en effekt som var tydelig innen 3 måneder etter behandlingsstart. AVAPRO reduserte signifikant frekvensen av tap av nyrefunksjon (glomerulær filtrasjonshastighet), målt ved resiprok av serumkreatininkonsentrasjonen, med 18,2 %.
Tabell 2 viser resultater for demografiske undergrupper. Undergruppeanalyser er vanskelige å tolke, og det er ikke kjent om disse observasjonene representerer sanne forskjeller eller tilfeldige effekter. For det primære endepunktet ble AVAPROs gunstige effekter sett hos pasienter som også tok andre antihypertensive medisiner (angiotensin II-reseptorantagonister, angiotensin-konverterende-enzymhemmere og kalsiumkanalblokkere var ikke tillatt), orale hypoglykemiske midler og lipid- senkemidler.
PASIENTINFORMASJON
Svangerskap
Informer kvinnelige pasienter i fertil alder om konsekvensene av eksponering for AVAPRO under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Pasienter bør bes om å rapportere graviditet til legen så snart som mulig.
Kaliumtilskudd
Råd pasienter som får AVAPRO til ikke å bruke kaliumtilskudd eller salterstatninger som inneholder kalium uten å konsultere helsepersonell [se NARKOTIKAHANDEL ].
