Zestoretic 5/12.5g/mg Lisinopril Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Zestoretic og hvordan brukes det?
Zestoretic er en reseptbelagt medisin som brukes til å behandle symptomene på hypertensjon (høyt blodtrykk) og væskeretensjon. Zestoretic 5mg kan brukes alene eller sammen med andre medisiner.
Det er ikke kjent om Zestoretic 5mg er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Zestoretic 5mg?
Zestoretic kan forårsake alvorlige bivirkninger, inkludert:
- . føler seg svimmel, . øyesmerter eller synsproblemer, . lite eller ingen vannlating, . svakhet, . døsighet, . føler seg rastløs, . feber , . frysninger, . sår hals, . munnsår, . problemer med å svelge, . gulfarging av hud og øyne (gulsott), . kvalme, . oppkast, . prikkende følelse, . brystsmerter, . uregelmessige hjerteslag eller flagrende i brystet, . tap av bevegelse, . kramper i benet, . forstoppelse, . ekstrem tørst, . økt vannlating, . nummenhet eller prikking, . muskel svakhet, . hodepine, . tap eller koordinering, og . føler seg ustø
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Zestoretic inkluderer:
- . hoste . hodepine . svimmelhet . føler seg sliten
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Zestoretic. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
- . Når graviditet oppdages, seponer behandlingen med ZESTORETIC så snart som mulig. . Legemidler som virker direkte på renin-angiotensin-systemet kan forårsake skade og død for det utviklende fosteret. Se ADVARSLER Fostertoksisitet.
BESKRIVELSE
ZESTORETIC® (lisinopril og hydroklortiazid) kombinerer en angiotensinkonverterende enzymhemmer, lisinopril, og et vanndrivende middel, hydroklortiazid.
Lisinopril, et syntetisk peptidderivat, er en oral langtidsvirkende angiotensinkonverterende enzymhemmer. Det er kjemisk beskrevet som (S)-1-[N2-(1-karboksy-3-fenylpropyl)-L-lysyl]-L-prolin-dihydrat. Dens empiriske formel er C21H31N3O5. 2H2O og dens strukturformel er:
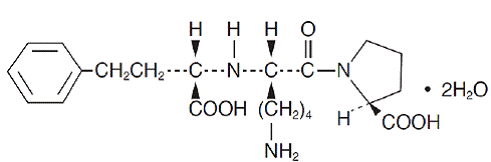
Lisinopril er et hvitt til off-white, krystallinsk pulver, med en molekylvekt på 441,53. Det er løselig i vann, lite løselig i metanol og praktisk talt uløselig i etanol.
Hydroklortiazid er 6-klor-3,4-dihydro-2H-1,2,4-benzotiadiazin-7-sulfonamid-1,1-dioksid. Dens empiriske formel er C7H8ClN3O4S2 og dens strukturformel er:
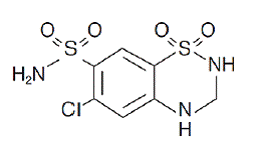
Hydroklortiazid er et hvitt, eller praktisk talt hvitt, krystallinsk pulver med en molekylvekt på 297,72, som er lett løselig i vann, men fritt løselig i natriumhydroksidløsning.
ZESTORETIC 5mg er tilgjengelig for oral bruk i tre tablettkombinasjoner av lisinopril med hydroklortiazid: ZESTORETIC 10-12,5 som inneholder 10 mg lisinopril og 12,5 mg hydroklortiazid; ZESTORETIC 20Referanse 12.5 som inneholder 20 mg lisinopril og 12,5 mg hydroklortiazid; og ZESTORETIC 20-25 som inneholder 20 mg lisinopril og 25 mg hydroklortiazid.
Inaktive ingredienser
10-12,5 tabletter -kalsiumfosfat, magnesiumstearat, mannitol, rødt jernoksid, maisstivelse, gult jernoksid.
20-12,5 tabletter -kalsiumfosfat, magnesiumstearat, mannitol, maisstivelse.
20-25 tabletter -kalsiumfosfat, magnesiumstearat, mannitol, rødt jernoksid, maisstivelse, gult jernoksid.
INDIKASJONER
ZESTORETIC er indisert for behandling av hypertensjon, for å senke blodtrykket. Senking av blodtrykket reduserer risikoen for dødelige og ikke-dødelige kardiovaskulære hendelser, først og fremst hjerneslag og hjerteinfarkt. Disse fordelene har blitt sett i kontrollerte studier av antihypertensiva fra en rekke farmakologiske klasser, inkludert lisinopril og hydroklortiazid.
Kontroll av høyt blodtrykk bør være en del av omfattende kardiovaskulær risikostyring, inkludert, etter behov, lipidkontroll, diabetesbehandling, antitrombotisk terapi, røykeslutt, trening og begrenset natriuminntak. Mange pasienter vil kreve mer enn 1 medikament for å oppnå blodtrykksmål. For spesifikke råd om mål og ledelse, se publiserte retningslinjer, for eksempel de fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Tallrike antihypertensiva, fra en rekke farmakologiske klasser og med forskjellige virkningsmekanismer, har i randomiserte kontrollerte studier vist seg å redusere kardiovaskulær sykelighet og dødelighet, og det kan konkluderes med at det er blodtrykksreduksjon, og ikke noen annen farmakologisk egenskap av stoffene, som i stor grad er ansvarlig for disse fordelene. Den største og mest konsistente fordelen for kardiovaskulær utfall har vært en reduksjon i risikoen for hjerneslag, men reduksjoner i hjerteinfarkt og kardiovaskulær dødelighet har også blitt sett regelmessig.
Forhøyet systolisk eller diastolisk trykk forårsaker økt kardiovaskulær risiko, og den absolutte risikoøkningen per mmHg er større ved høyere blodtrykk, slik at selv beskjedne reduksjoner av alvorlig hypertensjon kan gi betydelig fordel. Relativ risikoreduksjon fra blodtrykksreduksjon er lik på tvers av populasjoner med varierende absolutt risiko, så den absolutte fordelen er større hos pasienter som har høyere risiko uavhengig av deres hypertensjon (for eksempel pasienter med diabetes eller hyperlipidemi), og slike pasienter kan forventes å dra nytte av mer aggressiv behandling til et lavere blodtrykksmål.
Noen antihypertensiva har mindre blodtrykkseffekter (som monoterapi) hos svarte pasienter, og mange antihypertensiva har ytterligere godkjente indikasjoner og effekter (f.eks. på angina, hjertesvikt eller diabetisk nyresykdom). Disse betraktningene kan lede valg av terapi.
Disse kombinasjonene med faste doser er ikke indisert for initial behandling (se DOSERING OG ADMINISTRASJON ).
Ved bruk av ZESTORETIC bør det tas hensyn til det faktum at en angiotensin-konverterende enzymhemmer, kaptopril, har forårsaket agranulocytose, spesielt hos pasienter med nedsatt nyrefunksjon eller kollagen vaskulær sykdom, og at tilgjengelige data er utilstrekkelige til å vise at lisinopril ikke har en lignende risiko (se ADVARSLER ).
Ved vurdering av bruk av ZESTORETIC mg, bør det bemerkes at ACE-hemmere har vært assosiert med en høyere forekomst av angioødem hos svarte enn hos ikke-svarte pasienter (se ADVARSLER , Lisinopril ).
DOSERING OG ADMINISTRASJON
Lisinopril monoterapi er en effektiv behandling av hypertensjon i doser én gang daglig på 10 mg til 80 mg, mens hydroklortiazid monoterapi er effektiv i doser på 12,5 mg per dag til 50 mg per dag. I kliniske studier med kombinasjonsbehandling med lisinopril/hydroklortiazid med lisinoprildoser på 10 mg til 80 mg og hydroklortiaziddoser på 6,25 mg til 50 mg, økte den antihypertensive responsraten vanligvis med økende dose av begge komponentene.
Bivirkningene (se ADVARSLER ) av lisinopril er generelt sjeldne og tilsynelatende uavhengige av dose; de av hydroklortiazid er en blanding av doseavhengige fenomener (primært hypokalemi) og doseuavhengige fenomener (f.eks. pankreatitt), førstnevnte mye mer vanlig enn sistnevnte. Terapi med en hvilken som helst kombinasjon av lisinopril og hydroklortiazid kan være assosiert med en av eller begge doseuavhengige eller doseavhengige bivirkninger, men tillegg av lisinopril i kliniske studier stumpe den hypokalemi som vanligvis sees med diuretika.
For å minimere doseavhengige bivirkninger er det vanligvis hensiktsmessig å starte kombinasjonsbehandling først etter at en pasient ikke har oppnådd ønsket effekt med monoterapi.
Dosetitrering veiledet av klinisk effekt
En pasient hvis blodtrykk ikke er tilstrekkelig kontrollert med enten lisinopril eller hydroklortiazid monoterapi, kan byttes til lisinopril/HCTZ 10/12,5 eller lisinopril/HCTZ 20/12,5, avhengig av gjeldende monoterapidose. Ytterligere økninger av en eller begge komponentene bør avhenge av klinisk respons med blodtrykk målt ved interdoseringsintervallet for å sikre at det er en tilstrekkelig antihypertensiv effekt på det tidspunktet. Hydroklortiaziddosen bør vanligvis ikke økes før det har gått 2 til 3 uker. Etter tilsetning av vanndrivende middel kan det være mulig å redusere dosen av lisinopril. Pasienter hvis blodtrykk er tilstrekkelig kontrollert med 25 mg daglig hydroklortiazid, men som opplever betydelig kaliumtap med dette regimet, kan oppnå tilsvarende eller større blodtrykkskontroll uten elektrolyttforstyrrelser hvis de byttes til lisinopril/HCTZ 10/12,5.
Hos pasienter som for tiden behandles med et vanndrivende middel, kan det av og til oppstå symptomatisk hypotensjon etter startdosen med lisinopril. Diuretikaet bør om mulig seponeres i to til tre dager før behandling med lisinopril starter for å redusere sannsynligheten for hypotensjon (se pkt. ADVARSLER ). Hvis pasientens blodtrykk ikke kontrolleres med lisinopril alene, kan diuretikabehandling gjenopptas.
Hvis diuretika ikke kan seponeres, bør en startdose på 5 mg lisinopril brukes under medisinsk tilsyn i minst to timer og til blodtrykket har stabilisert seg i minst en ekstra time (se pkt. ADVARSLER og FORHOLDSREGLER , NARKOTIKAHANDEL ).
Samtidig administrering av ZESTORETIC med kaliumtilskudd, kaliumsalterstatninger eller kaliumsparende diuretika kan føre til økning av serumkalium (se pkt. FORHOLDSREGLER ).
Erstatningsterapi
Kombinasjonen kan erstatte de titrerte individuelle komponentene.
Bruk ved nedsatt nyrefunksjon
Behandlingsregimer med lisinopril/HCTZ trenger ikke ta hensyn til nyrefunksjonen så lenge pasientens kreatininclearance er >30 ml/min/1,7 m2 (serumkreatinin ca. ≤3 mg/dL eller 265 μmol/L). Hos pasienter med mer alvorlig nedsatt nyrefunksjon foretrekkes loop-diuretika fremfor tiazider, så lisinopril/HCTZ anbefales ikke (se ADVARSLER , Anafylaktoide reaksjoner under membraneksponering ).
HVORDAN LEVERES
ZESTORETIC 10-12,5 tabletter: Ferskenfarget, runde, bikonvekse, ubestrøede tabletter identifisert med "141" preget på den ene siden og "ZESTORETIC" på den andre siden leveres i flasker med 90 tabletter ( NDC 52427-435-90) og flasker med 100 tabletter ( NDC 52427-435-01).
ZESTORETIC 20-12,5 tabletter : Hvite, runde, bikonvekse, ikke-drasjerte tabletter identifisert med "142" preget på den ene siden og "ZESTORETIC" på den andre siden leveres i flasker med 90 tabletter ( NDC 52427-436-90) og flasker med 100 tabletter ( NDC 52427-436-01).
ZESTORETIC 20-25 tabletter Ferskenfargede, runde, bikonvekse, ubelagte tabletter identifisert med "145" preget på den ene siden og "ZESTORETIC" på den andre siden, leveres i flasker med 90 tabletter ( NDC 52427-43790) og flasker med 100 tabletter ( NDC 52427-437-01).
Oppbevaring
Oppbevares ved kontrollert romtemperatur, 20-25°C (68-77°F) [se USP]. Beskytt mot overdreven lys og fuktighet.
Distribuert av: Almatica Pharma, Inc. Pine Brook, NJ 07058 USA. Revidert: juli 2017.
BIVIRKNINGER
ZESTORETIC 12,5gmg har blitt evaluert for sikkerhet hos 930 pasienter inkludert 100 pasienter behandlet i 50 uker eller mer.
I kliniske studier med ZESTORETIC er det ikke observert noen bivirkninger som er særegne for dette kombinasjonslegemidlet. Bivirkninger som har oppstått har vært begrenset til de som tidligere er rapportert med lisinopril eller hydroklortiazid.
De hyppigste kliniske bivirkningene i kontrollerte studier (inkludert åpne utvidelser) med enhver kombinasjon av lisinopril og hydroklortiazid var: svimmelhet (7,5 %), hodepine (5,2 %), hoste (3,9 %), tretthet (3,7 %) og ortostatiske effekter (3,2 %) som alle var mer vanlige enn hos placebobehandlede pasienter. Generelt var uønskede opplevelser milde og forbigående, men se ADVARSLER angående angioødem og overdreven hypotensjon eller synkope. Seponering av behandlingen på grunn av bivirkninger var nødvendig hos 4,4 % av pasientene, hovedsakelig på grunn av svimmelhet, hoste, tretthet og muskelkramper.
Bivirkninger som forekommer hos mer enn én prosent av pasientene behandlet med lisinopril pluss hydroklortiazid i kontrollerte kliniske studier er vist nedenfor.
Prosent av pasienter i kontrollerte studier
Kliniske bivirkninger som forekommer hos 0,3 % til 1,0 % av pasientene i kontrollerte studier og sjeldnere, alvorlige, muligens medikamentrelaterte hendelser rapportert i markedsføringserfaring, er oppført nedenfor:
Kroppen som helhet: Brystsmerter, magesmerter, synkope, ubehag i brystet, feber, traumer, virusinfeksjon. Kardiovaskulær: Hjertebank, ortostatisk hypotensjon. Fordøyelsessystemet: Mage-tarmkramper, munntørrhet, forstoppelse, halsbrann. Muskuloskeletal: Ryggsmerter, skuldersmerter, knesmerter, ryggbelastning, myalgi, fotsmerter. Nervøs/psykiatrisk: Nedsatt libido, svimmelhet, depresjon, somnolens. Luftveiene: Forkjølelse, tett nese, influensa, bronkitt, svelgsmerter, dyspné, lungetetthet, kronisk bihulebetennelse, allergisk rhinitt, ubehag i svelget. Hud: Rødming, kløe, hudbetennelse, diaforese, kutant pseudolymfom. Spesielle sanser: Tørkesyn, tinnitus, otalgi. Urogenital: Urinveisinfeksjon.
Angioødem: Angioødem i ansikt, ekstremiteter, lepper, tunge, glottis og/eller strupehode er rapportert (se ADVARSLER ).
I sjeldne tilfeller har intestinalt angioødem blitt rapportert etter markedsføring.
Hypotensjon: I kliniske studier forekom bivirkninger relatert til hypotensjon som følger: hypotensjon (1,4 %), ortostatisk hypotensjon (0,5 %), andre ortostatiske effekter (3,2 %). I tillegg forekom synkope hos 0,8 % av pasientene (se ADVARSLER ).
Hoste: Se FORHOLDSREGLER - Hoste .
Funn fra kliniske laboratorieprøver
Serum elektrolytter
(Se FORHOLDSREGLER ).
Kreatinin, Blod Urea Nitrogen
Mindre reversible økninger i blodurea-nitrogen og serumkreatinin ble observert hos pasienter med essensiell hypertensjon behandlet med ZESTORETIC. Mer markerte økninger har også blitt rapportert og var mer sannsynlig å oppstå hos pasienter med nyrearteriestenose (se FORHOLDSREGLER ).
Serum Urinsyre, Glukose, Magnesium, Kolesterol, Triglyserider og Kalsium
(Se FORHOLDSREGLER ).
Hemoglobin og hematokrit
Små reduksjoner i hemoglobin og hematokrit (gjennomsnittlig reduksjon på henholdsvis ca. 0,5 g% og 1,5 vol%) forekom hyppig hos hypertensive pasienter behandlet med ZESTORETIC 5 mg, men var sjelden av klinisk betydning med mindre en annen årsak til anemi eksisterte samtidig. I kliniske studier avbrøt 0,4 % av pasientene behandlingen på grunn av anemi.
Leverfunksjonstester
I sjeldne tilfeller har forhøyelser av leverenzymer og/eller serumbilirubin forekommet. (Se ADVARSLER , Leversvikt ).
Andre bivirkninger som er rapportert med de enkelte komponentene er listet opp nedenfor:
Lisinopril
I kliniske studier ble bivirkninger som oppstod med lisinopril også sett med ZESTORETIC. I tillegg, og siden lisinopril har blitt markedsført, har følgende bivirkninger blitt rapportert med lisinopril og bør betraktes som potensielle bivirkninger for ZESTORETIC: Kroppen som helhet: Anafylaktoide reaksjoner (se ADVARSLER , Anafylaktoide reaksjoner under membraneksponering ), ubehag, ødem, ansiktsødem, smerte, bekkensmerter, flankesmerter, frysninger; Kardiovaskulær: Hjertestans, hjerteinfarkt eller cerebrovaskulær ulykke, muligens sekundært til overdreven hypotensjon hos høyrisikopasienter (se ADVARSLER , Hypotensjon ), lungeemboli og infarkt, forverring av hjertesvikt, arytmier (inkludert takykardi, ventrikkeltakykardi, atrietakykardi, atrieflimmer, bradykardi og for tidlige ventrikkelsammentrekninger), angina pectoris, forbigående iskemiske trykkanfall, nocturnoksy-blod, redusert blodtrykk. ødem, vaskulitt; Fordøyelsessystemet: Pankreatitt, hepatitt (hepatocellulær eller kolestatisk gulsott) (se ADVARSLER , Leversvikt ), gastritt, anoreksi, flatulens, økt salivasjon; Endokrine: Diabetes mellitus, upassende sekresjon av antidiuretisk hormon; Hematologisk: Sjeldne tilfeller av benmargsdepresjon, hemolytisk anemi, leukopeni/nøytropeni og trombocytopeni er rapportert hvor en årsakssammenheng med lisinopril ikke kan utelukkes; Metabolsk: Gikt, vekttap, dehydrering, væskeoverbelastning, vektøkning; Muskuloskeletal: Leddgikt, artralgi, nakkesmerter, hoftesmerter, leddsmerter, bensmerter, armsmerter, lumbago; Nervesystem/psykiatrisk: Ataksi, hukommelsessvikt, tremor, søvnløshet, hjerneslag, nervøsitet, forvirring, perifer nevropati (f.eks. parestesi, dysestesi), spasmer, hypersomni, irritabilitet; humørsvingninger (inkludert depressive symptomer); hallusinasjoner; Luftveiene: Ondartede lunge-neoplasmer, hemoptyse, lungeødem, lungeinfiltrater, bronkospasme, astma, pleural effusjon, lungebetennelse, eosinofil pneumonitt, hvesing, ortopné, smertefull åndedrett, neseblødning, laryngitt, bihulebetennelse, abnormitet, rhinorrheat, normal; Hud: Urticaria, alopecia, herpes zoster, lysfølsomhet, hudlesjoner, hudinfeksjoner, pemfigus, erytem, psoriasis, sjeldne tilfeller av andre alvorlige hudreaksjoner, inkludert toksisk epidermal nekrolyse og Stevens-Johnsons syndrom (årsakssammenheng er ikke fastslått); Spesielle sanser: Synstap, diplopi, fotofobi, smaksendring, luktforstyrrelse; Urogenital: Akutt nyresvikt, oliguri, anuri, uremi, progressiv azotemi, nedsatt nyrefunksjon (se FORHOLDSREGLER og DOSERING OG ADMINISTRASJON ), pyelonefritt, dysuri, brystsmerter.
Diverse
Et symptomkompleks er rapportert som kan inkludere en positiv ANA, en forhøyet erytrocyttsedimentasjonsrate, artralgi/artritt, myalgi, feber, vaskulitt, eosinofili og leukocytose. Utslett, lysfølsomhet eller andre dermatologiske manifestasjoner kan forekomme alene eller i kombinasjon med disse symptomene.
Hydroklortiazid
Kroppen som helhet: Svakhet; Fordøyelsessystemet: Anoreksi, gastrisk irritasjon, kramper, gulsott (intrahepatisk kolestatisk gulsott) (se ADVARSLER , Leversvikt ), pankreatitt, sialoadenitt, forstoppelse; Hematologisk: Leukopeni, agranulocytose, trombocytopeni, aplastisk anemi, hemolytisk anemi; Muskuloskeletal: Muskelspasme; Nervesystem/psykiatrisk: Rastløshet; Nyre: Nyresvikt, nedsatt nyrefunksjon, interstitiell nefritt (se ADVARSLER ); Hud: Erythema multiforme inkludert Stevens-Johnsons syndrom, eksfoliativ dermatitt inkludert toksisk epidermal nekrolyse, alopecia; Spesielle sanser: Xanthopsia; Overfølsomhet: Purpura, lysfølsomhet, urticaria, nekrotiserende angiitt (vaskulitt og kutan vaskulitt), pustebesvær inkludert pneumonitt og lungeødem, anafylaktiske reaksjoner.
NARKOTIKAHANDEL
Lisinopril
Hypotensjon - Pasienter på vanndrivende terapi
Pasienter på diuretika og spesielt de som nylig har startet behandling med diuretika, kan av og til oppleve en overdreven reduksjon av blodtrykket etter oppstart av behandling med lisinopril. Muligheten for hypotensive effekter med lisinopril kan minimeres ved enten å seponere diuretika eller øke saltinntaket før oppstart av behandling med lisinopril. Hvis det er nødvendig å fortsette med diuretika, initier behandlingen med lisinopril med en dose på 5 mg daglig, og sørg for tett medisinsk tilsyn etter startdosen i minst to timer og til blodtrykket har stabilisert seg i minst en ekstra time (se pkt. ADVARSLER , og DOSERING OG ADMINISTRASJON ). Når et vanndrivende middel legges til behandlingen til en pasient som får lisinopril, observeres vanligvis en ekstra antihypertensiv effekt (se DOSERING OG ADMINISTRASJON ).
Ikke-steroide antiinflammatoriske midler, inkludert selektive cyklooksygenase-2-hemmere (COX-2-hemmere)
Hos eldre pasienter, volumfattige (inkludert de som får diuretikabehandling), eller med nedsatt nyrefunksjon, kan samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med ACE-hemmere, inkludert lisinopril, føre til forverring av nyrefunksjonen , inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får lisinopril og NSAID-behandling.
Den antihypertensive effekten av ACE-hemmere, inkludert lisinopril, kan svekkes av NSAIDs.
Dobbel blokade av Renin-Angiotensin-systemet (RAS)
Dobbel blokkering av RAS med angiotensinreseptorblokkere, ACE-hemmere eller aliskiren er assosiert med økt risiko for hypotensjon, hyperkalemi og endringer i nyrefunksjon (inkludert akutt nyresvikt) sammenlignet med monoterapi.
VA NEPHRON-studien inkluderte 1448 pasienter med type 2-diabetes, forhøyet urin-albumin-til-kreatinin-ratio og redusert estimert glomerulær filtrasjonshastighet (GFR 30 til 89,9 ml/min), randomiserte dem til lisinopril eller placebo på bakgrunn av losartanbehandling og fulgte dem i en median på 2,2 år. Pasienter som fikk kombinasjonen losartan og lisinopril oppnådde ingen ytterligere fordel sammenlignet med monoterapi for det kombinerte endepunktet med reduksjon i GFR, slutttilstand nyresykdom eller død, men opplevde en økt forekomst av hyperkalemi og akutt nyreskade sammenlignet med monoterapigruppen .
Generelt, unngå kombinert bruk av RAS-hemmere, overvåk nøye blodtrykk, nyrefunksjon og elektrolytter hos pasienter på ZESTORETIC og andre midler som påvirker RAS.
Ikke gi aliskiren samtidig med ZESTORETIC hos pasienter med diabetes. Unngå bruk av aliskiren med ZESTORETIC 5mg hos pasienter med nedsatt nyrefunksjon (GFR
Andre agenter
Lisinopril har blitt brukt samtidig med nitrater og/eller digoksin uten bevis for klinisk signifikante uønskede interaksjoner. Ingen meningsfulle klinisk viktige farmakokinetiske interaksjoner forekom når lisinopril ble brukt samtidig med propranolol, digoksin eller hydroklortiazid. Tilstedeværelsen av mat i magen endrer ikke biotilgjengeligheten av lisinopril.
Midler som øker serumkalium
Lisinopril demper kaliumtap forårsaket av diuretika av tiazidtypen. Bruk av lisinopril med kaliumsparende diuretika (f.eks. spironolakton, eplerenon, triamteren eller amilorid), kaliumtilskudd eller kaliumholdige salterstatninger kan føre til betydelig økning i serumkalium. Derfor, hvis samtidig bruk av disse midlene er indisert, på grunn av påvist hypokalemi, bør de brukes med forsiktighet og med hyppig overvåking av serumkalium.
Litium
Litiumtoksisitet er rapportert hos pasienter som får litium samtidig med legemidler som forårsaker eliminering av natrium, inkludert ACE-hemmere. Litiumtoksisitet var vanligvis reversibel ved seponering av litium og ACE-hemmeren. Det anbefales at serumlitiumnivåer overvåkes ofte hvis lisinopril administreres samtidig med litium.
mTOR (pattedyr Target Of Rapamycin)-hemmere
Pasienter som får samtidig behandling med ACE-hemmer og mTOR-hemmer (f.eks. temsirolimus, sirolimus, everolimus) kan ha økt risiko for angioødem. (se ADVARSLER )
Neprilysin-hemmere
Pasienter som samtidig tar neprilysinhemmere kan ha økt risiko for angioødem. (se ADVARSLER )
Hydroklortiazid
Når de administreres samtidig, kan følgende legemidler interagere med tiaziddiuretika.
Alkohol, barbiturater eller narkotika -potensering av ortostatisk hypotensjon kan forekomme.
Antidiabetika (orale midler og insulin) -dosejustering av det antidiabetiske legemidlet kan være nødvendig.
Andre antihypertensiva -additiv effekt eller potensering.
Kolestyramin og kolestipolharpikser - Absorpsjon av hydroklortiazid er svekket i nærvær av anionbytterharpikser. Enkeltdoser av enten kolestyramin- eller kolestipolharpikser binder hydroklortiazidet og reduserer dets absorpsjon fra mage-tarmkanalen med henholdsvis opptil 85 % og 43 %.
Kortikosteroider, ACTH - forsterket elektrolyttmangel, spesielt hypokalemi.
Pressoraminer (f.eks. noradrenalin) - mulig redusert respons på pressoraminer, men ikke tilstrekkelig til å utelukke bruken av dem.
Skjelettmuskelavslappende midler, ikke-depolariserende (f.eks. tubokurarin) - mulig økt respons på muskelavslappende midler.
Litium -Bør vanligvis ikke gis sammen med vanndrivende midler. Vanndrivende midler reduserer renal clearance av litium og øker risikoen for litiumtoksisitet. Se pakningsvedlegget for litiumpreparater før bruk av slike preparater med ZESTORETIC.
Ikke-steroide antiinflammatoriske legemidler Hos noen pasienter kan administrering av et ikke-steroid antiinflammatorisk middel redusere de vanndrivende, natriuretiske og antihypertensive effektene av loop-, kaliumsparende og tiaziddiuretika. Derfor, når ZESTORETIC og ikke-steroide antiinflammatoriske midler brukes samtidig, bør pasienten følges nøye for å avgjøre om den ønskede effekten av ZESTORETIC 5 mg oppnås.
Gull
Nitritoidreaksjoner (symptomer inkluderer rødme i ansiktet, kvalme, oppkast og hypotensjon) har i sjeldne tilfeller blitt rapportert hos pasienter på behandling med injiserbart gull (natriumaurotiomalat) og samtidig behandling med ACE-hemmere inkludert ZESTORETIC.
ADVARSLER
Lisinopril
Anafylaktoide og muligens relaterte reaksjoner
Antagelig fordi angiotensin-konverterende enzymhemmere påvirker metabolismen av eikosanoider og polypeptider, inkludert endogent bradykinin, kan pasienter som får ACE-hemmere (inkludert ZESTORETIC) bli utsatt for en rekke bivirkninger, noen av dem alvorlige.
Hode og nakke angioødem
Angioødem i ansikt, ekstremiteter, lepper, tunge, glottis og/eller strupehode er rapportert hos pasienter behandlet med angiotensin-konverterende enzymhemmere, inkludert lisinopril. Dette kan oppstå når som helst under behandlingen. ACE-hemmere har vært assosiert med en høyere forekomst av angioødem hos svarte enn hos ikke-svarte pasienter. ZESTORETIC 12,5gmg bør seponeres umiddelbart og passende terapi og overvåking bør gis inntil fullstendig og vedvarende opphør av tegn og symptomer har funnet sted. Selv i de tilfellene hvor hevelse av kun tungen er involvert, uten pustebesvær, kan pasienter kreve langvarig observasjon siden behandling med antihistaminer og kortikosteroider kanskje ikke er tilstrekkelig. Svært sjeldne har dødsfall blitt rapportert på grunn av angioødem assosiert med larynxødem eller tungeødem. Pasienter med involvering av tungen, glottis eller strupehodet vil sannsynligvis oppleve luftveisobstruksjon, spesielt de med en historie med luftveiskirurgi. Der det er involvering av tungen, glottis eller strupehodet som sannsynligvis forårsaker luftveisobstruksjon, bør subkutan epinefrinoppløsning 1:1000 (0,3 ml til 0,5 ml) og/eller nødvendige tiltak for å sikre frie luftveier gis umiddelbart (se BIVIRKNINGER) .
Pasienter som får samtidig administrering av ACE-hemmer og mTOR (pattedyrmål for rapamycin)-hemmer (f.eks. temsirolimus, sirolimus, everolimus) eller en neprilysinhemmer kan ha økt risiko for angioødem (se FORHOLDSREGLER ).
Intestinalt angioødem
Intestinalt angioødem er rapportert hos pasienter behandlet med ACE-hemmere. Disse pasientene fikk magesmerter (med eller uten kvalme eller oppkast); i noen tilfeller var det ingen tidligere angioødem i ansiktet, og C-1-esterasenivåene var normale. Angioødem ble diagnostisert ved prosedyrer inkludert abdominal CT-skanning eller ultralyd, eller ved operasjon, og symptomene forsvant etter seponering av ACE-hemmeren. Intestinalt angioødem bør inkluderes i differensialdiagnosen for pasienter på ACE-hemmere med magesmerter.
Pasienter med angioødem i anamnesen som ikke er relatert til ACE-hemmerbehandling, kan ha økt risiko for angioødem mens de får en ACE-hemmer (se INDIKASJONER og KONTRAINDIKASJONER ).
Anafylaktoide reaksjoner under desensibilisering
To pasienter som gjennomgikk desensibiliserende behandling med hymenoptera-gift mens de fikk ACE-hemmere, fikk livstruende anafylaktoide reaksjoner.
Hos de samme pasientene ble disse reaksjonene unngått når ACE-hemmere ble midlertidig holdt tilbake, men de dukket opp igjen ved utilsiktet ny behandling.
Anafylaktoide reaksjoner under membraneksponering
Tiazidholdige kombinasjonsprodukter anbefales ikke til pasienter med alvorlig nedsatt nyrefunksjon. Plutselige og potensielt livstruende anafylaktoide reaksjoner er rapportert hos noen pasienter dialysert med høyfluxmembraner (f.eks. AN69®**) og behandlet samtidig med en ACE-hemmer. Hos slike pasienter må dialyse stoppes umiddelbart, og aggressiv behandling for anafylaktoide reaksjoner må settes i gang. Symptomer har ikke blitt lindret av antihistaminer i disse situasjonene. Hos disse pasientene bør det vurderes å bruke en annen type dialysemembran eller en annen klasse antihypertensiva. Anafylaktoide reaksjoner er også rapportert hos pasienter som gjennomgår lipoproteinaferese med lav tetthet med dekstransulfatabsorpsjon.
Hypotensjon og relaterte effekter
Overdreven hypotensjon ble sjelden sett hos ukompliserte hypertensive pasienter, men er en mulig konsekvens av bruk av lisinopril hos salt-/volumfattige personer som de som ble kraftig behandlet med diuretika eller pasienter i dialyse (se NARKOTIKAHANDEL og BIVIRKNINGER ).
Synkope er rapportert hos 0,8 prosent av pasientene som får ZESTORETIC. Hos pasienter med hypertensjon som fikk lisinopril alene, var forekomsten av synkope 0,1 prosent. Den totale forekomsten av synkope kan reduseres ved riktig titrering av de individuelle komponentene (se NARKOTIKAHANDEL , BIVIRKNINGER og DOSERING OG ADMINISTRASJON ).
Hos pasienter med alvorlig kongestiv hjertesvikt, med eller uten assosiert nyresvikt, har overdreven hypotensjon blitt observert og kan være assosiert med oliguri og/eller progressiv azotemi, og sjelden med akutt nyresvikt og/eller død. På grunn av potensielt blodtrykksfall hos disse pasientene, bør behandlingen startes under svært nøye medisinsk tilsyn. Slike pasienter bør følges nøye de første to ukene av behandlingen og hver gang dosen av lisinopril og/eller diuretika økes. Lignende hensyn gjelder for pasienter med iskemisk hjerte eller cerebrovaskulær sykdom der et for høyt blodtrykksfall kan resultere i hjerteinfarkt eller cerebrovaskulær ulykke.
Hvis hypotensjon oppstår, bør pasienten plasseres i ryggleie og om nødvendig få en intravenøs infusjon av vanlig saltvann. En forbigående hypotensiv respons er ikke en kontraindikasjon for ytterligere doser som vanligvis kan gis uten problemer når blodtrykket har økt etter volumutvidelse.
Leukopeni/Neutropeni/Agranulocytose
En annen angiotensin-konverterende enzymhemmer, kaptopril, har vist seg å forårsake agranulocytose og benmargsdepresjon, sjelden hos ukompliserte pasienter, men oftere hos pasienter med nedsatt nyrefunksjon, spesielt hvis de også har en kollagen karsykdom. Tilgjengelige data fra kliniske studier med lisinopril er utilstrekkelige til å vise at lisinopril ikke forårsaker agranulocytose i tilsvarende forekomst. Markedsføringserfaring har avdekket sjeldne tilfeller av leukopeni/nøytropeni og benmargsdepresjon der en årsakssammenheng med lisinopril ikke kan utelukkes. Periodisk overvåking av antall hvite blodlegemer hos pasienter med kollagen vaskulær sykdom og nyresykdom bør vurderes.
Leversvikt
sjeldne tilfeller har ACE-hemmere vært assosiert med et syndrom som starter med kolestatisk gulsott eller hepatitt og utvikler seg til fulminant levernekrose og (noen ganger) død. Mekanismen for dette syndromet er ikke forstått. Pasienter som får ACE-hemmere og som utvikler gulsott eller markerte økninger i leverenzymer bør seponere ACE-hemmeren og få passende medisinsk oppfølging.
Fostertoksisitet
Graviditetskategori D
Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer behandlingen med ZESTORETIC så snart som mulig. Disse uønskede utfallene er vanligvis forbundet med bruk av disse stoffene i andre og tredje trimester av svangerskapet. De fleste epidemiologiske studier som undersøker føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester har ikke skilt medisiner som påvirker renin-angiotensin-systemet fra andre antihypertensiva. Riktig behandling av mors hypertensjon under graviditet er viktig for å optimalisere resultatene for både mor og foster.
det uvanlige tilfellet at det ikke er noe passende alternativ til behandling med legemidler som påvirker reninangiotensinsystemet for en bestemt pasient, informere moren om den potensielle risikoen for fosteret. Utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Hvis oligohydramnios observeres, seponer ZESTORETIC, med mindre det anses som livreddende for moren. Fostertesting kan være aktuelt, basert på graviditetsuken. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade. Følg nøye med spedbarn med historier om in utero eksponering for ZESTORETIC for hypotensjon, oliguri og hyperkalemi. (Se FORHOLDSREGLER, Pediatrisk bruk ).
Ingen teratogene effekter av lisinopril ble sett i studier av gravide rotter, mus og kaniner. På mg/kg basis var dosene som ble brukt opptil 625 ganger (i mus), 188 ganger (i rotter) og 0,6 ganger (i kaniner) den maksimale anbefalte dosen til mennesker.
Lisinopril og Hydroklortiazid
Teratogenisitetsstudier ble utført på mus og rotter med opptil 90 mg/kg/dag lisinopril (56 ganger maksimal anbefalt human dose) i kombinasjon med 10 mg/kg/dag hydroklortiazid (2,5 ganger maksimal anbefalt human dose). Maternelle eller føtotoksiske effekter ble ikke sett hos mus med kombinasjonen. Hos rotter forekom redusert vektøkning hos mor og redusert fostervekt ned til 3/10 mg/kg/dag (den laveste dosen som ble testet). Assosiert med den reduserte fostervekten var en forsinkelse i fosterforbening. Den reduserte fostervekten og forsinkelsen i fosterforbening ble ikke sett hos dyr tilsatt saltvann som ble gitt 90/10 mg/kg/dag.
Når det brukes under graviditet, i løpet av andre og tredje trimester, kan ACE-hemmere forårsake skade og til og med død for det utviklende fosteret. Når graviditet oppdages, seponer ZESTORETIC 5mg så snart som mulig ( Se Lisinopril, føtal toksisitet ).
Hydroklortiazid
Akutt nærsynthet og sekundær vinkel-lukkende glaukom
Hydroklortiazid, et sulfonamid, kan forårsake en idiosynkratisk reaksjon, som resulterer i akutt forbigående nærsynthet og akutt vinkel-lukkende glaukom. Symptomer inkluderer akutt innsettende nedsatt synsskarphet eller øyesmerter og oppstår vanligvis innen timer til uker etter medikamentstart. Ubehandlet akutt vinkel-lukkende glaukom kan føre til permanent synstap. Den primære behandlingen er å seponere hydroklortiazid så raskt som mulig. Raske medisinske eller kirurgiske behandlinger må kanskje vurderes hvis det intraokulære trykket forblir ukontrollert. Risikofaktorer for å utvikle akutt lukket vinkelglaukom kan inkludere en historie med sulfonamid- eller penicillinallergi.
Teratogene effekter
Reproduksjonsstudier på kanin, mus og rotte ved doser opp til 100 mg/kg/dag (50 ganger human dose) viste ingen tegn på ytre abnormiteter hos fosteret på grunn av hydroklortiazid. Hydroklortiazid gitt i en to-kulls studie på rotter i doser på 4 mg/kg/dag til 5,6 mg/kg/dag (ca. 1 til 2 ganger vanlig daglig dose hos mennesker) svekket ikke fertiliteten eller ga fødselsavvik hos avkommet. Tiazider krysser placentabarrieren og vises i navlestrengsblod.
Ikke-ratatogene effekter
Disse kan inkludere føtal eller neonatal gulsott, trombocytopeni, og muligens andre bivirkninger har oppstått hos den voksne.
Hydroklortiazid
Tiazider bør brukes med forsiktighet ved alvorlig nyresykdom. Hos pasienter med nyresykdom kan tiazider utløse azotemi. Kumulative effekter av legemidlet kan utvikle seg hos pasienter med nedsatt nyrefunksjon.
Tiazider bør brukes med forsiktighet hos pasienter med nedsatt leverfunksjon eller progressiv leversykdom, siden mindre endringer i væske- og elektrolyttbalansen kan utløse leverkoma.
Følsomhetsreaksjoner kan forekomme hos pasienter med eller uten en historie med allergi eller bronkial astma.
Muligheten for forverring eller aktivering av systemisk lupus erythematosus er rapportert.
Litium bør generelt ikke gis sammen med tiazider (se NARKOTIKAHANDEL , Lisinopril og Hydroklortiazid ).
FORHOLDSREGLER
Generell
Lisinopril
Aortastenose/hypertrofisk kardiomyopati
Som med alle vasodilatorer, bør lisinopril gis med forsiktighet til pasienter med obstruksjon i utstrømningskanalen til venstre ventrikkel.
Nedsatt nyrefunksjon
Som en konsekvens av hemming av renin-angiotensin-aldosteron-systemet, kan endringer i nyrefunksjonen forventes hos følsomme personer. Hos pasienter med alvorlig kongestiv hjertesvikt hvis nyrefunksjon kan avhenge av aktiviteten til renin-angiotensin-aldosteron-systemet, kan behandling med angiotensin-konverterende enzymhemmere, inkludert lisinopril, være assosiert med oliguri og/eller progressiv azotemi og sjelden med akutt nyre. feil og/eller død.
Hos hypertensive pasienter med unilateral eller bilateral nyrearteriestenose kan økning i blodurea-nitrogen og serumkreatinin forekomme. Erfaring med en annen angiotensin-konverterende enzymhemmer tyder på at disse økningene vanligvis er reversible ved seponering av lisinopril og/eller diuretikabehandling. Hos slike pasienter bør nyrefunksjonen overvåkes i løpet av de første ukene av behandlingen.
Noen hypertensive pasienter uten tilsynelatende eksisterende renal vaskulær sykdom har utviklet økninger i blodurea og serumkreatinin, vanligvis mindre og forbigående, spesielt når lisinopril er gitt samtidig med et diuretikum. Dette er mer sannsynlig hos pasienter med tidligere nedsatt nyrefunksjon. Dosereduksjon av lisinopril og/eller seponering av diuretika kan være nødvendig.
Evaluering av den hypertensive pasienten bør alltid inkludere vurdering av nyrefunksjonen (se DOSERING OG ADMINISTRASJON).
Hyperkalemi
kliniske studier forekom hyperkalemi (serumkalium større enn 5,7 mEq/L) hos omtrent 1,4 prosent av hypertensive pasienter behandlet med lisinopril pluss hydroklortiazid. I de fleste tilfeller var dette isolerte verdier som forsvant til tross for fortsatt behandling. Hyperkalemi var ikke en årsak til seponering av behandlingen. Risikofaktorer for utvikling av hyperkalemi inkluderer nyresvikt, diabetes mellitus og samtidig bruk av kaliumsparende diuretika, kaliumtilskudd og/eller kaliumholdige salterstatninger. Hyperkalemi kan forårsake alvorlige, noen ganger dødelige, arytmier. ZESTORETIC bør brukes med forsiktighet, hvis i det hele tatt, med disse midlene og med hyppig overvåking av serumkalium (se NARKOTIKAHANDEL ).
Hoste
Antagelig på grunn av hemming av nedbrytningen av endogent bradykinin, har vedvarende ikke-produktiv hoste blitt rapportert med alle ACE-hemmere, som nesten alltid går over etter seponering av behandlingen. ACE-hemmerindusert hoste bør vurderes ved differensialdiagnose av hoste.
Kirurgi/anestesi
Hos pasienter som gjennomgår større kirurgi eller under anestesi med midler som produserer hypotensjon, kan lisinopril blokkere angiotensin II-dannelse sekundært til kompenserende reninfrigjøring. Hvis hypotensjon oppstår og anses å skyldes denne mekanismen, kan den korrigeres ved volumekspansjon.
Hydroklortiazid
Periodisk bestemmelse av serumelektrolytter for å oppdage mulig elektrolyttubalanse bør utføres med passende intervaller.
Alle pasienter som får tiazidbehandling bør observeres for kliniske tegn på væske- eller elektrolyttubalanse: nemlig hyponatremi, hypokloremisk alkalose og hypokalemi. Serum- og urinelektrolyttbestemmelser er spesielt viktige når pasienten kaster opp for mye eller får parenterale væsker. Advarselstegn eller symptomer på væske- og elektrolyttubalanse, uavhengig av årsak, inkluderer munntørrhet, tørste, svakhet, sløvhet, døsighet, rastløshet, forvirring, anfall, muskelsmerter eller kramper, muskeltretthet, hypotensjon, oliguri, takykardi og gastrointestinale forstyrrelser. som kvalme og oppkast.
Hypokalemi kan utvikles, spesielt med rask diurese, når alvorlig cirrhose er tilstede, eller etter langvarig behandling.
Interferens med tilstrekkelig oralt elektrolyttinntak vil også bidra til hypokalemi. Hypokalemi kan forårsake hjertearytmi og kan også sensibilisere eller overdrive hjertets respons på de toksiske effektene av digitalis (f.eks. økt ventrikulær irritabilitet). Fordi lisinopril reduserer produksjonen av aldosteron, demper samtidig behandling med lisinopril det diuretika-induserte kaliumtapet (se NARKOTIKAHANDEL , Agenter som øker serumkalium ).
Selv om ethvert kloridunderskudd generelt er mildt og vanligvis ikke krever spesifikk behandling, bortsett fra under ekstraordinære omstendigheter (som ved leversykdom eller nyresykdom), kan kloriderstatning være nødvendig ved behandling av metabolsk alkalose.
Fortynningshyponatremi kan forekomme hos ødematøse pasienter i varmt vær; passende terapi er vannrestriksjon, snarere enn administrering av salt, bortsett fra i sjeldne tilfeller når hyponatremien er livstruende. Ved faktisk saltmangel er passende erstatning den foretrukne terapien.
Hyperurikemi kan forekomme eller åpen gikt kan utløses hos enkelte pasienter som får tiazidbehandling.
Hos diabetikere kan det være nødvendig med dosejustering av insulin eller orale hypoglykemiske midler. Hyperglykemi kan forekomme med tiaziddiuretika. Derfor kan latent diabetes mellitus bli manifest under tiazidbehandling.
De antihypertensive effektene av legemidlet kan forsterkes hos pasienten etter sympatektomi.
Hvis progressiv nyresvikt blir tydelig, bør du vurdere å holde tilbake eller seponere diuretikabehandling.
Tiazider har vist seg å øke urinutskillelsen av magnesium; dette kan føre til hypomagnesemi.
Tiazider kan redusere kalsiumutskillelsen i urinen. Tiazider kan forårsake intermitterende og svak økning av serumkalsium i fravær av kjente forstyrrelser i kalsiummetabolismen. Markert hyperkalsemi kan være tegn på skjult hyperparatyreoidisme. Tiazider bør seponeres før det utføres tester for biskjoldbruskfunksjon.
Økning i kolesterol- og triglyseridnivåer kan være assosiert med tiaziddiuretikabehandling.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Lisinopril og hydroklortiazid
Lisinopril i kombinasjon med hydroklortiazid var ikke mutagent i en mikrobiell mutagentest med Salmonella typhimurium (Ames-test) eller Escherichia coli med eller uten metabolsk aktivering eller i en forovermutasjonsanalyse med lungeceller fra kinesisk hamster. Lisinopril og hydroklortiazid ga ikke DNA-enkeltstrengsbrudd i en in vitro alkalisk elueringsanalyse av rottehepatocytter. I tillegg ga det ikke økninger i kromosomavvik i en in vitro-test i eggstokkceller fra kinesisk hamster eller i en in vivo-studie i benmarg hos mus.
Lisinopril
Det var ingen tegn på tumorigen effekt når lisinopril ble administrert i 105 uker til hann- og hunnrotter i doser på opptil 90 mg/kg/dag (ca. 56 eller 9 ganger* den maksimale daglige dosen til mennesker, basert på kroppsvekt og kroppsoverflate henholdsvis området). Det var ingen tegn på karsinogenitet når lisinopril ble administrert i 92 uker til (hann- og hunnmus) i doser på opptil 135 mg/kg/dag (omtrent 84 ganger* den maksimale anbefalte daglige dosen til mennesker). Denne dosen var 6,8 ganger den maksimale humane dosen basert på kroppsoverflate hos mus.
*Beregninger forutsetter en menneskevekt på 50 kg og kroppsoverflate på 1,62 m2.
Lisinopril var ikke mutagent i Ames mikrobielle mutagentest med eller uten metabolsk aktivering. Det var også negativt i en forovermutasjonsanalyse med lungeceller fra kinesisk hamster. Lisinopril produserte ikke enkelttråds DNA-brudd i en in vitro alkalisk elueringsanalyse av rottehepatocytter. I tillegg ga ikke lisinopril økninger i kromosomavvik i en in vitro-test i eggstokkceller fra kinesisk hamster eller i en in vivo-studie i benmarg hos mus.
Det var ingen bivirkninger på reproduksjonsevnen hos hann- og hunnrotter behandlet med opptil 300 mg/kg/dag lisinopril. Denne dosen er 188 ganger og 30 ganger maksimal daglig dose for mennesker basert på henholdsvis mg/kg og mg/m2.
Hydroklortiazid
To-årige fôringsstudier på mus og rotter utført i regi av National Toxicology Program (NTP) avdekket ingen bevis på et kreftfremkallende potensial for hydroklortiazid hos hunnmus (ved doser på opptil ca. 600 mg/kg/dag) eller hos hanner. og hunnrotter (ved doser på opptil ca. 100 mg/kg/dag). Disse dosene er 150 ganger og 12 ganger for mus og 25 ganger og 4 ganger for rotter den maksimale menneskelige daglige dosen basert på henholdsvis mg/kg og mg/m2. NTP fant imidlertid tvetydige bevis for hepatokarsinogenitet hos hannmus.
Hydroklortiazid var ikke genotoksisk in vitro i Ames-mutagenisitetsanalysen av Salmonella typhimurium-stammer TA 98, TA 100, TA 1535, TA 1537 og TA 1538 og i Chinese Hamster Ovary (CHO)-testen for kromosomavvik ved bruk av vibrasjoner, eller musekimcellekromosomer, benmargskromosomer fra kinesisk hamster og det kjønnsbundne recessive dødelige trekkgenet Drosophila. Positive testresultater ble kun oppnådd i in vitro CHO Sister Chromatid Exchange (klastogenesitet) og i muselymfomcelle (mutagenisitet) assayene, ved bruk av konsentrasjoner av hydroklortiazid fra 43 mcg/mL til 1300 mcg/mL, og i Aspergillus nidulans nondisjunction assay i en uspesifisert konsentrasjon.
Hydroklortiazid hadde ingen negative effekter på fertiliteten til mus og rotter av begge kjønn i studier der disse artene ble eksponert, via kostholdet, for doser på henholdsvis opptil 100 mg/kg og 4 mg/kg før unnfangelse og gjennom hele svangerskapet. . Hos mus er denne dosen 25 ganger og 2 ganger maksimal daglig dose for mennesker basert på henholdsvis mg/kg og mg/m2. Hos rotter er denne dosen 1 ganger og 0,2 ganger maksimal daglig dose for mennesker basert på henholdsvis mg/kg og mg/m2.
Ammende mødre
Det er ikke kjent om lisinopril skilles ut i morsmelk. Imidlertid inneholder melk fra diegivende rotter radioaktivitet etter administrering av 14C lisinopril. I en annen studie var lisinopril tilstede i rottemelk i nivåer som ligner på plasmanivåer i mor. Tiazider forekommer i morsmelk. På grunn av potensialet for alvorlige bivirkninger hos ammende spedbarn fra ACE-hemmere og hydroklortiazid, bør det tas en beslutning om å avbryte ammingen og/eller seponere ZESTORETIC 12,5gmg, tatt i betraktning stoffets betydning for moren.
Pediatrisk bruk
Nyfødte med en historie med i utero eksponering for ZESTORETIC
Hvis oliguri eller hypotensjon oppstår, må du rette oppmerksomheten mot støtte av blodtrykk og nyreperfusjon. Utvekslingstransfusjoner eller dialyse kan være nødvendig som et middel for å reversere hypotensjon og/eller erstatte forstyrret nyrefunksjon. Lisinopril, som krysser placenta, har blitt fjernet fra neonatal sirkulasjon ved peritonealdialyse med en viss klinisk fordel, og kan teoretisk fjernes ved byttetransfusjon, selv om det ikke er erfaring med sistnevnte prosedyre.
Sikkerhet og effektivitet hos pediatriske pasienter er ikke fastslått.
Geriatrisk bruk
Kliniske studier av ZESTORETIC mg inkluderte ikke tilstrekkelig antall forsøkspersoner i alderen 65 år og over til å avgjøre om de responderer annerledes enn yngre forsøkspersoner. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter. Generelt bør dosevalg for en eldre pasient være forsiktig, vanligvis fra den lave enden av doseringsområdet, noe som gjenspeiler den høyere frekvensen av nedsatt lever-, nyre- eller hjertefunksjon, og samtidig sykdom eller annen medikamentell behandling.
Dette legemidlet er kjent for å utskilles i stor grad av nyrene, og risikoen for toksiske reaksjoner på dette legemidlet kan være større hos pasienter med nedsatt nyrefunksjon. Fordi det er mer sannsynlig at eldre pasienter har nedsatt nyrefunksjon, bør det utvises forsiktighet ved doseringsvalg. Evaluering av den hypertensive pasienten bør alltid inkludere vurdering av nyrefunksjonen.
OVERDOSE
Ingen spesifikk informasjon er tilgjengelig om behandling av overdosering med ZESTORETIC. Behandlingen er symptomatisk og støttende. Behandling med ZESTORETIC 12,5gmg bør seponeres og pasienten observeres nøye. Foreslåtte tiltak inkluderer induksjon av brekninger og/eller mageskylling, og korrigering av dehydrering, elektrolyttubalanse og hypotensjon ved etablerte prosedyrer.
Lisinopril
Etter en enkelt oral dose på 20 g/kg forekom ingen dødelighet hos rotter, og døden skjedde hos en av 20 mus som fikk samme dose. Den mest sannsynlige manifestasjonen av overdosering vil være hypotensjon, hvor den vanlige behandlingen vil være intravenøs infusjon av normal saltvannsoppløsning.
Lisinopril kan fjernes ved hemodialyse (se ADVARSLER , Anafylaktoid reaksjon under membraneksponering ).
Hydroklortiazid
Oral administrering av en enkelt oral dose på 10 g/kg til mus og rotter var ikke dødelig. De vanligste tegnene og symptomene som er observert er de forårsaket av elektrolyttmangel (hypokalemi, hypokloremi, hyponatremi) og dehydrering som følge av overdreven diurese. Hvis digitalis også har blitt administrert, kan hypokalemi fremheve hjertearytmier.
KONTRAINDIKASJONER
ZESTORETIC 12,5 g er kontraindisert hos pasienter som er overfølsomme overfor dette produktet og hos pasienter med tidligere angioødem relatert til tidligere behandling med en angiotensinkonverterende enzymhemmer og hos pasienter med arvelig eller idiopatisk angioødem. På grunn av hydroklortiazid-komponenten er dette produktet kontraindisert hos pasienter med anuri eller overfølsomhet overfor andre sulfonamid-avledede legemidler.
ZESTORETIC 12,5 g er kontraindisert i kombinasjon med en neprilysinhemmer (f.eks. sacubitril). Ikke administrer ZESTORETIC 5 mg innen 36 timer etter bytte til eller fra sacubitril/valsartan, en neprilysinhemmer (se ADVARSLER ).
Ikke gi aliskiren samtidig med ZESTORETIC hos pasienter med diabetes (se NARKOTIKAHANDEL ).
KLINISK FARMAKOLOGI
Lisinopril og hydroklortiazid
Som et resultat av dets vanndrivende effekt øker hydroklortiazid plasmareninaktiviteten, øker aldosteronsekresjonen og reduserer serumkalium. Administrering av lisinopril blokkerer reninangiotensinaldosteronaksen og har en tendens til å reversere kaliumtapet forbundet med diuretikaet.
I kliniske studier var graden av blodtrykksreduksjon sett med kombinasjonen av lisinopril og hydroklortiazid tilnærmet additiv. ZESTORETIC 10-12.5-kombinasjonen fungerte like godt hos svarte og hvite pasienter. Kombinasjonene ZESTORETIC 20-12.5 og ZESTORETIC 20-25 virket noe mindre effektive hos svarte pasienter, men relativt få svarte pasienter ble studert. Hos de fleste pasienter ble den antihypertensive effekten av ZESTORETIC opprettholdt i minst 24 timer.
en randomisert, kontrollert sammenligning var de gjennomsnittlige antihypertensive effektene av ZESTORETIC 20-12.5 og ZESTORETIC 20-25 like, noe som tyder på at mange pasienter som responderer adekvat på sistnevnte kombinasjon kan kontrolleres med ZESTORETIC 20-12.5 (se DOSERING OG ADMINISTRASJON ).
Samtidig administrering av lisinopril og hydroklortiazid har liten eller ingen effekt på biotilgjengeligheten til begge legemidlene. Kombinasjonstabletten er bioekvivalent med samtidig administrering av de separate enhetene.
Lisinopril
Virkningsmekanismen
Lisinopril hemmer angiotensin-konverterende enzym (ACE) hos mennesker og dyr. ACE er en peptidyldipeptidase som katalyserer omdannelsen av angiotensin I til vasokonstriktorstoffet, angiotensin II. Angiotensin II stimulerer også aldosteronsekresjon av binyrebarken. Hemming av ACE resulterer i redusert plasmaangiotensin II som fører til redusert vasopressoraktivitet og til redusert aldosteronsekresjon. Sistnevnte reduksjon kan resultere i en liten økning av serumkalium. Fjerning av angiotensin II negativ tilbakemelding på reninsekresjon fører til økt plasmareninaktivitet. Hos hypertensive pasienter med normal nyrefunksjon behandlet med lisinopril alene i opptil 24 uker, var den gjennomsnittlige økningen i serumkalium mindre enn 0,1 mEq/L; imidlertid hadde omtrent 15 prosent av pasientene økninger større enn 0,5 mEq/L og omtrent seks prosent hadde en reduksjon større enn 0,5 mEq/L. I den samme studien viste pasienter behandlet med lisinopril pluss et tiaziddiuretikum praktisk talt ingen endring i serumkalium (se FORHOLDSREGLER ).
ACE er identisk med kininase, et enzym som bryter ned bradykinin. Hvorvidt økte nivåer av bradykinin, et potent vasodepressorpeptid, spiller en rolle i de terapeutiske effektene av lisinopril gjenstår å belyse.
Mens mekanismen som lisinopril senker blodtrykket antas å være primært undertrykkelse av renin-angiotensin-aldosteron-systemet, er lisinopril antihypertensiv selv hos pasienter med lav-renin hypertensjon. Selv om lisinopril var antihypertensiv i alle undersøkte raser, hadde svarte hypertensive pasienter (vanligvis en lav-renin hypertensiv populasjon) en lavere gjennomsnittlig respons på lisinopril monoterapi enn ikke-svarte pasienter.
Farmakokinetikk og metabolisme
Etter oral administrering av lisinopril oppstår maksimale serumkonsentrasjoner innen ca. 7 timer. Synkende serumkonsentrasjoner viser en forlenget terminalfase som ikke bidrar til legemiddelakkumulering. Denne terminale fasen representerer sannsynligvis metningsbar binding til ACE og er ikke proporsjonal med dose. Lisinopril ser ikke ut til å være bundet til andre serumproteiner.
Lisinopril metaboliseres ikke og utskilles uendret helt i urinen. Basert på uringjenvinning er gjennomsnittlig absorpsjonsgrad av lisinopril ca. 25 prosent, med stor variasjon mellom individene (6 % til 60 %) ved alle testede doser (5 mg til 80 mg). Lisinoprilabsorpsjon påvirkes ikke av tilstedeværelsen av mat i mage-tarmkanalen.
Ved gjentatt dosering viser lisinopril en effektiv akkumuleringshalveringstid på 12 timer.
Nedsatt nyrefunksjon reduserer eliminasjonen av lisinopril, som hovedsakelig utskilles gjennom nyrene, men denne reduksjonen blir klinisk viktig først når den glomerulære filtrasjonshastigheten er under 30 ml/min. Over denne glomerulære filtrasjonshastigheten er eliminasjonshalveringstiden lite endret. Med større svekkelse øker imidlertid topp- og bunnnivået av lisinopril, tiden til toppkonsentrasjonen øker og tiden til å oppnå steady state forlenges. Eldre pasienter har i gjennomsnitt (omtrent doblet) høyere blodnivåer og areal under plasmakonsentrasjonstidskurven (AUC) enn yngre pasienter (se DOSERING OG ADMINISTRASJON ). I en farmakokinetisk flerdosestudie hos eldre versus unge hypertensive pasienter som brukte lisinopril/hydroklortiazid-kombinasjonen, økte AUC ca. 120 % for lisinopril og ca. 80 % for hydroklortiazid hos eldre pasienter. Lisinopril kan fjernes ved hemodialyse.
Studier på rotter indikerer at lisinopril krysser blod-hjerne-barrieren dårlig. Flere doser lisinopril hos rotter resulterer ikke i akkumulering i noe vev; melk fra diegivende rotter inneholder imidlertid radioaktivitet etter administrering av 14C lisinopril. Ved autoradiografi av hele kroppen ble radioaktivitet funnet i morkaken etter administrering av merket medikament til gravide rotter, men ingen ble funnet i fostrene.
Farmakodynamikk
Administrering av lisinopril til pasienter med hypertensjon resulterer i en reduksjon av liggende og stående blodtrykk i omtrent samme grad uten kompensatorisk takykardi. Symptomatisk postural hypotensjon observeres vanligvis ikke selv om den kan forekomme og bør forventes hos pasienter med volum og/eller saltfattige (se ADVARSLER ).
Hos de fleste studerte pasienter ble antihypertensiv aktivitet sett én time etter oral administrering av en individuell dose lisinopril, med maksimal reduksjon av blodtrykket oppnådd med seks timer.
Hos noen pasienter kan oppnåelse av optimal blodtrykksreduksjon kreve to til fire ukers behandling.
Ved anbefalte daglige enkeltdoser har den antihypertensive effekten blitt opprettholdt i minst 24 timer etter dosering, selv om effekten etter 24 timer var vesentlig mindre enn effekten seks timer etter dosering.
De antihypertensive effektene av lisinopril har fortsatt under langtidsbehandling. Brå seponering av lisinopril har ikke vært assosiert med en rask økning i blodtrykket; heller ikke med et betydelig overskudd av blodtrykket før behandling.
hemodynamiske studier hos pasienter med essensiell hypertensjon ble blodtrykksreduksjon ledsaget av en reduksjon i perifer arteriell motstand med liten eller ingen endring i hjertevolum og hjertefrekvens. I en studie med ni hypertensive pasienter, etter administrering av lisinopril, var det en økning i gjennomsnittlig renal blodstrøm som ikke var signifikant. Data fra flere små studier er inkonsistente med hensyn til effekten av lisinopril på glomerulær filtrasjonshastighet hos hypertensive pasienter med normal nyrefunksjon, men tyder på at endringer, hvis noen, ikke er store.
Hos pasienter med renovaskulær hypertensjon har lisinopril vist seg å være godt tolerert og effektivt til å kontrollere blodtrykket (se FORHOLDSREGLER ).
Hydroklortiazid
Mekanismen for den antihypertensive effekten av tiazider er ukjent. Tiazider påvirker vanligvis ikke normalt blodtrykk.
Hydroklortiazid er et vanndrivende og antihypertensivt middel. Det påvirker den distale renale tubulære mekanismen for elektrolyttreabsorpsjon. Hydroklortiazid øker utskillelsen av natrium og klorid i omtrent like store mengder. Natriurese kan være ledsaget av noe tap av kalium og bikarbonat.
Etter oral bruk begynner diuresen innen to timer, topper etter omtrent fire timer og varer i omtrent 6 til 12 timer.
Hydroklortiazid metaboliseres ikke, men elimineres raskt av nyrene. Når plasmanivåene er fulgt i minst 24 timer, har plasmahalveringstiden blitt observert å variere mellom 5,6 og 14,8 timer. Minst 61 prosent av den orale dosen elimineres uendret innen 24 timer. Hydroklortiazid krysser placenta, men ikke blod-hjerne-barrieren.
PASIENTINFORMASJON
Angioødem
Angioødem, inkludert larynxødem, kan oppstå når som helst under behandling med angiotensin-konverterende enzymhemmere, inkludert ZESTORETIC. Pasienter bør informeres og fortelles om umiddelbart å rapportere alle tegn eller symptomer som tyder på angioødem (hevelse i ansikt, ekstremiteter, øyne, lepper, tunge, vanskeligheter med å svelge eller puste) og ikke ta mer medikament før de har rådført seg med den forskrivende legen.
Symptomatisk hypotensjon
Pasienter bør advares om å rapportere svimmelhet, spesielt i løpet av de første dagene av behandlingen. Hvis faktisk synkope oppstår, bør pasientene få beskjed om å seponere medikamentet til de har konsultert den forskrivende legen.
Alle pasienter bør advares om at overdreven svette og dehydrering kan føre til et for høyt blodtrykksfall på grunn av reduksjon i væskevolum. Andre årsaker til volummangel som oppkast eller diaré kan også føre til blodtrykksfall; Pasienter bør rådes til å konsultere legen sin.
Hyperkalemi
Pasienter bør fortelles om ikke å bruke salterstatninger som inneholder kalium uten å konsultere legen sin.
Leukopeni/Neutropeni
Pasienter bør få beskjed om å rapportere omgående enhver indikasjon på infeksjon (f.eks. sår hals, feber) som kan være tegn på leukopeni/nøytropeni.
Svangerskap
Kvinnelige pasienter i fertil alder bør informeres om konsekvensene av eksponering for ZESTORETIC under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Pasienter bør bes om å rapportere graviditet til legen så snart som mulig.
MERK: Som med mange andre legemidler, er visse råd til pasienter som behandles med ZESTORETIC 12,5 g berettiget. Denne informasjonen er ment å hjelpe til med sikker og effektiv bruk av denne medisinen. Det er ikke en avsløring av alle mulige negative eller tiltenkte effekter.
