Prinivil 2.5mg, 5mg, 10mg Lisinopril Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Prinivil 2,5 mg og hvordan brukes det?
Prinivil er et reseptbelagt legemiddel som brukes til å behandle symptomene på høyt blodtrykk (hypertensjon) etter et hjerteinfarkt eller hjertesvikt. Prinivil kan brukes alene eller sammen med andre medisiner.
- . Prinivil tilhører en klasse legemidler som kalles ACE-hemmere. . Det er ikke kjent om Prinivil er trygt og effektivt hos barn under 6 år.
Hva er de mulige bivirkningene av Prinivil?
Prinivil kan forårsake alvorlige bivirkninger inkludert:
- . svimmelhet, . feber, . sår hals, . kvalme, . svakhet, . prikkende følelse, . brystsmerter, . uregelmessige hjerteslag, . tap av bevegelse, . lite eller ingen vannlating, . hevelse i føttene eller anklene, . føler meg sliten, . kortpustet, . smerter i øvre mage, . kløe, . trøtt følelse, . tap av Appetit, . mørk urin, . leirefarget avføring, og . gulfarging av hud eller øyne (gulsott)
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Prinivil 5mg inkluderer:
- . hodepine, . svimmelhet, . hoste, og . brystsmerter
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Prinivil. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
- . Når graviditet oppdages, seponer PRINIVIL så snart som mulig [se ADVARSLER OG FORHOLDSREGLER]. . Legemidler som virker direkte på renin-angiotensin-systemet kan forårsake skade og død for det utviklende fosteret [se ADVARSLER OG FORHOLDSREGLER].
BESKRIVELSE
PRINIVIL inneholder lisinopril, et syntetisk peptidderivat, og en oral, langtidsvirkende angiotensinkonverterende enzymhemmer. Lisinopril er kjemisk beskrevet som (S)-1-[N2-(1-karboksy-3-fenylpropyl)-Llysyl]-L-prolin dihydrat. Dens empiriske formel er C21H31N3O5•2H2O og dens strukturformel er:
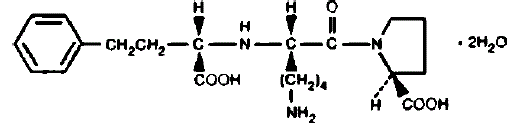
Lisinopril er et hvitt til off-white, krystallinsk pulver, med en molekylvekt på 441,52. Det er løselig i vann og lite løselig i metanol og praktisk talt uløselig i etanol.
PRINIVIL 10 mg leveres som 5 mg, 10 mg og 20 mg tabletter for oral administrering. I tillegg til den aktive ingrediensen, lisinopril, inneholder hver tablett følgende inaktive ingredienser: kalsiumfosfat, mannitol, magnesiumstearat og stivelse. 10 mg og 20 mg tablettene inneholder også jernoksid.
INDIKASJONER
Hypertensjon
PRINIVIL er indisert for behandling av hypertensjon hos voksne pasienter og pediatriske pasienter 6 år og eldre for å senke blodtrykket. Senking av blodtrykket reduserer risikoen for dødelige og ikke-dødelige kardiovaskulære hendelser, først og fremst hjerneslag og hjerteinfarkt. Disse fordelene har blitt sett i kontrollerte studier av antihypertensiva fra en rekke farmakologiske klasser.
Kontroll av høyt blodtrykk bør være en del av omfattende kardiovaskulær risikostyring, inkludert, etter behov, lipidkontroll, diabetesbehandling, antitrombotisk terapi, røykeslutt, trening og begrenset natriuminntak. Mange pasienter vil kreve mer enn 1 medikament for å oppnå blodtrykksmål. For spesifikke råd om mål og ledelse, se publiserte retningslinjer, for eksempel de fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Tallrike antihypertensiva, fra en rekke farmakologiske klasser og med forskjellige virkningsmekanismer, har i randomiserte kontrollerte studier vist seg å redusere kardiovaskulær sykelighet og dødelighet, og det kan konkluderes med at det er blodtrykksreduksjon, og ikke noen annen farmakologisk egenskap av stoffene, som i stor grad er ansvarlig for disse fordelene. Den største og mest konsistente fordelen for kardiovaskulær utfall har vært en reduksjon i risikoen for hjerneslag, men reduksjoner i hjerteinfarkt og kardiovaskulær dødelighet har også blitt sett regelmessig.
Forhøyet systolisk eller diastolisk trykk forårsaker økt kardiovaskulær risiko, og den absolutte risikoøkningen per mmHg er større ved høyere blodtrykk, slik at selv beskjedne reduksjoner av alvorlig hypertensjon kan gi betydelig fordel. Relativ risikoreduksjon fra blodtrykksreduksjon er lik på tvers av populasjoner med varierende absolutt risiko, så den absolutte fordelen er større hos pasienter som har høyere risiko uavhengig av deres hypertensjon (for eksempel pasienter med diabetes eller hyperlipidemi), og slike pasienter kan forventes å dra nytte av mer aggressiv behandling til et lavere blodtrykksmål.
Noen antihypertensiva har mindre blodtrykkseffekter (som monoterapi) hos svarte pasienter, og mange antihypertensiva har ytterligere godkjente indikasjoner og effekter (f.eks. på angina, hjertesvikt eller diabetisk nyresykdom). Disse betraktningene kan lede valg av terapi.
PRINIVIL kan administreres alene eller sammen med andre antihypertensiva [se Kliniske studier ].
Hjertefeil
PRINIVIL er indisert for å redusere tegn og symptomer på hjertesvikt hos pasienter som ikke responderer tilstrekkelig på diuretika og digitalis [se Kliniske studier ].
Akutt hjerteinfarkt
PRINIVIL er indisert for reduksjon av dødelighet ved behandling av hemodynamisk stabile pasienter innen 24 timer etter akutt hjerteinfarkt. Pasienter bør motta, etter behov, standard anbefalte behandlinger som trombolytika, aspirin og betablokkere [se Kliniske studier ].
DOSERING OG ADMINISTRASJON
Hypertensjon
Initial behandling hos voksne: Anbefalt startdose er 10 mg én gang daglig. Juster dosen i henhold til blodtrykksresponsen. Det vanlige doseringsområdet er 20 til 40 mg per dag administrert i en enkelt daglig dose. Doser opp til 80 mg er brukt, men ser ikke ut til å gi større effekt.
Bruk sammen med diuretika hos voksne
Hvis blodtrykket ikke kontrolleres med PRINIVIL 10 mg alene, kan en lav dose av et vanndrivende middel tilsettes (f.eks. hydroklortiazid 12,5 mg).
Anbefalt startdose hos voksne pasienter med hypertensjon som tar diuretika er 5 mg én gang daglig [se NARKOTIKAHANDEL ].
Pediatriske pasienter 6 år og eldre med hypertensjon
For pediatriske pasienter med glomerulær filtrasjonshastighet >30 ml/min/1,73 m² er anbefalt startdose 0,07 mg/kg én gang daglig (opptil 5 mg totalt). Dosering bør justeres i henhold til blodtrykksrespons opp til maksimalt 0,61 mg/kg (opptil 40 mg) én gang daglig. Doser over 0,61 mg/kg (eller over 40 mg) er ikke studert hos pediatriske pasienter [se KLINISK FARMAKOLOGI ].
PRINIVIL 2,5 mg anbefales ikke til pediatriske pasienter Bruk i spesifikke populasjoner og Kliniske studier ].
Hjertefeil
Den anbefalte startdosen for PRINIVIL 2,5 mg, når det brukes sammen med diuretika og (vanligvis) digitalis som tilleggsbehandling er 5 mg én gang daglig. Anbefalt startdose hos disse pasientene med hyponatremi (serumnatrium
Vanndrivende dose må kanskje justeres for å redusere hypovolemi, som kan bidra til hypotensjon [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ]. Forekomsten av hypotensjon etter startdosen av PRINIVIL utelukker ikke påfølgende forsiktig dosetitrering med legemidlet, etter effektiv behandling av hypotensjonen.
Akutt hjerteinfarkt
Hos hemodynamisk stabile pasienter innen 24 timer etter debut av symptomer på akutt hjerteinfarkt, gi PRINIVIL 5 mg oralt, etterfulgt av 5 mg etter 24 timer, 10 mg etter 48 timer og deretter 10 mg én gang daglig. Doseringen bør fortsette i minst 6 uker.
Start behandling med 2,5 mg hos pasienter med lavt systolisk blodtrykk (100-120 mmHg) i løpet av de første 3 dagene etter infarktet [se ADVARSLER OG FORHOLDSREGLER ]. Hvis hypotensjon oppstår (systolisk blodtrykk ≤100 mmHg) bør du vurdere doser på 2,5 eller 5 mg. Hvis det oppstår langvarig hypotensjon (systolisk blodtrykk
Dose hos pasienter med nedsatt nyrefunksjon
Ingen dosejustering av PRINIVIL 2,5 mg er nødvendig hos pasienter med kreatininclearance >30 ml/min. Hos pasienter med kreatininclearance 10-30 ml/min, reduser startdosen av PRINIVIL til halvparten av den vanlige anbefalte dosen (dvs. hypertensjon, 5 mg; hjertesvikt eller akutt MI, 2,5 mg). For pasienter på hemodialyse eller kreatininclearance Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
Forberedelse av suspensjon
For å lage 200 ml av en suspensjon med 1,0 mg/ml, tilsett 10 ml renset vann USP til en polyetylentereftalat (PET)-flaske som inneholder ti 20 mg tabletter med PRINIVIL 5 mg og rist i minst ett minutt. Tilsett 30 mL natriumsitrat og sitronsyre oral løsning eller Cytra-2 fortynningsmiddel og 160 mL Ora-Sweet SF™ til konsentratet i PET-flasken og rist forsiktig i flere sekunder for å spre ingrediensene. Suspensjonen skal oppbevares ved eller under 25°C (77°F) og kan oppbevares i opptil fire uker. Rist suspensjonen før hver bruk.
HVORDAN LEVERES
Doseringsformer og styrker
Tabletter PRINIVIL, 5 mg, er hvite, ovale komprimerte tabletter med kode MSD 19 på den ene siden og delestrek på den andre siden.
Tabletter PRINIVIL, 10 mg, er lysegule, ovale komprimerte tabletter med kode MSD 106 på den ene siden og delestrek på den andre siden.
Tabletter PRINIVIL, 20 mg, er ferskenfargede, ovale komprimerte tabletter med kode MSD 207 på den ene siden og delestrek på den andre siden.
Oppbevaring og håndtering
PRINIVIL 10mg leveres som ovale, komprimerte tabletter med delestrek på den ene siden.
Oppbevaring
Oppbevares ved kontrollert romtemperatur, 15-30°C (59-86°F), og beskytt mot fuktighet.
Dispenser i en tett beholder hvis produktpakken er delt opp.
Distribuert av: Merck Sharp & Dohme Corp., et datterselskap av MERCK & CO., INC., Whitehouse Station, NJ 08889, USA. Revidert: november 2021
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
Hypertensjon
Følgende bivirkninger (hendelser 2 % større på PRINIVIL 5 mg enn på placebo) ble observert med PRINIVIL 2,5 mg vs. placebo: hodepine (5,7 % vs 1,9 %), svimmelhet (5,4 % vs 1,9 %), hoste (3,5 % vs 1,0 % ).
Hjertefeil
kontrollerte studier hos pasienter med hjertesvikt ble behandlingen avbrutt hos 8,1 % av pasientene behandlet med PRINIVIL 10 mg i 12 uker, sammenlignet med 7,7 % av pasientene behandlet med placebo i 12 uker.
Følgende bivirkninger (hendelser 2 % større på PRINIVIL 2,5 mg enn på placebo) ble observert med PRINIVIL vs placebo: hypotensjon (4,4 % vs 0,6 %), brystsmerter (3,4 % vs 1,3 %).
I ATLAS-forsøket [se Kliniske studier ] hos pasienter med hjertesvikt, var seponeringer for bivirkninger lik i lav- og høydosegruppene. Følgende bivirkninger, hovedsakelig relatert til ACE-hemming, ble rapportert mer vanlig i høydosegruppen:
Akutt hjerteinfarkt
Pasienter i GISSI-3-studien, behandlet med PRINIVIL 10 mg, hadde en høyere forekomst av hypotensjon (9,0 % vs 3,7 %) og nedsatt nyrefunksjon (2,4 % vs 1,1 %) sammenlignet med pasienter som ikke tok PRINIVIL.
Andre kliniske bivirkninger som forekommer hos 1 % eller høyere av pasienter med hypertensjon eller hjertesvikt behandlet med PRINIVIL 2,5 mg i kontrollerte kliniske studier og ikke vises i andre deler av merkingen, er oppført nedenfor:
Kroppen som helhet: Tretthet, asteni, ortostatiske effekter.
Fordøyelsessystemet: Pankreatitt, forstoppelse, flatulens, munntørrhet, diaré.
Hematologisk: Sjeldne tilfeller av benmargsdepresjon, hemolytisk anemi, leukopeni/nøytropeni og trombocytopeni.
Endokrine: Diabetes mellitus, upassende antidiuretisk hormonsekresjon.
Metabolsk: Gikt
Hud: Urticaria, alopecia, lysfølsomhet, erytem, rødme, diaforese, kutant pseudolymfom, toksisk epidermal nekrolyse, Stevens-Johnsons syndrom og kløe.
Spesielle sanser: Synstap, diplopi, tåkesyn, tinnitus, fotofobi, smaksforstyrrelser, luktforstyrrelser.
Urogenital: Maktesløshet
Diverse: Et symptomkompleks er rapportert som kan inkludere en positiv ANA, en forhøyet erytrocyttsedimentasjonsrate, artralgi/artritt, myalgi, feber, vaskulitt, eosinofili, leukocytose, parestesi og vertigo. Utslett, lysfølsomhet eller andre dermatologiske manifestasjoner kan forekomme alene eller i kombinasjon med disse symptomene.
Funn fra kliniske laboratorieprøver
Serum kalium
I kliniske studier forekom hyperkalemi (serumkalium >5,7 mEq/L) hos 2,2 % og 4,8 % av PRINIVIL-behandlede pasienter med henholdsvis hypertensjon og hjertesvikt [se ADVARSLER OG FORHOLDSREGLER ].
Kreatinin, Blod Urea Nitrogen
Mindre økninger i blodurea-nitrogen og serumkreatinin, reversible ved seponering av behandlingen, ble observert hos ca. 2 % av pasientene med hypertensjon behandlet med PRINIVIL 5 mg alene. Økning var mer vanlig hos pasienter som samtidig fikk diuretika og hos pasienter med nyrearteriestenose [se ADVARSLER OG FORHOLDSREGLER ]. Reversible mindre økninger i blodurea-nitrogen og serumkreatinin ble observert hos 11,6 % av pasientene med hjertesvikt ved samtidig diuretikabehandling. Disse abnormitetene forsvant ofte når dosen av diuretika ble redusert.
Pasienter med akutt hjerteinfarkt i GISSI-3-studien behandlet med PRINIVIL hadde en høyere (2,4 % versus 1,1 % i placebo) forekomst av nyresvikt på sykehus og etter 6 uker (økende kreatininkonsentrasjon til over 3 mg/dL eller en dobling eller mer av baseline serumkreatininkonsentrasjonen).
Hemoglobin og hematokrit
Små reduksjoner i hemoglobin (gjennomsnittlig 0,4 mg/dL) og hematokrit (gjennomsnittlig 1,3 %) forekom hyppig hos pasienter behandlet med PRINIVIL 5 mg, men var sjelden av klinisk betydning hos pasienter uten annen årsak til anemi. I kliniske studier avbrøt færre enn 0,1 % av pasientene behandlingen for anemi.
Leverenzymer
I sjeldne tilfeller har forhøyelser av leverenzymer og/eller serumbilirubin forekommet [se ADVARSLER OG FORHOLDSREGLER ].
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av lisinopril etter godkjenning som ikke er inkludert i andre deler av merkingen. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering. Andre reaksjoner inkluderer:
Metabolisme og ernæringsforstyrrelser
Hyponatremi [se ADVARSLER OG FORHOLDSREGLER ], tilfeller av hypoglykemi hos diabetespasienter på orale antidiabetika eller insulin [se NARKOTIKAHANDEL ]
Nervesystemet og psykiatriske lidelser
Humørsendringer (inkludert depressive symptomer), mental forvirring
NARKOTIKAHANDEL
Diuretika
Oppstart av PRINIVIL hos pasienter på diuretika kan føre til for sterk reduksjon av blodtrykket. Muligheten for hypotensive effekter med PRINIVIL kan minimeres ved enten å redusere eller seponere diuretikumet eller øke saltinntaket før oppstart av behandling med PRINIVIL. Hvis dette ikke er mulig, reduser startdosen av PRINIVIL [se DOSERING OG ADMINISTRASJON og ADVARSLER OG FORHOLDSREGLER ].
PRINIVIL 2,5 mg demper kaliumtap forårsaket av diuretika av tiazidtypen. Kaliumsparende diuretika (spironolakton, amilorid, triamteren og andre) eller andre legemidler som kan øke serumkalium kan øke risikoen for hyperkalemi. Derfor, hvis samtidig bruk av slike midler er indisert, overvåk pasientens serumkalium ofte.
Antidiabetikere
Samtidig administrering av PRINIVIL 10 mg og antidiabetika (insuliner, orale hypoglykemiske midler) kan forårsake en økt blodsukkersenkende effekt med risiko for hypoglykemi.
Ikke-steroide antiinflammatoriske midler, inkludert selektive cyklooksygenase-2-hemmere (COX-2-hemmere)
Hos eldre pasienter, volumdepletert (inkludert de som får diuretikabehandling), eller med nedsatt nyrefunksjon, kan samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med ACE-hemmere, inkludert lisinopril, føre til forverring av nyrefunksjonen, inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får lisinopril og NSAID-behandling.
Den antihypertensive effekten av ACE-hemmere, inkludert lisinopril, kan svekkes av NSAIDs.
Dobbel blokade av Renin-Angiotensin-systemet (RAS)
Dobbel blokkering av RAS med angiotensinreseptorblokkere, ACE-hemmere eller direkte reninhemmere (som aliskiren) er assosiert med økt risiko for hypotensjon, synkope, hyperkalemi og endringer i nyrefunksjon (inkludert akutt nyresvikt) sammenlignet med monoterapi.
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D)-studien inkluderte 1448 pasienter med type 2-diabetes, forhøyet urin-albumin-til-kreatinin-forhold og redusert estimert glomerulær filtrasjonshastighet (GFR 30 til 89,9 ml/min), randomiserte dem til lisinopril eller placebo på bakgrunn av losartanbehandling og fulgte dem i median på 2,2 år. Pasienter som fikk kombinasjonen losartan og lisinopril oppnådde ingen ytterligere fordel sammenlignet med monoterapi for det kombinerte endepunktet med reduksjon i GFR, nyresykdom i sluttstadiet eller død, men opplevde en økt forekomst av hyperkalemi og akutt nyreskade sammenlignet med monoterapigruppen .
Generelt, unngå kombinert bruk av RAS-hemmere. Overvåk blodtrykk, nyrefunksjon og elektrolytter hos pasienter på PRINIVIL 5mg og andre midler som påvirker RAS.
Ikke gi aliskiren samtidig med PRINIVIL hos pasienter med diabetes. Unngå bruk av aliskiren med PRINIVIL 2,5 mg hos pasienter med nedsatt nyrefunksjon (GFR
Litium
Litiumtoksisitet er rapportert hos pasienter som får litium samtidig med legemidler som forårsaker eliminering av natrium, inkludert ACE-hemmere. Litiumtoksisitet var vanligvis reversibel ved seponering av litium og ACE-hemmeren. Overvåk serumlitiumnivået ved samtidig bruk.
Gull
Nitritoidreaksjoner (symptomer inkluderer rødme i ansiktet, kvalme, oppkast og hypotensjon) er rapportert i sjeldne tilfeller hos pasienter på behandling med injiserbart gull (natriumaurotiomalat) og samtidig behandling med ACE-hemmere inkludert PRINIVIL.
Pattedyrmål for Rapamycin (mTOR)-hemmere
Pasienter som samtidig tar behandling med mTOR-hemmere (f.eks. temsirolimus, sirolimus, everolimus) kan ha økt risiko for angioødem [se ADVARSLER OG FORHOLDSREGLER ].
Neprilysin-hemmere
Pasienter som samtidig tar en neprilysinhemmer (f.eks. sacubitril) kan ha økt risiko for angioødem [se KONTRAINDIKASJONER og ADVARSLER OG FORHOLDSREGLER ].
ADVARSLER
Inkludert som en del av FORHOLDSREGLER seksjon.
FORHOLDSREGLER
Fostertoksisitet
PRINIVIL kan forårsake fosterskader når det administreres til en gravid kvinne. Bruk av legemidler som virker på reninangiotensinsystemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer PRINIVIL så snart som mulig [se Bruk i spesifikke populasjoner ].
Angioødem og anafylaktoide reaksjoner
Angioødem
Hode og nakke angioødem
Angioødem i ansikt, ekstremiteter, lepper, tunge, glottis og/eller strupehode, inkludert noen fatale reaksjoner, har oppstått hos pasienter behandlet med angiotensinkonverterende enzymhemmere, inkludert PRINIVIL, når som helst under behandlingen. Pasienter med involvering av tungen, glottis eller strupehodet vil sannsynligvis oppleve luftveisobstruksjon, spesielt de med en historie med luftveiskirurgi. PRINIVIL 5mg bør seponeres umiddelbart og passende behandling og overvåking bør gis inntil fullstendig og vedvarende opphør av tegn og symptomer på angioødem har oppstått.
Pasienter med angioødem i anamnesen som ikke er relatert til ACE-hemmerbehandling kan ha økt risiko for angioødem mens de får en ACE-hemmer [se KONTRAINDIKASJONER ]. ACE-hemmere har vært assosiert med en høyere forekomst av angioødem hos svarte enn hos ikke-svarte pasienter.
Pasienter som samtidig får behandling med ACE-hemmer og mTOR (pattedyr målet for rapamycin)-hemmer (f.eks. temsirolimus, sirolimus, everolimus) kan ha økt risiko for angioødem [se NARKOTIKAHANDEL ].
Pasienter som får samtidig behandling med ACE-hemmer og neprilysinhemmer kan ha økt risiko for angioødem [se KONTRAINDIKASJONER og NARKOTIKAHANDEL ].
Intestinalt angioødem
Intestinalt angioødem har forekommet hos pasienter behandlet med ACE-hemmere. Disse pasientene fikk magesmerter (med eller uten kvalme eller oppkast); i noen tilfeller var det ingen tidligere angioødem i ansiktet, og C-1-esterasenivåene var normale. I noen tilfeller ble angioødem diagnostisert ved prosedyrer inkludert abdominal CT-skanning eller ultralyd, eller ved operasjon, og symptomene forsvant etter seponering av ACE-hemmeren.
Anafylaktoide reaksjoner
Anafylaktoide reaksjoner under desensibilisering
To pasienter som gjennomgikk desensibiliserende behandling med Hymenoptera-gift mens de fikk ACE-hemmere, fikk livstruende anafylaktoide reaksjoner.
Anafylaktoide reaksjoner under dialyse
Plutselige og potensielt livstruende anafylaktoide reaksjoner har forekommet hos noen pasienter dialysert med høyfluxmembraner og behandlet samtidig med en ACE-hemmer. Hos slike pasienter må dialyse stoppes umiddelbart, og aggressiv behandling for anafylaktoide reaksjoner må settes i gang. Symptomer har ikke blitt lindret av antihistaminer i disse situasjonene. Hos disse pasientene bør det vurderes å bruke en annen type dialysemembran eller en annen klasse antihypertensiva. Anafylaktoide reaksjoner er også rapportert hos pasienter som gjennomgår lipoproteinaferese med lav tetthet med dekstransulfatabsorpsjon.
Nedsatt nyrefunksjon
Overvåk nyrefunksjonen regelmessig hos pasienter som behandles med PRINIVIL. Endringer i nyrefunksjonen inkludert akutt nyresvikt kan være forårsaket av legemidler som hemmer renin-angiotensin-systemet. Pasienter hvis nyrefunksjon delvis kan avhenge av aktiviteten til renin-angiotensin-systemet (f.eks. pasienter med nyrearteriestenose, kronisk nyresykdom, alvorlig kongestiv hjertesvikt, post-myokardinfarkt eller volumdeplesjon) kan ha særlig risiko for å utvikle akutt nyresvikt på PRINIVIL. Vurder å holde tilbake eller avbryte behandlingen hos pasienter som utvikler en klinisk signifikant reduksjon i nyrefunksjonen på PRINIVIL [se BIVIRKNINGER og NARKOTIKAHANDEL ].
Hypotensjon
PRINIVIL kan forårsake symptomatisk hypotensjon, noen ganger komplisert av oliguri, progressiv azotemi, akutt nyresvikt eller død. Pasienter med risiko for overdreven hypotensjon inkluderer de med følgende tilstander eller egenskaper: hjertesvikt med systolisk blodtrykk under 100 mmHg, iskemisk hjertesykdom, cerebrovaskulær sykdom, hyponatremi, høydose diuretikabehandling, nyredialyse eller alvorlig volum- og/eller saltmangel. av enhver etiologi.
Hos disse pasientene, start PRINIVIL under medisinsk tilsyn og følg slike pasienter de første to ukene av behandlingen og når dosen av PRINIVIL og/eller diuretika økes. Unngå bruk av PRINIVIL 2,5 mg hos pasienter som er hemodynamisk ustabile etter akutt hjerteinfarkt.
Symptomatisk hypotensjon er også mulig hos pasienter med alvorlig aortastenose eller hypertrofisk kardiomyopati.
Kirurgi/anestesi
Hos pasienter som gjennomgår større kirurgi eller under anestesi med midler som produserer hypotensjon, kan PRINIVIL blokkere angiotensin II-dannelse sekundært til kompenserende reninfrigjøring. Hvis hypotensjon oppstår og anses å skyldes denne mekanismen, kan den korrigeres ved volumekspansjon.
Hyperkalemi
Overvåk serumkalium regelmessig hos pasienter som får PRINIVIL. Legemidler som hemmer reninangiotensinsystemet kan forårsake hyperkalemi. Risikofaktorer for utvikling av hyperkalemi inkluderer nyresvikt, diabetes mellitus og samtidig bruk av kaliumsparende diuretika, kaliumtilskudd, kaliumholdige salterstatninger eller andre legemidler som kan øke serumkalium [se NARKOTIKAHANDEL ].
Leversvikt
ACE-hemmere har vært assosiert med et syndrom som starter med kolestatisk gulsott eller hepatitt og utvikler seg til fulminant levernekrose og noen ganger død. Mekanismen for dette syndromet er ikke forstått. Pasienter som får ACE-hemmere og som utvikler gulsott eller markerte forhøyelser av leverenzymer bør seponere ACE-hemmeren og få passende medisinsk behandling.
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Det var ingen tegn på tumorigen effekt når lisinopril ble administrert i 105 uker til hann- og hunnrotter i doser opptil 90 mg per kg per dag eller i 92 uker til hann- og hunnmus i doser opptil 135 mg per kg per dag. Disse dosene er henholdsvis 10 ganger og 7 ganger MRHDD sammenlignet med kroppsoverflate.
Lisinopril var ikke mutagent i Ames mikrobielle mutagentest med eller uten metabolsk aktivering. Det var også negativt i en forovermutasjonsanalyse med lungeceller fra kinesisk hamster. Lisinopril produserte ikke enkelttråds DNA-brudd i en in vitro alkalisk elueringsanalyse av rottehepatocytter. I tillegg ga ikke lisinopril økninger i kromosomavvik i en in vitro-test i eggstokkceller fra kinesisk hamster eller i en in vivo-studie i benmarg hos mus.
Det var ingen negative effekter på reproduksjonsevnen hos hann- og hunnrotter behandlet med opptil 300 mg/kg/dag lisinopril (33 ganger MRHDD sammenlignet med kroppsoverflate).
Studier på rotter indikerer at lisinopril krysser blod-hjernebarrieren dårlig. Flere doser lisinopril hos rotter resulterer ikke i akkumulering i noe vev. Melk fra diegivende rotter inneholder radioaktivitet etter administrering av 14C lisinopril. Ved autoradiografi av hele kroppen ble radioaktivitet funnet i morkaken etter administrering av merket medikament til gravide rotter, men ingen ble funnet i fostrene.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
PRINIVIL kan forårsake fosterskader når det administreres til en gravid kvinne. Bruk av legemidler som virker på reninangiotensinsystemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. De fleste epidemiologiske studier som undersøker føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester, har ikke skilt medisiner som påvirker reninangiotensinsystemet fra andre antihypertensiva. Når graviditet oppdages, seponer PRINIVIL 5mg så snart som mulig.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2-4 % og 15-20 %.
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-/fosterrisiko
Hypertensjon i svangerskapet øker mors risiko for svangerskapsforgiftning, svangerskapsdiabetes, for tidlig fødsel og fødselskomplikasjoner (f.eks. behov for keisersnitt og blødning etter fødsel). Hypertensjon øker fosterets risiko for intrauterin vekstbegrensning og intrauterin død. Gravide kvinner med hypertensjon bør overvåkes nøye og behandles deretter.
Fetale/neonatale bivirkninger
Oligohydramnios hos gravide kvinner som bruker legemidler som påvirker renin-angiotensin-systemet i andre og tredje trimester av svangerskapet kan resultere i følgende: redusert føtal nyrefunksjon som fører til anuri og nyresvikt, føtal lungehypoplasi og skjelettdeformasjoner, inkludert hodeskallehypoplasi, hypotensjon , og døden. I det uvanlige tilfellet at det ikke finnes noen passende alternativ behandling til legemidler som påvirker renin-angiotensin-systemet for en bestemt pasient, informere moren om den potensielle risikoen for fosteret.
Hos pasienter som tar PRINIVIL under graviditet, utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Fostertesting kan være aktuelt, basert på svangerskapsuken. Hvis oligohydramnios observeres, seponer PRINIVIL 10 mg, med mindre det anses som livreddende for moren. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade.
Følg nøye med spedbarn med historier om in utero eksponering for PRINIVIL for hypotensjon, oliguri og hyperkalemi. Hos nyfødte med en historie med in utero eksponering for PRINIVIL, hvis oliguri eller hypotensjon oppstår, støtte blodtrykk og nyreperfusjon. Utvekslingstransfusjoner eller dialyse kan være nødvendig som et middel for å reversere hypotensjon og/eller erstatte forstyrret nyrefunksjon.
Amming
Risikosammendrag
Det er ingen tilgjengelige data angående tilstedeværelsen av lisinopril i morsmelk eller effekten av lisinopril på spedbarn som ammes eller på melkeproduksjonen. Lisinopril finnes i rottemelk. Fordi mange legemidler skilles ut i morsmelk, og på grunn av potensialet for alvorlige bivirkninger hos spedbarn som ammes fra ACE-hemmere, må du avbryte ammingen eller avslutte behandlingen med PRINIVIL.
Pediatrisk bruk
Antihypertensive effekter og sikkerhet av PRINIVIL er etablert hos pediatriske pasienter i alderen 6 til 16 år [se DOSERING OG ADMINISTRASJON og Kliniske studier ]. Ingen relevante forskjeller mellom bivirkningsprofilen for pediatriske pasienter og voksne pasienter ble identifisert.
Sikkerhet og effektivitet av PRINIVIL er ikke fastslått hos pediatriske pasienter under 6 år eller hos pediatriske pasienter med glomerulær filtrasjonshastighet KLINISK FARMAKOLOGI og Kliniske studier ].
Geriatrisk bruk
Ingen dosejustering med PRINIVIL 2,5 mg er nødvendig hos eldre pasienter. I en klinisk studie med PRINIVIL 10 mg hos pasienter med hjerteinfarkt (GISSI-3-studie) var 4413 (47%) 65 og over, mens 1656 (18%) var 75 og over. I denne studien avbrøt 4,8 % av pasientene i alderen 75 år og eldre behandling med PRINIVIL 5 mg på grunn av nedsatt nyrefunksjon vs. 1,3 % av pasientene yngre enn 75 år. Ingen andre forskjeller i sikkerhet eller effektivitet ble observert mellom eldre og yngre pasienter, men større sensitivitet hos noen eldre individer kan ikke utelukkes.
Løp
ACE-hemmere, inkludert PRINIVIL, har en effekt på blodtrykket som er mindre hos svarte pasienter enn hos ikke-svarte.
Nedsatt nyrefunksjon
Dosejustering av PRINIVIL er nødvendig hos pasienter som gjennomgår hemodialyse eller hvis kreatininclearance er ≤30 ml/min. Ingen dosejustering av PRINIVIL 5 mg er nødvendig hos pasienter med kreatininclearance >30 ml/min [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ].
OVERDOSE
Etter en enkelt oral dose på 20 g/kg forekom ingen dødelighet hos rotter, og døden skjedde hos en av 20 mus som fikk samme dose. Den mest sannsynlige manifestasjonen av overdosering vil være hypotensjon, hvor den vanlige behandlingen vil være intravenøs infusjon av normal saltvannsoppløsning.
Lisinopril kan fjernes ved hemodialyse [se ADVARSLER OG FORHOLDSREGLER ].
KONTRAINDIKASJONER
PRINIVIL 10 mg er kontraindisert hos pasienter med:
- . en historie med angioødem eller overfølsomhet relatert til tidligere behandling med en angiotensinkonverterende enzymhemmer . arvelig eller idiopatisk angioødem.
Ikke administrer aliskiren samtidig med PRINIVIL 5mg hos pasienter med diabetes [se NARKOTIKAHANDEL ]. PRINIVIL er kontraindisert i kombinasjon med en neprilysinhemmer (f.eks. sacubitril). Ikke administrer PRINIVIL 2,5 mg innen 36 timer etter bytte til eller fra sacubitril/valsartan, et produkt som inneholder en neprilysinhemmer [se ADVARSLER OG FORHOLDSREGLER og NARKOTIKAHANDEL ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Lisinopril hemmer angiotensin-konverterende enzym (ACE) hos mennesker og dyr. ACE er en peptidyldipeptidase som katalyserer omdannelsen av angiotensin I til vasokonstriktorstoffet, angiotensin II. Angiotensin II stimulerer også aldosteronsekresjon av binyrebarken. De gunstige effektene av lisinopril ved hypertensjon og hjertesvikt ser ut til først og fremst å skyldes undertrykkelse av renin-angiotensinaldosteronsystemet. Hemming av ACE resulterer i redusert plasmaangiotensin II som fører til redusert vasopressoraktivitet og til redusert aldosteronsekresjon. Sistnevnte reduksjon kan resultere i en liten økning av serumkalium. Hos hypertensive pasienter med normal nyrefunksjon behandlet med PRINIVIL 10 mg alene i opptil 24 uker, var gjennomsnittlig økning i serumkalium ca. 0,1 mEq/L; Imidlertid hadde omtrent 15 % av pasientene økninger større enn 0,5 mEq/L og omtrent 6 % hadde en reduksjon større enn 0,5 mEq/L. I den samme studien hadde pasienter behandlet med PRINIVIL 2,5 mg og hydroklortiazid i opptil 24 uker en gjennomsnittlig reduksjon i serumkalium på 0,1 mEq/L; ca. 4 % av pasientene hadde økninger større enn 0,5 mEq/L og ca. 12 % hadde en reduksjon større enn 0,5 mEq/L [se ADVARSLER OG FORHOLDSREGLER ]. Fjerning av angiotensin II negativ tilbakemelding på reninsekresjon fører til økt plasmareninaktivitet.
ACE er identisk med kininase, et enzym som bryter ned bradykinin. Hvorvidt økte nivåer av bradykinin, et potent vasodepressorpeptid, spiller en rolle i den terapeutiske effekten av PRINIVIL 5mg gjenstår å avklare.
Mens mekanismen som PRINIVIL 2,5 mg senker blodtrykket er antatt å være primært undertrykkelse av renin-angiotensin-aldosteron-systemet, er PRINIVIL antihypertensiv selv hos pasienter med lav-renin hypertensjon. Selv om PRINIVIL 10 mg var antihypertensiv i alle studerte raser, hadde svarte hypertensive pasienter (vanligvis en lav-renin hypertensiv populasjon) en lavere gjennomsnittlig respons på monoterapi enn ikke-svarte pasienter.
Samtidig administrering av PRINIVIL 5 mg og hydroklortiazid reduserte blodtrykket ytterligere hos svarte og ikke-svarte pasienter, og noen raseforskjell i blodtrykksrespons var ikke lenger tydelig.
Farmakodynamikk
Hypertensjon
Voksne pasienter
Administrering av PRINIVIL til pasienter med hypertensjon resulterer i en reduksjon av liggende og stående blodtrykk i omtrent samme grad uten kompensatorisk takykardi. Symptomatisk postural hypotensjon observeres vanligvis ikke selv om den kan forekomme og bør forventes hos pasienter med volum og/eller saltfattige [se ADVARSLER OG FORHOLDSREGLER ]. Når de gis sammen med diuretika av tiazidtypen, er de blodtrykkssenkende effektene av de to legemidlene tilnærmet additive.
Hos de fleste studerte pasienter ble antihypertensiv aktivitet sett én time etter oral administrering av en individuell dose av PRINIVIL, med maksimal reduksjon av blodtrykket oppnådd etter 6 timer. Selv om en antihypertensiv effekt ble observert 24 timer etter dosering med anbefalte daglige enkeltdoser, var effekten mer konsistent og gjennomsnittlig effekt var betydelig større i enkelte studier med doser på 20 mg eller mer enn ved lavere doser. Ved alle studerte doser var imidlertid den gjennomsnittlige antihypertensive effekten vesentlig mindre 24 timer etter dosering enn 6 timer etter dosering.
Den antihypertensive effekten av PRINIVIL opprettholdes under langtidsbehandling. Brå seponering av PRINIVIL 10 mg har ikke vært assosiert med en rask økning i blodtrykket eller en signifikant økning i blodtrykket sammenlignet med nivåene før behandling.
Farmakokinetikk
Voksne pasienter
Etter oral administrering av PRINIVIL oppstår maksimale serumkonsentrasjoner av lisinopril innen ca. 7 timer, selv om det var en trend til en liten forsinkelse i tiden det tok å nå maksimale serumkonsentrasjoner hos pasienter med akutt hjerteinfarkt. Synkende serumkonsentrasjoner viser en forlenget terminalfase som ikke bidrar til legemiddelakkumulering. Denne terminale fasen representerer sannsynligvis metningsbar binding til ACE og er ikke proporsjonal med dose. Ved gjentatt dosering viser lisinopril en effektiv halveringstid på 12 timer.
Lisinopril ser ikke ut til å være bundet til andre serumproteiner. Lisinopril metaboliseres ikke og utskilles uendret helt i urinen. Basert på uringjenvinning er gjennomsnittlig absorpsjonsgrad av lisinopril omtrent 25 prosent, med stor variasjon mellom individene (6-60 prosent) ved alle testede doser (5-80 mg). Lisinoprilabsorpsjon påvirkes ikke av tilstedeværelsen av mat i mage-tarmkanalen. Den absolutte biotilgjengeligheten av lisinopril er redusert til ca. 16 prosent hos pasienter med stabil NYHA klasse II-IV kongestiv hjertesvikt, og distribusjonsvolumet ser ut til å være litt mindre enn hos normale personer.
Den orale biotilgjengeligheten av lisinopril hos pasienter med akutt hjerteinfarkt er lik den hos friske frivillige.
Nedsatt nyrefunksjon reduserer eliminasjonen av lisinopril, som hovedsakelig utskilles gjennom nyrene, men denne reduksjonen blir klinisk viktig først når den glomerulære filtrasjonshastigheten er under 30 ml/min. Over denne glomerulære filtrasjonshastigheten er eliminasjonshalveringstiden lite endret. Med større svekkelse øker imidlertid topp- og bunnnivået av lisinopril, tiden til toppkonsentrasjonen øker og tiden til å oppnå steady state forlenges. Eldre pasienter har i gjennomsnitt (omtrent doblet) høyere blodnivåer og areal under plasmakonsentrasjonstidskurven (AUC) enn yngre pasienter [se DOSERING OG ADMINISTRASJON ]. Lisinopril kan fjernes ved hemodialyse.
Studier på rotter indikerer at lisinopril krysser blod-hjerne-barrieren dårlig. Flere doser lisinopril hos rotter resulterer ikke i akkumulering i noe vev. Melk fra diegivende rotter inneholder radioaktivitet etter administrering av 14C lisinopril. Ved autoradiografi av hele kroppen ble radioaktivitet funnet i morkaken etter administrering av merket medikament til gravide rotter, men ingen ble funnet i fostrene.
Pediatriske pasienter
Farmakokinetikken til lisinopril ble studert hos 29 pediatriske hypertensive pasienter mellom 6 år og 16 år med glomerulær filtrasjonshastighet >30 ml/min/1,73 m². Etter doser på 0,1 til 0,2 mg/kg oppsto steady state maksimale plasmakonsentrasjoner av lisinopril innen 6 timer, og absorpsjonsgraden basert på urinrestitusjon var ca. 28 %. Disse verdiene ligner de som ble oppnådd tidligere hos voksne. Den typiske verdien av lisinopril oral clearance (systemisk clearance/absolutt biotilgjengelighet) hos et barn som veier 30 kg er 10 l/t, som øker proporsjonalt med nyrefunksjonen.
Kliniske studier
Hypertensjon
Voksne pasienter
To dose-respons-studier med et regime én gang daglig ble utført på 438 milde til moderate hypertensive pasienter som ikke brukte diuretika. Blodtrykket ble målt 24 timer etter dosering. En antihypertensiv effekt av PRINIVIL ble sett med 5 mg hos noen pasienter. I begge studiene skjedde imidlertid blodtrykksreduksjonen tidligere og var større hos pasienter behandlet med 10, 20 eller 80 mg PRINIVIL. I kontrollerte kliniske studier hos pasienter med mild til moderat hypertensjon er PRINIVIL 20-80 mg sammenlignet med hydroklortiazid 12,5-50 mg og med atenolol 50-500 mg, og hos pasienter med moderat til alvorlig hypertensjon med metoprolol 100-200 mg. Det var overlegent hydroklortiazid i effekter på systolisk og diastolisk blodtrykk i en populasjon som var 75 % kaukasisk. PRINIVIL 10 mg var omtrent ekvivalent med atenolol og metoprolol i effekter på diastolisk blodtrykk og hadde noe større effekt på systolisk blodtrykk.
PRINIVIL hadde lignende effekt og bivirkninger hos yngre og eldre (>65 år) pasienter. Det var mindre effektivt hos svarte enn hos kaukasiere.
I hemodynamiske studier av PRINIVIL 5 mg hos pasienter med essensiell hypertensjon, ble blodtrykksreduksjon ledsaget av en reduksjon i perifer arteriell motstand med liten eller ingen endring i hjertevolum og hjertefrekvens. I en studie med ni hypertensive pasienter, etter administrering av PRINIVIL 5 mg, var det en økning i gjennomsnittlig nyreblodstrøm som ikke var signifikant. Data fra flere små studier er inkonsistente med hensyn til effekten av lisinopril på glomerulær filtrasjonshastighet hos hypertensive pasienter med normal nyrefunksjon, men tyder på at endringer, hvis noen, ikke er store.
Hos pasienter med renovaskulær hypertensjon har PRINIVIL vist seg å være godt tolerert og effektivt til å redusere blodtrykket [se ADVARSLER OG FORHOLDSREGLER ].
Pediatriske pasienter
en klinisk studie som involverte 115 hypertensive pediatriske pasienter i alderen 6 til 16 år, fikk pasienter som veide 1,25 mg (0,02 mg/kg). Denne effekten ble bekreftet i en abstinensfase, hvor det diastoliske trykket økte med ca. 9 mmHg mer hos pasienter randomisert til placebo enn hos pasienter som ble randomisert til å forbli på middels og høye doser lisinopril. Den doseavhengige antihypertensive effekten av lisinopril var konsistent på tvers av flere demografiske undergrupper: alder, tannerstadium, kjønn og rase. I denne studien ble lisinopril generelt godt tolerert.
de ovennevnte pediatriske studiene ble lisinopril gitt enten som tabletter eller i suspensjon for de barn og spedbarn som ikke klarte å svelge tabletter eller som trengte en lavere dose enn det som er tilgjengelig i tablettform [se DOSERING OG ADMINISTRASJON ].
Hjertefeil
to placebokontrollerte, 12-ukers kliniske studier sammenlignet tillegget av PRINIVIL 2,5 mg opptil 20 mg daglig med digitalis og diuretika alene. Kombinasjonen av PRINIVIL, digitalis og diuretika reduserte følgende tegn og symptomer på hjertesvikt: ødem, raser, paroksysmal nattlig dyspné og jugular venøs oppblåsthet. I en av studiene reduserte kombinasjonen av PRINIVIL 2,5 mg, digitalis og diuretika ortopné, tilstedeværelse av tredje hjertelyd og antall pasienter klassifisert som NYHA klasse III og IV, og det forbedret treningstoleransen. En stor (over 3000 pasienter) overlevelsesstudie, ATLAS Trial, som sammenlignet 2,5 og 35 mg lisinopril hos pasienter med systolisk hjertesvikt, viste at den høyere dosen av lisinopril hadde minst like gunstige resultater som den lavere dosen. Under baseline-kontrollerte kliniske studier, hos pasienter som fikk digitalis og diuretika, resulterte enkeltdoser av PRINIVIL 5 mg i reduksjoner i pulmonal kapillærkiletrykk, systemisk vaskulær motstand og blodtrykk ledsaget av en økning i hjertevolum og ingen endring i hjertefrekvens.
Akutt hjerteinfarkt
Gruppo Italiano per lo Studio della Sopravvienza nell’Infarto Miocardico (GISSI-3)-studien var en multisenter, kontrollert, randomisert, ublindet klinisk studie utført på 19 394 pasienter med akutt hjerteinfarkt (MI) innlagt på en koronaravdeling. Den ble designet for å undersøke effekten av kortvarig (6 uker) behandling med lisinopril, nitrater, deres kombinasjon eller ingen terapi på kortvarig (6 uker) dødelighet og på langsiktig død og markert nedsatt hjertefunksjon. Hemodynamisk stabile pasienter som presenterte innen 24 timer etter symptomdebut ble randomisert, i en 2 x 2 faktoriell design, til 6 uker med enten 1) PRINIVIL alene (n=4841), 2) nitrater alene (n=4869), 3 ) PRINIVIL 2,5 mg pluss nitrater (n=4841), eller 4) åpen kontroll (n=4843). Alle pasienter fikk rutinebehandlinger, inkludert trombolytika (72 %), aspirin (84 %) og en betablokker (31 %), etter behov, som vanligvis brukes hos pasienter med akutt hjerteinfarkt (MI).
Protokollen ekskluderte pasienter med hypotensjon (systolisk blodtrykk ≤100 mmHg), alvorlig hjertesvikt, kardiogent sjokk og nedsatt nyrefunksjon (serumkreatinin >2 mg/dL og/eller proteinuri >500 mg per 24 timer). Pasienter randomisert til PRINIVIL 5 mg fikk 5 mg innen 24 timer etter symptomdebut, 5 mg etter 24 timer, og deretter 10 mg daglig. Pasienter med systolisk blodtrykk mindre enn 120 mmHg ved baseline fikk 2,5 mg PRINIVIL. Hvis hypotensjon oppsto, ble PRINIVIL 10 mg-dosen redusert eller hvis alvorlig hypotensjon oppsto, ble PRINIVIL stoppet [se DOSERING OG ADMINISTRASJON ].
De primære resultatene av studien var den totale dødeligheten ved 6 uker og et kombinert endepunkt 6 måneder etter hjerteinfarktet, bestående av antall pasienter som døde, hadde sent (dag 4) klinisk kongestiv hjertesvikt eller hadde omfattende venstre ventrikkel. skade definert som ejeksjonsfraksjon ≤35 %, eller en akinetisk-dyskinetisk [AD]-score ≥45 %. Pasienter som fikk PRINIVIL (n=9646), alene eller med nitrater, hadde 11 % lavere risiko for død (p =0,04) sammenlignet med pasienter som ikke fikk PRINIVIL (n=9672) (henholdsvis 6,4 % vs. 7,2 %). ved 6 uker. Selv om pasienter randomisert til å motta PRINIVIL i opptil 6 uker også klarte seg numerisk bedre på det kombinerte endepunktet etter 6 måneder, var den åpne karakteren av vurderingen av hjertesvikt, betydelig tap av oppfølgingsekkokardiografi og betydelig overdreven bruk av PRINIVIL 10 mg, mellom 6 uker og 6 måneder i gruppen randomisert til 6 uker med lisinopril, utelukker enhver konklusjon om dette endepunktet.
Pasienter med akutt hjerteinfarkt, behandlet med PRINIVIL 10 mg, hadde en høyere (9,0 % versus 3,7 %) forekomst av vedvarende hypotensjon (systolisk blodtrykk BIVIRKNINGER ].
PASIENTINFORMASJON
MERK: Denne informasjonen er ment å hjelpe til med sikker og effektiv bruk av denne medisinen. Det er ikke en avsløring av alle mulige negative eller tiltenkte effekter.
Svangerskap
Fortell kvinnelige pasienter i fertil alder om konsekvensene av eksponering for PRINIVIL 10 mg under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Fortell pasientene om å rapportere graviditeter til legen så snart som mulig.
Angioødem
Angioødem, inkludert larynxødem, kan oppstå når som helst under behandling med angiotensinkonverterende enzymhemmere, inkludert PRINIVIL. Fortell pasientene om umiddelbart å rapportere alle tegn eller symptomer som tyder på angioødem (hevelse i ansikt, ekstremiteter, øyne, lepper, tunge, problemer med å svelge eller puste) og ikke ta mer medikament før de har rådført seg med den forskrivende legen.
Symptomatisk hypotensjon
Be pasientene rapportere ørhet, spesielt i løpet av de første dagene av behandlingen. Hvis faktisk synkope oppstår, be pasienten om å seponere stoffet til de har konsultert den forskrivende legen.
Fortell pasientene at overdreven svette og dehydrering kan føre til et for høyt blodtrykksfall på grunn av reduksjon i væskevolum. Andre årsaker til volummangel som oppkast eller diaré kan også føre til blodtrykksfall; gi pasienter råd om dette.
Hyperkalemi
Fortell pasienter om ikke å bruke salterstatninger som inneholder kalium uten å konsultere legen sin.
Hypoglykemi
Fortell diabetikere som behandles med orale antidiabetika eller insulin som starter en ACE-hemmer, om å overvåke for hypoglykemi nøye, spesielt i løpet av den første måneden med kombinert bruk [se NARKOTIKAHANDEL ].
Leukopeni/Neutropeni
Fortell pasientene om umiddelbart å rapportere enhver indikasjon på infeksjon (f.eks. sår hals, feber), som kan være tegn på leukopeni/nøytropeni.
