Cozaar 25mg, 50mg, 100mg Losartan Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Cozaar 50mg og hvordan brukes det?
Cozaar er et reseptbelagt legemiddel som brukes til å behandle symptomene på høyt blodtrykk (hypertensjon), redusere risikoen for hjerneslag hos visse personer med hjertesykdom og diabetisk nervesmerter (nevropati). Cozaar 100mg kan brukes alene eller sammen med andre medisiner.
Cozaar 25mg tilhører en klasse legemidler som kalles angiotensin II-reseptorantagonist (ARB).
Det er ikke kjent om Cozaar 25mg er trygt og effektivt hos barn yngre enn 6 år.
Hva er de mulige bivirkningene av Cozaar 100mg?
Cozaar 100mg kan forårsake alvorlige bivirkninger inkludert:
- . svimmelhet, . smerte eller svie når du tisser, . kvalme, . svakhet, . prikkende følelse, . brystsmerter, . uregelmessige hjerteslag, . tap av bevegelser, . lite eller ingen vannlating, . rask vektøkning, og . hevelse i hender, føtter eller ankler
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Cozaar inkluderer:
- . svimmelhet, . ryggsmerter, og . forkjølelsessymptomer (tett nese, nysing, sår hals)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Cozaar. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
Når graviditet oppdages, avbryt COZAAR så snart som mulig. Legemidler som virker direkte på renin-angiotensin-systemet kan forårsake skade og død for det utviklende fosteret [se ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
COZAAR (losartan kalium) er en angiotensin II-reseptorblokker som virker på AT1-reseptorsubtypen. Losartankalium, et ikke-peptidmolekyl, er kjemisk beskrevet som 2-butyl-4-klor-1-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]imidazol-5-metanolmonokaliumsalt.
Dens empiriske formel er C22H22ClKN6O, og dens strukturformel er:
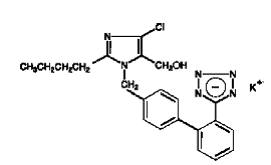
Losartan kalium er et hvitt til off-white frittflytende krystallinsk pulver med en molekylvekt på 461,01. Det er fritt løselig i vann, løselig i alkoholer og lett løselig i vanlige organiske løsningsmidler, som acetonitril og metyletylketon. Oksidasjon av 5-hydroksymetylgruppen på imidazolringen resulterer i den aktive metabolitten til losartan.
COZAAR 100mg er tilgjengelig som tabletter for oral administrering som inneholder enten 25 mg, 50 mg eller 100 mg losartankalium og følgende inaktive ingredienser: mikrokrystallinsk cellulose, laktosevannholdig, pregelatinisert stivelse, magnesiumstearat, hydroksypropylcellulose, hypromellose og titandioksid.
COZAAR 25 mg, 50 mg og 100 mg tabletter inneholder kalium i følgende mengder: henholdsvis 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) og 8,48 mg (0,216 mEq). COZAAR 25 mg, COZAAR 50 mg og COZAAR 100 mg kan også inneholde karnaubavoks.
INDIKASJONER
Hypertensjon
COZAAR® er indisert for behandling av hypertensjon hos voksne og pediatriske pasienter 6 år og eldre, for å senke blodtrykket. Senking av blodtrykket reduserer risikoen for fatale og ikke-dødelige kardiovaskulære (CV) hendelser, primært hjerneslag og hjerteinfarkt. Disse fordelene har blitt sett i kontrollerte studier av antihypertensiva fra en rekke farmakologiske klasser inkludert losartan.
Kontroll av høyt blodtrykk bør være en del av omfattende kardiovaskulær risikostyring, inkludert, etter behov, lipidkontroll, diabetesbehandling, antitrombotisk terapi, røykeslutt, trening og begrenset natriuminntak. Mange pasienter vil kreve mer enn 1 medikament for å oppnå blodtrykksmål. For spesifikke råd om mål og ledelse, se publiserte retningslinjer, for eksempel de fra National High Blood Pressure Education Programs Joint National Committeeon Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Tallrike antihypertensive legemidler, fra en rekke farmakologiske klasser og med forskjellige virkningsmekanismer, har blitt vist i randomiserte kontrollerte studier for å redusere kardiovaskulær sykelighet og dødelighet, og det kan konkluderes med at det er blodtrykksreduksjon, og ikke noen annen farmakologisk egenskap ved narkotika, som i stor grad er ansvarlig for disse fordelene. Den største og mest konsistente fordelen for kardiovaskulær utfall har vært en reduksjon i risikoen for hjerneslag, men reduksjoner i hjerteinfarkt og kardiovaskulær dødelighet har også blitt sett regelmessig.
Forhøyet systolisk eller diastolisk trykk forårsaker økt kardiovaskulær risiko, og den absolutte risikoøkningen per mmHg er større ved høyere blodtrykk, slik at selv beskjedne reduksjoner av alvorlig hypertensjon kan gi betydelig fordel. Relativ risikoreduksjon fra blodtrykksreduksjon er lik på tvers av populasjoner med varierende absolutt risiko, så den absolutte fordelen er større hos pasienter som har høyere risiko uavhengig av deres hypertensjon (for eksempel pasienter med diabetes eller hyperlipidemi), og slike pasienter vil forventes å ha fordeler fra mer aggressiv behandling til et lavere blodtrykksmål.
Noen antihypertensiva har mindre blodtrykkseffekter (som monoterapi) hos svarte pasienter, og mange antihypertensiva har ytterligere godkjente indikasjoner og effekter (f.eks. på angina, hjertesvikt eller diabetisk nyresykdom). Disse betraktningene kan lede valg av terapi.
COZAAR kan gis sammen med andre antihypertensiva.
Hypertensive pasienter med venstre ventrikkelhypertrofi
COZAAR 25mg er indisert for å redusere risikoen for hjerneslag hos pasienter med hypertensjon og venstre ventrikkelhypertrofi, men det er bevis på at denne fordelen ikke gjelder for svarte pasienter [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ] .
Nefropati hos type 2 diabetespasienter
COZAAR er indisert for behandling av diabetisk nefropati med forhøyet serumkreatinin og proteinuri (urinalbumin til kreatinin ratio ≥300 mg/g) pasienter med type 2 diabetes og tidligere hypertensjon. I denne populasjonen reduserer COZAAR 50 mg progresjonshastigheten av nefropati målt ved forekomsten av dobling av serumkreatinin eller nyresykdom i sluttstadiet (behov for dialyse eller nyretransplantasjon) [se Kliniske studier ] .
DOSERING OG ADMINISTRASJON
Hypertensjon
Hypertensjon hos voksne
Den vanlige startdosen av COZAAR 50 mg er 50 mg én gang daglig. Dosen kan økes til en maksimal dose på 100 mg én gang daglig etter behov for å kontrollere blodtrykket [se Kliniske studier ] . En startdose på 25 mg anbefales for pasienter med mulig intravaskulær deplesjon (f.eks. på diuretikabehandling).
Pediatrisk hypertensjon
Den vanlige anbefalte startdosen er 0,7 mg per kg én gang daglig (opptil 50 mg totalt) administrert som en tablett eller en suspensjon [se Tilberedning av suspensjon (for 200 ml av en 2,5 mg/ml suspensjon) ] .Dosering bør justeres i henhold til blodtrykksrespons. Doser over 1,4 mg per kg (eller over 100 mg) daglig har ikke blitt studert hos pediatriske pasienter [se KLINISK FARMAKOLOGI , Kliniske studier og ADVARSLER OG FORHOLDSREGLER ] .
COZAAR anbefales ikke til pediatriske pasienter under 6 år eller til pediatriske pasienter med estimert glomerulær filtrasjonshastighet mindre enn 30 ml/min/1,73 m 2 [se Bruk i spesifikke populasjoner , KLINISK FARMAKOLOGI og Kliniske studier ] .
Hypertensive pasienter med venstre ventrikkelhypertrofi
Vanlig startdose er 50 mg COZAAR én gang daglig. Hydroklortiazid 12,5 mg daglig bør tilsettes og/eller dosen av COZAAR bør økes til 100 mg én gang daglig etterfulgt av en økning i hydroklortiazid til 25 mg én gang daglig basert på blodtrykksrespons [se Kliniske studier ] .
Nefropati hos type 2 diabetespasienter
Vanlig startdose er 50 mg én gang daglig. Dosen bør økes til 100 mg én gang daglig basert på blodtrykksrespons [se Kliniske studier ] .
Doseendringer hos pasienter med nedsatt leverfunksjon
Hos pasienter med lett til moderat nedsatt leverfunksjon er den anbefalte startdosen av COZAAR 25 mg én gang daglig. COZAAR har ikke blitt studert hos pasienter med alvorlig nedsatt leverfunksjon [se Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ] .
Tilberedning av suspensjon (for 200 ml av en 2,5 mg/ml suspensjon)
Tilsett 10 mL renset vann USP til en 8 unse (240 mL) ravfarget polyetylentereftalat (PET)-flaske som inneholder ti 50 mg COZAAR-tabletter. Rist umiddelbart i minst 2 minutter. La konsentratet stå i 1 time og rist deretter i 1 minutt for å spre tablettinnholdet. Forbered separat en 50/50 volumetrisk blanding av Ora-Plus™ og Ora-Sweet SF™. Tilsett 190 mL av 50/50 Ora-Plus™/Ora-Sweet SF™-blandingen til tabletten og vannoppslemmingen i PET-flasken og rist i 1 minutt for å spre ingrediensene. Suspensjonen skal oppbevares i kjøleskap ved 2-8°C (36-46°F) og kan oppbevares i opptil 4 uker. Rist suspensjonen før hver bruk og returner den umiddelbart til kjøleskapet.
HVORDAN LEVERES
Doseringsformer og styrker
- . COZAAR 100 mg, 25 mg, er hvite, ovale, filmdrasjerte tabletter med kode 951 på den ene siden. . COZAAR, 50 mg, er hvite, ovale, filmdrasjerte tabletter med kode 952 på den ene siden og delestrek på den andre. . COZAAR 25 mg, 100 mg, er hvite, dråpeformede, filmdrasjerte tabletter med kode 960 på den ene siden.
Oppbevaring og håndtering
COZAAR er en hvit filmdrasjert tablett som leveres som følger:
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP-kontrollert romtemperatur]. Hold beholderen tett lukket. Beskytt mot lys.
Produsert for: Organon LLC, et datterselskap av ORGANON & Co., Jersey City, NJ 07302, USA. Revidert: oktober 2021.
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet legemiddel og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Hypertensjon
COZAAR har blitt evaluert for sikkerhet hos mer enn 3300 voksne pasienter behandlet for essensiell hypertensjon og 4058 pasienter/individer totalt sett. Over 1200 pasienter ble behandlet i over 6 måneder og mer enn 800 i over ett år.
Behandling med COZAAR 25 mg ble godt tolerert med en total forekomst av bivirkninger som ligner på placebo. I kontrollerte kliniske studier forekom seponering av behandlingen for bivirkninger hos 2,3 % av pasientene behandlet med COZAAR 25 mg og 3,7 % av pasientene som fikk placebo. I 4 kliniske studier som involverte over 1000 pasienter på ulike doser (10-150 mg) losartankalium og over 300 pasienter som fikk placebo, var bivirkningene som forekom hos ≥2 % av pasientene behandlet med COZAAR 25 mg og mer vanlig enn placebo: svimmelhet (3 % vs. 2 %), øvre luftveisinfeksjon (8 % vs. 7 %), nesetetthet (2 % vs. 1 %) og ryggsmerter (2 % vs. 1 %).
Følgende mindre vanlige bivirkninger er rapportert:
Blod- og lymfesystemet: Anemi.
Psykiatriske lidelser: Depresjon.
Forstyrrelser i nervesystemet: Somnolens, hodepine, søvnforstyrrelser, parestesi, migrene.
Øre- og labyrintlidelser: Vertigo, tinnitus.
Hjertesykdommer: Hjertebank, synkope, atrieflimmer, CVA.
Sykdommer i luftveiene, thorax og mediastinum: Dyspné.
Gastrointestinale lidelser: Magesmerter, forstoppelse, kvalme, oppkast.
Hud- og subkutane vevssykdommer: Urticaria, kløe, utslett, lysfølsomhet.
Muskel- og bindevevslidelser: Myalgi, artralgi.
Reproduksjonssystem og brystsykdommer: Maktesløshet.
Generelle lidelser og tilstander på administrasjonsstedet: Ødem.
Hoste
Vedvarende tørrhoste (med en forekomst på noen få prosent) har vært assosiert med bruk av ACE-hemmer og kan i praksis være årsak til seponering av ACE-hemmerbehandling. To prospektive, parallellgruppe, dobbeltblinde, randomiserte, kontrollerte studier ble utført for å vurdere effekten av losartan på forekomsten av hoste-inhypertensive pasienter som hadde opplevd hoste mens de fikk ACE-hemmerbehandling. Pasienter som hadde typisk ACE-hemmer hoste når de ble utfordret med lisinopril, hvis hoste forsvant ved placebo, ble randomisert til losartan 50 mg, lisinopril 20 mg, eller enten placebo (en studie, n=97) eller 25 mg hydroklortiazid (n=135). Den dobbeltblindede behandlingsperioden varte i opptil 8 uker. Forekomsten av hoste er vist i tabell 1 nedenfor.
Disse studiene viser at forekomsten av hoste assosiert med losartanbehandling, i en populasjon som alle hadde hoste assosiert med ACE-hemmerbehandling, er lik den som er forbundet med hydroklortiazid- eller placebobehandling.
Tilfeller av hoste, inkludert positive re-utfordringer, er rapportert etter bruk av losartan etter markedsføring.
Hypertensive pasienter med venstre ventrikkelhypertrofi
I Losartan Intervention for Endpoint-studien (LIFE) var bivirkninger med COZAAR 100 mg lik de som er rapportert tidligere for pasienter med hypertensjon.
Nefropati hos type 2 diabetespasienter
reduksjon av endepunkter i NIDDM med angiotensin II-reseptorantagonist losartan (RENAAL)-studien som involverte 1513 pasienter behandlet med COZAAR 100 mg eller placebo, var den totale forekomsten av rapporterte bivirkninger lik for de to gruppene. Seponering av COZAAR på grunn av bivirkninger var lik placebo (19 % for COZAAR 100 mg, 24 % for placebo). Bivirkningene, uavhengig av medikamentrelasjon, rapportert med en forekomst på ≥4 % av pasientene behandlet med COZAAR 50 mg og som forekom med ≥2 % forskjell i losartangruppen vs. placebo på bakgrunn av konvensjonell antihypertensiv behandling, var asteni/tretthet, brystsmerter , hypotensjon, ortostatisk hypotensjon, diaré, anemi, hyperkalemi, hypoglykemi, ryggsmerter, muskelsvakhet og urinveisinfeksjon.
Postmarketing-erfaring
Følgende tilleggsbivirkninger er rapportert etter markedsføring med COZAAR. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å estimere frekvensen deres pålitelig eller å etablere en årsakssammenheng med legemiddeleksponering:
Fordøyelsessystemet: Hepatitt.
Generelle lidelser og administrasjonsbetingelser: Uvelhet.
Hematologisk: Trombocytopeni.
Overfølsomhet: Angioødem, inkludert hevelse i strupehodet og glottis, som forårsaker luftveisobstruksjon og/eller hevelse i ansikt, lepper, svelg og/eller tunge er rapportert i sjeldne tilfeller hos pasienter behandlet med losartan; noen av disse pasientene har tidligere opplevd angioødem med andre legemidler inkludert ACE-hemmere. Vaskulitt, inkludert Henoch-Schönlein purpura, er rapportert. Anafylaktiske reaksjoner er rapportert.
Metabolsk og ernæring: Hyponatremi.
Muskuloskeletal: Rabdomyolyse.
Forstyrrelser i nervesystemet: Dysgeusi.
Hud: Erytrodermi.
NARKOTIKAHANDEL
Midler som øker serumkalium
Samtidig administrering av losartan med andre legemidler som øker serumkaliumnivået kan føre til hyperkalemi. Overvåk serumkalium hos slike pasienter.
Litium
Økning i serumlitiumkonsentrasjoner og litiumtoksisitet er rapportert ved samtidig administrering av litium og angiotensin II-reseptorantagonister. Overvåk serumlitiumnivåer ved samtidig bruk.
Ikke-steroide antiinflammatoriske legemidler (NSAIDs) inkludert selektive cyklooksygenase-2-hemmere (COX-2-hemmere)
Hos eldre pasienter, volummangel (inkludert de som får diuretikabehandling), eller med nedsatt nyrefunksjon, kan samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med angiotensin II-reseptorantagonister (inkludert losartan) føre til forverring av nyrefunksjonen. inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får losartan- og NSAID-behandling.
Den antihypertensive effekten av angiotensin II-reseptorantagonister, inkludert losartan, kan svekkes av NSAIDs, inkludert selektive COX-2-hemmere.
Dobbel blokade av Renin-Angiotensin-systemet (RAS)
Dobbel blokkering av RAS med angiotensinreseptorblokkere, ACE-hemmere eller aliskiren er assosiert med økt risiko for hypotensjon, synkope, hyperkalemi og endringer i nyrefunksjon (inkludert akutt nyresvikt) sammenlignet med monoterapi.
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) studien inkluderte 1448 pasienter med type 2 diabetes, forhøyet urin-albumin-til-kreatinin-ratio og redusert estimert glomerulær filtrasjonshastighet (GFR 30 til 89,9 ml/min), randomiserte dem til lisinopril. eller placebo på bakgrunn av losartanbehandling og fulgte dem i en median på 2,2 år. Pasienter som fikk kombinasjonen losartan og lisinopril oppnådde ingen ytterligere fordel sammenlignet med monoterapi for det kombinerte endepunktet med reduksjon i GFR, nyresykdom i sluttstadiet eller død, men opplevde en økt forekomst av hyperkalemi og akutt nyreskade sammenlignet med monoterapigruppen.
Hos de fleste pasienter har det ikke vært noen fordel forbundet med bruk av to RAS-hemmere samtidig. Generelt, unngå kombinert bruk av RAS-hemmere. Overvåk blodtrykk, nyrefunksjon og elektrolytter nøye hos pasienter på COZAAR 100 mg og andre midler som påvirker RAS.
Ikke administrer aliskiren samtidig med COZAAR 100 mg hos pasienter med diabetes. Unngå bruk av aliskiren med COZAAR hos pasienter med nedsatt nyrefunksjon (GFR
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Fostertoksisitet
COZAAR kan forårsake fosterskader når det gis til en gravid kvinne. Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer COZAAR 100 mg så snart som mulig [se Bruk i spesifikke populasjoner ] .
Hypotensjon hos pasienter med volum eller saltfattige
Hos pasienter med et aktivert renin-angiotensin-system, slik som pasienter med volum- eller saltfattige (f.eks. de som behandles med høye doser diuretika), kan symptomatisk hypotensjon oppstå etter oppstart av behandling med COZAAR. Korriger volum eller saltmangel før administrering av COZAAR [se DOSERING OG ADMINISTRASJON ] .
Forringelse av nyrefunksjonen
Endringer i nyrefunksjonen inkludert akutt nyresvikt kan være forårsaket av legemidler som hemmer renin-angiotensin-systemet og av diuretika. Pasienter hvis nyrefunksjon delvis kan avhenge av aktiviteten til renin-angiotensin-systemet (f.eks. pasienter med nyrearteriestenose, kronisk nyresykdom, alvorlig kongestiv hjertesvikt eller volumdeplesjon) kan ha særlig risiko for å utvikle akutt nyresvikt på COZAAR. Overvåk nyrefunksjonen med jevne mellomrom hos disse pasientene. Vurder å holde tilbake eller avbryte behandlingen hos pasienter som utvikler en klinisk signifikant reduksjon i nyrefunksjonen på COZAAR [se NARKOTIKAHANDEL og Bruk i spesifikke populasjoner ] .
Hyperkalemi
Overvåk serumkalium med jevne mellomrom og behandle riktig. Dosereduksjon eller seponering av COZAAR 25 mg kan være nødvendig [se BIVIRKNINGER ] .
Samtidig bruk av andre legemidler som kan øke serumkalium kan føre til hyperkalemi [se NARKOTIKAHANDEL ] .
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen (pasientinformasjon).
Svangerskap
Informer kvinnelige pasienter i fertil alder om konsekvensene av eksponering for COZAAR 100 mg under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Be pasienter rapportere graviditeter til legen så snart som mulig [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ] .
Kaliumtilskudd
Råd pasienter som får COZAAR om ikke å bruke kaliumtilskudd eller salterstatninger som inneholder kalium uten å konsultere helsepersonell [se NARKOTIKAHANDEL ] .
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Losartankalium var ikke karsinogent når det ble administrert i maksimalt tolererte doser til rotter og mus i henholdsvis 105 og 92 uker. Hunnrotter som fikk den høyeste dosen (270 mg/kg/dag) hadde en litt høyere forekomst av acinar adenom i bukspyttkjertelen. De maksimalt tolererte dosene (270 mg/kg/dag hos rotter, 200 mg/kg/dag hos mus) ga systemisk eksponering for losartan og dets farmakologisk aktive metabolitt som var omtrent 160 og 90 ganger (rotter) og 30 og 15 ganger (mus) eksponeringen av et menneske på 50 kg gitt 100 mg per dag.
Losartankalium var negativt i mikrobiell mutagenese og V-79 pattedyrcellemutageneseanalyse og i in vitro alkalisk eluering og in vitro og in vivo kromosomavviksanalyser. I tillegg viste den aktive metabolitten ingen tegn på genotoksisitet i mikrobiell mutagenese, in vitro alkalisk eluering og in vitro kromosomavviksanalyser.
Fertilitet og reproduksjonsevne ble ikke påvirket i studier med hannrotter som fikk orale doser av losartankalium opp til ca. 150 mg/kg/dag. Administrering av toksiske dosenivåer hos kvinner (300/200 mg/kg/dag) var assosiert med en signifikant (p
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
COZAAR kan forårsake fosterskader når det gis til en gravid kvinne. Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. De fleste epidemiologiske studier som undersøkte føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester, har ikke skilt medisiner som påvirker renin-angiotensin-systemet fra andre antihypertensiva. Når graviditet oppdages, avbryt COZAAR så snart som mulig (se Kliniske betraktninger ).
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 % til 4 % og 15 % til 20 %.
Kliniske betraktninger
Sykdomsrelatert mors- og/eller embryo-/fosterrisiko
Hypertensjon i svangerskapet øker mors risiko for svangerskapsforgiftning, svangerskapsdiabetes, for tidlig fødsel og fødselskomplikasjoner (f.eks. behov for keisersnitt, blødning etter fødselen). Hypertensjon øker fosterets risiko for intrauterin vekstbegrensning og intrauterin død. Gravide kvinner med hypertensjon bør overvåkes nøye og behandles deretter.
Fetale/neonatale bivirkninger
Oligohydramnios hos gravide kvinner som bruker legemidler som påvirker renin-angiotensin-systemet i andre og tredje trimester av svangerskapet kan resultere i følgende: redusert føtal nyrefunksjon som fører til anuri og nyresvikt, føtal lungehypoplasi, skjelettdeformasjoner, inkludert hodeskallehypoplasi, hypotensjon , og døden. I det uvanlige tilfellet at det ikke er noe passende alternativ til behandling med legemidler som påvirker renin-angiotensin-systemet for en bestemt pasient, informere moren om den potensielle risikoen for fosteret.
Hos pasienter som tar COZAAR under graviditet, utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Fostertesting kan være aktuelt, basert på svangerskapsuken. Hvis oligohydramnios observeres, seponer COZAAR 50 mg, med mindre det anses som livreddende for moren. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade.
Følg nøye med nyfødte med historier om in utero eksponering for COZAAR for hypotensjon, oliguri og hyperkalemi. Hos nyfødte med en historie med in utero eksponering for COZAAR 100 mg, hvis oliguri eller hypotensjon oppstår, støtte blodtrykk og nyreperfusjon. Utvekslingstransfusjoner eller dialyse kan være nødvendig som et middel for å reversere hypotensjon og erstatte nyrefunksjonen.
Data
Dyredata
Losartankalium ble administrert oralt til rotter i perioden med sen drektighet gjennom amming (drektighetsdag 15 til ammingsdag 20) i doser på 10, 25 og 100 mg/kg/dag. Losartankalium har vist seg å gi bivirkninger hos rottefostre og nyfødte, inkludert redusert kroppsvekt, forsinket fysisk og atferdsmessig utvikling, dødelighet og nyretoksisitet. Med unntak av neonatal vektøkning (som ble påvirket ved doser så lave som 10 mg/kg/dag), oversteg doser assosiert med disse effektene 25 mg/kg/dag (omtrent tre ganger maksimal anbefalt human dose på 100 mg på en mg). /m basis). Disse funnene tilskrives legemiddeleksponering sent i svangerskapet og under amming. Signifikante nivåer av losartan og dets aktive metabolitt ble vist å være tilstede i rottefosterplasma under sen svangerskap og i rottemelk.
Amming
Risikosammendrag
Det er ikke kjent om losartan skilles ut i morsmelk, men signifikante nivåer av losartan og dets aktive metabolitt ble vist å være tilstede i rottemelk. På grunn av potensialet for uønskede effekter på det ammende spedbarnet, bør det tas en beslutning om å avbryte ammingen eller avbryte stoffet, tatt i betraktning stoffets betydning for moren.
Pediatrisk bruk
Antihypertensive effekter av COZAAR er etablert hos hypertensive pediatriske pasienter i alderen 6 til 16 år. Sikkerhet og effektivitet er ikke etablert hos pediatriske pasienter under 6 år eller hos pediatriske pasienter med glomerulær filtrasjonshastighet DOSERING OG ADMINISTRASJON , KLINISK FARMAKOLOGI og Kliniske studier ] .
Geriatrisk bruk
Av det totale antallet pasienter som fikk COZAAR 25 mg i kontrollerte kliniske studier for hypertensjon, var 391 pasienter (19 %) 65 år og over, mens 37 pasienter (2 %) var 75 år og eldre. I en kontrollert klinisk studie for nyrebeskyttelse hos type 2-diabetespasienter med proteinuri, var 248 pasienter (33 %) 65 år og eldre. I en kontrollert klinisk studie for reduksjon i den kombinerte risikoen for kardiovaskulær død, hjerneslag og hjerteinfarkt hos hypertensive pasienter med venstre ventrikkelhypertrofi, var 2857 pasienter (62%) 65 år og over, mens 808 pasienter (18%) var 75 år og eldre. . Ingen generelle forskjeller i effektivitet eller sikkerhet ble observert mellom disse pasientene og yngre pasienter, men større sensitivitet hos noen eldre individer kan ikke utelukkes.
Løp
LIFE-studien hadde svarte pasienter med hypertensjon og venstre ventrikkelhypertrofi behandlet med atenolol lavere risiko for å oppleve det primære sammensatte endepunktet sammenlignet med svarte pasienter behandlet med COZAAR (begge ble samtidig behandlet med hydroklortiazid hos flertallet av pasientene). Det primære endepunktet var den første forekomsten av hjerneslag, hjerteinfarkt eller kardiovaskulær død, analysert ved bruk av en intensjon-å-behandle-tilnærming (ITT). I undergruppen av svarte pasienter (n=533, 6 % av pasientene i LIFE-studien), var det 29 primære endepunkter blant 263 pasienter på atenolol (11 %, 26 per 1000 pasientår) og 46 primære endepunkter blant 270 pasienter (17 % , 42 per 1000 pasientår) på COZAAR. Dette funnet kunne ikke forklares ut fra forskjeller i andre populasjoner enn rase eller på eventuelle ubalanser mellom behandlingsgrupper. I tillegg var blodtrykksreduksjoner i begge behandlingsgruppene konsistente mellom svarte og ikke-svarte pasienter. Gitt vanskeligheten med å tolke undergruppeforskjeller i store forsøk, kan det ikke være kjent om den observerte forskjellen er et resultat av tilfeldigheter. LIFE-studien gir imidlertid ingen bevis for at fordelene med COZAAR 100 mg for å redusere risikoen for kardiovaskulære hendelser hos hypertensive pasienter med venstre ventrikkelhypertrofi gjelder for svarte pasienter [se Kliniske studier ] .
Nedsatt nyrefunksjon
Pasienter med nyreinsuffisiens har forhøyede plasmakonsentrasjoner av losartan og dets aktive metabolitt sammenlignet med personer med normal nyrefunksjon. Ingen dosejustering er nødvendig hos pasienter med nedsatt nyrefunksjon med mindre en pasient med nedsatt nyrefunksjon også er volumdepletert [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ] .
Nedsatt leverfunksjon
Den anbefalte startdosen av COZAAR er 25 mg hos pasienter med lett til moderat nedsatt leverfunksjon. Etter oral administrering hos pasienter med mild til moderat nedsatt leverfunksjon, var plasmakonsentrasjonene av losartan og dets aktive metabolitt henholdsvis 5 ganger og 1,7 ganger høyere enn hos friske frivillige. COZAAR har ikke blitt studert hos pasienter med alvorlig nedsatt leverfunksjon [se DOSERING OG ADMINISTRASJON og KLINISK FARMAKOLOGI ] .
OVERDOSE
Signifikant dødelighet ble observert hos mus og rotter etter oral administrering av henholdsvis 1000 mg/kg og 2000 mg/kg, ca. 44 og 170 ganger den maksimale anbefalte humane dosen på mg/m2-basis.
Begrensede data er tilgjengelige med hensyn til overdosering hos mennesker. Den mest sannsynlige manifestasjonen av overdosering vil være hypotensjon og takykardi; bradykardi kan oppstå fra parasympatisk (vagal) stimulering. Hvis symptomatisk hypotensjon skulle oppstå, bør støttende behandling settes i gang.
Verken losartan eller dens aktive metabolitt kan fjernes ved hemodialyse.
KONTRAINDIKASJONER
COZAAR 50 mg er kontraindisert:
- . Hos pasienter som er overfølsomme overfor noen komponent i dette produktet. . For samtidig administrering med aliskiren hos pasienter med diabetes.
KLINISK FARMAKOLOGI
Virkningsmekanismen
Angiotensin II [dannet fra angiotensin I i en reaksjon katalysert av angiotensinkonverterende enzym (ACE, kininase II)] er en potent vasokonstriktor, det primære vasoaktive hormonet i renin-angiotensinsystemet, og en viktig komponent i patofysiologien til hypertensjon. Det stimulerer også aldosteronsekresjon av binyrebarken. Losartan og dets viktigste aktive metabolitt blokkerer de vasokonstriktor- og aldosteron-utskillende effektene av angiotensin II ved selektivt å blokkere bindingen av angiotensin II til AT1-reseptoren som finnes i mange vev, (f.eks. vaskulær glatt muskulatur, binyrene). Det er også en AT1-reseptor funnet i mange vev, men det er ikke kjent å være assosiert med kardiovaskulær homeostase. Verken losartan eller dens viktigste aktive metabolitt viser noen delvis agonistaktivitet ved AT1-reseptoren, og begge har mye større affinitet (omtrent 1000 ganger) for AT1-reseptoren enn for AT1-reseptoren. In vitro bindingsstudier indikerer at losartan er en reversibel, konkurrerende hemmer av AT1-reseptoren. Den aktive metabolitten er 10 til 40 ganger sterkere i vekt enn losartan og ser ut til å være en reversibel, ikke-konkurrerende hemmer av AT1-reseptoren.
Verken losartan eller dets aktive metabolitt hemmer ACE (kininase II, enzymet som omdanner angiotensin I til angiotensin II og bryter ned bradykinin), og de binder heller ikke til eller blokkerer andre hormonreseptorer eller ionekanaler som er kjent for å være viktige i kardiovaskulær regulering.
Farmakodynamikk
Losartan hemmer pressoreffekten av angiotensin II (så vel som angiotensin I) infusjoner. En dose på 100 mg hemmer pressoreffekten med ca. 85 % ved topp, med 25-40 % inhibering vedvarer i 24 timer. Fjerning av den negative tilbakemeldingen til angiotensin II forårsaker en dobling til tredobling i plasmareninaktivitet og påfølgende økning av inangiotensin II plasmakonsentrasjon hos hypertensive pasienter. Losartan påvirker ikke responsen på bradykinin, mens ACE-hemmere øker responsen på bradykinin. Plasmakonsentrasjonen av aldosteron faller etter administrering av losartan. Til tross for effekten av losartan på aldosteronsekresjonen, ble det observert svært liten effekt på kalium i serum.
Effekten av losartan er hovedsakelig tilstede i løpet av en uke, men i noen studier kom den maksimale effekten etter 3-6 uker. I langsiktige oppfølgingsstudier (uten placebokontroll) så det ut til at effekten av losartan ble opprettholdt i opptil ett år. Det er ingen tilsynelatende rebound-effekt etter brå seponering av losartan. Det var i hovedsak ingen endring i gjennomsnittlig hjertefrekvens hos losartan-behandlede pasienter i kontrollerte studier.
Farmakokinetikk
Absorpsjon
Etter oral administrering absorberes losartan godt og gjennomgår betydelig first-pass metabolisme. Den systemiske biotilgjengeligheten til losartan er omtrent 33 %. Gjennomsnittlig maksimal konsentrasjon av losartan og dets aktive metabolitt nås i løpet av henholdsvis 1 time og 3-4 timer. Mens maksimale plasmakonsentrasjoner av losartan og dets aktive metabolitt er omtrent like, er AUC (arealet under kurven) for metabolitten omtrent 4 ganger så stor som for losartan. Et måltid bremser absorpsjonen av losartan og reduserer Cmax, men har bare mindre effekter på losartan AUC eller på AUC av metabolitten (~10 % reduksjon). Farmakokinetikken til losartan og dets aktive metabolitt er lineær med orale losartandoser på opptil 200 mg og endres ikke over tid.
Fordeling
Distribusjonsvolumet av losartan og den aktive metabolitten er henholdsvis ca. 34 liter og 12 liter. Både losartan og dets aktive metabolitt er sterkt bundet til plasmaproteiner, primært albumin, med plasmafrie fraksjoner på henholdsvis 1,3 % og 0,2 %. Plasmaproteinbindingen er konstant over konsentrasjonsområdet som oppnås med anbefalte doser. Studier på rotter indikerer at losartan krysser blod-hjerne-barrieren dårlig, om i det hele tatt.
Metabolisme
Losartan er et oralt aktivt middel som gjennomgår betydelig first-pass metabolisme av cytokrom P450-enzymer. Det omdannes delvis til en aktiv karboksylsyremetabolitt som er ansvarlig for det meste av angiotensin II-reseptorantagonismen som følger etter losartanbehandling. Omtrent 14 % av en oralt administrert dose av losartan omdannes til den aktive metabolitten. I tillegg til den aktive karboksylsyremetabolitten dannes det flere inaktive metabolitter. In vitro-studier indikerer at cytokrom P450 2C9 og 3A4 er involvert i biotransformasjonen av losartan til metabolittene.
Eliminering
Total plasmaclearance av losartan og den aktive metabolitten er henholdsvis ca. 600 ml/min og 50 ml/min, med nyreclearance på henholdsvis ca. 75 ml/min og 25 ml/min. Den terminale halveringstiden for losartan er ca. 2 timer og metabolitten er ca. 6-9 timer. Etter enkeltdoser av losartan administrert oralt, utskilles ca. 4 % av dosen uendret i urinen og ca. 6 % utskilles i urinen som aktiv metabolitt. Biliær utskillelse bidrar til eliminering av losartan og dets metabolitter. Etter oral 14C-merket losartan, gjenfinnes ca. 35 % av radioaktiviteten i urinen og ca. 60 % i avføringen. Etter en intravenøs dose av 14C-merket losartan, gjenfinnes ca. 45 % av radioaktiviteten i urinen og 50 % i avføringen. Verken losartan eller metabolitten akkumuleres i plasma ved gjentatt dosering én gang daglig.
Spesifikke populasjoner
Pediatrisk
Farmakokinetiske parametere etter gjentatte doser losartan (gjennomsnittlig dose 0,7 mg/kg, område 0,36 til 0,97 mg/kg) som en tablett til 25 hypertensive pasienter i alderen 6 til 16 år er vist i tabell 4 nedenfor. Farmakokinetikken til losartan og dets aktive metabolitt var generelt lik på tvers av de studerte aldersgruppene og lik historiske farmakokinetiske data hos voksne. De viktigste farmakokinetiske parameterne hos voksne og barn er vist i tabellen nedenfor.
Biotilgjengeligheten til suspensjonsformuleringen ble sammenlignet med losartan-tabletter hos friske voksne. Suspensjonen og tabletten er like i biotilgjengelighet med hensyn til både losartan og den aktive metabolitten [se DOSERING OG ADMINISTRASJON ] .
Geriatrisk og kjønn
Losartans farmakokinetikk er undersøkt hos eldre (65-75 år) og hos begge kjønn. Plasmakonsentrasjoner av losartan og dets aktive metabolitt er like hos eldre og unge hypertensive. Plasmakonsentrasjoner av losartan var omtrent dobbelt så høye hos kvinnelige hypertensive som malehypertensive, men konsentrasjonene av den aktive metabolitten var like hos menn og kvinner. Ingen dosejustering er nødvendig [se DOSERING OG ADMINISTRASJON ] .
Løp
Farmakokinetiske forskjeller på grunn av rase er ikke studert [se Bruk i spesifikke populasjoner ] .
Nyreinsuffisiens
Etter oral administrering økes plasmakonsentrasjoner og AUC for losartan og dets aktive metabolitt med 50-90 % hos pasienter med mild (kreatininclearance på 50 til 74 ml/min) eller moderat (kreatininclearance 30 til 49 ml/min) nyresvikt. . I denne studien ble renal clearance redusert med 55-85 % for både losartan og dets aktive metabolitt hos pasienter med mild eller moderat nyreinsuffisiens. Verken losartan eller dets aktive metabolitt kan fjernes ved hemodialyse [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ] .
Leverinsuffisiens
Etter oral administrering hos pasienter med mild til moderat alkoholisk levercirrhose, var plasmakonsentrasjonen av losartan og dets aktive metabolitt henholdsvis 5 ganger og ca. 1,7 ganger høyere enn hos unge mannlige frivillige. Sammenlignet med normale forsøkspersoner var den totale plasmaclearance av losartan-pasienter med leverinsuffisiens omtrent 50 % lavere og den orale biotilgjengeligheten var omtrent doblet. Bruk en startdose på 25 mg for pasienter med lett til moderat nedsatt leverfunksjon. COZAAR 50 mg har ikke blitt studert hos pasienter med alvorlig nedsatt leverfunksjon [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ] .
Narkotikahandel
Ingen klinisk signifikante legemiddelinteraksjoner er funnet i studier av losartankalium med hydroklortiazid, digoksin, warfarin, cimetidin og fenobarbital. Imidlertid har rifampin vist seg å redusere AUC for losartan og dets aktive metabolitt med henholdsvis 30 % og 40 %. Flukonazol, en hemmer av cytokromP450 2C9, reduserte AUC for den aktive metabolitten med omtrent 40 %, men økte AUC for losartan med omtrent 70 % etter gjentatte doser. Konvertering av losartan til dens aktive metabolitt etter intravenøs administrering påvirkes ikke av ketokonazol, en hemmer av P450 3A4. AUC for aktiv metabolitt etter oral losartan ble ikke påvirket av erytromycin, en hemmer av P450 3A4, men AUC for losartan ble økt med 30 %.
De farmakodynamiske konsekvensene av samtidig bruk av losartan og hemmere av P450 2C9 er ikke undersøkt. Personer som ikke metaboliserer losartan til aktiv metabolitt har vist seg å ha en spesifikk, sjelden defekt i cytokrom P450 2C9. Disse dataene tyder på at omdannelsen av losartan til den aktive metabolitten hovedsakelig formidles av P450 2C9 og ikke P450 3A4.
Kliniske studier
Hypertensjon
Hypertensjon hos voksne
Den antihypertensive effekten av COZAAR 25 mg ble hovedsakelig demonstrert i 4 placebokontrollerte, 6- til 12-ukers studier med doser fra 10 til 150 mg per dag hos pasienter med diastolisk blodtrykk ved baseline på 95-115. Studiene tillot sammenligninger av to doser (50-100 mg/dag) som regimer én gang daglig eller to ganger daglig, sammenligninger av topp- og bunneffekter, og sammenligninger av respons etter kjønn, alder og rase. Tre ytterligere studier undersøkte de antihypertensive effektene av losartan og hydroklortiazid i kombinasjon.
De 4 studiene med losartan monoterapi inkluderte totalt 1075 pasienter randomisert til flere doser losartan og 334 til placebo. 10- og 25-mg-dosene ga en viss effekt ved topp (6 timer etter dosering), men liten og inkonsekvent bunnrespons (24 timer). Doser på 50, 100 og 150 mg én gang daglig ga statistisk signifikant systolisk/diastolisk gjennomsnittlig blodtrykksreduksjon, sammenlignet med placebo i området 5,5-10,5/3,5-7,5 mmHg, hvor 150-mg-dosen ikke ga større effekt enn 50- 100 mg. Dosering to ganger daglig ved 50-100 mg/dag ga konsekvent større bunnrespons enn dosering én gang daglig ved samme totaldose. Toppeffekter (6 timer) var jevnt, men moderat, større enn bunneffekter, med bunn-til-topp-forholdet for systoliske og diastoliske responser på henholdsvis 50-95 % og 60-90 %.
Tillegg av en lav dose hydroklortiazid (12,5 mg) til losartan 50 mg én gang daglig resulterte i placebojusterte blodtrykksreduksjoner på 15,5/9,2 mmHg.
Analyse av alders-, kjønns- og raseundergrupper av pasienter viste at menn og kvinner, og pasienter over og under 65, generelt hadde lignende svar. COZAAR 25 mg var effektivt for å redusere blodtrykket uavhengig av rase, selv om effekten var noe mindre hos svarte pasienter (vanligvis en lav-renin-populasjon).
Pediatrisk hypertensjon
Den antihypertensive effekten av losartan ble undersøkt i en studie med 177 hypertensive pediatriske pasienter i alderen 6 til 16 år. Barn som veide DOSERING OG ADMINISTRASJON . Flertallet av barna hadde hypertensjon assosiert med nyre- og urogenital sykdom. Det sittende diastoliske blodtrykket (SiDBP) ved inntreden i studien var høyere enn 95. persentilnivået for pasientens alder, kjønn og høyde. På slutten av tre uker reduserte losartan det systoliske og diastoliske blodtrykket, målt ved bunnen, på en doseavhengig måte. Totalt sett reduserte de to høyere dosene (25 til 50 mg hos pasienter
Hypertensive pasienter med venstre ventrikkelhypertrofi
LIFE-studien var en multinasjonal, dobbeltblind studie som sammenlignet COZAAR 50 mg og atenolol hos 9193 hypertensive pasienter med EKG-dokumentert venstre ventrikkelhypertrofi. Pasienter med hjerteinfarkt eller hjerneslag innen seks måneder før randomisering ble ekskludert. Pasientene ble randomisert til å få COZAAR 50 mg én gang daglig eller atenolol 50 mg. Hvis målblodtrykk (
Av de randomiserte pasientene var 4963 (54 %) kvinner og 533 (6 %) svarte. Gjennomsnittsalderen var 67 med 5704 (62%) alder ≥65. Ved baseline hadde 1195 (13%) diabetes, 1326 (14%) hadde isolert systolisk hypertensjon, 1469 (16%) hadde koronar hjertesykdom, og 728 (8%) hadde cerebrovaskulær sykdom. Baseline gjennomsnittlig blodtrykk var 174/98 mmHg i begge behandlingsgruppene. Gjennomsnittlig lengde på oppfølgingen var 4,8 år. Ved slutten av studien eller ved siste besøk før et primært endepunkt, tok 77 % av gruppen behandlet med COZAAR 50 mg og 73 % av gruppen behandlet med atenolol fortsatt studiemedisin. Av pasientene som fortsatt tok studiemedisiner, var gjennomsnittsdosene av COZAAR og atenolol begge ca. 80 mg/dag, og 15 % tok atenolol eller losartan som monoterapi, mens 77 % også fikk hydroklortiazid (ved gjennomsnittlig dose på 20 mg/dag i hver gruppe). Blodtrykksreduksjonen målt ved bunnen var lik for begge behandlingsgruppene, men blodtrykket ble ikke målt på noe annet tidspunkt på dagen. Ved slutten av studien eller ved siste besøk før et primært endepunkt var gjennomsnittlig blodtrykk 144,1/81,3 mmHg for gruppen behandlet med COZAAR og 145,4/80,9 mmHg for gruppen behandlet med atenolol; forskjellen i systolisk blodtrykk (SBP) på 1,3 mmHg var signifikant (p
Det primære endepunktet var den første forekomsten av kardiovaskulær død, ikke-dødelig hjerneslag eller ikke-dødelig hjerteinfarkt. Pasienter med ikke-dødelige hendelser forble i forsøket, slik at det også var en undersøkelse av den første hendelsen av hver type selv om det ikke var den første hendelsen (f.eks. et slag etter et innledende hjerteinfarkt vil bli regnet med i analysen av hjerneslag). Behandling med COZAAR 50 mg resulterte i en 13 % reduksjon (p=0,021) i risikoen for det primære endepunktet sammenlignet med atenololgruppen (se figur 1 og tabell 3); denne forskjellen var først og fremst et resultat av en effekt på dødelig og ikke-dødelig hjerneslag. Behandling med COZAAR reduserte risikoen for hjerneslag med 25 % i forhold til atenolol (p=0,001) (se figur 2 og tabell 3).
Figur 1: Kaplan-Meier estimater av det primære endepunktet for tid til kardiovaskulær død, ikke-dødelig hjerneslag eller ikke-dødelig hjerteinfarkt i gruppene behandlet med COZAAR 100 mg og atenolol. Risikoreduksjonen er justert for grunnlinje Framingham-risikoscore og nivå av elektrokardiografisk venstre ventrikkelhypertrofi
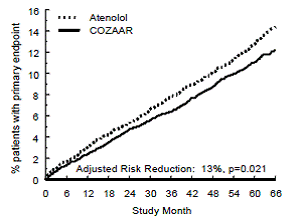
Figur 2: Kaplan-Meier-estimat av tiden til dødelig/ikke-dødelig hjerneslag i gruppene behandlet med COZAAR 50 mg og atenolol. Risikoreduksjonen er justert for grunnlinjeFramingham-risikoscore og nivå av elektrokardiografisk venstre ventrikkelhypertrofi
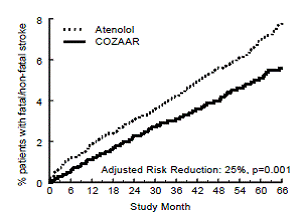
Tabell 3 viser resultatene for det primære sammensatte endepunktet og de individuelle endepunktene. Det primære endepunktet var den første forekomsten av hjerneslag, myokardinfarkt eller kardiovaskulær død, analysert ved hjelp av en ITT-tilnærming. Tabellen viser antall hendelser for hver komponent på to forskjellige måter. Komponentene til det primære endepunktet (som en første hendelse) teller bare hendelsene som definerer det primære endepunktet, mens de sekundære endepunktene teller alle første hendelser av en bestemt type, enten de ble innledet av en annen type hendelse eller ikke.
Selv om LIFE-studien favoriserte COZAAR fremfor atenolol med hensyn til det primære endepunktet (p=0,021), er dette resultatet fra en enkelt studie og er derfor mindre overbevisende enn forskjellen mellom COZAAR og placebo. Selv om det ikke måles direkte, er forskjellen mellom COZAAR og placebo overbevisende fordi det er bevis på at atenolol i seg selv er effektivt (vs. placebo) for å redusere kardiovaskulære hendelser, inkludert hjerneslag, hos hypertensive pasienter.
Andre kliniske endepunkter i LIFE-studien var: total dødelighet, sykehusinnleggelse for hjertesvikt eller angina pectoris, koronare eller perifere revaskulariseringsprosedyrer og gjenopplivet hjertestans. Det var ingen signifikante forskjeller i frekvensen av disse endepunktene mellom COZAAR- og atenololgruppene.
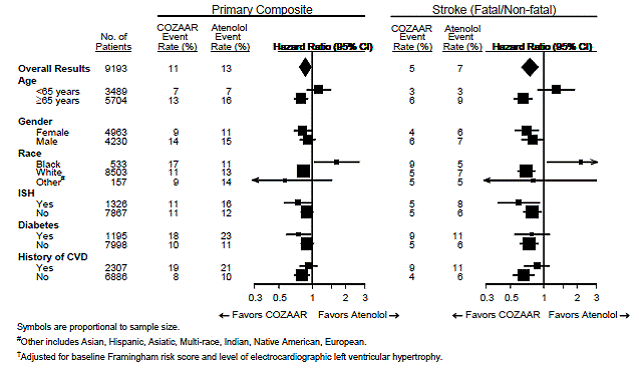
For det primære endepunktet og hjerneslag, er effekten av COZAAR 25 mg i pasientundergrupper definert av alder, kjønn, rase og tilstedeværelse eller fravær av isolert systolisk hypertensjon (ISH), diabetes og historie med kardiovaskulær sykdom (CVD) vist i figur 3 nedenfor. . Undergruppeanalyser kan være vanskelige å tolke og det er ikke kjent om disse representerer sanne forskjeller eller tilfeldige effekter.
Figur 3: Primære endepunkthendelser† innenfor demografiske undergrupper
Nefropati hos type 2 diabetespasienter
RENAAL-studien var en randomisert, placebokontrollert, dobbeltblind, multisenterstudie utført over hele verden med 1513 pasienter med type 2 diabetes med nefropati (definert som serumkreatinin 1,3 til 3,0 mg/dL hos kvinner eller menn ≤60 kg og 1,5 til 3,0 mg /dL hos menn >60 kg og proteinuri [urinalbumin-tokreatinin-forhold ≥300 mg/g]).
Pasientene ble randomisert til å få COZAAR 50 mg én gang daglig eller placebo på bakgrunn av konvensjonell antihypertensiv terapi ekskludert ACE-hemmere og angiotensin II-antagonister. Etter en måned ble etterforskerne instruert om å titrere studiemedikamentet til 100 mg én gang daglig hvis bunnmålet for blodtrykk (140/90 mmHg) ikke ble oppnådd. Totalt sett fikk 72 % av pasientene 100 mg daglig dose mer enn 50 % av tiden de tok studiemedisin. Fordi studien ble designet for å oppnå lik blodtrykkskontroll i begge grupper, kan andre antihypertensiva (diuretika, kalsiumkanalblokkere, alfa- eller betablokkere og sentralt virkende midler) tilsettes etter behov i begge grupper. Pasientene ble fulgt i en gjennomsnittlig varighet på 3,4 år.
Studiepopulasjonen var mangfoldig med hensyn til rase (asiatiske 16,7 %, svarte 15,2 %, latinamerikanske 18,3 %, hvite 48,6 %). Totalt sett var 63,2 % av pasientene menn, og 66,4 % var under 65 år. Nesten alle pasientene (96,6 %) hadde en historie med hypertensjon, og pasientene gikk inn i studien med en gjennomsnittlig serumkreatinin på 1,9 mg/dL og gjennomsnittlig proteinuri (urinalbumin/kreatinin) på 1808 mg/g ved baseline.
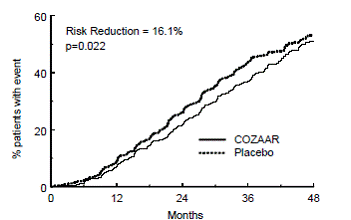
Det primære endepunktet for studien var tiden til den første forekomsten av en av følgende hendelser: dobling av serumkreatinin, nyresykdom i sluttstadium (ESRD) (behov for dialyse eller transplantasjon) eller død. Behandling med COZAAR resulterte i en risikoreduksjon på 16 % i dette endepunktet (se figur 4 og tabell 4). Behandling med COZAAR reduserte også forekomsten av vedvarende dobling av serumkreatinin med 25 % og ESRD med 29 % som separate endepunkter, men hadde ingen effekt på totaldødeligheten (se tabell 4).
Gjennomsnittlig baseline-blodtrykk var 152/82 mmHg for COZAAR pluss konvensjonell antihypertensiv terapi og 153/82 mmHg for placebo pluss konvensjonell antihypertensiv terapi. Ved slutten av studien var gjennomsnittlig blodtrykk 143/76 mmHg for gruppen behandlet med COZAAR 100 mg og 146/77 mmHg for gruppen behandlet med placebo.
Figur 4: Kaplan-Meier-kurve for det primære sammensatte endepunktet for dobling av serumkreatinin, nyresykdom i sluttstadiet (behov for dialyse eller transplantasjon) eller død
De sekundære endepunktene for studien var endring i proteinuri, endring i progresjonshastigheten av nyresykdom og sammensetningen av sykelighet og dødelighet fra kardiovaskulære årsaker (sykehusinnleggelse for hjertesvikt, hjerteinfarkt, revaskularisering, hjerneslag, sykehusinnleggelse for ustabil angina eller kardiovaskulær død). Sammenlignet med placebo reduserte COZAAR proteinuri signifikant med gjennomsnittlig 34 %, en effekt som var tydelig innen 3 måneder etter oppstart av behandlingen, og reduserte signifikant nedgangen i glomerulær filtrasjonshastighet under studien med 13 %, målt ved den gjensidige av serumkreatininkonsentrasjonen. Det var ingen signifikant forskjell i forekomsten av det sammensatte endepunktet av kardiovaskulær morbiditet og dødelighet.
De gunstige effektene av COZAAR ble sett hos pasienter som også tok andre antihypertensive medisiner (angiotensin II-reseptorantagonister og angiotensin convertingenzyme-hemmere var ikke tillatt), orale hypoglykemiske midler og lipidsenkende midler.
For det primære endepunktet og ESRD er effekten av COZAAR i pasientundergrupper definert av alder, kjønn og rase vist i tabell 5 nedenfor. Undergruppeanalyser kan være vanskelig å tolke og det er ikke kjent om disse representerer sanne forskjeller eller tilfeldige effekter.
PASIENTINFORMASJON
COZAAR® (CO-zar) (losartan kalium tabletter) 25 mg, 50 mg, 100 mg
Les pasientinformasjonen som følger med COZAAR før du begynner å ta den og hver gang du får påfyll. Det kan komme ny informasjon. Dette pakningsvedlegget erstatter ikke å snakke med legen din om din tilstand og behandling.
Hva er den viktigste informasjonen jeg bør vite om COZAAR?
- . COZAAR kan forårsake skade eller død for et ufødt barn. . Snakk med legen din om andre måter å senke blodtrykket på hvis du planlegger å bli gravid. . Fortell legen din med en gang hvis du blir gravid mens du tar COZAAR.
Hva er COZAAR 100mg?
COZAAR 100mg er et reseptbelagt legemiddel kalt en angiotensinreseptorblokker (ARB). Det er brukt:
- . alene eller sammen med andre blodtrykksmedisiner for å senke høyt blodtrykk (hypertensjon). . for å redusere sjansen for hjerneslag hos pasienter med høyt blodtrykk og et hjerteproblem kalt venstre ventrikkelhypertrofi. COZAAR hjelper kanskje ikke svarte pasienter med dette problemet. . å bremse forverringen av diabetisk nyresykdom (nefropati) hos pasienter med type 2-diabetes som har eller hadde høyt blodtrykk.
COZAAR 25 mg har ikke blitt undersøkt hos barn under 6 år eller hos barn med visse nyreproblemer.
Høyt blodtrykk (hypertensjon) Blodtrykket er kraften i blodårene når hjertet slår og når hjertet hviler. Du har høyt blodtrykk når kraften er for stor. COZAAR 25mg kan hjelpe blodårene til å slappe av slik at blodtrykket blir lavere.
Venstre ventrikkelhypertrofi (LVH) er en forstørrelse av veggene i venstre hjertekammer (hjertets hovedpumpekammer). LVH kan skje fra flere ting. Høyt blodtrykk er den vanligste årsaken til LVH.
Type 2 diabetes med nefropati . Type 2 diabetes er en type diabetes som hovedsakelig forekommer hos voksne. Hvis du har diabetisk nefropati betyr det at nyrene dine ikke fungerer som de skal på grunn av skade fra diabetes.
Hvem bør ikke ta COZAAR 100mg?
- . Ikke ta COZAAR 25 mg hvis du er allergisk mot noen av innholdsstoffene i COZAAR . Se slutten av dette pakningsvedlegget for en fullstendig liste over ingredienser i COZAAR. . Ikke ta COZAAR hvis du har diabetes og tar et legemiddel kalt aliskiren for å redusere blodtrykket.
Hva bør jeg fortelle legen min før jeg tar COZAAR 50mg?
Fortell legen din om alle dine medisinske tilstander, inkludert hvis du:
- . er gravid eller planlegger å bli gravid. Se " Hva er den viktigste informasjonen jeg bør vite om COZAAR 25mg? " . ammer . Det er ikke kjent om COZAAR 50 mg går over i morsmelk. Du bør velge enten å ta COZAAR 50 mg eller amme, men ikke begge deler. . kaster opp mye eller har mye diaré . har leverproblemer . har nyreproblemer
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd. COZAAR og visse andre medisiner kan interagere med hverandre. Fortell legen din spesielt hvis du tar:
- . kaliumtilskudd . salterstatninger som inneholder kalium . andre legemidler som kan øke serumkalium . vannpiller (diuretika) . litium (et legemiddel som brukes til å behandle en viss type depresjon) . legemidler som brukes til å behandle smerte og leddgikt, kalt ikke-steroide antiinflammatoriske legemidler (NSAIDs), inkludert COX-2-hemmere . andre medisiner for å redusere blodtrykket
Hvordan skal jeg ta COZAAR 25mg?
- . Ta COZAAR 100 mg nøyaktig som foreskrevet av legen din. Legen din kan endre dosen om nødvendig. . COZAAR 50 mg kan tas med eller uten mat. . Hvis du glemmer en dose, ta den så snart du husker det. Hvis det er nær neste dose, ikke ta den glemte dosen. Bare ta neste dose til vanlig tid. . Hvis du tar for mye COZAAR, ring legen din eller giftkontrollsenteret, eller gå til nærmeste legevakt umiddelbart.
Hva er de mulige bivirkningene av COZAAR?
COZAAR 25mg kan forårsake følgende bivirkninger som kan være alvorlige:
- . Skade eller død av ufødte babyer. Se "Hva er den viktigste informasjonen jeg bør vite om COZAAR?" . Allergisk reaksjon Symptomer på en allergisk reaksjon er hevelse i ansikt, lepper, svelg eller tunge. Få akutt medisinsk hjelp med en gang og slutt å ta COZAAR. . Lavt blodtrykk (hypotensjon) . Lavt blodtrykk kan føre til at du føler deg svimmel eller svimmel. Legg deg ned hvis du føler deg svak eller svimmel. Ring legen din med en gang. . For personer som allerede har nyreproblemer, kan du se en forverring i hvor godt nyrene dine fungerer. Ring legen din hvis du får hevelser i føttene, anklene eller hendene, eller uforklarlig vektøkning. . Høye nivåer av kalium i blodet
De vanligste bivirkningene av COZAAR 50 mg hos personer med høyt blodtrykk er:
- . "forkjølelse" (øvre luftveisinfeksjon) . svimmelhet . tett nese . ryggsmerte
De vanligste bivirkningene av COZAAR 50mg hos personer med type 2 diabetes med diabetisk nyresykdom er:
- . diaré . tretthet . lavt blodsukker . brystsmerter . høyt blodkalium . lavt blodtrykk
Fortell legen din dersom du får en bivirkning som plager deg eller som ikke vil forsvinne.
Dette er ikke en komplett liste over bivirkninger. For en fullstendig liste, spør legen din eller apoteket.
Hvordan oppbevarer jeg COZAAR 100mg?
- . Oppbevar COZAAR-tabletter ved 59 °F til 86 °F (15 °C til 30 °C). . Oppbevar COZAAR i en tett lukket beholder som beskytter medisinen mot lys. . Oppbevar COZAAR og alle legemidler utilgjengelig for barn.
Generell informasjon om COZAAR
Medisiner er noen ganger foreskrevet for tilstander som ikke er nevnt i pasientopplysninger. Ikke bruk COZAAR for en tilstand det ikke er foreskrevet for. Ikke gi COZAAR til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Dette pakningsvedlegget oppsummerer den viktigste informasjonen om COZAAR. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre farmasøyten eller lege om informasjon om COZAAR som er skrevet for helsepersonell.
Hva er ingrediensene i COZAAR 25mg?
Aktive ingredienser: losartan kalium
Inaktive ingredienser:
mikrokrystallinsk cellulose, vannholdig laktose, pregelatinisert stivelse, magnesiumstearat, hydroksypropylcellulose, hypromellose og titandioksid. COZAAR 25 mg, COZAAR 50 mg og COZAAR 100 mg kan også inneholde karnaubavoks.
