Catapres 100mcg Clonidine Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Catapres og hvordan brukes det?
Catapres er et reseptbelagt legemiddel som brukes til å behandle symptomer på høyt blodtrykk, oppmerksomhetsunderskudd hyperaktivitetsforstyrrelse (ADHD) og kreftsmerter. Catapres 100mcg kan brukes alene eller sammen med andre medisiner.
Catapres 100mcg tilhører en klasse medikamenter som kalles Alpha2-agonister, sentralvirkende, ADHD-midler.
Det er ikke kjent om Catapres 100mcg er trygt og effektivt hos barn yngre enn 12 år.
Hva er de mulige bivirkningene av Catapres?
Catapres kan forårsake alvorlige bivirkninger, inkludert:
- . abstinenssymptomer, . nervøsitet, . opphisselse, . hodepine, . skjelving, og . rask økning i blodtrykket
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Catapres 100mcg inkluderer:
- . tørr i munnen, . svimmelhet, . døsighet, . utmattelse, . forstoppelse, . hodepine, . kvalme, og . problemer med å sove (søvnløshet)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Catapres. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
BESKRIVELSE
Catapres® (klonidinhydroklorid, USP) er et sentralt virkende alfa-agonist hypotensivt middel tilgjengelig som tabletter for oral administrering i tre doseringsstyrker: 0,1 mg, 0,2 mg og 0,3 mg. 0,1 mg tabletten tilsvarer 0,087 mg av den frie basen.
De inaktive ingrediensene er kolloidalt silisiumdioksid, maisstivelse, dibasisk kalsiumfosfat, FD&C Yellow No. 6, gelatin, glyserin, laktose og magnesiumstearat. Catapres 0,1 mg tablett inneholder også FD&C Blue No.1 og FD&C Red No.3.
Klonidinhydroklorid er et imidazolinderivat og eksisterer som en mesomer forbindelse. Det kjemiske navnet er 2-(2,6-diklorfenylamino)-2-imidazolinhydroklorid. Følgende er strukturformelen:
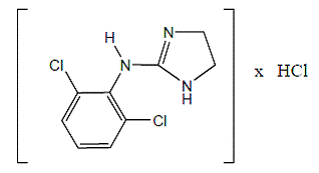 C9H9Cl2N3 · HCl Mol. Wt. 266,56
C9H9Cl2N3 · HCl Mol. Wt. 266,56 Klonidinhydroklorid er et luktfritt, bittert, hvitt, krystallinsk stoff som er løselig i vann og alkohol.
INDIKASJONER
CATAPRES tabletter er indisert for behandling av hypertensjon. CATAPRES tabletter kan brukes alene eller samtidig med andre antihypertensiva.
DOSERING OG ADMINISTRASJON
Voksne
Dosen av Catapres® (klonidinhydroklorid, USP) tabletter må justeres i henhold til pasientens individuelle blodtrykksrespons. Følgende er en generell veiledning for administrasjonen.
Startdose
0,1 mg tablett to ganger daglig (morgen og leggetid). Eldre pasienter kan ha nytte av en lavere startdose.
Vedlikeholdsdose
Ytterligere økninger på 0,1 mg per dag kan gjøres med ukentlige intervaller om nødvendig inntil ønsket respons er oppnådd. Å ta den største delen av den orale daglige dosen ved sengetid kan minimere forbigående tilpasningseffekter av munntørrhet og døsighet. De mest brukte terapeutiske dosene har variert fra 0,2 mg til 0,6 mg per dag gitt i oppdelte doser. Studier har indikert at 2,4 mg er den maksimale effektive daglige dosen, men så høye doser har sjelden vært brukt.
Nedsatt nyrefunksjon
Pasienter med nedsatt nyrefunksjon kan ha nytte av en lavere startdose. Pasienter bør overvåkes nøye. Siden bare en minimal mengde klonidin fjernes under rutinemessig hemodialyse, er det ikke nødvendig å gi supplerende klonidin etter dialyse.
HVORDAN LEVERES
Catapres® (klonidinhydroklorid, USP) tabletter leveres som følger:
Oppbevares ved 25°C (77°F); utflukter tillatt til 15°-30°C (59°-86°F) [se USP kontrollert romtemperatur ].
Fordel i tett, lysbestandig beholder.
Distribuert av: Boehringer Ingelheim Pharmaceuticals, Inc., Ridgefield, CT 06877 USA. Produsert av: Boehringer Ingelheim Promeco SA de CV, Mexico City, Mexico. Lisensiert fra: Boehringer Ingelheim, International GmbH, Adresser medisinske henvendelser til: (800) 542-6257 eller (800) 459-9906. Revidert: mai 2012
BIVIRKNINGER
De fleste bivirkningene er milde og har en tendens til å avta ved fortsatt behandling. De hyppigste (som ser ut til å være doserelaterte) er munntørrhet, som forekommer hos ca. 40 av 100 pasienter; døsighet, omtrent 33 av 100; svimmelhet, ca 16 av 100; forstoppelse og sedasjon, hver rundt 10 av 100.
Følgende mindre hyppige bivirkninger er også rapportert hos pasienter som fikk CATAPRES 100 mikrogram tabletter, men i mange tilfeller fikk pasienter samtidig medisinering og en årsakssammenheng er ikke fastslått.
Kroppen som helhet: Tretthet, feber, hodepine, blekhet, svakhet og abstinenssyndrom. Det ble også rapportert om en svakt positiv Coombs' test og økt følsomhet for alkohol.
Kardiovaskulær: Bradykardi, kongestiv hjertesvikt, elektrokardiografiske abnormiteter (dvs. sinusknutestans, junctional bradykardi, høy grad av AV-blokkering og arytmier), ortostatiske symptomer, hjertebank, Raynauds fenomen, synkope og takykardi. Tilfeller av sinusbradykardi og atrioventrikulær blokkering er rapportert, både med og uten bruk av samtidig digitalis.
Sentralnervesystemet: Agitasjon, angst, delirium, vrangforestillinger, hallusinasjoner (inkludert visuelle og auditive), søvnløshet, mental depresjon, nervøsitet, andre atferdsendringer, parestesi, rastløshet, søvnforstyrrelser og livlige drømmer eller mareritt.
Dermatologisk: Alopecia, angioneurotisk ødem, elveblest, kløe, utslett og urticaria.
Gastrointestinale: Magesmerter, anoreksi, forstoppelse, hepatitt, ubehag, milde forbigående abnormiteter i leverfunksjonstester, kvalme, parotitt, pseudo-obstruksjon (inkludert colon-pseudo-obstruksjon), spyttkjertelsmerter og oppkast.
Genitourinært: Redusert seksuell aktivitet, problemer med vannlating, erektil dysfunksjon, tap av libido, natturi og urinretensjon.
Hematologisk: Trombocytopeni.
Metabolsk: Gynekomasti, forbigående økning av blodsukker eller serumkreatinfosfokinase og vektøkning.
Muskuloskeletal: Benkramper og muskel- eller leddsmerter.
Oro-otolaryngeal: Tørrhet i neseslimhinnen.
Oftalmologisk: Akkommodasjonsforstyrrelse, tåkesyn, svie i øynene, redusert tåreflåd og tørre øyne.
NARKOTIKAHANDEL
Klonidin kan potensere de CNS-depressive effektene av alkohol, barbiturater eller andre beroligende medikamenter. Hvis en pasient som får klonidinhydroklorid også tar trisykliske antidepressiva, kan den hypotensive effekten av klonidin reduseres, noe som nødvendiggjør en økning i klonidindosen. Hvis en pasient som får klonidin også tar neuroleptika, kan ortostatiske reguleringsforstyrrelser (f.eks. ortostatisk hypotensjon, svimmelhet, tretthet) induseres eller forverres.
Overvåk hjertefrekvensen hos pasienter som får klonidin samtidig med midler som er kjent for å påvirke sinusknutefunksjon eller AV-knuteledning, f.eks. digitalis, kalsiumkanalblokkere og betablokkere. Sinusbradykardi som resulterer i sykehusinnleggelse og pacemakerinnsetting er rapportert i forbindelse med bruk av klonidin samtidig med diltiazem eller verapamil.
Amitriptylin i kombinasjon med klonidin øker manifestasjonen av hornhinnelesjoner hos rotter (se Toksikologi ).
Basert på observasjoner hos pasienter i en tilstand av alkoholisk delirium har det blitt foreslått at høye intravenøse doser av klonidin kan øke det arytmogene potensialet (QT-forlengelse, ventrikkelflimmer) ved høye intravenøse doser av haloperidol. Årsakssammenheng og relevans for klonidin orale tabletter er ikke fastslått.
ADVARSLER
Uttak
Pasienter bør instrueres om ikke å avbryte behandlingen uten å konsultere legen sin. Plutselig seponering av klonidinbehandling har i noen tilfeller resultert i symptomer som nervøsitet, agitasjon, hodepine og skjelving ledsaget eller etterfulgt av en rask økning i blodtrykket og forhøyede katekolaminkonsentrasjoner i plasma. Sannsynligheten for slike reaksjoner ved seponering av klonidinbehandling ser ut til å være større etter administrering av høyere doser eller fortsettelse av samtidig behandling med betablokker, og spesiell forsiktighet anbefales derfor i disse situasjonene. Sjeldne tilfeller av hypertensiv encefalopati, cerebrovaskulære ulykker og død er rapportert etter seponering av klonidin. Når behandlingen med CATAPRES-tabletter avsluttes, bør legen redusere dosen gradvis over 2 til 4 dager for å unngå abstinenssymptomatologi.
En overdreven økning i blodtrykket etter seponering av behandlingen med CATAPRES 100 mcg tabletter kan reverseres ved administrering av oral klonidinhydroklorid eller ved intravenøs fentolamin. Hvis behandlingen skal seponeres hos pasienter som får en betablokker og klonidin samtidig, bør betablokkeren seponeres flere dager før gradvis seponering av CATAPRES 100mcg tabletter.
Fordi barn ofte har gastrointestinale sykdommer som fører til oppkast, kan de være spesielt utsatt for hypertensive episoder som følge av brå manglende evne til å ta medisiner.
FORHOLDSREGLER
Generell
Hos pasienter som har utviklet lokal kontaktsensibilisering overfor Catapres-TTS® (klonidin), kan fortsettelse av Catapres-TTS eller substitusjon av oral klonidinhydrokloridbehandling være assosiert med utvikling av et generalisert hudutslett.
Hos pasienter som utvikler en allergisk reaksjon på Catapres-TTS, kan substitusjon av oral klonidinhydroklorid også utløse en allergisk reaksjon (inkludert generalisert utslett, urticaria eller angioødem).
Den sympatolytiske virkningen av klonidin kan forverre sinusknutedysfunksjon og atrioventrikulær (AV) blokkering, spesielt hos pasienter som tar andre sympatolytiske legemidler. Det er rapporter etter markedsføring om pasienter med ledningsforstyrrelser og/eller som tok andre sympatolytiske legemidler som utviklet alvorlig bradykardi som krever IV atropin, IV isoproterenol og midlertidig hjertestimulering mens de tok klonidin.
Ved hypertensjon forårsaket av feokromocytom kan ingen terapeutisk effekt av CATAPRES 100mcg tabletter forventes.
Perioperativ bruk
Administrering av Catapres® (klonidinhydroklorid, USP) tabletter bør fortsettes til innen 4 timer etter operasjonen og gjenopptas så snart som mulig deretter. Blodtrykket bør overvåkes nøye under operasjonen, og ytterligere tiltak for å kontrollere blodtrykket bør være tilgjengelig om nødvendig.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Kronisk diettadministrasjon av klonidin var ikke kreftfremkallende for henholdsvis rotter (132 uker) eller mus (78 uker) dosert med opptil 46 eller 70 ganger maksimal anbefalt daglig dose for mennesker som mg/kg (9 eller 6 ganger MRDHD på en mg/m² basis). Det var ingen bevis for genotoksisitet i Ames-testen for mutagenitet eller musemikronukleustesten for klastogenisitet.
Fertiliteten til hann- eller hunnrotter var upåvirket av klonidindoser så høye som 150 μg/kg (ca. 3 ganger MRDHD). I et separat eksperiment så det ut til at fertiliteten til hunnrotter ble påvirket ved dosenivåer på 500 til 2000 μg/kg (10 til 40 ganger oral MRDHD på mg/kg-basis; 2 til 8 ganger MRDHD på mg/m²-basis ).
Svangerskap
Teratogene effekter
Graviditetskategori C
Reproduksjonsstudier utført på kaniner ved doser opp til ca. 3 ganger den orale maksimale anbefalte daglige humane dosen (MRDHD) av Catapres® (klonidinhydroklorid, USP)-tabletter ga ingen tegn på teratogent eller embryotoksisk potensial hos kaniner. Hos rotter var imidlertid doser så lave som 1/3 oral MRDHD (1/15 MRDHD på mg/m²-basis) av klonidin assosiert med økte resorpsjoner i en studie der mødre ble behandlet kontinuerlig fra 2 måneder før paring . Økte resorpsjoner var ikke assosiert med behandling på samme tid eller ved høyere dosenivåer (opptil 3 ganger oral MRDHD) når mødrene ble behandlet på drektighetsdager 6 til 15. Økning i resorpsjon ble observert ved mye høyere dosenivåer (40 ganger) oral MRDHD på mg/kg-basis; 4 til 8 ganger MRDHD på mg/m²-basis) hos mus og rotter behandlet på drektighetsdager 1 til 14 (laveste dose brukt i studien var 500 μg/kg).
Det er ikke utført tilstrekkelige, godt kontrollerte studier på gravide kvinner. Klonidin krysser placentabarrieren (se KLINISK FARMAKOLOGI , Farmakokinetikk ). Fordi reproduksjonsstudier på dyr ikke alltid er prediktive for menneskelig respons, bør dette legemidlet kun brukes under graviditet hvis det er klart nødvendig.
Ammende mødre
Siden klonidinhydroklorid skilles ut i morsmelk, bør det utvises forsiktighet når CATAPRES 100 mcg tabletter administreres til en ammende kvinne.
Pediatrisk bruk
Sikkerhet og effektivitet hos pediatriske pasienter har ikke blitt fastslått i tilstrekkelige og velkontrollerte studier (se ADVARSLER , Uttak ).
OVERDOSE
Hypertensjon kan utvikles tidlig og kan følges av hypotensjon, bradykardi, respirasjonsdepresjon, hypotermi, døsighet, reduserte eller fraværende reflekser, svakhet, irritabilitet og miose. Hyppigheten av CNS-depresjon kan være høyere hos barn enn hos voksne. Store overdoser kan føre til reversible hjerteledningsfeil eller dysrytmier, apné, koma og anfall. Tegn og symptomer på overdose oppstår vanligvis innen 30 minutter til to timer etter eksponering. Så lite som 0,1 mg klonidin har gitt tegn på toksisitet hos barn.
Det finnes ingen spesifikk motgift mot overdosering av klonidin. Overdosering av klonidin kan føre til rask utvikling av CNS-depresjon; derfor anbefales ikke fremkalling av brekninger med ipecac sirup. Mageskylling kan være indisert etter nylige og/eller store inntak. Administrering av aktivt kull og/eller et rensemiddel kan være fordelaktig. Støttende behandling kan omfatte atropinsulfat for bradykardi, intravenøse væsker og/eller vasopressormidler for hypotensjon og vasodilatorer for hypertensjon. Naloxon kan være et nyttig tillegg for behandling av klonidin-indusert respirasjonsdepresjon, hypotensjon og/eller koma; blodtrykket bør overvåkes siden administrering av nalokson av og til har resultert i paradoksal hypertensjon. Dialyse vil sannsynligvis ikke øke eliminasjonen av klonidin signifikant.
Den største overdosen rapportert til dags dato involverte en 28 år gammel mann som inntok 100 mg klonidinhydrokloridpulver. Denne pasienten utviklet hypertensjon etterfulgt av hypotensjon, bradykardi, apné, hallusinasjoner, semikom og for tidlige ventrikkelsammentrekninger. Pasienten ble helt frisk etter intensiv behandling. Klonidinnivåer i plasma var 60 ng/ml etter 1 time, 190 ng/ml etter 1,5 timer, 370 ng/ml etter 2 timer og 120 ng/ml etter 5,5 og 6,5 timer. Hos mus og rotter er den orale LD50 av klonidin henholdsvis 206 og 465 mg/kg.
KONTRAINDIKASJONER
Catapres® (klonidinhydroklorid, USP) tabletter skal ikke brukes hos pasienter med kjent overfølsomhet overfor klonidin (se FORHOLDSREGLER ).
KLINISK FARMAKOLOGI
Klonidin stimulerer alfa-adrenoreseptorer i hjernestammen. Denne handlingen resulterer i redusert sympatisk utstrømning fra sentralnervesystemet og i reduksjoner i perifer motstand, renal vaskulær motstand, hjertefrekvens og blodtrykk. CATAPRES 100mcg tabletter virker relativt raskt. Pasientens blodtrykk synker i løpet av 30 til 60 minutter etter en oral dose, den maksimale reduksjonen skjer innen 2 til 4 timer. Renal blodstrøm og glomerulær filtrasjonshastighet forblir i det vesentlige uendret. Normale posturale reflekser er intakte; derfor er ortostatiske symptomer milde og sjeldne.
Akuttstudier med klonidinhydroklorid hos mennesker har vist en moderat reduksjon (15 % til 20 %) av hjertevolum i ryggleie uten endring i den perifere motstanden: ved 45° tilt er det en mindre reduksjon i hjertevolum og en reduksjon. av perifer motstand. Under langtidsbehandling har hjerteminuttet en tendens til å gå tilbake til kontrollverdier, mens perifer motstand fortsatt er redusert. Reduksjon av pulsfrekvensen er observert hos de fleste pasienter som får klonidin, men stoffet endrer ikke normal hemodynamisk respons på trening.
Toleranse for den antihypertensive effekten kan utvikles hos noen pasienter, noe som nødvendiggjør en revurdering av behandlingen.
Andre studier på pasienter har gitt bevis på en reduksjon i plasmareninaktivitet og i utskillelsen av aldosteron og katekolaminer. Den nøyaktige sammenhengen mellom disse farmakologiske virkningene og den antihypertensive effekten av klonidin er ikke fullstendig klarlagt.
Klonidin stimulerer akutt frigjøring av veksthormon hos både barn og voksne, men gir ikke en kronisk økning av veksthormon ved langvarig bruk.
Farmakokinetikk
Farmakokinetikken til klonidin er doseproporsjonal i området 100 til 600 μg. Den absolutte biotilgjengeligheten av klonidin ved oral administrering er 70 % til 80 %. Maksimale plasmaklonidinnivåer oppnås i løpet av ca. 1 til 3 timer.
Etter intravenøs administrering viser klonidin bifasisk disposisjon med en distribusjonshalveringstid på ca. 20 minutter og en eliminasjonshalveringstid fra 12 til 16 timer. Halveringstiden øker opptil 41 timer hos pasienter med alvorlig nedsatt nyrefunksjon. Klonidin krysser placentabarrieren. Det har vist seg å krysse blod-hjerne-barrieren hos rotter.
Etter oral administrering gjenfinnes ca. 40 % til 60 % av den absorberte dosen i urinen som uendret legemiddel i løpet av 24 timer. Omtrent 50 % av den absorberte dosen metaboliseres i leveren. Verken mat eller rasen til pasienten påvirker farmakokinetikken til klonidin.
Den antihypertensive effekten oppnås ved plasmakonsentrasjoner mellom ca. 0,2 og 2,0 ng/ml hos pasienter med normal utskillelsesfunksjon. En ytterligere økning i plasmanivåene vil ikke forsterke den antihypertensive effekten.
Toksikologi
I flere studier med oralt klonidinhydroklorid ble det sett en doseavhengig økning i forekomst og alvorlighetsgrad av spontan retinal degenerasjon hos albinorotter behandlet i seks måneder eller lenger. Studier av vevsfordeling hos hunder og aper viste en konsentrasjon av klonidin i årehinnen.
Med tanke på retinal degenerasjon sett hos rotter, ble øyeundersøkelser utført under kliniske studier hos 908 pasienter før og med jevne mellomrom etter oppstart av klonidinbehandling. Hos 353 av disse 908 pasientene ble øyeundersøkelsene utført over perioder på 24 måneder eller lenger. Bortsett fra noe tørrhet i øynene, ble det ikke registrert noen legemiddelrelaterte unormale oftalmologiske funn, og i henhold til spesialiserte tester som elektroretinografi og makulær blending var netthinnefunksjonen uendret.
I kombinasjon med amitriptylin førte administrering av klonidinhydroklorid til utvikling av hornhinnelesjoner hos rotter innen 5 dager.
PASIENTINFORMASJON
Pasienter bør advares mot å avbryte behandlingen med CATAPRES 100mcg tabletter uten legens råd.
Siden pasienter kan oppleve en mulig beroligende effekt, svimmelhet eller akkommodasjonsforstyrrelse ved bruk av klonidin, må pasienter være forsiktige med å delta i aktiviteter som å kjøre bil eller betjene apparater eller maskiner. Informer også pasienter om at denne beroligende effekten kan økes ved samtidig bruk av alkohol, barbiturater eller andre beroligende medikamenter.
Pasienter som bruker kontaktlinser bør advares om at behandling med CATAPRES tabletter kan forårsake tørre øyne.
