Minipress 1mg, 2mg Prazosin Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Minipress og hvordan brukes det?
Minipress (prazosinhydroklorid) er en alfa-adrenerg blokker som brukes til å behandle hypertensjon (høyt blodtrykk).
Hva er bivirkningene av Minipress 2mg?
Vanlige bivirkninger av Minipress 1mg inkluderer:
- . hodepine, . døsighet, . tretthet, . svakhet, . tåkesyn, . kvalme, . oppkast, . diaré, eller . forstoppelse når kroppen tilpasser seg medisinen
Andre bivirkninger av Minipress 2mg inkluderer:
- . svimmelhet eller svimmelhet når du står opp, spesielt etter den første dosen og kort tid etter å ha tatt en dose av legemidlet i løpet av den første uken av behandlingen.
Fortell legen din dersom du opplever alvorlige bivirkninger av Minipress 1mg, inkludert raske eller bankende hjerteslag eller flagrende i brystet, føler at du kan besvime, pusteproblemer, hevelser i hender eller føtter, eller en ereksjon som er smertefull eller varer i 4 timer eller lenger.
BESKRIVELSE
MINIPRESS® (prazosinhydroklorid), et kinazolinderivat, er det første i en ny kjemisk klasse av antihypertensiva. Det er hydrokloridsaltet av 1-(4-amino-6,7-dimetoksy-2-kinazolinyl)-4-(2-furoyl) piperazin og dets strukturformel er:
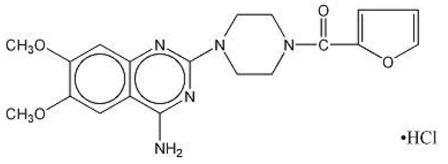
Molekylformel C19H21N5O4•HCl
Det er en hvit, krystallinsk substans, lett løselig i vann og isotonisk saltvann, og har en molekylvekt på 419,87. Hver 1 mg kapsel med MINIPRESS for oral bruk inneholder legemiddel tilsvarende 1 mg fri base.
Inerte ingredienser i formuleringene er: harde gelatinkapsler (som kan inneholde blå 1, rød 3, rød 28, rød 40 og andre inerte ingredienser); magnesiumstearat; natriumlaurylsulfat; stivelse; sukrose.
INDIKASJONER
MINIPRESS 1mg er indisert for behandling av hypertensjon, for å senke blodtrykket. Senking av blodtrykket reduserer risikoen for dødelige og ikke-dødelige kardiovaskulære hendelser, først og fremst hjerneslag og hjerteinfarkt. Disse fordelene har blitt sett i kontrollerte studier av antihypertensiva fra en rekke farmakologiske klasser, inkludert dette legemidlet.
Kontroll av høyt blodtrykk bør være en del av omfattende kardiovaskulær risikostyring, inkludert, etter behov, lipidkontroll, diabetesbehandling, antitrombotisk terapi, røykeslutt, trening og begrenset natriuminntak. Mange pasienter vil kreve mer enn ett medikament for å oppnå blodtrykksmål. For spesifikke råd om mål og ledelse, se publiserte retningslinjer, for eksempel de fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Tallrike antihypertensiva, fra en rekke farmakologiske klasser og med forskjellige virkningsmekanismer, har i randomiserte kontrollerte studier vist seg å redusere kardiovaskulær sykelighet og dødelighet, og det kan konkluderes med at det er blodtrykksreduksjon, og ikke noen annen farmakologisk egenskap av stoffene, som i stor grad er ansvarlig for disse fordelene. Den største og mest konsistente fordelen for kardiovaskulær utfall har vært en reduksjon i risikoen for hjerneslag, men reduksjoner i hjerteinfarkt og kardiovaskulær dødelighet har også blitt sett regelmessig.
Forhøyet systolisk eller diastolisk trykk forårsaker økt kardiovaskulær risiko, og den absolutte risikoøkningen per mmHg er større ved høyere blodtrykk, slik at selv beskjedne reduksjoner av alvorlig hypertensjon kan gi betydelig fordel. Relativ risikoreduksjon fra blodtrykksreduksjon er lik på tvers av populasjoner med varierende absolutt risiko, så den absolutte fordelen er større hos pasienter som har høyere risiko uavhengig av deres hypertensjon (for eksempel pasienter med diabetes eller hyperlipidemi), og slike pasienter kan forventes å dra nytte av mer aggressiv behandling til et lavere blodtrykksmål.
Noen antihypertensiva har mindre blodtrykkseffekter (som monoterapi) hos svarte pasienter, og mange antihypertensiva har ytterligere godkjente indikasjoner og effekter (f.eks. på angina, hjertesvikt eller diabetisk nyresykdom). Disse betraktningene kan lede valg av terapi.
MINIPRESS kan brukes alene eller i kombinasjon med andre antihypertensiva som diuretika eller beta-adrenerge blokkere.
DOSERING OG ADMINISTRASJON
Dosen av MINIPRESS 1 mg bør justeres i henhold til pasientens individuelle blodtrykksrespons. Følgende er en veiledning for administrasjonen:
Startdose
1 mg to eller tre ganger daglig (se ADVARSLER .)
Vedlikeholdsdose
Dosen kan økes sakte til en total daglig dose på 20 mg gitt i oppdelte doser. De mest brukte terapeutiske dosene har variert fra 6 mg til 15 mg daglig gitt i oppdelte doser. Doser høyere enn 20 mg øker vanligvis ikke effekten, men noen få pasienter kan ha nytte av ytterligere økninger opp til en daglig dose på 40 mg gitt i delte doser. Etter initial titrering kan noen pasienter opprettholdes tilstrekkelig på et doseringsregime to ganger daglig.
Bruk sammen med andre stoffer
Ved tilsetning av et vanndrivende middel eller et annet antihypertensivt middel, bør dosen av MINIPRESS 1 mg reduseres til 1 mg eller 2 mg tre ganger daglig og retitrering deretter utføres.
Samtidig administrering av MINIPRESS 1mg med en PDE-5-hemmer kan resultere i additive blodtrykkssenkende effekter og symptomatisk hypotensjon; derfor bør PDE-5-hemmerbehandling startes med laveste dose hos pasienter som tar MINIPRESS.
HVORDAN LEVERES
Distribuert av: Pfizer Labs, Divsion of Pfizer Inc., NY, NY 10017. Revidert: feb 2015
BIVIRKNINGER
Kliniske studier ble utført på mer enn 900 pasienter. Under disse forsøkene og påfølgende markedsføringserfaring er de hyppigste reaksjonene forbundet med MINIPRESS-behandling: svimmelhet 10,3 %, hodepine 7,8 %, døsighet 7,6 %, mangel på energi 6,9 %, svakhet 6,5 %, hjertebank 5,3 % og kvalme 4,9 %. I de fleste tilfeller har bivirkninger forsvunnet med fortsatt behandling eller har blitt tolerert uten reduksjon i dose av medikament.
Mindre hyppige bivirkninger som er rapportert å forekomme hos 1-4 % av pasientene er:
Gastrointestinale: oppkast, diaré, forstoppelse.
Kardiovaskulær: ødem, ortostatisk hypotensjon, dyspné, synkope.
Sentralnervesystemet: svimmelhet, depresjon, nervøsitet.
Dermatologisk: utslett.
Genitourinært: urinfrekvens.
EENT: tåkesyn, rødmet sklera, neseblødning, munntørrhet, tett nese.
I tillegg har færre enn 1 % av pasientene rapportert følgende (i noen tilfeller er eksakte årsakssammenhenger ikke etablert):
Gastrointestinale: ubehag og/eller smerte i magen, unormale leverfunksjoner, pankreatitt.
Kardiovaskulær: takykardi.
Sentralnervesystemet: parestesi, hallusinasjoner.
Dermatologisk: pruritus, alopecia, lichen planus.
Genitourinært: inkontinens, impotens, priapisme.
EENT: tinnitus.
Annen: diaforese, feber, positiv ANA-titer, artralgi.
Enkeltrapporter om pigmentflekker og serøs retinopati, og noen få rapporter om kataraktutvikling eller forsvinning er rapportert. I disse tilfellene har den eksakte årsakssammenhengen ikke blitt fastslått fordi baseline-observasjonene ofte var utilstrekkelige.
I mer spesifikke spaltelampe- og funduskopiske studier, som inkluderte tilstrekkelige baselineundersøkelser, er det ikke rapportert om legemiddelrelaterte unormale oftalmologiske funn.
Det finnes litteraturrapporter som forbinder MINIPRESS 1 mg-behandling med en forverring av eksisterende narkolepsi. En årsakssammenheng er usikker i disse tilfellene.
Etter markedsføring har følgende bivirkninger blitt rapportert:
Autonome nervesystem: rødming.
Kroppen som helhet: allergisk reaksjon, asteni, ubehag, smerte.
Kardiovaskulær, generelt: angina pectoris, hypotensjon.
Endokrine: gynekomasti.
Hjertefrekvens/rytme: bradykardi.
Psykiatrisk: søvnløshet.
Hud/vedlegg: urticaria.
Vaskulær (ekstrakardialt): vaskulitt.
Syn: øyesmerter.
Spesielle sanser: Under kataraktkirurgi er det rapportert om en variant av småpupillsyndrom kjent som Intraoperativt Floppy Iris Syndrome (IFIS) i forbindelse med alfa-1-blokkerbehandling (se FORHOLDSREGLER ).
NARKOTIKAHANDEL
MINIPRESS 2mg har blitt administrert uten noen uønskede legemiddelinteraksjoner i begrenset klinisk erfaring til dags dato med følgende: (1) hjerteglykosider-digitalis og digoksin; (2) hypoglykemiske midler-insulin, klorpropamid, fenformin, tolazamid og tolbutamid; (3) beroligende midler og beroligende midler - klordiazepoksid, diazepam og fenobarbital; (4) anti-allopurinol, kolkisin og probenecid; (5) antiarytmika-prokainamid, propranolol (se ADVARSLER imidlertid), og kinidin; og (6) smertestillende, febernedsettende og antiinflammatoriske midler - propoksyfen, aspirin, indometacin og fenylbutazon.
Tilsetning av et vanndrivende eller annet antihypertensivt middel til MINIPRESS 2mg har vist seg å forårsake en additiv hypotensiv effekt. Denne effekten kan minimeres ved å redusere MINIPRESS-dosen til 1 til 2 mg tre ganger daglig, ved å introdusere ekstra antihypertensiva forsiktig, og deretter ved å retitrere MINIPRESS basert på klinisk respons. Samtidig administrering av MINIPRESS og en fosfodiesterase-5 (PDE-5) hemmer kan resultere i additive blodtrykkssenkende effekter og symptomatisk hypotensjon (se DOSERING OG ADMINISTRASJON ).
Interaksjoner med legemiddel/laboratorietest
en studie på fem pasienter gitt fra 12 til 24 mg prazosin per dag i 10 til 14 dager, var det en gjennomsnittlig økning på 42 % i urinmetabolitten av noradrenalin og en gjennomsnittlig økning i urin-VMA på 17 %. Derfor kan falske positive resultater forekomme i screeningtester for feokromocytom hos pasienter som behandles med prazosin. Hvis en forhøyet VMA oppdages, bør prazosin seponeres og pasienten testes på nytt etter en måned.
Laboratorietester
I kliniske studier der lipidprofiler ble fulgt, ble det generelt sett ingen uønskede endringer mellom lipidnivåer før og etter behandling.
ADVARSLER
Som med alle alfablokkere, kan MINIPRESS forårsake synkope med plutselig tap av bevissthet. I de fleste tilfeller antas dette å skyldes en overdreven postural hypotensiv effekt, selv om syncopalepis-ode av og til har blitt innledet av en anfall av alvorlig takykardi med hjertefrekvenser på 120-160 slag per minutt. Syncopalepis-oder har vanligvis oppstått innen 30 til 90 minutter etter den første dosen av legemidlet; Noen ganger har de blitt rapportert i forbindelse med raske aldersøkninger eller introduksjon av et annet antihypertensivt legemiddel i regimet til en pasient som tar høye doser MINIPRESS. Forekomsten av syncopalepis odes er omtrent 1 % hos pasienter som får en startdose på 2 mg eller mer. Kliniske studier utført i undersøkelsesfasen av dette legemidlet tyder på at synkopale episoder kan minimeres ved å begrense den initiale dosen av legemidlet til 1 mg, ved deretter å øke dosealderen sakte, og ved å introdusere eventuelle ekstra antihypertensive legemidler i pasientens regime. med forsiktighet (se DOSERING OG ADMINISTRASJON). Hypotensjon kan utvikles hos pasienter som får MINIPRESS som også får en betablokker som propranolol.
Hvis synkope oppstår, skal pasienten legges i liggende stilling og behandles støttende etter behov. Denne bivirkningen er selvbegrensende og oppstår i de fleste tilfeller ikke etter den første behandlingsperioden eller under påfølgende dosetitrering.
Pasienter bør alltid startes med 1 mg kapsler av MINIPRESS. 2 og 5 mg kapslene er ikke indisert for initial behandling.
Mer vanlig enn tap av bevissthet er symptomene som ofte er forbundet med senking av blodtrykket, nemlig svimmelhet og svimmelhet. Pasienten bør advares om disse mulige bivirkningene og informeres om hvilke tiltak som skal iverksettes dersom de utvikler seg. Pasienten bør også advares om å unngå situasjoner der skade kan oppstå dersom synkope oppstår under oppstart av MINIPRESS 2 mg-behandling.
Priapisme
Forlengede ereksjoner og priapisme er rapportert med alfa-1-blokkere inkludert prazosin etter markedsføring. Ved en ereksjon som varer lenger enn 4 timer, søk øyeblikkelig medisinsk hjelp. Hvis priapisme ikke behandles umiddelbart, kan penisvevsskade og permanent tap av styrke føre til.
FORHOLDSREGLER
Generell
Intraoperativt Floppy Iris Syndrome (IFIS) har blitt observert under kataraktkirurgi hos noen pasienter behandlet med alfa-1-blokkere. Denne varianten av lite pupillsyndrom er preget av kombinasjonen av en slapp iris som bølger som respons på intraoperative irrigasjonsstrømmer, progressiv intraoperativ miose til tross for preoperativ dilatasjon med standard mydriatiske legemidler, og potensiell prolaps av iris mot fakoemulsifiseringssnittene. Pasientens øyelege bør være forberedt på mulige modifikasjoner av operasjonsteknikken, for eksempel bruk av iriskroker, irisdilatatorringer eller viskoelastiske stoffer. Det ser ikke ut til å være noen fordel ved å stoppe alfa-1-blokkerbehandlingen før kataraktoperasjon.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Det ble ikke påvist noe karsinogent potensial i en 18 måneders studie på rotter med MINIPRESS 1 mg ved dosenivåer mer enn 225 ganger den vanlige maksimale anbefalte humane dosen på 20 mg per dag. MINIPRESS 2mg var ikke mutagent i in vivo genetiske toksikologiske studier. I en fertilitets- og generell reproduksjonsstudie hos rotter, viste både hanner og hunner, behandlet med 75 mg/kg (225 ganger vanlig maksimal anbefalt human dose), redusert fertilitet, mens de som ble behandlet med 25 mg/kg (75 ganger vanlig) maksimal anbefalt human dose) gjorde det ikke.
kroniske studier (ett år eller mer) av MINIPRESS hos rotter og hunder, oppsto testikkelforandringer bestående av atrofi og nekrose ved 25 mg/kg/dag (75 ganger vanlig maksimal anbefalt human dose). Ingen testikkelforandringer ble sett hos rotter eller hunder ved 10 mg/kg/dag (30 ganger vanlig maksimal anbefalt human dose). I lys av testikkelforandringene som ble observert hos dyr, ble 105 pasienter på langtidsbehandling med MINIPRESS overvåket for 17-ketosteroidutskillelse, og ingen endringer som indikerer en medikamentell effekt ble observert. I tillegg hadde 27 menn på MINIPRESS 1mg i opptil 51 måneder ingen endringer i spermmorfologi som tyder på medikamenteffekt.
Bruk under graviditet
Graviditetskategori C. MINIPRESS 1mg har vist seg å være assosiert med redusert kullstørrelse ved fødsel, 1, 4 og 21 dager gamle hos rotter når de får doser mer enn 225 ganger den vanlige maksimale anbefalte humane dosen. Ingen tegn på legemiddelrelaterte eksterne, viscerale eller skjelettfetale abnormiteter ble observert. Ingen legemiddelrelaterte eksterne, viscerale eller skjelettavvik ble observert hos fostre til drektige kaniner og drektige aper ved doser over henholdsvis 225 ganger og 12 ganger vanlig maksimal anbefalt human dose.
Bruk av prazosin og en betablokker for kontroll av alvorlig hypertensjon hos 44 gravide kvinner avslørte ingen legemiddelrelaterte føtale abnormiteter eller bivirkninger. Behandling med prazosin ble fortsatt i så lenge som 14 uker.1
Prazosin har også blitt brukt alene eller i kombinasjon med andre hypotensive midler ved alvorlig hypertensjon under graviditet av andre etterforskere. Ingen føtale eller neonatale abnormiteter er rapportert ved bruk av prazosin.2
Det finnes ingen tilstrekkelige og godt kontrollerte studier som fastslår sikkerheten til MINIPRESS hos gravide kvinner. MINIPRESS skal kun brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for mor og foster.
Ammende mødre
MINIPRESS 1mg har vist seg å skilles ut i små mengder i morsmelk. Forsiktighet bør utvises når MINIPRESS 2mg gis til en ammende kvinne.
Bruk hos barn
Sikkerhet og effektivitet hos barn er ikke fastslått.
REFERANSER
1. Lubbe, WF og Hodge, JV: New Zealand Med J, 94 (691) 169-172, 1981.
2. Davey, DA, og Dommisse, J: SA Med J, 4. oktober 1980 (551-556).
OVERDOSE
Utilsiktet inntak av minst 50 mg MINIPRESS hos et to år gammelt barn resulterte i dyp døsighet og deprimerte reflekser. Det ble ikke observert noen reduksjon i blodtrykket. Utvinningen var begivenhetsløs.
Skulle overdosering føre til hypotensjon, er støtte til det kardiovaskulære systemet av første betydning. Gjenoppretting av blodtrykket og normalisering av hjertefrekvensen kan oppnås ved å holde pasienten i ryggleie. Hvis dette tiltaket er utilstrekkelig, bør sjokk først behandles med volumutvidere. Om nødvendig bør vasopressorer brukes. Nyrefunksjonen bør overvåkes og støttes etter behov. Laboratoriedata indikerer at MINIPRESS ikke kan dialyseres fordi det er proteinbundet.
KONTRAINDIKASJONER
MINIPRESS er kontraindisert hos pasienter med kjent følsomhet overfor kinazoliner, prazosin eller noen av de inerte ingrediensene.
KLINISK FARMAKOLOGI
Den nøyaktige mekanismen for den hypotensive virkningen av prazosin er ukjent. Prazosin forårsaker en reduksjon i total perifer motstand og ble opprinnelig antatt å ha en direkte avslappende virkning på vaskulær glatt muskulatur. Nyere dyrestudier har imidlertid antydet at den vasodilatoriske effekten av prazosin også er relatert til blokkering av postsynaptiske alfa-adrenoceptorer. Resultatene av hundeforbenseksperimenter viser at den perifere vasodilatoreffekten av prazosin hovedsakelig er begrenset til nivået av motstandskarene (arteriolene). I motsetning til konvensjonelle alfablokkere, er den antihypertensive virkningen av prazosin vanligvis ikke ledsaget av reflekstakykardi. Toleranse har ikke blitt observert å utvikle seg ved langtidsbehandling.
Hemodynamiske studier har blitt utført hos mennesker etter akutt enkeltdoseadministrasjon og i løpet av langvarig vedlikeholdsbehandling. Resultatene bekrefter at den terapeutiske effekten er et blodtrykksfall uten følge av en klinisk signifikant endring i hjertevolum, hjertefrekvens, renal blodstrøm og glomerulær filtrasjonshastighet. Det er ingen målbar negativ kronotrop effekt.
I kliniske studier til dags dato har ikke prazosinhydroklorid økt plasmareninaktivitet.
Hos mennesker senkes blodtrykket både i liggende og stående stilling. Denne effekten er mest uttalt på det diastoliske blodtrykket.
Etter oral administrering når plasmakonsentrasjoner hos mennesker en topp etter ca. tre timer med en plasmahalveringstid på to til tre timer. Legemidlet er sterkt bundet til plasmaprotein. Biotilgjengelighetsstudier har vist at den totale absorpsjonen i forhold til stoffet i en 20 % alkoholholdig løsning er 90 %, noe som resulterer i toppnivåer på omtrent 65 % av stoffet i løsningen. Dyrestudier indikerer at prazosinhydroklorid metaboliseres i stor grad, primært ved demetylering og konjugering, og utskilles hovedsakelig via galle og avføring. Mindre omfattende menneskelige studier tyder på lignende metabolisme og utskillelse hos mennesker.
I kliniske studier der lipidprofiler ble fulgt, ble det generelt sett ingen uønskede endringer mellom lipidnivåer før og etter behandling.
PASIENTINFORMASJON
Svimmelhet eller døsighet kan oppstå etter den første dosen av dette legemidlet. Unngå å kjøre bil eller utføre farlige oppgaver de første 24 timene etter at du har tatt dette legemidlet eller når dosen økes. Svimmelhet, svimmelhet eller besvimelse kan forekomme, spesielt når du reiser deg fra liggende eller sittende stilling. Å reise seg sakte kan bidra til å redusere problemet. Disse effektene kan også oppstå hvis du drikker alkohol, står i lange perioder, trener eller hvis været er varmt. Mens du tar MINIPRESS, vær forsiktig med mengden alkohol du drikker. Vær også ekstra forsiktig under trening eller varmt vær, eller hvis du står i lange perioder. Sjekk med legen din hvis du har spørsmål.
