Hyzaar 12.5mg Hydrochlorothiazide Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Hyzaar og hvordan brukes det?
Hyzaar 12,5mg er et reseptbelagt legemiddel som brukes til å behandle symptomene på høyt blodtrykk (hypertensjon). Hyzaar kan brukes alene eller sammen med andre medisiner.
Hyzaar tilhører en klasse medikamenter kalt ARB/HCTZ Combos.
Det er ikke kjent om Hyzaar er trygt og effektivt hos barn.
Hva er de mulige bivirkningene av Hyzaar 12,5 mg?
Hyzaar kan forårsake alvorlige bivirkninger, inkludert:
- . svimmelhet, . uregelmessige hjerteslag, . øyesmerter, . synsproblemer, . lite eller ingen vannlating, . rask vektøkning, . hevelse i hender, føtter eller ankler, . leddsmerter, . hudutslett på kinnene eller armene som forverres i sollys, . økt tørst, . økt vannlating, . forvirring, . oppkast, . forstoppelse, . Muskelsmerte, . kramper i benet, . alvorlig svakhet, . nummenhet eller prikking, . tap av bevegelse, og . føler seg nervøs eller ustø
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Hyzaar inkluderer:
- . svimmelhet, . ryggsmerter, og . forkjølelsessymptomer (tett nese, nysing, sår hals)
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Hyzaar. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
Når graviditet oppdages, seponer HYZAAR så snart som mulig. Legemidler som virker direkte på renin-angiotensin-systemet kan forårsake skade og død for det utviklende fosteret [se ADVARSLER OG FORHOLDSREGLER ].
BESKRIVELSE
HYZAAR 50/12.5 (losartan kalium-hydroklortiazid), HYZAAR 100/12.5 (losartan kaliumhydroklortiazid) og HYZAAR 100/25 (losartan kalium-hydroklortiazid) tabletter kombinerer en angiotensin II reseptor a 1-reseptor-, subtype-diklorazid-reseptor-blokker og subtype-receptorblokker av hydroklorazid.
Losartankalium, et ikke-peptidmolekyl, er kjemisk beskrevet som 2-butyl-4-klor-1-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]imidazol-5-metanolmonokaliumsalt. Dens empiriske formel er C22H22ClKN6O, og dens strukturformel er:
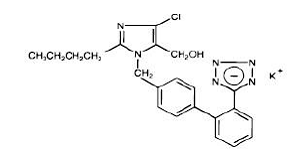
Losartan kalium er et hvitt til off-white frittflytende krystallinsk pulver med en molekylvekt på 461,01. Det er fritt løselig i vann, løselig i alkoholer og lett løselig i vanlige organiske løsningsmidler, som acetonitril og metyletylketon.
Oksidasjon av 5-hydroksymetylgruppen på imidazolringen resulterer i den aktive metabolitten til losartan.
Hydroklortiazid er 6-klor-3,4-dihydro-2H-1,2,4-benzotiadiazin-7-sulfonamid-1,1-dioksid. Dens empiriske formel er C7H8ClN3O4S2 og dens strukturformel er:
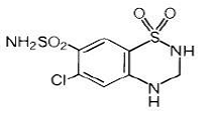
Hydroklortiazid er et hvitt, eller praktisk talt hvitt, krystallinsk pulver med en molekylvekt på 297,74, som er lett løselig i vann, men fritt løselig i natriumhydroksidløsning.
HYZAAR er tilgjengelig for oral administrering i tre tablettkombinasjoner av losartan og hydroklortiazid. HYZAAR 50/12,5 inneholder 50 mg losartankalium og 12,5 mg hydroklortiazid. HYZAAR 100/12,5 inneholder 100 mg losartankalium og 12,5 mg hydroklortiazid. HYZAAR 100/25 inneholder 100 mg losartankalium og 25 mg hydroklortiazid. Inaktive ingredienser er mikrokrystallinsk cellulose, vannholdig laktose, pregelatinisert stivelse, magnesiumstearat, hydroksypropylcellulose, hypromellose og titandioksid.
HYZAAR 50/12.5 og HYZAAR 100/25 inneholder også D&C gul nr. 10 aluminiumssjø. HYZAAR 50/12.5, HYZAAR 100/12.5 og HYZAAR 100/25 kan også inneholde karnaubavoks.
HYZAAR 50/12,5 inneholder 4,24 mg (0,108 mEq) kalium, HYZAAR 100/12,5 inneholder 8,48 mg (0,216 mEq) kalium, og HYZAAR 100/25 inneholder 8,48 mg (0,216 mEq) kalium.
INDIKASJONER
Hypertensjon
HYZAAR® er indisert for behandling av hypertensjon, for å senke blodtrykket. Senking av blodtrykket reduserer risikoen for fatale og ikke-dødelige kardiovaskulære (CV) hendelser, først og fremst hjerneslag og hjerteinfarkt. Disse fordelene har blitt sett i kontrollerte studier av antihypertensiva fra en lang rekke farmakologiske klasser, inkludert losartan og hydroklortiazid.
Kontroll av høyt blodtrykk bør være en del av omfattende kardiovaskulær risikostyring, inkludert, etter behov, lipidkontroll, diabetesbehandling, antitrombotisk terapi, røykeslutt, trening og begrenset natriuminntak. Mange pasienter vil kreve mer enn 1 medikament for å oppnå blodtrykksmål. For spesifikke råd om mål og ledelse, se publiserte retningslinjer, for eksempel de fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Tallrike antihypertensiva, fra en rekke farmakologiske klasser og med forskjellige virkningsmekanismer, har i randomiserte kontrollerte studier vist seg å redusere kardiovaskulær sykelighet og dødelighet, og det kan konkluderes med at det er blodtrykksreduksjon, og ikke noen annen farmakologisk egenskap av stoffene, som i stor grad er ansvarlig for disse fordelene. Den største og mest konsistente fordelen for kardiovaskulær utfall har vært en reduksjon i risikoen for hjerneslag, men reduksjoner i hjerteinfarkt og kardiovaskulær dødelighet har også blitt sett regelmessig.
Forhøyet systolisk eller diastolisk trykk forårsaker økt kardiovaskulær risiko, og den absolutte risikoøkningen per mmHg er større ved høyere blodtrykk, slik at selv beskjedne reduksjoner av alvorlig hypertensjon kan gi betydelig fordel. Relativ risikoreduksjon fra blodtrykksreduksjon er lik på tvers av populasjoner med varierende absolutt risiko, så den absolutte fordelen er større hos pasienter som har høyere risiko uavhengig av deres hypertensjon (for eksempel pasienter med diabetes eller hyperlipidemi), og slike pasienter kan forventes å dra nytte av mer aggressiv behandling til et lavere blodtrykksmål.
Noen antihypertensiva har mindre blodtrykkseffekter (som monoterapi) hos svarte pasienter, og mange antihypertensiva har ytterligere godkjente indikasjoner og effekter (f.eks. på angina, hjertesvikt eller diabetisk nyresykdom). Disse betraktningene kan lede valg av terapi.
Denne faste dosekombinasjonen er ikke indisert for initial behandling av hypertensjon, bortsett fra når hypertensjonen er alvorlig nok til at verdien av å oppnå rask blodtrykkskontroll overstiger risikoen for å starte kombinasjonsbehandling hos disse pasientene [se Kliniske studier og DOSERING OG ADMINISTRASJON ].
HYZAAR kan administreres sammen med andre antihypertensiva.
Hypertensive pasienter med venstre ventrikkelhypertrofi
HYZAAR er indisert for å redusere risikoen for hjerneslag hos pasienter med hypertensjon og venstre ventrikkelhypertrofi, men det er bevis på at denne fordelen ikke gjelder for svarte pasienter. [Se Bruk i spesifikke populasjoner , KLINISK FARMAKOLOGI , og DOSERING OG ADMINISTRASJON .]
DOSERING OG ADMINISTRASJON
Hypertensjon
Vanlig startdose av HYZAAR er 50/12,5 (losartan 50 mg/hydroklortiazid 12,5 mg) én gang daglig. Dosen kan økes etter 3 ukers behandling til maksimalt 100/25 (losartan 100 mg/hydroklortiazid 25 mg) én gang daglig etter behov for å kontrollere blodtrykket [se Kliniske studier ].
Start en pasient hvis blodtrykk ikke er tilstrekkelig kontrollert med losart en 50 mg monoterapi med HYZAAR 50/12,5 én gang daglig. Hvis blodtrykket fortsatt er under kontroll etter ca. 3 ukers behandling, kan dosen økes til to tabletter HYZAAR 50/12,5 én gang daglig eller én tablett HYZAAR 100/25 én gang daglig.
Start en pasient hvis blodtrykk ikke er tilstrekkelig kontrollert med losartan 100 mg monoterapi med HYZAAR 100/12,5 (losartan 100 mg/hydroklortiazid 12,5 mg) én gang daglig. Hvis blodtrykket forblir ukontrollert etter ca. 3 ukers behandling, øk dosen til to tabletter HYZAAR 50/12,5 én gang daglig eller én tablett HYZAAR 100/25 én gang daglig.
Initier en pasient hvis blodtrykk er utilstrekkelig kontrollert med hydroklortiazid 25 mg én gang daglig, eller er kontrollert, men som opplever hypokalemi med dette regimet, med HYZAAR 50/12,5 én gang daglig, og reduser dosen av hydroklortiazid uten å redusere den generelle forventede antihypertensive responsen. Evaluer den kliniske responsen på HYZAAR 50/12.5, og hvis blodtrykket forblir ukontrollert etter ca. 3 ukers behandling, øk dosen til to tabletter HYZAAR 50/12.5 én gang daglig eller én tablett HYZAAR 100/25 én gang daglig.
Hypertensive pasienter med venstre ventrikkelhypertrofi
Start behandling med HYZAAR 50/12.5 hos pasienter hvis blodtrykk ikke er tilstrekkelig kontrollert med 50 mg losartankalium. Hvis ytterligere blodtrykksreduksjon er nødvendig, øk dosen til HYZAAR 100/12,5, etterfulgt av HYZAAR 100/25. For ytterligere blodtrykksreduksjon legg til andre antihypertensiva [se Kliniske studier ].
HVORDAN LEVERES
Doseringsformer og styrker
- . HYZAAR 50/12.5 er gule, ovale, filmdrasjerte tabletter, med kode 717 på den ene siden. . HYZAAR 100/12.5 er hvite, ovale, filmdrasjerte tabletter, med kode 745 på den ene siden. . HYZAAR 100/25 er lysegule, ovale, filmdrasjerte tabletter, med kode 747 på den ene siden.
Oppbevaring og håndtering
HYZAAR leveres som en filmdrasjert tablett.
Oppbevares ved 25°C (77°F); utflukter tillatt til 15-30°C (59-86°F) [se USP kontrollert romtemperatur ]. Hold beholderen tett lukket. Beskytt mot lys.
Produsert for: Organon LLC, et datterselskap av ORGANON & Co., Jersey City, NJ 07302, USA. Revidert: juni 2021
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et medikament ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke hyppighetene observert i praksis.
Losartan-kalium-hydroklortiazid har blitt evaluert for sikkerhet hos 858 pasienter behandlet for essensiell hypertensjon og 3889 pasienter behandlet for hypertensjon og venstre ventrikkelhypertrofi. De fleste bivirkningene har vært milde og forbigående og har ikke krevd seponering av behandlingen. I kontrollerte kliniske studier var det nødvendig med seponering av behandlingen på grunn av kliniske bivirkninger hos bare 2,8 % og 2,3 % av pasientene behandlet med henholdsvis kombinasjonen og placebo.
I disse dobbeltblinde kontrollerte kliniske studiene var bivirkninger som forekom hos mer enn 2 % av pasientene behandlet med losartan-hydroklortiazid og med en høyere rate enn placebo: ryggsmerter (2,1 % vs 0,6 %), svimmelhet (5,7 % vs 2,9 %). , og øvre luftveisinfeksjon (6,1 % mot 4,6 %).
Følgende tilleggsbivirkninger er rapportert i kliniske studier med HYZAAR og/eller de enkelte komponentene:
Blod og lymfesystemet lidelser: Anemi, aplastisk anemi, hemolytisk anemi, leukopeni, agranulocytose.
Metabolisme og ernæringsforstyrrelser: Anoreksi, hyperglykemi, hyperurikemi, elektrolyttubalanse inkludert hyponatremi og hypokalemi.
Psykiatriske lidelser: Søvnløshet, rastløshet.
Forstyrrelser i nervesystemet: Dysgeusi, hodepine, migrene, parestesier.
Øyelidelser: Xanthopsia, forbigående tåkesyn.
Hjertesykdommer: Hjertebank, takykardi.
Vaskulære lidelser: Doserelaterte ortostatiske effekter, nekrotiserende angiitt (vaskulitt, kutan vaskulitt).
Sykdommer i luftveiene, thorax og mediastinum: Nesetetthet.
Gastrointestinale lidelser: Dyspepsi, magesmerter, mageirritasjon, kramper, kvalme, oppkast, pankreatitt, sialoadenitt.
Lever- og gallesykdommer: Gulsott (intrahepatisk kolestatisk gulsott).
Hud- og subkutane vevssykdommer: Utslett, kløe, purpura, giftig epidermal nekrolyse, urticaria, lysfølsomhet, kutan lupus erythematosus.
Muskel- og bindevevslidelser: Muskelkramper, muskelspasmer.
Nyre- og urinveislidelser: Glykosuri, nedsatt nyrefunksjon, interstitiell nefritt, nyresvikt.
Reproduksjonssystem og brystsykdommer: Erektil dysfunksjon/impotens.
Generelle lidelser og tilstander på administrasjonsstedet: Brystsmerter, ubehag, svakhet.
Undersøkelser: Unormale leverfunksjoner.
Hoste
Vedvarende tørrhoste har vært assosiert med bruk av ACE-hemmere og kan i praksis være en årsak til seponering av ACE-hemmerbehandling. To prospektive, parallellgruppe, dobbeltblinde, randomiserte, kontrollerte studier ble utført for å vurdere effekten av losartan på forekomsten av hoste hos hypertensive pasienter som hadde opplevd hoste mens de fikk ACE-hemmerbehandling. Pasienter som hadde typisk ACE-hemmer hoste da de ble utfordret med lisinopril, hvis hoste forsvant på placebo, ble randomisert til losartan 50 mg, lisinopril 20 mg, eller enten placebo (en studie, n=97) eller 25 mg hydroklortiazid (n=135). Den dobbeltblindede behandlingsperioden varte i opptil 8 uker. Forekomsten av hoste er vist i tabell 1 nedenfor.
Disse studiene viser at forekomsten av hoste assosiert med losartanbehandling, i en populasjon som alle hadde hoste assosiert med ACE-hemmerbehandling, er lik den som er forbundet med hydroklortiazid- eller placebobehandling.
Tilfeller av hoste, inkludert positive re-utfordringer, er rapportert etter bruk av losartan etter markedsføring.
Postmarketing-erfaring
Følgende bivirkninger er identifisert under bruk av HYZAAR etter godkjenning. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å estimere frekvensen pålitelig eller å etablere en årsakssammenheng med legemiddeleksponering.
Fordøyelsessystemet: Hepatitt er sjelden rapportert hos pasienter behandlet med losartan.
Hematologisk: Trombocytopeni.
Overfølsomhet: Angioødem, inkludert hevelse i strupehodet og glottis, som forårsaker luftveisobstruksjon og/eller hevelse i ansikt, lepper, svelg og/eller tunge er rapportert i sjeldne tilfeller hos pasienter behandlet med losartan; noen av disse pasientene har tidligere opplevd angioødem med andre legemidler inkludert ACE-hemmere. Vaskulitt, inkludert Henoch-Schönlein purpura, er rapportert med losartan. Anafylaktiske reaksjoner er rapportert.
Muskuloskeletal: Rabdomyolyse.
Hud: Erytrodermi.
Ikke-melanom hudkreft: Hydroklortiazid er assosiert med økt risiko for ikke-melanom hudkreft. I en studie utført i Sentinel System var økt risiko hovedsakelig for plateepitelkarsinom (SCC) og hos hvite pasienter som tok store kumulative doser. Den økte risikoen for SCC i den totale befolkningen var omtrent 1 ekstra tilfelle per 16 000 pasienter per år, og for hvite pasienter som tok en kumulativ dose på ≥ 50 000 mg var risikoøkningen omtrent 1 ekstra SCC-tilfelle for hver 6 700 pasienter per år.
NARKOTIKAHANDEL
Midler som øker serumkalium
Samtidig administrering av losartan med andre legemidler som øker serumkaliumnivået kan føre til hyperkalemi. Overvåk serumkalium hos slike pasienter.
Litium
Økning i serumlitiumkonsentrasjoner og litiumtoksisitet er rapportert ved samtidig bruk av angiotensin II-reseptorantagonister eller tiaziddiuretika. Overvåk litiumnivåer hos pasienter som får HYZAAR 12,5 mg og litium.
Ikke-steroide antiinflammatoriske midler, inkludert selektive cyklooksygenase-2-hemmere
Losartan kalium
Hos eldre pasienter, volummangel (inkludert de som får diuretikabehandling), eller med nedsatt nyrefunksjon, kan samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med angiotensin II-reseptorantagonister (inkludert losartan) føre til forverring av nyrefunksjon, inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får losartan- og NSAID-behandling.
Den antihypertensive effekten av angiotensin II-reseptorantagonister, inkludert losartan, kan svekkes av NSAIDs, inkludert selektive COX-2-hemmere.
Hydroklortiazid
Administrering av et ikke-steroid antiinflammatorisk middel inkludert en selektiv COX-2-hemmer kan redusere de vanndrivende, natriuretiske og antihypertensive effektene av loop, kaliumsparende og tiaziddiuretika. Derfor, når HYZAAR og ikke-steroide antiinflammatoriske midler inkludert selektive COX-2-hemmere brukes samtidig, observer nøye for å avgjøre om den ønskede effekten av diuretikaet oppnås.
Hos pasienter som får diuretikabehandling, kan samtidig administrering av NSAIDs med angiotensinreseptorblokkere, inkludert losartan, føre til forverring av nyrefunksjonen, inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får hydroklortiazid-, losartan- og NSAID-behandling.
Dobbel blokade av Renin-Angiotensin-systemet (RAS)
Dobbel blokkering av RAS med angiotensinreseptorblokkere, ACE-hemmere eller aliskiren er assosiert med økt risiko for hypotensjon, synkope, hyperkalemi og endringer i nyrefunksjon (inkludert akutt nyresvikt) sammenlignet med monoterapi.
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D)-studien inkluderte 1448 pasienter med type 2-diabetes, forhøyet urin-albumin-til-kreatinin-forhold og redusert estimert glomerulær filtrasjonshastighet (GFR 30 til 89,9 mL/min), randomiserte dem til lisinopril eller placebo på bakgrunn av losartanbehandling og fulgte dem i median på 2,2 år. Pasienter som fikk kombinasjonen losartan og lisinopril oppnådde ingen ytterligere fordel sammenlignet med monoterapi for det kombinerte endepunktet med reduksjon i GFR, nyresykdom i sluttstadiet eller død, men opplevde en økt forekomst av hyperkalemi og akutt nyreskade sammenlignet med monoterapien. gruppe.
Overvåk blodtrykk, nyrefunksjon og elektrolytter nøye hos pasienter på HYZAAR 12,5 mg og andre midler som påvirker RAS.
Ikke administrer aliskiren samtidig med HYZAAR 12,5 mg hos pasienter med diabetes. Unngå bruk av aliskiren med HYZAAR 12,5 mg hos pasienter med nedsatt nyrefunksjon (GFR
Bruken av hydroklortiazid med andre legemidler
Når de administreres samtidig, kan følgende legemidler interagere med tiaziddiuretika [se KLINISK FARMAKOLOGI ]:
Antidiabetika (orale midler og insulin) - dosejustering av det antidiabetiske legemidlet kan være nødvendig.
Kolestyramin- og kolestipolharpikser - Absorpsjonen av hydroklortiazid er svekket i nærvær av anionbytterharpikser. Enkeltdoser av enten kolestyramin- eller kolestipolharpikser binder hydroklortiazidet og reduserer dets absorpsjon fra mage-tarmkanalen med henholdsvis opptil 85 og 43 prosent.
Fordel doseringen av hydroklortiazid og harpiksen slik at hydroklortiazid administreres minst 4 timer før eller 4 til 6 timer etter administrering av harpiksen.
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Fostertoksisitet
Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer HYZAAR 12,5 mg så snart som mulig.
Tiazider krysser placentabarrieren og vises i navlestrengsblod. Bivirkninger inkluderer føtal eller neonatal gulsott, trombocytopeni [se Bruk i spesifikke populasjoner ].
Hypotensjon hos pasienter med volum eller saltfattige
Hos pasienter med et aktivert renin-angiotensin-system, slik som pasienter med volum- eller saltfattige (f.eks. de som behandles med høye doser diuretika), kan symptomatisk hypotensjon oppstå etter oppstart av behandling med HYZAAR. Korriger volum eller saltmangel før administrering av HYZAAR. Ikke bruk HYZAAR som initial terapi hos pasienter med intravaskulær volumdeplesjon.
Nedsatt nyrefunksjon
Endringer i nyrefunksjonen inkludert akutt nyresvikt kan være forårsaket av legemidler som hemmer reninangiotensinsystemet og av diuretika. Pasienter hvis nyrefunksjon delvis kan avhenge av aktiviteten til renin-angiotensin-systemet (f.eks. pasienter med nyrearteriestenose, kronisk nyresykdom, alvorlig kongestiv hjertesvikt eller volummangel) kan ha særlig risiko for å utvikle akutt nyresvikt på HYZAAR. Overvåk nyrefunksjonen med jevne mellomrom hos disse pasientene. Vurder å holde tilbake eller avbryte behandlingen hos pasienter som utvikler en klinisk signifikant reduksjon i nyrefunksjonen på HYZAAR [se NARKOTIKAHANDEL og Bruk i spesifikke populasjoner ].
Overfølsomhet
Overfølsomhetsreaksjoner overfor hydroklortiazid kan forekomme hos pasienter med eller uten en historie med allergi eller bronkial astma, men er mer sannsynlig hos pasienter med en slik historie.
Elektrolytt og metabolske effekter
dobbeltblinde kliniske studier med ulike doser losartankalium og hydroklortiazid, var forekomsten av hypertensive pasienter som utviklet hypokalemi (serumkalium 5,7 mEq/L) var 0,4 % mot 0 % for placebo.
HYZAAR inneholder hydroklortiazid som kan forårsake hypokalemi, hyponatremi og hypomagnesemi. Hypomagnesemi kan resultere i hypokalemi som kan være vanskelig å behandle til tross for kaliumreplesjon. HYZAAR 12,5 mg inneholder også losartan som kan forårsake hyperkalemi. Overvåk serumelektrolytter med jevne mellomrom [se NARKOTIKAHANDEL ].
Samtidig bruk av andre legemidler som kan øke serumkalium kan føre til hyperkalemi [se NARKOTIKAHANDEL ].
Hydroklortiazid kan endre glukosetoleransen og øke serumnivået av kolesterol og triglyserider.
Hyperurikemi kan forekomme eller åpen gikt kan utløses hos pasienter som får tiazidbehandling. Fordi losartan reduserer urinsyre, demper losartan i kombinasjon med hydroklortiazid den diuretika-induserte hyperurikemien.
Hydroklortiazid reduserer kalsiumutskillelsen i urinen og kan forårsake forhøyede serumkalsium. Overvåk kalsiumnivået.
Akutt nærsynthet og sekundær vinkel-lukkende glaukom
Hydroklortiazid, et sulfonamid, kan forårsake en idiosynkratisk reaksjon, som resulterer i akutt forbigående nærsynthet og akutt vinkel-lukkende glaukom. Symptomer inkluderer akutt innsettende nedsatt synsskarphet eller øyesmerter og oppstår vanligvis innen timer til uker etter medikamentstart. Ubehandlet akutt vinkel-lukkende glaukom kan føre til permanent synstap. Den primære behandlingen er å seponere hydroklortiazid så raskt som mulig. Raske medisinske eller kirurgiske behandlinger må kanskje vurderes hvis det intraokulære trykket forblir ukontrollert. Risikofaktorer for å utvikle akutt lukket vinkelglaukom kan inkludere en historie med sulfonamid- eller penicillinallergi.
Systemisk lupus erythematosus
Tiaziddiuretika er rapportert å forårsake forverring eller aktivering av systemisk lupus erythematosus.
Postsympathectomy pasienter
De antihypertensive effektene av legemidlet kan forsterkes hos pasienten etter sympatektomi.
Informasjon om pasientveiledning
Råd pasienten til å lese den FDA-godkjente pasientmerkingen ( PASIENTINFORMASJON ).
Svangerskap
Informer kvinnelige pasienter i fertil alder om konsekvensene av eksponering for HYZAAR 12,5 mg under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Be pasienter rapportere graviditeter til legen så snart som mulig [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].

Symptomatisk hypotensjon
Gi pasienter beskjed om at svimmelhet kan oppstå, spesielt i løpet av de første dagene av behandlingen, og rapporter dette symptomet til en helsepersonell. Informer pasienter om at dehydrering fra utilstrekkelig væskeinntak, overdreven svette, oppkast eller diaré kan føre til et for høyt blodtrykksfall. Hvis synkope oppstår, råd pasientene til å kontakte helsepersonell [se ADVARSLER OG FORHOLDSREGLER ].
Kaliumtilskudd
Råd pasienter om å ikke bruke kaliumtilskudd eller salterstatninger som inneholder kalium uten å konsultere helsepersonell [se NARKOTIKAHANDEL ].
Akutt nærsynthet og sekundær vinkel-lukkende glaukom
Råd pasientene til å seponere HYZAAR 12,5 mg og søke øyeblikkelig legehjelp hvis de opplever symptomer på akutt nærsynthet eller sekundær vinkelglaukom [se ADVARSLER OG FORHOLDSREGLER ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Losartan kalium-hydroklortiazid
Ingen karsinogenitetsstudier er utført med losartan-kalium-hydroklortiazid-kombinasjonen.
Losartan-kalium-hydroklortiazid var, når det ble testet i et vektforhold på 4:1, negativt i Ames mikrobiell mutageneseanalyse og V-79 kinesisk hamster lungecellemutageneseanalyse. I tillegg var det ingen bevis for direkte genotoksisitet i in vitro alkalisk elueringsanalyse i rottehepatocytter og in vitro kromosomavviksanalyse i kinesisk hamster-ovarieceller ved ikke-cytotoksiske konsentrasjoner.
Losartankalium, administrert samtidig med hydroklortiazid, hadde ingen effekt på fertiliteten eller parringsatferden til hannrotter ved doser opp til 135 mg/kg/dag av losartan og 33,75 mg/kg/dag av hydroklortiazid. Disse dosene har vist seg å gi respektive systemisk eksponering (AUC) for losartan, dets aktive metabolitt og hydroklortiazid som er omtrent 60, 60 og 30 ganger høyere enn de som oppnås hos mennesker med 100 mg losartankalium i kombinasjon med 25 mg hydroklortiazid. Hos hunnrotter var imidlertid samtidig administrering av doser så lave som 10 mg/kg/dag losartan og 2,5 mg/kg/dag hydroklortiazid assosiert med en liten, men statistisk signifikant reduksjon i fruktbarhets- og fertilitetsindekser. AUC-verdier for losartan, dets aktive metabolitt og hydroklortiazid, ekstrapolert fra data oppnådd med losartan administrert til rotter i en dose på 50 mg/kg/dag i kombinasjon med 12,5 mg/kg/dag hydroklortiazid, var omtrent 6, 2 og 2 ganger større enn de som oppnås hos mennesker med 100 mg losartan i kombinasjon med 25 mg hydroklortiazid.
Losartan kalium
Losartankalium var ikke karsinogent når det ble administrert i maksimalt tolererte doser til rotter og mus i henholdsvis 105 og 92 uker. Hunnrotter som fikk den høyeste dosen (270 mg/kg/dag) hadde en litt høyere forekomst av pankreas acinar adenom. De maksimalt tolererte dosene (270 mg/kg/dag hos rotter, 200 mg/kg/dag hos mus) ga systemisk eksponering for losartan og dets farmakologisk aktive metabolitt som var omtrent 160 og 90 ganger (rotter) og 30 og 15 ganger (mus) ) eksponeringen av et menneske på 50 kg gitt 100 mg per dag.
Losartankalium var negativt i mikrobiell mutagenese og V-79 pattedyrcellemutageneseanalyse og i in vitro alkalisk eluering og in vitro og in vivo kromosomavviksanalyser. I tillegg viste den aktive metabolitten ingen tegn på genotoksisitet i mikrobiell mutagenese, in vitro alkalisk eluering og in vitro kromosomavviksanalyser.
Fertilitet og reproduksjonsevne ble ikke påvirket i studier med hannrotter som fikk orale doser av losartankalium opp til ca. 150 mg/kg/dag. Administrering av toksiske dosenivåer hos kvinner (300/200 mg/kg/dag) var assosiert med en signifikant (p
Hydroklortiazid
To-årige fôringsstudier på mus og rotter utført i regi av National Toxicology Program (NTP) avdekket ingen bevis på et kreftfremkallende potensial for hydroklortiazid hos hunnmus (ved doser på opptil ca. 600 mg/kg/dag) eller hos hanner. og hunnrotter (ved doser på opptil ca. 100 mg/kg/dag). NTP fant imidlertid tvetydige bevis for hepatokarsinogenitet hos hannmus.
Hydroklortiazid var ikke genotoksisk in vitro i Ames-mutagenisitetsanalysen av Salmonella typhimurium-stammer TA 98, TA 100, TA 1535, TA 1537 og TA 1538 og i Chinese Hamster Ovary (CHO)-testen for kromosomavvik ved bruk av vibrasjoner, eller musekimcellekromosomer, benmargskromosomer fra kinesisk hamster og det kjønnsbundne recessive dødelige trekkgenet Drosophila. Positive testresultater ble kun oppnådd i in vitro CHO Sister Chromatid Exchange (klastogenesitet) og i muselymfomcelle (mutagenisitet) assayene, ved bruk av konsentrasjoner av hydroklortiazid fra 43 til 1300 mcg/ml, og i Aspergillus nidulans non-disjunction assay kl. en uspesifisert konsentrasjon.
Hydroklortiazid hadde ingen bivirkninger på fertiliteten til mus og rotter av begge kjønn i studier der disse artene ble eksponert, via kostholdet, for doser på henholdsvis opptil 100 og 4 mg/kg før paring og gjennom hele svangerskapet.
Bruk i spesifikke populasjoner
Svangerskap
Graviditetskategori D
Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer losartan så snart som mulig. Disse uønskede utfallene er vanligvis forbundet med bruk av disse stoffene i andre og tredje trimester av svangerskapet. De fleste epidemiologiske studier som undersøker føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester har ikke skilt medisiner som påvirker renin-angiotensin-systemet fra andre antihypertensiva. Riktig behandling av mors hypertensjon under graviditet er viktig for å optimalisere resultatene for både mor og foster.
det uvanlige tilfellet at det ikke er noe passende alternativ til behandling med legemidler som påvirker reninangiotensinsystemet for en bestemt pasient, informere moren om den potensielle risikoen for fosteret. Utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Hvis oligohydramnios observeres, seponer HYZAAR, med mindre det anses som livreddende for moren. Fostertesting kan være aktuelt, basert på graviditetsuken. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade. Følg nøye med spedbarn med historier om in utero eksponering for HYZAAR 12,5 mg for hypotensjon, oliguri og hyperkalemi [se Pediatrisk bruk ].
Det var ingen tegn på teratogenisitet hos rotter eller kaniner behandlet med en maksimal losartankaliumdose på 10 mg/kg/dag i kombinasjon med 2,5 mg/kg/dag hydroklortiazid. Ved disse dosene var de respektive eksponeringene (AUC) av losartan, dets aktive metabolitt og hydroklortiazid hos kaniner omtrent 5, 1,5 og 1,0 ganger de som ble oppnådd hos mennesker med 100 mg losartan i kombinasjon med 25 mg hydroklortiazid. AUC-verdier for losartan, dets aktive metabolitt og hydroklortiazid, ekstrapolert fra data oppnådd med losartan administrert til rotter i en dose på 50 mg/kg/dag i kombinasjon med 12,5 mg/kg/dag hydroklortiazid, var omtrent 6, 2 og 2 ganger større enn de som oppnås hos mennesker med 100 mg losartan i kombinasjon med 25 mg hydroklortiazid. Føtal toksisitet hos rotter, som påvist ved en lett økning i overtallige ribbein, ble observert når hunner ble behandlet før og gjennom svangerskapet med 10 mg/kg/dag losartan i kombinasjon med 2,5 mg/kg/dag hydroklortiazid. Som også observert i studier med losartan alene, oppsto uønskede føtale og neonatale effekter, inkludert redusert kroppsvekt, nyretoksisitet og dødelighet, når drektige rotter ble behandlet sent i svangerskapet og/eller amming med 50 mg/kg/dag losartan i kombinasjon med 12,5 mg/kg/dag hydroklortiazid. Respektive AUC for losartan, dets aktive metabolitt og hydroklortiazid ved disse dosene hos rotter var omtrent 35, 10 og 10 ganger høyere enn de som ble oppnådd hos mennesker ved administrering av 100 mg losartan i kombinasjon med 25 mg hydroklortiazid. Når hydroklortiazid ble administrert uten losartan til gravide mus og rotter i deres respektive perioder med større organogenese, i doser opp til henholdsvis 3000 og 1000 mg/kg/dag, var det ingen tegn på skade på fosteret.
Tiazider krysser placentabarrieren og vises i navlestrengsblod. Det er en risiko for føtal eller neonatal gulsott, trombocytopeni og muligens andre bivirkninger som har oppstått hos voksne.
Ammende mødre
Det er ikke kjent om losartan skilles ut i morsmelk, men signifikante nivåer av losartan og dets aktive metabolitt ble vist å være tilstede i rottemelk. Tiazider vises i morsmelk. På grunn av potensialet for uønskede effekter på det ammende spedbarnet, bør det tas en beslutning om å avbryte ammingen eller avbryte medikamentet, tatt i betraktning stoffets betydning for moren.
Pediatrisk bruk
Sikkerhet og effektivitet av HYZAAR hos pediatriske pasienter er ikke fastslått.
Nyfødte med en historie med eksponering for HYZAAR i livmoren
Hvis oliguri eller hypotensjon oppstår, må du rette oppmerksomheten mot støtte av blodtrykk og nyreperfusjon. Utvekslingstransfusjon eller dialyse kan være nødvendig for å reversere hypotensjon og/eller erstatte forstyrret nyrefunksjon.
Geriatrisk bruk
en kontrollert klinisk studie for reduksjon i den kombinerte risikoen for kardiovaskulær død, hjerneslag og hjerteinfarkt hos hypertensive pasienter med venstre ventrikkelhypertrofi, var 2857 pasienter (62%) 65 år og over, mens 808 pasienter (18%) var 75 år. og over. I et forsøk på å kontrollere blodtrykket i denne studien, ble pasientene administrert losartan og hydroklortiazid samtidig 74 % av den totale tiden de brukte studiemedisinen. Ingen generelle forskjeller i effektivitet ble observert mellom disse pasientene og yngre pasienter. Bivirkninger var noe hyppigere hos eldre sammenlignet med ikke-eldre pasienter for både losartan-hydroklortiazid- og kontrollgruppene [se KLINISK FARMAKOLOGI ].
Løp
Losartan Intervention For Endpoint Reduction in Hypertension (LIFE)-studien hadde svarte pasienter med hypertensjon og venstre ventrikkelhypertrofi behandlet med atenolol lavere risiko for hjerneslag, det primære sammensatte endepunktet, sammenlignet med svarte pasienter behandlet med losartan (begge behandlet samtidig med hydroklortiazid hos de fleste pasienter). I undergruppen av svarte pasienter (n=533, 6 % av pasientene i LIFE-studien), var det 29 primære endepunkter blant 263 pasienter på atenolol (11 %, 26 per 1000 pasientår) og 46 primære endepunkter blant 270 pasienter (17). %, 42 per 1000 pasientår) på losartan. Dette funnet kunne ikke forklares på grunnlag av forskjeller i populasjonene utenom rase eller på eventuelle ubalanser mellom behandlingsgruppene. I tillegg var blodtrykksreduksjoner i begge behandlingsgruppene konsistente mellom svarte og ikke-svarte pasienter. Gitt vanskeligheten med å tolke undergruppeforskjeller i store forsøk, kan det ikke vites om den observerte forskjellen er et resultat av tilfeldigheter. LIFE-studien gir imidlertid ingen bevis for at fordelene med losartan for å redusere risikoen for kardiovaskulære hendelser hos hypertensive pasienter med venstre ventrikkelhypertrofi gjelder for svarte pasienter [se KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Oppstart av HYZAAR 12,5 mg anbefales ikke for pasienter med nedsatt leverfunksjon fordi passende startdose av losartan, 25 mg, ikke er tilgjengelig.
Nedsatt nyrefunksjon
Endringer i nyrefunksjonen er rapportert hos følsomme personer [se DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER , og KLINISK FARMAKOLOGI ]. Sikkerhet og effektivitet av HYZAAR hos pasienter med alvorlig nedsatt nyrefunksjon (kreatininclearance
OVERDOSE
Losartan kalium
Signifikant dødelighet ble observert hos mus og rotter etter oral administrering av henholdsvis 1000 mg/kg og 2000 mg/kg, omtrent 44 og 170 ganger den maksimale anbefalte humane dosen på mg/m-basis.
Begrensede data er tilgjengelige med hensyn til overdosering hos mennesker. Den mest sannsynlige manifestasjonen av overdosering vil være hypotensjon og takykardi; bradykardi kan oppstå fra parasympatisk (vagal) stimulering. Hvis symptomatisk hypotensjon skulle oppstå, bør støttende behandling settes i gang.
Verken losartan eller dens aktive metabolitt kan fjernes ved hemodialyse.
Hydroklortiazid
Den orale LD av hydroklortiazid er større enn 10 g/kg hos både mus og rotter. De vanligste tegnene og symptomene som er observert er de forårsaket av elektrolyttmangel (hypokalemi, hypokloremi, hyponatremi) og dehydrering som følge av overdreven diurese. Hvis digitalis også har blitt administrert, kan hypokalemi fremheve hjertearytmier. I hvilken grad hydroklortiazid fjernes ved hemodialyse er ikke fastslått.
KONTRAINDIKASJONER
HYZAAR 12,5 mg er kontraindisert:
- . Hos pasienter som er overfølsomme overfor noen komponent i dette produktet. . Hos pasienter med anuri . For samtidig administrering med aliskiren hos pasienter med diabetes
KLINISK FARMAKOLOGI
Virkningsmekanismen
Losartan kalium
Angiotensin II [dannet fra angiotensin I i en reaksjon katalysert av angiotensinkonverterende enzym (ACE, kininase II)], er en potent vasokonstriktor, det primære vasoaktive hormonet i renin-angiotensinsystemet og en viktig komponent i patofysiologien til hypertensjon. Det stimulerer også aldosteronsekresjon av binyrebarken. Losartan og dets viktigste aktive metabolitt blokkerer de vasokonstriktor- og aldosteron-utskillende effektene av angiotensin II ved selektivt å blokkere bindingen av angiotensin II til AT1-reseptoren som finnes i mange vev (f.eks. vaskulær glatt muskulatur, binyrene). Det er også en AT2-reseptor funnet i mange vev, men det er ikke kjent å være assosiert med kardiovaskulær homeostase. Verken losartan eller dens viktigste aktive metabolitt viser noen delvis agonistaktivitet ved AT1-reseptoren, og begge har mye større affinitet (omtrent 1000 ganger) for AT1-reseptoren enn for AT2-reseptoren. In vitro bindingsstudier indikerer at losartan er en reversibel, konkurrerende hemmer av AT1-reseptoren. Den aktive metabolitten er 10 til 40 ganger sterkere i vekt enn losartan og ser ut til å være en reversibel, ikke-konkurrerende hemmer av AT1-reseptoren.
Verken losartan eller dets aktive metabolitt hemmer ACE (kininase II, enzymet som omdanner angiotensin I til angiotensin II og bryter ned bradykinin), og de binder heller ikke til eller blokkerer andre hormonreseptorer eller ionekanaler som er kjent for å være viktige i kardiovaskulær regulering.
Hydroklortiazid
Hydroklortiazid er et tiaziddiuretikum. Tiazider påvirker de renale tubulære mekanismene for elektrolyttreabsorpsjon, og øker direkte utskillelsen av natrium og klorid i omtrent tilsvarende mengder. Indirekte reduserer den diuretiske virkningen av hydroklortiazid plasmavolum, med påfølgende økning i plasmareninaktivitet, økning i aldosteronsekresjon, økning i urintap av kalium og reduksjon i serumkalium. Renin-aldosteron-koblingen er mediert av angiotensin II, så samtidig administrering av en angiotensin II-reseptorantagonist har en tendens til å reversere kaliumtapet forbundet med disse diuretika. Mekanismen for den antihypertensive effekten av tiazider er ukjent.
Farmakodynamikk
Losartan kalium
Losartan hemmer pressoreffekten av angiotensin II (så vel som angiotensin I) infusjoner. En dose på 100 mg hemmer pressoreffekten med ca. 85 % ved topp, med 25-40 % inhibering vedvarer i 24 timer. Fjerning av den negative tilbakemeldingen til angiotensin II forårsaker en dobling til tredobling i plasmareninaktivitet og påfølgende økning i angiotensin II plasmakonsentrasjon hos hypertensive pasienter. Losartan påvirker ikke responsen på bradykinin, mens ACE-hemmere øker responsen på bradykinin. Plasmakonsentrasjonen av aldosteron faller etter administrering av losartan. Til tross for effekten av losartan på aldosteronsekresjonen, ble det observert svært liten effekt på serumkalium.
Effekten av losartan er hovedsakelig tilstede i løpet av en uke, men i noen studier kom den maksimale effekten etter 3-6 uker. I langtidsoppfølgingsstudier (med outplacebokontroll) så det ut til at effekten av losartan var opprettholdt i opptil ett år. Det er ingen tilsynelatende rebound-effekt etter brå seponering av losartan. Det var i hovedsak ingen endring i gjennomsnittlig hjertefrekvens hos losartan-behandlede pasienter i kontrollerte studier.
Hydroklortiazid
Etter oral administrering av hydroklortiazid begynner diuresen innen 2 timer, topper etter ca. 4 timer og varer ca. 6 til 12 timer.
Narkotikahandel
Hydroklortiazid
Alkohol, barbiturater eller narkotika - potensering av ortostatisk hypotensjon kan forekomme.
Andre antihypertensiva - additiv effekt eller potensering.
Skjelettmuskelavslappende midler, ikke-depolariserende (f.eks. tubokurarin) - mulig økt respons på muskelavslappende midler.
Kortikosteroider, ACTH eller glycyrrhizin (finnes i lakris) - intensivert elektrolyttmangel, spesielt hypokalemi.
Pressoraminer (f.eks. noradrenalin) - mulig redusert respons på pressoraminer, men ikke tilstrekkelig til å utelukke bruken av dem.
Farmakokinetikk
Losartan kalium
Absorpsjon
Etter oral administrering absorberes losartan godt og gjennomgår betydelig first-pass metabolisme. Den systemiske biotilgjengeligheten av losartan er omtrent 33 %. Gjennomsnittlig maksimal konsentrasjon av losartan og dets aktive metabolitt nås i løpet av henholdsvis 1 time og 3-4 timer. Mens maksimale plasmakonsentrasjoner av losartan og dets aktive metabolitt er omtrent like, er AUC (arealet under kurven) for metabolitten omtrent 4 ganger så stor som for losartan. Et måltid bremser absorpsjonen av losartan og reduserer Cmax max, men har kun små effekter på losartan AUC eller på AUC av metabolitten (~10 % reduksjon). Farmakokinetikken til losartan og dets aktive metabolitt er lineær med orale losartandoser på opptil 200 mg og endres ikke over tid.
Fordeling
Distribusjonsvolumet av losartan og den aktive metabolitten er henholdsvis ca. 34 liter og 12 liter. Både losartan og dets aktive metabolitt er sterkt bundet til plasmaproteiner, primært albumin, med plasmafrie fraksjoner på henholdsvis 1,3 % og 0,2 %. Plasmaproteinbinding er konstant over konsentrasjonsområdet som oppnås med anbefalte doser. Studier på rotter indikerer at losartan krysser blod-hjerne-barrieren dårlig, om i det hele tatt.
Metabolisme
Losartan er et oralt aktivt middel som gjennomgår betydelig first-pass metabolisme av cytokrom P450-enzymer. Det omdannes delvis til en aktiv karboksylsyremetabolitt som er ansvarlig for det meste av angiotensin II-reseptorantagonismen som følger etter losartanbehandling. Omtrent 14 % av en oral administrert dose losartan omdannes til den aktive metabolitten. I tillegg til den aktive karboksylsyremetabolitten dannes det flere inaktive metabolitter. In vitro-studier indikerer at cytokrom P450 2C9 og 3A4 er involvert i biotransformasjonen av losartan til metabolittene.
Eliminering
Total plasmaclearance av losartan og den aktive metabolitten er henholdsvis ca. 600 ml/min og 50 ml/min, med nyreclearance på henholdsvis ca. 75 ml/min og 25 ml/min. Den terminale halveringstiden for losartan er ca. 2 timer og metabolitten er ca. 6-9 timer. Etter enkeltdoser losartan administrert oralt, utskilles ca. 4 % av dosen uendret i urinen og ca. 6 % utskilles i urinen som aktiv metabolitt. Biliær utskillelse bidrar til eliminering av losartan og dets metabolitter. Etter oral 14C-merket losartan, gjenfinnes ca. 35 % av radioaktiviteten i urinen og ca. 60 % i avføringen. Etter en intravenøs dose av 14C-merket losartan, gjenfinnes ca. 45 % av radioaktiviteten i urinen og 50 % i avføringen. Verken losartan eller metabolitten akkumuleres i plasma ved gjentatt dosering én gang daglig.
Hydroklortiazid
Hydroklortiazid metaboliseres ikke, men elimineres raskt av nyrene. Når plasmanivåene er fulgt i minst 24 timer, har plasmahalveringstiden blitt observert å variere mellom 5,6 og 14,8 timer. Minst 61 prosent av den orale dosen elimineres uendret innen 24 timer. Hydroklortiazid krysser placenta, men ikke blod-hjerne-barrieren og skilles ut i morsmelk.
Spesifikke populasjoner
Geriatrisk og kjønn
Losartans farmakokinetikk er undersøkt hos eldre (65-75 år) og hos begge kjønn. Plasmakonsentrasjoner av losartan og dets aktive metabolitt er like hos eldre og unge hypertensive. Plasmakonsentrasjoner av losartan var omtrent dobbelt så høye hos kvinnelige hypertensive pasienter som hos mannlige hypertensive, men konsentrasjonene av den aktive metabolitten var like hos menn og kvinner.
Løp
Farmakokinetiske forskjeller på grunn av rase er ikke studert [se også Bruk i spesifikke populasjoner ].
Leverinsuffisiens
Etter oral administrering hos pasienter med mild til moderat alkoholisk levercirrhose, var plasmakonsentrasjonen av losartan og dets aktive metabolitt henholdsvis 5 ganger og omtrent 1,7 ganger høyere enn hos unge mannlige frivillige. Sammenlignet med normale forsøkspersoner var den totale plasmaclearance av losartan hos pasienter med leverinsuffisiens omtrent 50 % lavere, og den orale biotilgjengeligheten var omtrent doblet. Den lavere startdosen av losartan som anbefales til pasienter med nedsatt leverfunksjon kan ikke gis ved bruk av HYZAAR. Bruk hos slike pasienter som et middel for losartan-titrering er derfor ikke anbefalt [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Nyreinsuffisiens
Losartan
Etter oral administrering økes plasmakonsentrasjoner og AUC for losartan og dets aktive metabolitt med 50-90 % hos pasienter med mild (kreatininclearance på 50 til 74 ml/min) eller moderat (kreatininclearance 30 til 49 ml/min) nyresvikt. I denne studien ble renal clearance redusert med 55-85 % for bådelosartan og dets aktive metabolitt hos pasienter med mild eller moderat nyreinsuffisiens. Verken losartan eller dens aktive metabolitt kan fjernes ved hemodialyse.
Hydroklortiazid
Etter oral administrering økes AUC for hydroklortiazid med 70 og 700 % for pasienter med henholdsvis mild og moderat nyresvikt. I denne studien ble renal clearance av hydroklortiazid redusert med 45 og 85 % hos pasienter med henholdsvis mild og moderat nedsatt nyrefunksjon.
Bruk de vanlige behandlingsregimene med HYZAAR så lenge pasientens kreatininclearance er større enn 30 ml/min. Sikkerhet og effektivitet av HYZAAR 12,5 mg inneliggende pasienter med alvorlig nedsatt nyrefunksjon (kreatininclearance mindre enn 30 ml/min) er ikke fastslått [se Bruk i spesifikke populasjoner ].
Narkotikahandel
Losartan kalium
Ingen klinisk signifikante legemiddelinteraksjoner er funnet i studier av losartankalium med hydroklortiazid, digoksin, warfarin, cimetidin og fenobarbital. Imidlertid har rifampin vist seg å redusere AUC for losartan og dets aktive metabolitt med henholdsvis 30 % og 40 %. Flukonazol, en hemmer av cytokromP450 2C9, reduserte AUC for den aktive metabolitten med ca. 40 %, men økte AUC for losartan med ca. 70 % etter gjentatte doser. Omdannelse av losartan til den aktive metabolitten etter intravenøs administrering påvirkes ikke av ketokonazol, en hemmer av P450 3A4. AUC for aktiv metabolitt etter oral losartan ble ikke påvirket av erytromycin, en hemmer av P450 3A4, men AUC for losartan ble økt med 30 %.
De farmakodynamiske konsekvensene av samtidig bruk av losartan og hemmere av P450 2C9 er ikke undersøkt. Personer som ikke metaboliserer losartan til aktiv metabolitt har vist seg å ha en spesifikk, sjelden defekt i cytokrom P450 2C9. Disse dataene tyder på at omdannelsen av losartan til dets aktive metabolitt primært medieres av P450 2C9 og ikke P450 3A4.
Kliniske studier
Losartan monoterapi
Reduksjon i risikoen for hjerneslag
LIFE-studien var en multinasjonal, dobbeltblind studie som sammenlignet losartan og atenolol hos 9193 hypertensive pasienter med EKG-dokumentert venstre ventrikkelhypertrofi. Pasienter med hjerteinfarkt eller hjerneslag innen seks måneder før randomisering ble ekskludert. Pasientene ble randomisert til å få losartan en gang daglig 50 mg eller atenolol 50 mg. Hvis målblodtrykk (
forsøk på å kontrollere blodtrykket ble pasientene i begge armene av LIFE-studien administrert samtidig hydroklortiazid mesteparten av tiden de var på studiemedikamentet (henholdsvis 73,9 % og 72,4 % av dagene i losartan- og atenolol-armene).
Av de randomiserte pasientene var 4963 (54 %) kvinner og 533 (6 %) svarte. Gjennomsnittsalderen var 67 med 5704 (62%) alder ≥65. Ved baseline hadde 1195 (13%) diabetes, 1326 (14%) hadde isolert systolisk hypertensjon, 1469 (16%) hadde koronar hjertesykdom, og 728 (8%) hadde cerebrovaskulær sykdom. Baseline gjennomsnittlig blodtrykk var 174/98 mmHg i begge behandlingsgruppene. Gjennomsnittlig lengde på oppfølgingen var 4,8 år. Ved slutten av studien eller ved siste besøk før et primært endepunkt, tok 77 % av gruppen behandlet med losartan og 73 % av gruppen behandlet med atenolol fortsatt studiemedisin. Av pasientene som fortsatt tok studiemedisiner, var gjennomsnittsdosene av losartan og atenolol begge ca. 80 mg/dag, og 15 % tok atenolol eller losartan som monoterapi, mens 77 % også fikk hydroklortiazid (ved gjennomsnittlig dose på 20 mg/dag i hver gruppe). Blodtrykksreduksjonen målt ved bunnen var lik for begge behandlingsgruppene, men blodtrykket ble ikke målt på noe annet tidspunkt på dagen. Ved slutten av studien eller ved siste besøk før et primært endepunkt var gjennomsnittlig blodtrykk 144,1/81,3 mmHg for gruppen behandlet med losartan og 145,4/80,9 mmHg for gruppen behandlet med atenolol [forskjellen i SBP på 1,3 mmHg var signifikant (p
Det primære endepunktet var den første forekomsten av kardiovaskulær død, ikke-dødelig hjerneslag eller ikke-dødelig hjerteinfarkt. Pasienter med ikke-dødelige hendelser forble i forsøket, slik at det også var en undersøkelse av den første hendelsen av hver type selv om det ikke var den første hendelsen (f.eks. et slag etter et innledende hjerteinfarkt vil bli regnet med i analysen av hjerneslag) . Behandling med losartan resulterte i en 13 % reduksjon (p=0,021) i risikoen for det primære endepunktet sammenlignet med atenololgruppen; denne forskjellen var først og fremst et resultat av en effekt på dødelig og ikke-dødelig hjerneslag. Behandling med losartan reduserte risikoen for hjerneslag med 25 % i forhold til atenolol (p=0,001).
Losartan kalium-hydroklortiazid
De 3 kontrollerte studiene av losartan og hydroklortiazid inkluderte over 1300 pasienter som vurderte den antihypertensive effekten av ulike doser losartan (25, 50 og 100 mg) og samtidig hydroklortiazid (6,25, 12,5 og 25 mg). En faktoriell studie sammenlignet kombinasjonen av losartan/hydroklortiazid 50/12,5 mg med dets komponenter og placebo. Kombinasjonen av losartan/hydroklortiazid 50/12,5 mg resulterte i en tilnærmet additiv placebojustert systolisk/diastolisk respons (15,5/9,0 mmHg for kombinasjonen sammenlignet med 8,5/5,0 mmHg for losartan alene og 7,0/3,0 mmHg for hydroklortiazid alene). En annen studie undersøkte dose-respons-forholdet mellom ulike doser hydroklortiazid (6,25, 12,5 og 25 mg) eller placebo på bakgrunn av losartan (50 mg) hos pasienter som ikke var tilstrekkelig kontrollert (sittende diastolisk blodtrykk [SiDBP] 93-120 mmHg) på losartan (50 mg) alene. Den tredje studien undersøkte dose-respons-forholdet mellom ulike doser losartan (25, 50 og 100 mg) eller placebo på bakgrunn av hydroklortiazid (25 mg) hos pasienter som ikke var tilstrekkelig kontrollert (SiDBP93-120 mmHg) på hydroklortiazid (25 mg) alene. Disse studiene viste en ekstra antihypertensiv respons ved bunnfall (24 timer etter dosering) av hydroklortiazid 12,5 eller 25 mg tilsatt losartan 50 mg på henholdsvis 5,5/3,5 og 10,0/6,0 mmHg. På samme måte var det en økt antihypertensiv respons når losartan 50 eller 100 mg ble tilsatt til hydroklortiazid 25 mg på henholdsvis 9,0/5,5 og 12,5/6,5 mmHg. Det var ingen signifikant effekt på hjertefrekvensen.
Det var ingen forskjell i respons for menn og kvinner eller hos pasienter over eller under 65 år.
Svarte pasienter hadde en større respons på hydroklortiazid enn ikke-svarte pasienter og en mindre respons på losartan. Den generelle responsen på kombinasjonen var lik for svarte og ikke-svarte pasienter.
Alvorlig hypertensjon (SiDBP ≥110 mmHg)
Sikkerheten og effekten av HYZAAR som initial behandling for alvorlig hypertensjon (definert som en gjennomsnittlig SiDBP ≥110 mmHg bekreftet ved 2 separate anledninger av all antihypertensiv terapi) ble studert i en 6-ukers dobbeltblind, randomisert, multisenterstudie. Pasientene ble randomisert til enten losartan og hydroklortiazid (50/12,5 mg, én gang daglig) eller til losartan (50 mg, én gang daglig) og fulgt for blodtrykksrespons. Pasientene ble titrert med 2-ukers intervaller hvis SiDBP ikke nådde målet (
Studien inkluderte 585 pasienter, inkludert 264 (45 %) kvinner, 124 (21 %) svarte og 21 (4 %) ≥65 år. Gjennomsnittlig blodtrykk ved baseline for den totale populasjonen var 171/113 mmHg. Gjennomsnittsalderen var 53 år. Etter 4 ukers behandling var gjennomsnittlig SiDBP 3,1 mmHg lavere og gjennomsnittlig SiSBP var 5,6 mmHglowre i gruppen behandlet med HYZAAR. Som et resultat nådde en større andel av pasientene på HYZAAR 12,5 mg måldiastolisk blodtrykk (17,6 % for HYZAAR 12,5 mg, 9,4 % for losartan; p=0,006). Lignende trender ble sett når pasientene ble gruppert etter kjønn, rase eller alder (
Etter 6 ukers behandling nådde flere pasienter som fikk kombinasjonsregimet målet diastolisk blodtrykk enn de som fikk monoterapiregimet (29,8 % versus 12,5 %).
PASIENTINFORMASJON
HYZAAR® (HY-zar) (losartan kalium og hydroklortiazid tabletter)50/12,5 mg, 100/12,5 mg, 100/25 mg
Les pasientinformasjonen som følger med HYZAAR ® før du begynner å ta den og hver gang du får påfyll. Det kan komme ny informasjon. Dette pakningsvedlegget erstatter ikke å snakke med legen din om din tilstand og behandling.
Hva er den viktigste informasjonen jeg bør vite om HYZAAR?
- . HYZAAR kan forårsake skade eller død for et ufødt barn. . Snakk med legen din om andre måter å senke blodtrykket på hvis du planlegger å bli gravid. . Hvis du blir gravid mens du tar HYZAAR 12,5 mg, fortell legen din med en gang.
Hva er HYZAAR 12,5 mg?
HYZAAR 12,5mg inneholder 2 reseptbelagte legemidler, en angiotensinreseptorblokker (ARB) og et vanndrivende middel (vannpille). Det brukes til å:
- . lavere høyt blodtrykk (hypertensjon). HYZAAR er vanligvis ikke det første legemidlet som brukes til å behandle høyt blodtrykk. . redusere sjansen for hjerneslag hos pasienter med høyt blodtrykk og et hjerteproblem kalt venstre ventrikkelhypertrofi (LVH). HYZAAR hjelper kanskje ikke svarte pasienter med dette problemet.
HYZAAR har ikke blitt undersøkt hos barn under 18 år.
Høyt blodtrykk (hypertensjon). Blodtrykket er kraften i blodårene når hjertet slår og når hjertet hviler. Du har høyt blodtrykk når kraften er for stor. Losartan-ingrediensen i HYZAAR 12,5 mg kan hjelpe blodårene til å slappe av slik at blodtrykket blir lavere. Hydroklortiazidet i gredientin HYZAAR virker ved å få nyrene til å passere mer vann og salt.
Venstre ventrikkelhypertrofi (LVH) er en forstørrelse av veggene i venstre hjertekammer (hjertets hovedpumpekammer). LVH kan skje av flere ting. Høyt blodtrykk er den vanligste årsaken til LVH.
Hvem bør ikke ta HYZAAR?
Ikke ta HYZAAR 12,5 mg hvis du:
- . er allergisk mot noen av ingrediensene i HYZAAR. Se en fullstendig liste over ingredienser i HYZAAR på slutten av dette pakningsvedlegget. . ikke tisser. . har diabetes og tar et legemiddel kalt aliskiren for å redusere blodtrykket.
Hva bør jeg fortelle legen min før jeg tar HYZAAR?
Fortell legen din om alle dine medisinske tilstander, inkludert hvis du:
- . er gravid eller planlegger å bli gravid. Se "Hva er den viktigste informasjonen jeg bør vite om HYZAAR?" . ammer eller planlegger å amme. HYZAAR kan gå over i melken din og kan skade babyen din. Du og legen din bør bestemme om du vil ta HYZAAR eller amme. Du bør ikke gjøre begge deler. . har kastet opp (kastet opp), hatt diaré, svettet mye eller ikke drukket nok væske. Disse kan føre til at du har lavt blodtrykk. . har leverproblemer . har nyreproblemer . har systemisk lupus erythematosus (Lupus; SLE) . har diabetes . har gikt . har noen allergier . har hatt hudkreft eller hvis du utvikler en ny hudlesjon under behandlingen. Behandling med hydroklortiazid kan øke risikoen for enkelte typer hudkreft (hudkreft uten melanom). Diskuter med legen din hvordan du kan beskytte huden mot soleksponering og hvor ofte du bør gjennomgå hudkreftscreening.
Fortell legen din om alle medisinene du tar, inkludert reseptbelagte og reseptfrie medisiner, vitaminer og urtetilskudd.
HYZAAR 12,5 mg og visse andre legemidler kan interagere med hverandre. Fortell legen din spesielt hvis du tar:
- . kaliumtilskudd . salterstatninger som inneholder kalium . andre legemidler som kan øke serumkalium . vannpiller (diuretika) . litium (et legemiddel som brukes til å behandle en viss type depresjon) . legemidler som brukes til å behandle smerte og leddgikt, kalt ikke-steroide antiinflammatoriske legemidler (NSAIDs), inkludert COX-2-hemmere . andre medisiner for å redusere blodtrykket.
Kjenn til medisinene du tar. Hold en liste over medisinene dine og vis den til legen din og apoteket når du får en ny medisin.
Hvordan skal jeg ta HYZAAR 12,5 mg?
- . Ta HYZAAR 12,5 mg nøyaktig som foreskrevet av legen din. Legen din kan endre dosen om nødvendig. . HYZAAR kan tas med eller uten mat. . Hvis du glemmer en dose, ta den så snart du husker det. Hvis det er nær neste dose, ikke ta den glemte dosen. Bare ta neste dose til vanlig tid. . Hvis du tar for mye HYZAAR 12,5 mg, ring legen din eller giftkontrollsenteret, eller gå til nærmeste legevakt umiddelbart. . Legen din kan ta blodprøver fra tid til annen mens du tar HYZAAR.
Hva er de mulige bivirkningene av HYZAAR?
HYZAAR kan forårsake følgende bivirkninger som kan være alvorlige:
- . Skade eller død av ufødte babyer. Se "Hva er den viktigste informasjonen jeg bør vite om HYZAAR?" . Allergisk reaksjon. Symptomer på en allergisk reaksjon er hevelse i ansikt, lepper, svelg eller tunge. Få akutt medisinsk hjelp med en gang og slutt å ta HYZAAR. . Lavt blodtrykk (hypotensjon). Lavt blodtrykk kan føre til at du føler deg svimmel eller svimmel. Legg deg ned hvis du føler deg svak eller svimmel. Ring legen din med en gang. . Hvis du har nyreproblemer, kan du se en forverring i hvor godt nyrene dine fungerer. Ring legen din hvis du får hevelser i føttene, anklene eller hendene, eller uforklarlig vektøkning. . En ny eller forverret tilstand kalt systemisk lupus erythematosus (Lupus; SLE) . Øyeproblemer. En av medisinene i HYZAAR 12,5 mg kan forårsake øyeproblemer som, hvis de ikke behandles, kan føre til synstap. Symptomer på øyeproblemer kan oppstå innen timer til uker etter oppstart av HYZAAR. Fortell legen din umiddelbart hvis du har:
- . nedgang i synet . øyesmerter
De vanligste bivirkningene av HYZAAR 12,5 mg hos personer med høyt blodtrykk er:
- . "forkjølelse" (øvre luftveisinfeksjon) . svimmelhet . tett nese . ryggsmerte
Fortell legen din dersom du får en bivirkning som plager deg eller som ikke vil forsvinne. Dette er ikke en fullstendig liste over bivirkninger. For en fullstendig liste, spør legen din eller apoteket.
Hvordan bør jeg oppbevare HYZAAR 12,5 mg?
- . Oppbevar HYZAAR ved romtemperatur ved 59 °F til 86 °F (15 °C til 30 °C). . Oppbevar HYZAAR i en tett lukket beholder, og hold HYZAAR unna lyset. . Oppbevar HYZAAR 12,5 mg og alle legemidler utilgjengelig for barn.
Generell informasjon om HYZAAR
Medisiner er noen ganger foreskrevet for tilstander som ikke er nevnt i pasientopplysninger. Ikke bruk HYZAAR for en tilstand som det ikke er foreskrevet for. Ikke gi HYZAAR til andre mennesker, selv om de har de samme symptomene som du har. Det kan skade dem.
Dette pakningsvedlegget oppsummerer den viktigste informasjonen om HYZAAR. Hvis du vil ha mer informasjon, snakk med legen din. Du kan spørre apoteket eller legen om informasjon som er skrevet for helsepersonell.
Hva er ingrediensene i HYZAAR?
Aktive ingredienser: losartan kalium, hydroklortiazid
Inaktive ingredienser:
mikrokrystallinsk cellulose, vannholdig laktose, pregelatinisert stivelse, magnesiumstearat, hydroksypropylcellulose, hypromellose, titandioksid. HYZAAR 50/12.5 og HYZAAR 100/25 inneholder også D&C gul nr. 10 aluminiumssjø.
HYZAAR 50/12.5, HYZAAR 100/12.5 og HYZAAR 100/25 kan også inneholde karnaubavoks.
