Benicar 10mg, 20mg, 40mg Olmesartan Bruk, bivirkninger og dosering. Pris i nettapotek. Generisk medisin uten resept.
Hva er Benicar 40mg og hvordan brukes det?
Benicar er et reseptbelagt legemiddel som brukes til å behandle symptomene på høyt blodtrykk (hypertensjon). Benicar 10mg kan brukes alene eller sammen med andre medisiner.
Benicar er en angiotensin II-reseptorblokker eller ARB.
Det er ikke kjent om Benicar er trygt og effektivt hos barn under 6 år.
Hva er de mulige bivirkningene av Benicar 40mg?
Benicar kan forårsake alvorlige bivirkninger, inkludert:
- . svimmelhet . lite eller ingen vannlating . hevelse i hender eller føtter . kvalme . svakhet . prikkende følelse . brystsmerter . rask eller uregelmessig hjerterytme . tap av bevegelse
Få medisinsk hjelp med en gang hvis du har noen av symptomene nevnt ovenfor.
De vanligste bivirkningene av Benicar inkluderer:
- . svimmelhet
Fortell legen dersom du har noen bivirkninger som plager deg eller som ikke går over.
Dette er ikke alle mulige bivirkninger av Benicar. Spør legen din eller apoteket for mer informasjon.
Ring legen din for medisinsk råd om bivirkninger. Du kan rapportere bivirkninger til FDA på 1-800-FDA-1088.
ADVARSEL
FØTALT TOKSISITET
- . Når graviditet oppdages, seponer Benicar 40mg så snart som mulig [se ADVARSLER OG FORHOLDSREGLER] . Legemidler som virker direkte på renin-angiotenene i systemet kan forårsake skade og død for det utviklende fosteret [se ADVARSLER OG FORHOLDSREGLER]
BESKRIVELSE
Olmesartanmedoksomil, et prodrug, hydrolyseres til olmesartan under absorpsjon fra mage-tarmkanalen. Olmesartan er en selektiv AT1-subtype angiotensin II-reseptorantagonist.
Olmesartanmedoksomil beskrives kjemisk som 2,3-dihydroksy-2-butenyl 4-(1 hydroksy-1-metyletyl)-2-propyl-1-[p-(o-1H-tetrazol-5-ylfenyl)benzyl]imidazol- 5 karboksylat, syklisk 2,3-karbonat.
Dens empiriske formel er C29H30N6O6 og dens strukturformel er:
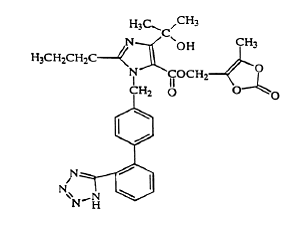
Olmesartanmedoxomil er et hvitt til lys gulhvitt pulver eller krystallinsk pulver med en molekylvekt på 558,59. Det er praktisk talt uløselig i vann og lite løselig i metanol. Benicar 20mg er tilgjengelig for oral bruk som filmdrasjerte tabletter som inneholder 5 mg, 20 mg eller 40 mg olmesartanmedoksomil og følgende inaktive ingredienser: hydroksypropylcellulose, hypromellose, laktosemonohydrat, lavsubstituert hydroksypropylcellulose, magnesiumstearat, mikrokrystallinsk cellulose , talkum, titandioksid og (kun 5 mg) gult jernoksid.
INDIKASJONER
Benicar 40mg er indisert for behandling av hypertensjon hos voksne og barn seks år og eldre, for å senke blodtrykket. Senking av blodtrykket reduserer risikoen for dødelige og ikke-dødelige kardiovaskulære hendelser, først og fremst hjerneslag og hjerteinfarkt. Disse fordelene har blitt sett i kontrollerte studier av antihypertensiva fra en lang rekke farmakologiske klasser, inkludert klassen som dette legemidlet hovedsakelig tilhører. Det er ingen kontrollerte studier som viser risikoreduksjon med Benicar.
Kontroll av høyt blodtrykk bør være en del av omfattende kardiovaskulær risikostyring, inkludert, etter behov, lipidkontroll, diabetesbehandling, antitrombotisk terapi, røykeslutt, trening og begrenset natriuminntak. Mange pasienter vil kreve mer enn ett medikament for å oppnå blodtrykksmål. For spesifikke råd om mål og ledelse, se publiserte retningslinjer, for eksempel de fra National High Blood Pressure Education Programs Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure (JNC).
Tallrike antihypertensiva, fra en rekke farmakologiske klasser og med forskjellige virkningsmekanismer, har i randomiserte kontrollerte studier vist seg å redusere kardiovaskulær sykelighet og dødelighet, og det kan konkluderes med at det er blodtrykksreduksjon, og ikke noen annen farmakologisk egenskap av stoffene, som i stor grad er ansvarlig for disse fordelene. Den største og mest konsistente fordelen for kardiovaskulær utfall har vært en reduksjon i risikoen for hjerneslag, men reduksjoner i hjerteinfarkt og kardiovaskulær dødelighet har også blitt sett regelmessig.
Forhøyet systolisk eller diastolisk trykk forårsaker økt kardiovaskulær risiko, og den absolutte risikoøkningen per mmHg er større ved høyere blodtrykk, slik at selv beskjedne reduksjoner av alvorlig hypertensjon kan gi betydelig fordel. Relativ risikoreduksjon fra blodtrykksreduksjon er lik på tvers av populasjoner med varierende absolutt risiko, så den absolutte fordelen er større hos pasienter som har høyere risiko uavhengig av deres hypertensjon (for eksempel pasienter med diabetes eller hyperlipidemi), og slike pasienter kan forventes å dra nytte av mer aggressiv behandling til et lavere blodtrykksmål.
Noen antihypertensiva har mindre blodtrykkseffekter (som monoterapi) hos svarte pasienter, og mange antihypertensiva har ytterligere godkjente indikasjoner og effekter (f.eks. på angina, hjertesvikt eller diabetisk nyresykdom). Disse betraktningene kan lede valg av terapi.
Det kan brukes alene eller i kombinasjon med andre antihypertensiva.
DOSERING OG ADMINISTRASJON
Hypertensjon hos voksne
Dosering må være individualisert. Den vanlige anbefalte startdosen av Benicar 20 mg er 20 mg én gang daglig når den brukes som monoterapi hos pasienter som ikke er volumkontrakterte. For pasienter som trenger ytterligere reduksjon i blodtrykket etter 2 ukers behandling, kan dosen av Benicar økes til 40 mg. Doser over 40 mg ser ikke ut til å ha større effekt. Dosering to ganger daglig gir ingen fordel i forhold til samme totale dose gitt én gang daglig.
For pasienter med mulig utarming av intravaskulært volum (f.eks. pasienter behandlet med diuretika, spesielt de med nedsatt nyrefunksjon), initier Benicar under nøye medisinsk tilsyn og vurder å bruke en lavere startdose [se ADVARSLER OG FORHOLDSREGLER ].
Pediatrisk hypertensjon (6 år og eldre)
Dosering må være individualisert. For barn som kan svelge tabletter, er den vanlige anbefalte startdosen av Benicar 10 mg én gang daglig for pasienter som veier 20 til
Bruk av Benicar 10mg hos barn ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
For barn som ikke kan svelge tabletter, kan samme dose gis ved bruk av en ekstemporesuspensjon som beskrevet nedenfor [se KLINISK FARMAKOLOGI ]. Følg instruksjonene for tilberedning av suspensjonen nedenfor for å administrere Benicar som en suspensjon.
Tilberedning av suspensjon (for 200 ml av en 2 mg/ml suspensjon)
Tilsett 50 mL renset vann til en ravgul polyetylentereftalat (PET) flaske som inneholder tjue Benicar 20 mg tabletter og la stå i minst 5 minutter. Rist beholderen i minst 1 minutt og la suspensjonen stå i minst 1 minutt. Gjenta 1 minutts risting og 1 minutt stående fire ganger til. Tilsett 100 mL ORA-Sweet® og 50 mL ORA-Plus®* til suspensjonen og rist godt i minst 1 minutt. Suspensjonen skal oppbevares i kjøleskap ved 2-8°C (36-46°F) og kan oppbevares i opptil 4 uker. Rist suspensjonen godt før hver bruk og returner umiddelbart til kjøleskapet.
HVORDAN LEVERES
Doseringsformer og styrker
- . 5 mg gule, runde, filmdrasjerte tabletter uten skår, merket med Sankyo på den ene siden og C12 på den andre siden . 20 mg hvite, runde, filmdrasjerte tabletter uten skår, preget med Sankyo på den ene siden og C14 på den andre siden . 40 mg hvite, ovale, filmdrasjerte tabletter uten skår, preget med Sankyo på den ene siden og C15 på den andre siden
Oppbevaring og håndtering
Benicar leveres som gule, runde, filmdrasjerte, ikke-skårede tabletter som inneholder 5 mg olmesartanmedoxomil, som hvite, runde, filmdrasjerte, ikke-skårede tabletter som inneholder 20 mg olmesartanmedoxomil, og som hvite, ovale. , filmdrasjerte tabletter uten skår som inneholder 40 mg olmesartanmedoksomil. Tablettene er preget med Sankyo på den ene siden og C12, C14 eller C15 på den andre siden av henholdsvis 5, 20 og 40 mg tabletter.
Tabletter leveres som følger:
Oppbevaring
Oppbevares ved 20-25°C (68-77°F) [se USP-kontrollert romtemperatur].
Produsert for Daiichi Sankyo, Inc., Basking Ridge, NJ 07920. Revidert: oktober 2019
BIVIRKNINGER
Erfaring fra kliniske forsøk
Fordi kliniske studier utføres under vidt forskjellige forhold, kan bivirkningsrater observert i kliniske studier av et legemiddel ikke sammenlignes direkte med rater i kliniske studier av et annet medikament og gjenspeiler kanskje ikke ratene observert i praksis.
Hypertensjon hos voksne
Benicar har blitt evaluert for sikkerhet hos mer enn 3825 pasienter/individer, inkludert mer enn 3275 pasienter behandlet for hypertensjon i kontrollerte studier. Denne erfaringen inkluderte ca. 900 pasienter behandlet i minst 6 måneder og mer enn 525 i minst 1 år. Hendelsene var generelt milde, forbigående og hadde ingen sammenheng med dosen av Benicar.
Analyse av kjønn, alder og rasegrupper viste ingen forskjeller mellom Benicar 40 mg og placebobehandlede pasienter. Andelen av seponeringer på grunn av bivirkninger i alle studier med hypertensive pasienter var 2,4 % (dvs. 79/3278) av pasientene behandlet med Benicar 40 mg og 2,7 % (dvs. 32/1179) av kontrollpasientene. I placebokontrollerte studier var den eneste bivirkningen som oppsto hos mer enn 1 % av pasientene behandlet med Benicar 20 mg og med en høyere forekomst sammenlignet med placebo svimmelhet (3 % vs. 1 %).
Ansiktsødem ble rapportert hos fem pasienter som fikk Benicar. Angioødem er rapportert med angiotensin II-antagonister.
Pediatrisk hypertensjon
Ingen relevante forskjeller ble identifisert mellom bivirkningsprofilen for pediatriske pasienter i alderen 1 til 16 år og den tidligere rapportert for voksne pasienter.
Erfaring etter markedsføring
Følgende bivirkninger er rapportert etter markedsføring. Fordi disse reaksjonene rapporteres frivillig fra en populasjon av usikker størrelse, er det ikke alltid mulig å pålitelig estimere frekvensen deres eller etablere en årsakssammenheng med legemiddeleksponering.
Kroppen som helhet: Asteni, angioødem, anafylaktiske reaksjoner
Gastrointestinale: Oppkast, sprue-lignende enteropati [se ADVARSLER OG FORHOLDSREGLER ]
Metabolske og ernæringsforstyrrelser: Hyperkalemi
Muskuloskeletal: Rabdomyolyse
Urogenital system: Akutt nyresvikt, økte kreatininnivåer i blodet
Hud og vedheng: Alopecia, pruritus, urticaria
Data fra en kontrollert studie og en epidemiologisk studie har antydet at høydose olmesartan kan øke kardiovaskulær (CV) risiko hos diabetespasienter, men de samlede dataene er ikke avgjørende. Den randomiserte, placebokontrollerte, dobbeltblinde ROADMAP studien (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial, n=4447) undersøkte bruken av olmesartan, 40 mg daglig, vs. placebo hos pasienter med type 2 diabetes mellitus, normoalbuminuri og kl. minst én ekstra risikofaktor for CV-sykdom. Studien møtte sitt primære endepunkt, forsinket begynnelse av mikroalbuminuri, men olmesartan hadde ingen gunstig effekt på reduksjon i glomerulær filtrasjonshastighet (GFR). Det var et funn av økt CV-dødelighet (bedømt plutselig hjertedød, dødelig hjerteinfarkt, fatalt hjerneslag, revaskulariseringsdød) i olmesartan-gruppen sammenlignet med placebo-gruppen (15 olmesartan vs. 3 placebo, HR 4,9, 95 % konfidensintervall [CI ], 1,4, 17), men risikoen for ikke-dødelig hjerteinfarkt var lavere med olmesartan (HR 0,64, 95 % KI 0,35, 1,18).
Den epidemiologiske studien inkluderte pasienter 65 år og eldre med en samlet eksponering på > 300 000 pasientår. I undergruppen av diabetespasienter som fikk høydose olmesartan (40 mg/d) i > 6 måneder, så det ut til å være økt risiko for død (HR 2,0, 95 % KI 1,1, 3,8) sammenlignet med lignende pasienter som tok andre angiotensinreseptorblokkere. I motsetning til dette så høydose olmesartan bruk hos ikke-diabetikere ut til å være assosiert med en redusert risiko for død (HR 0,46, 95 % KI 0,24, 0,86) sammenlignet med lignende pasienter som tok andre angiotensinreseptorblokkere. Ingen forskjeller ble observert mellom gruppene som fikk lavere doser olmesartan sammenlignet med andre angiotensinblokkere eller de som fikk behandling i
Samlet sett gir disse dataene bekymring for en mulig økt CV-risiko forbundet med bruk av høydose olmesartan hos diabetikere. Det er imidlertid bekymringer med troverdigheten til funnet av økt CV-risiko, spesielt observasjonen i den store epidemiologiske studien for en overlevelsesgevinst hos ikke-diabetikere av en størrelsesorden som ligner på det negative funnet hos diabetikere.
NARKOTIKAHANDEL
Midler som øker serumkalium
Samtidig bruk av olmesartan og andre midler som blokkerer renin-angiotensin-systemet, kaliumsparende diuretika (f.eks. spironolakton, triamteren, amilorid), kaliumtilskudd, salterstatninger som inneholder kalium eller andre legemidler som kan øke kaliumnivået (f.eks. heparin) kan føre til økning i serumkalium. Hvis samtidig medisinering anses som nødvendig, er overvåking av serumkalium tilrådelig.
Ikke-steroide antiinflammatoriske midler, inkludert selektive cyklooksygenase-2-hemmere (COX-2-hemmere)
Hos eldre pasienter, volumfattige (inkludert de som får diuretikabehandling), eller med nedsatt nyrefunksjon, kan samtidig administrering av NSAIDs, inkludert selektive COX-2-hemmere, med angiotensin II-reseptorantagonister, inkludert olmesartanmedoksomil, føre til forverring av nyrefunksjon, inkludert mulig akutt nyresvikt. Disse effektene er vanligvis reversible. Overvåk nyrefunksjonen regelmessig hos pasienter som får olmesartanmedoksomil og NSAID-behandling.
Den antihypertensive effekten av angiotensin II-reseptorantagonister, inkludert olmesartanmedoksomil, kan svekkes av NSAIDs inkludert selektive COX-2-hemmere.
Dobbel blokade av Renin-Angiotensin-systemet (RAS)
Dobbel blokkering av RAS med angiotensinreseptorblokkere, ACE-hemmere eller aliskiren er assosiert med økt risiko for hypotensjon, hyperkalemi og endringer i nyrefunksjon (inkludert akutt nyresvikt) sammenlignet med monoterapi. De fleste pasienter som får kombinasjonen av to RAS-hemmere oppnår ingen ekstra fordel sammenlignet med monoterapi. Generelt, unngå kombinert bruk av RAS-hemmere. Overvåk nøye blodtrykk, nyrefunksjon og elektrolytter hos pasienter på Benicar og andre midler som påvirker RAS.
Ikke gi aliskiren samtidig med Benicar hos pasienter med diabetes [se KONTRAINDIKASJONER ]. Unngå bruk av aliskiren med Benicar 40 mg hos pasienter med nedsatt nyrefunksjon (GFR
Litium
Økning i serumlitiumkonsentrasjoner og litiumtoksisitet er rapportert ved samtidig administrering av litium og angiotensin II-reseptorantagonister, inkludert BENICAR. Overvåk serumlitiumnivåene ved samtidig bruk.
Colesevelam hydroklorid
Samtidig administrering av gallesyrebindende middel kolesevelamhydroklorid reduserer systemisk eksponering og maksimal plasmakonsentrasjon av olmesartan. Administrering av olmesartan minst 4 timer før colesevelamhydroklorid reduserte legemiddelinteraksjonseffekten. Vurder å administrere olmesartan minst 4 timer før dosen av colesevelamhydroklorid [se KLINISK FARMAKOLOGI ].
ADVARSLER
Inkludert som en del av "FORHOLDSREGLER" Seksjon
FORHOLDSREGLER
Fostertoksisitet
Benicar 10mg kan forårsake fosterskader når det administreres til en gravid kvinne. Bruk av legemidler som virker på renin-angiotensin-systemet (RAS) i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. Resulterende oligohydramnios kan være assosiert med føtal lungehypoplasi og skjelettdeformasjoner. Potensielle neonatale bivirkninger inkluderer hodeskallehypoplasi, anuri, hypotensjon, nyresvikt og død. Når graviditet oppdages, seponer Benicar så snart som mulig [se Bruk i spesifikke populasjoner ].
Sykelighet hos spedbarn
Bruk av Benicar hos barn Bruk i spesifikke populasjoner ].
Hypotensjon hos pasienter med volum-eller saltfattige
Hos pasienter med et aktivert renin-angiotensin-aldosteronsystem, som pasienter med volum og/eller saltfattige (f.eks. de som behandles med høye doser diuretika), kan symptomatisk hypotensjon forventes etter oppstart av behandling med Benicar. Start behandling under nøye medisinsk tilsyn og vurder å starte med en lavere dose. Hvis hypotensjon oppstår, plasser pasienten i ryggleie og om nødvendig gi en intravenøs infusjon av vanlig saltvann [se DOSERING OG ADMINISTRASJON ]. En forbigående hypotensiv respons er ikke en kontraindikasjon for videre behandling, som vanligvis kan fortsettes uten problemer når blodtrykket har stabilisert seg.
Nedsatt nyrefunksjon
Som en konsekvens av hemming av renin-angiotensin-aldosteron-systemet, kan endringer i nyrefunksjonen forventes hos mottakelige personer som behandles med Benicar. Hos pasienter hvis nyrefunksjon kan avhenge av aktiviteten til renin-angiotensinaldosteron-systemet (f.eks. pasienter med alvorlig kongestiv hjertesvikt), har behandling med angiotensinkonverterende enzym (ACE)-hemmere og angiotensinreseptorantagonister blitt assosiert med oliguri og/eller progressiv azotemi. og sjelden med akutt nyresvikt og/eller død. Lignende resultater kan forventes hos pasienter behandlet med Benicar [se DOSERING OG ADMINISTRASJON , NARKOTIKAHANDEL , Bruk i spesifikke populasjoner og KLINISK FARMAKOLOGI ].
I studier av ACE-hemmere hos pasienter med unilateral eller bilateral nyrearteriestenose, er økning i serumkreatinin eller blodureanitrogen (BUN) rapportert. Det har ikke vært langtidsbruk av Benicar hos pasienter med unilateral eller bilateral nyrearteriestenose, men lignende resultater kan forventes.
Sprue-lignende enteropati
Alvorlig, kronisk diaré med betydelig vekttap er rapportert hos pasienter som tar olmesartan måneder til år etter behandlingsstart. Intestinale biopsier av pasienter viste ofte villøs atrofi. Hvis en pasient utvikler disse symptomene under behandling med olmesartan, utelukk andre etiologier. Vurder alternativ antihypertensiv behandling i tilfeller der ingen annen etiologi er identifisert.
Hyperkalemi
Serumkalium bør overvåkes hos pasienter som får Benicar. Legemidler som hemmer renin-angiotensinsystemet kan forårsake hyperkalemi. Risikofaktorer for utvikling av hyperkalemi inkluderer nyresvikt, diabetes mellitus og samtidig bruk av kaliumsparende diuretika, kaliumtilskudd og/eller kaliumholdige salterstatninger [se NARKOTIKAHANDEL ].
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Olmesartanmedoksomil var ikke karsinogen når det ble administrert ved diett til rotter i opptil 2 år. Den høyeste dosen som ble testet (2000 mg/kg/dag) var, på mg/m2-basis, omtrent 480 ganger den maksimale anbefalte humane dosen (MRHD) på 40 mg/dag. To karsinogenitetsstudier utført på mus, en 6-måneders sondeernæringsstudie i p53 knockout-mus og en 6-måneders diettadministrasjonsstudie i den transgene Hras2-musen, i doser på opptil 1000 mg/kg/dag (omtrent 120 ganger MRHD) , avslørte ingen bevis for en karsinogen effekt av olmesartanmedoxomil.
Både olmesartanmedoksomil og olmesartan testet negativt i in vitro-analysen for syrisk hamsterembryocelletransformasjon og viste ingen tegn på genetisk toksisitet i Ames-testen (bakteriell mutagenisitet). Imidlertid ble begge vist å indusere kromosomavvik i dyrkede celler in vitro (kinesisk hamsterlunge) og testet positivt for tymidinkinasemutasjoner i in vitro muselymfomanalysen. Olmesartanmedoksomil testet negativt in vivo for mutasjoner i MutaMouse-tarmen og nyrene og for klastogenisitet i benmarg hos mus (mikronukleustest) ved orale doser på opptil 2000 mg/kg (olmesartan ikke testet).
Fertiliteten til rotter ble upåvirket av administrering av olmesartanmedoksomil i dosenivåer så høye som 1000 mg/kg/dag (240 ganger MRHD) i en studie der dosering ble startet 2 (hunn) eller 9 (hann) uker før paring.
Bruk i spesifikke populasjoner
Svangerskap
Risikosammendrag
Benicar 10mg kan forårsake fosterskader når det administreres til en gravid kvinne. Bruk av legemidler som virker på renin-angiotensin-systemet i løpet av andre og tredje trimester av svangerskapet reduserer fosterets nyrefunksjon og øker foster- og neonatal morbiditet og død. De fleste epidemiologiske studier som undersøker føtale abnormiteter etter eksponering for antihypertensiv bruk i første trimester har ikke skilt medisiner som påvirker renin-angiotensin-systemet fra andre antihypertensiva. I reproduksjonsstudier på dyr resulterte Benicar-behandling under organogenese i økt embryoføtal toksisitet hos rotter ved doser lavere enn maternalt toksiske doser.
Når graviditet oppdages, seponer Benicar så snart som mulig. Vurder alternativ antihypertensiv behandling under graviditet.
Estimert bakgrunnsrisiko for alvorlige fødselsskader og spontanabort for den angitte befolkningen er ukjent. Alle graviditeter har en bakgrunnsrisiko for fødselsskader, tap eller andre uheldige utfall. I den generelle befolkningen i USA er den estimerte bakgrunnsrisikoen for alvorlige fødselsskader og spontanabort i klinisk anerkjente svangerskap henholdsvis 2 %–4 % og 15 %–20 %.
Kliniske betraktninger
Sykdomsassosiert mors- og/eller embryo-/fosterrisiko
Hypertensjon i svangerskapet øker mors risiko for svangerskapsforgiftning, svangerskapsdiabetes, for tidlig fødsel og fødselskomplikasjoner (f.eks. behov for keisersnitt og blødning etter fødselen). Hypertensjon øker fosterets risiko for intrauterin vekstbegrensning og intrauterin død. Gravide kvinner med hypertensjon bør overvåkes nøye og behandles deretter.
Fetale/neonatale bivirkninger
Oligohydramnios hos gravide kvinner som bruker legemidler som påvirker renin-angiotensin-systemet i andre og tredje trimester av svangerskapet kan resultere i følgende: redusert føtal nyrefunksjon som fører til anuri og nyresvikt, føtal lungehypoplasi, skjelettdeformasjoner, inkludert hodeskallehypoplasi, hypotensjon og døden. Hos pasienter som tar Benicar 20 mg under graviditet, utfør serielle ultralydundersøkelser for å vurdere det intra-amniotiske miljøet. Fostertesting kan være aktuelt, basert på svangerskapsuken. Pasienter og leger bør imidlertid være oppmerksomme på at oligohydramnios kanskje ikke vises før etter at fosteret har fått irreversibel skade.
Følg nøye med spedbarn med historie om in utero eksponering for Benicar 40 mg for hypotensjon, oliguri og hyperkalemi. Hos nyfødte med en historie med in utero eksponering for Benicar, hvis oliguri eller hypotensjon oppstår, bruk tiltak for å opprettholde tilstrekkelig blodtrykk og nyreperfusjon. Utvekslingstransfusjoner eller dialyse kan være nødvendig som et middel for å reversere hypotensjon og støtte nyrefunksjonen.
Data
Dyredata
Ingen teratogene effekter ble observert når olmesartanmedoksomil ble administrert til drektige rotter i orale doser opptil 1000 mg/kg/dag (240 ganger maksimal anbefalt human dose (MRHD) på mg/m2-basis) eller gravide kaniner i orale doser opptil 1 mg/kg/dag (halvparten av MRHD på mg/m2-basis; høyere doser kunne ikke evalueres for effekter på fosterutviklingen da de var dødelige for dosene). Hos rotter ble det observert signifikant reduksjon i fødselsvekt og vektøkning ved doser ≥1,6 mg/kg/dag, og forsinkelser i utviklingsmessige milepæler (forsinket separasjon av øreauricula, utbrudd av nedre fortenner, utseende av abdominalhår, nedstigning av testikler, og separasjon av øyelokk) og doseavhengige økninger i forekomsten av utvidelse av nyrebekkenet ble observert ved doser ≥ 8 mg/kg/dag. Den ingen observerte effektdosen for utviklingstoksisitet hos rotter er 0,3 mg/kg/dag, omtrent en tidel av MRHD på 40 mg/dag.
Amming
Risikosammendrag
Det er ingen informasjon om tilstedeværelsen av olmesartan i morsmelk, effekten på spedbarnet som ammes, eller effekten på melkeproduksjonen. Olmesartan skilles ut i lav konsentrasjon i melken til diegivende rotter (se Data ). På grunn av potensialet for uønskede effekter på det ammende spedbarnet, bør det tas en beslutning om å avbryte ammingen eller avbryte medikamentet, tatt i betraktning stoffets betydning for moren.
Data
Tilstedeværelse av olmesartan i melk ble observert etter en enkelt oral administrering av 5 mg/kg [14C] olmesartanmedoksomil til diegivende rotter.
Pediatrisk bruk
De antihypertensive effektene av Benicar ble evaluert i en randomisert, dobbeltblind klinisk studie hos pediatriske pasienter i alderen 1 til 16 år [se Kliniske studier ]. Farmakokinetikken til Benicar ble evaluert hos pediatriske pasienter i alderen 1 til 16 år [se KLINISK FARMAKOLOGI ]. Benicar 10 mg ble generelt godt tolerert hos pediatriske pasienter, og bivirkningsprofilen var lik den beskrevet for voksne.
Benicar 20mg har ikke vist seg å være effektivt for hypertensjon hos barn
Bruk av Benicar hos barn ADVARSLER OG FORHOLDSREGLER ]. Renin-angiotensin-aldosteron-systemet (RAAS) spiller en kritisk rolle i nyreutviklingen. RAAS-blokade har vist seg å føre til unormal nyreutvikling hos svært unge mus. Administrering av legemidler som virker direkte på reninangiotensin-aldosteronsystemet (RAAS) kan endre normal nyreutvikling.
Geriatrisk bruk
Av det totale antallet hypertensive pasienter som fikk Benicar i kliniske studier, var mer enn 20 % 65 år eller eldre, mens mer enn 5 % var 75 år og eldre. Ingen generelle forskjeller i effektivitet eller sikkerhet ble observert mellom eldre pasienter og yngre pasienter. Annen rapportert klinisk erfaring har ikke identifisert forskjeller i respons mellom eldre og yngre pasienter, men større sensitivitet hos noen eldre individer kan ikke utelukkes [se KLINISK FARMAKOLOGI ].
Nedsatt leverfunksjon
Økning i AUC0-∞ og Cmax ble observert hos pasienter med moderat nedsatt leverfunksjon sammenlignet med de i matchede kontroller, med en økning i AUC på ca. 60 %. Ingen initial dosejustering anbefales for pasienter med moderat til markert leverdysfunksjon [se KLINISK FARMAKOLOGI ].
Nedsatt nyrefunksjon
Pasienter med nyreinsuffisiens har forhøyede serumkonsentrasjoner av olmesartan sammenlignet med personer med normal nyrefunksjon. Etter gjentatt dosering ble AUC omtrent tredoblet hos pasienter med alvorlig nedsatt nyrefunksjon (kreatininclearance DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER og KLINISK FARMAKOLOGI ].
Svarte pasienter
Den antihypertensive effekten av Benicar 10 mg var mindre hos svarte pasienter (vanligvis en lav-renin-populasjon), som har blitt sett med ACE-hemmere, betablokkere og andre angiotensinreseptorblokkere.
OVERDOSE
Begrensede data er tilgjengelige relatert til overdosering hos mennesker. De mest sannsynlige manifestasjonene av overdosering vil være hypotensjon og takykardi; bradykardi kan oppstå hvis parasympatisk (vagal) stimulering oppstår. Hvis symptomatisk hypotensjon oppstår, start støttende behandling. Dialyserbarheten til olmesartan er ukjent.
KONTRAINDIKASJONER
Ikke administrer aliskiren samtidig med Benicar 20 mg hos pasienter med diabetes [se NARKOTIKAHANDEL ].
KLINISK FARMAKOLOGI
Virkningsmekanismen
Angiotensin II dannes fra angiotensin I i en reaksjon katalysert av angiotensinkonverterende enzym (ACE, kininase II). Angiotensin II er det viktigste pressormiddelet i renin-angiotensin-systemet, med effekter som inkluderer vasokonstriksjon, stimulering av syntese og frigjøring av aldosteron, hjertestimulering og nyreabsorpsjon av natrium. Olmesartan blokkerer de vasokonstriktoreffekter av angiotensin II ved selektivt å blokkere bindingen av angiotensin II til AT1-reseptoren i vaskulær glatt muskulatur. Virkningen er derfor uavhengig av veiene for angiotensin II-syntese.
En AT2-reseptor finnes også i mange vev, men denne reseptoren er ikke kjent for å være assosiert med kardiovaskulær homeostase. Olmesartan har mer enn 12 500 ganger større affinitet for AT1-reseptoren enn til AT2-reseptoren.
Blokkering av renin-angiotensin-systemet med ACE-hemmere, som hemmer biosyntesen av angiotensin II fra angiotensin I, er en mekanisme for mange legemidler som brukes til å behandle hypertensjon. ACE-hemmere hemmer også nedbrytningen av bradykinin, en reaksjon som også katalyseres av ACE. Fordi olmesartanmedoksomil ikke hemmer ACE (kininase II), påvirker det ikke responsen på bradykinin. Hvorvidt denne forskjellen har klinisk relevans er ennå ikke kjent.
Blokkering av angiotensin II-reseptoren hemmer den negative regulatoriske tilbakemeldingen av angiotensin II på reninsekresjon, men den resulterende økte plasmareninaktiviteten og sirkulerende angiotensin II-nivåer overvinner ikke effekten av olmesartan på blodtrykket.
Farmakodynamikk
Benicar-doser på 2,5 mg til 40 mg hemmer pressoreffekten av angiotensin I-infusjon. Varigheten av den hemmende effekten var relatert til dose, med doser av Benicar >40 mg som ga >90 % hemming etter 24 timer.
Plasmakonsentrasjoner av angiotensin I og angiotensin II og plasmareninaktivitet (PRA) øker etter enkel og gjentatt administrering av Benicar 10 mg til friske personer og hypertensive pasienter. Gjentatt administrering av opptil 80 mg Benicar hadde minimal påvirkning på aldosteronnivået og ingen effekt på serumkalium.
Farmakokinetikk
Absorpsjon
Olmesartanmedoksomil bioaktiveres raskt og fullstendig ved esterhydrolyse til olmesartan under absorpsjon fra mage-tarmkanalen.
Benicar-tabletter og suspensjonsformuleringen fremstilt fra Benicar-tabletter er bioekvivalente [se DOSERING OG ADMINISTRASJON ].
Den absolutte biotilgjengeligheten av olmesartan er omtrent 26 %. Etter oral administrering nås maksimal plasmakonsentrasjon (Cmax) av olmesartan etter 1 til 2 timer. Mat påvirker ikke biotilgjengeligheten til olmesartan. Benicar kan administreres med eller uten mat.
Fordeling
Distribusjonsvolumet av olmesartan er ca. 17 l. Olmesartan er sterkt bundet til plasmaproteiner (99 %) og trenger ikke gjennom røde blodlegemer. Proteinbindingen er konstant ved plasmakonsentrasjoner av olmesartan godt over området som oppnås med anbefalte doser.
Hos rotter krysset olmesartan blod-hjerne-barrieren dårlig, om i det hele tatt. Olmesartan passerte over placentabarrieren hos rotter og ble distribuert til fosteret. Olmesartan ble distribuert til melk i lave nivåer hos rotter.
Metabolisme og utskillelse
Etter den raske og fullstendige konverteringen av olmesartanmedoksomil til olmesartan under absorpsjon, er det praktisk talt ingen ytterligere metabolisme av olmesartan. Total plasmaclearance av olmesartan er 1,3 l/t, med en renal clearance på 0,6 l/time. Omtrent 35 % til 50 % av den absorberte dosen gjenvinnes i urin, mens resten elimineres i feces via gallen.
Olmesartan ser ut til å bli eliminert på en bifasisk måte med en terminal halveringstid på ca. 13 timer. Olmesartan viser lineær farmakokinetikk etter orale enkeltdoser på opptil 320 mg og flere orale doser på opptil 80 mg. Steady-state-nivåer av olmesartan oppnås innen 3 til 5 dager, og det oppstår ingen akkumulering i plasma ved dosering én gang daglig.
Spesifikke populasjoner
Geriatriske pasienter
Farmakokinetikken til olmesartan ble undersøkt hos eldre (≥65 år). Totalt sett var maksimale plasmakonsentrasjoner av olmesartan lik hos unge voksne og eldre. Moderat akkumulering av olmesartan ble observert hos eldre ved gjentatt dosering; AUCss, τ var 33 % høyere hos eldre pasienter, tilsvarende en ca. 30 % reduksjon i CLR [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Pediatriske pasienter
Farmakokinetikken til olmesartan ble studert hos pediatriske hypertensive pasienter i alderen 1 til 16 år. Clearance av olmesartan hos pediatriske pasienter var lik den hos voksne pasienter når justert etter kroppsvekt [se Bruk i spesifikke populasjoner ].
Olmesartans farmakokinetikk har ikke blitt undersøkt hos pediatriske pasienter under 1 år [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Mannlige og kvinnelige pasienter
Mindre forskjeller ble observert i farmakokinetikken til olmesartan hos kvinner sammenlignet med menn. AUC og Cmax var 10-15 % høyere hos kvinner enn hos menn.
Pasienter med nedsatt leverfunksjon
Økning i AUC0-∞ og Cmax ble observert hos pasienter med moderat nedsatt leverfunksjon sammenlignet med de i matchede kontroller, med en økning i AUC på ca. 60 % [se DOSERING OG ADMINISTRASJON og Bruk i spesifikke populasjoner ].
Pasienter med nedsatt nyrefunksjon
Hos pasienter med nyreinsuffisiens var serumkonsentrasjonen av olmesartan forhøyet sammenlignet med personer med normal nyrefunksjon. Etter gjentatt dosering ble AUC omtrent tredoblet hos pasienter med alvorlig nedsatt nyrefunksjon (kreatininclearance DOSERING OG ADMINISTRASJON , ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Legemiddelinteraksjonsstudier
Gallesyrebindende middel Colesevelam
Samtidig administrering av 40 mg olmesartanmedoksomil og 3750 mg kolesevelamhydroklorid hos friske personer resulterte i 28 % reduksjon i Cmax og 39 % reduksjon i AUC for olmesartan. Mindre effekter, 4 % og 15 % reduksjon i henholdsvis Cmax og AUC, ble observert når olmesartanmedoksomil ble administrert 4 timer før colesevelamhydroklorid [se NARKOTIKAHANDEL ].
Andre studier
Ingen signifikante legemiddelinteraksjoner ble rapportert i studier der olmesartanmedoksomil ble administrert sammen med digoksin eller warfarin hos friske frivillige.
Biotilgjengeligheten til olmesartan ble ikke signifikant endret ved samtidig administrering av antacida [Al(OH)3/Mg(OH)2].
Olmesartanmedoksomil metaboliseres ikke av cytokrom P450-systemet og har ingen effekt på P450-enzymer; derfor forventes ikke interaksjoner med legemidler som hemmer, induserer eller metaboliseres av disse enzymene.
Kliniske studier
Hypertensjon hos voksne
Den antihypertensive effekten av Benicar 10 mg er vist i syv placebokontrollerte studier ved doser fra 2,5 mg til 80 mg i 6 til 12 uker, som hver viser statistisk signifikante reduksjoner i topp- og bunnblodtrykk. Totalt 2693 pasienter (2145 Benicar; 548 placebo) med essensiell hypertensjon ble studert. Benicar 40 mg én gang daglig senket det diastoliske og systoliske blodtrykket. Responsen var doserelatert, som vist i følgende graf. En Benicar-dose på 20 mg daglig gir en bunnfallsreduksjon i sittende blodtrykk (BP) i forhold til placebo på ca. 10/6 mmHg og en dose på 40 mg daglig gir en bunnfallsreduksjon i sittende blodtrykk i forhold til placebo på ca. 12/7 mmHg. Benicar 10 mg doser større enn 40 mg hadde liten tilleggseffekt. Utbruddet av den antihypertensive effekten inntraff innen 1 uke og var stort sett manifest etter 2 uker.
Benicar 40 mg doserespons Placebojustert reduksjon i blodtrykk (mmHg) 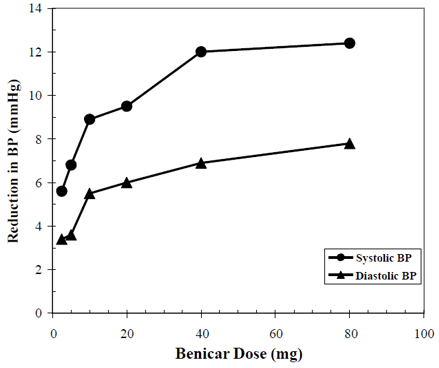
Data ovenfor er fra syv placebokontrollerte studier (2145 Benicar-pasienter, 548 placebopasienter). Den blodtrykkssenkende effekten ble opprettholdt gjennom hele 24-timersperioden med Benicar én gang daglig, med bunn-til-topp-forhold for systolisk og diastolisk respons mellom 60 og 80 %.
Den blodtrykkssenkende effekten av Benicar 40 mg, med og uten hydroklortiazid, ble opprettholdt hos pasienter behandlet i opptil 1 år. Det var ingen tegn på takyfylakse under langtidsbehandling med Benicar eller rebound-effekt etter brå seponering av olmesartanmedoksomil etter 1 års behandling.
Den antihypertensive effekten av Benicar var lik hos menn og kvinner og hos pasienter eldre og yngre enn 65 år. Effekten var mindre hos svarte pasienter (vanligvis en lav-renin-populasjon), som har blitt sett med ACE-hemmere, betablokkere og andre angiotensinreseptorblokkere. Benicar hadde en ekstra blodtrykkssenkende effekt når det ble lagt til hydroklortiazid.
Det er ingen studier av Benicar som viser reduksjon i kardiovaskulær risiko hos pasienter med hypertensjon, men minst ett farmakologisk lignende legemiddel har vist slike fordeler.
Pediatrisk hypertensjon
De antihypertensive effektene av Benicar 40 mg i den pediatriske populasjonen ble evaluert i en randomisert, dobbeltblind studie med 302 hypertensive pasienter i alderen 6 til 16 år. Studiepopulasjonen besto av en helsvart kohort på 112 pasienter og en blandet rasegruppe på 190 pasienter, inkludert 38 svarte pasienter. Etiologien til hypertensjonen var hovedsakelig essensiell hypertensjon (87 % av den svarte kohorten og 67 % av den blandede kohorten). Pasienter som veide 20 til
den samme studien fikk 59 pasienter i alderen 1 til 5 år som veide ≥5 kg 0,3 mg/kg Benicar 10 mg én gang daglig i tre uker i en åpen fase, og ble deretter randomisert til å få Benicar eller placebo i en dobbeltblindet fase. Ved slutten av den andre seponeringsuken var gjennomsnittlig systolisk/diastolisk blodtrykk ved bunnen 3/3 mmHg lavere i gruppen randomisert til Benicar; denne forskjellen i blodtrykk var ikke statistisk signifikant (95 % KI -2 til 7/-1 til 7).
PASIENTINFORMASJON
Svangerskap
Informer kvinnelige pasienter i fertil alder om konsekvensene av eksponering for Benicar 20 mg under graviditet. Diskuter behandlingsalternativer med kvinner som planlegger å bli gravide. Be pasienter rapportere graviditeter til legen så snart som mulig [se ADVARSLER OG FORHOLDSREGLER og Bruk i spesifikke populasjoner ].
Amming
Råd ammende kvinner til ikke å amme under behandling med BENICAR [se Bruk i spesifikke populasjoner ].
Hyperkalemi
Råd pasienter til å ikke bruke kaliumtilskudd eller salterstatninger som inneholder kalium uten å konsultere helsepersonell [se NARKOTIKAHANDEL ].
